Introducción
La leishmaniosis cutánea es una enfermedad causada por un parásito protozoo intracelular y transmitido por la picadura de mosquitos. Entre los medicamentos más frecuentemente utilizados para su tratamiento se encuentra el glucantime o antimoniato de meglumina o antimonio pentavalente, frecuentemente asociado a mialgias, alteraciones gastrointestinales, cefalea, fatiga, fiebre, reacciones cutáneas, elevación de enzimas hepáticas, alteraciones renales y toxicidad cardiovascular 1.
La prolongación del intervalo QTc es la alteración cardiovascular más frecuente en pacientes que utilizan glucantime, con una incidencia cercana al 20 %. Predispone al desarrollo de torsade de pointes y fue descrita originalmente por Dessertenne. Consiste en una taquicardia ventricular polimórfica que se presenta con salvas de corta duración y rápida frecuencia, con complejos QRS que alternan de polaridad con respecto a la línea isoeléctrica, se relaciona con intervalos QTc prolongados y puede desencadenar fibrilación ventricular y muerte súbita 2,3. Para evitarla se debe realizar monitoreo electrocardiográfico y si la prolongación del intervalo QTc excede los 450 ms, es mandatoria la suspensión del medicamento 1,4.
Por los múltiples efectos adversos y el gran potencial cardiotóxico del glucantime al aplicarse por vía intramuscular, se recomienda que la aplicación del tratamiento sea intralesional cuando se trata de la variedad cutánea limitada, en la que no existe compromiso de los demás órganos, como ocurre en las formas viscerales 5,6.
A pesar de la clara asociación del glucantime con las alteraciones electrocardiográ ficas, su potencial arritmogénico es frecuentemente olvidado 7,8,9. Presentamos el caso clínico de una paciente con leishmaniosis cutánea a quien se le inició trata miento con glucantime intramuscular presentando luego eventos adversos cardio vasculares fatales.
Caso clínico
Se trataba de una paciente de 77 años, procedente de área rural quien fue remitida en malas condiciones a hospital de tercer nivel de complejidad, por presentar cuadro clíni co de hipocalemia refractaria y varios episodios de taquicardia ventricular polimórfica tipo torsade de pointes, las cuales requirieron desfibrilación en diferentes oportunidades.
Se interrogó a sus familiares quienes refirieron antecedente de hipertensión arterial en tratamiento con losartan e hidroclorotiazida y describieron cuadro clínico de 15 días de evolución consistente en astenia, adinamia, hiporexia, brote en extremidades, diarrea de alto gasto y zona eritematosa en glúteo izquierdo posterior a aplicación de glucantime durante 14 días para manejo de leishmaniosis cutánea.
La paciente estuvo durante siete días en el hospital local de área rural, en donde ingresó por los mismos síntomas descritos anteriormente y allí se le detectó una medición de potasio sérico de 2,7 el cual fue corregido parcialmente y la paciente fue dada de alta al quinto día para terminar la reposición de potasio por vía oral.
Ante la no mejoría de los síntomas, la paciente reingresó a los dos días, con niveles de potasio de 2,25, por lo que se le reinició reposición de potasio intravenoso; sin embargo, durante la estancia presenta varios episodios de taquicardia ventricular polimórfica no sostenida, por lo que comienzan tratamiento con amiodarona a dosis de 1 miligramo/minuto por seis horas (360 mg) y posteriormente 0,5 miligramo/minuto durante las 18 horas siguientes (540 mg). Durante el tiempo de infusión la paciente se tornó hipotensa y presentó un nuevo episodio de taquicardia ventricular polimórfica tipo torsade de pointes que requirió desfibrilación con 100 Joules, la cual fue exitosa y posteriormente suspenden la amiodarona y realizan traslado a hospital de tercer nivel.
A la institución de tercer nivel ingresa somnolienta, deshidratada, con crépitos bibasales, desaturada, electrocardiograma con QTc largo, mayor a 500 milisegundos (Figura 1) y episodios frecuentes de complejos ventriculares prematuros y taquicardia ventricular no sostenida, tipo torsade de pointes; posteriormente, desarrolló nuevo episodio de taquicardia ventricular polimórfica sostenida e hipotensión, por lo cual, fue llevada a sala de reanimación en donde se realizó desfibrilación exitosamente.
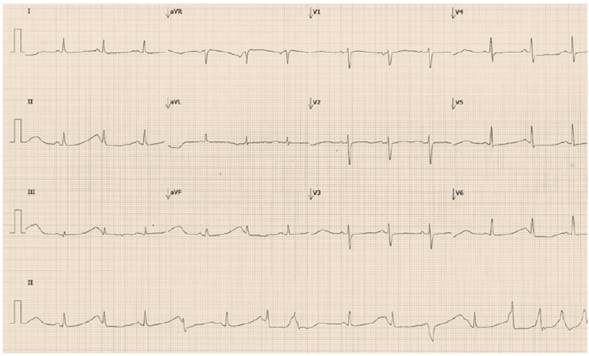
Figura 1 Electrocardiograma en ritmo sinusal con alternancia de la onda T y marcada prolongación del intervalo QT a expensas de la onda T; QTc 770-880 milisegundos, varía según la fórmula para corrección utilizada.
Se documentaron niveles de potasio sérico de 2,3, magnesio en 2,51, glucometría en 346 mg/dL, HbA1c 7,92, ALT 168 y AST 386, por lo que se inició reposición de potasio y magnesio, con mejoría eléctrica parcial; sin embargo, a las ocho horas de estancia hospitalaria, comienza nuevamente a presentar episodios repetidos de taquicardia ventricular polimórfica, requiriendo nueva desfibrilación (Figura 2).
Al ser valorada por cardiología y electrofisiología se recomendó reposición estricta de iones, paso de marcapasos transvenoso para sobre-estimulación, garantizando así reducción de los periodos refractarios y disminución de la vulnerabilidad a nuevos episodios arrítmicos, goteo de isoproterenol, propranolol, sedación e intubación para control de hipertonía simpática. Durante el paso del marcapasos presentó nuevo episodio de torsade de pointes que requirió desfibrilación y se deja corrección estricta de potasio para lograr niveles por encima de 4.
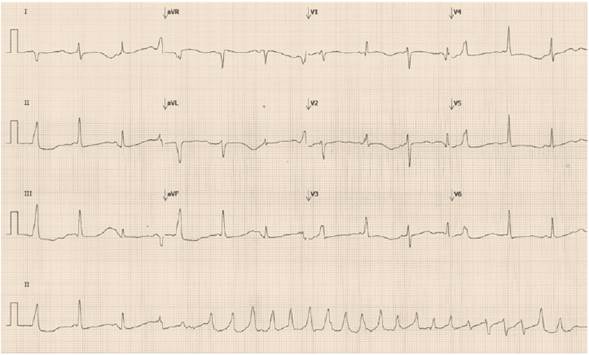
Figura 2 Electrocardiograma donde se evidencia el inicio de taquicardia tipo torsade de pointes secundaria a la prolongación del intervalo QT.
A pesar de la mejoría de los niveles del potasio (3,41) y del magnesio (2,54), de la continua hidratación y de la sobre-estimulación con marcapasos, presentó nuevo episodio de taquicardia ventricular polimórfica, llevándola a fibrilación ventricular, y requiriendo desfibrilación con 200 Joules y reanimación cardiopulmonar durante 10 minutos. La paciente sale a ritmo sinusal con marcada inestabilidad eléctrica y pos teriormente presentó nuevo episodio de taquicardia ventricular polimórfica torsade de pointes, con fibrilación ventricular y luego muerte.
Por dificultades en la consecución del isoproterenol este nunca pudo ser administrado.
Discusión
La leishmaniosis cutánea es una enfermedad trasmitida por vectores (zoonótica), principalmente del genero Lutzomia que es frecuente en el territorio colombiano. Se presenta con diferentes tasas, siendo la más alta en Guaviare (127,4 por 100 000 habitantes) y la menor en Nariño (14,8 por 100 000 habitantes), Antioquia tiene una tasa de 18,1 por 100 000 habitantes 10.
El tratamiento de elección se basa en el uso de glucantime, un compuesto que se ha relacionado con múltiples efectos adversos, entre ellos gastrointestinales, renales y cardiacos 8. Puede producir falla renal con necrosis tubular aguda y ocasionar al teraciones hidroelectrolíticas como hipocalemia 11, tal como lo encontrado en la paciente, en quien, adicionalmente, se evidenció manejo antihipertensivo con un diu rético tiazídico que potenciaba el efecto.
Los compuestos de antimoniato de meglumina producen alteraciones en la repola rización cardiaca. Se ha descrito la prolongación del intervalo QTc, alteraciones del segmento ST y de la onda T, así como la generación de arritmias letales tipo torsade de pointes4.
Mientras que en adultos la presencia de alteraciones electrocardiográficas en pa cientes tratados con antimoniales es del 54 % y la prolongación del QTc hasta en el 20 % 12, en los niños se encuentran presentes hasta en el 34,4 % y con QTc prolon gado en 11,5 % 13. Existe relación directa entre la dosis y duración del tratamiento con la presencia de anormalidades electrocardiográficas. Alrededor de 4,5 % de estos pacientes desarrollan muerte súbita 14.
Varias teorías podrían explicar las alteraciones en la repolarización, entre ellas un efecto secundario a la acumulación miocárdica de compuestos pentavalentes y tri valentes (más tóxicos que los primeros); además de la dispersión de la repolari zación cardíaca secundaria al bloqueo de las corrientes rectificadoras de potasio, siendo este último uno de los mecanismos que sustentan la aparición de la torsade de pointes15.
Recientemente, se plantea que la inducción de la arritmia por los compuestos an timoniales está relacionada con el aumento de las corrientes cardíacas de calcio, sin afectar las principales corrientes de potasio, como la IKr (rápidas), IKs (lentas) e IK1 16. Se plantea también la inhibición, por fármacos como la amiodarona, de las corrientes rectificadoras de potasio mediadas por IKr 7; así mismo que también hace presencia en el caso descrito; sin embargo, se cree que fue la inhibición de los canales de potasio hERG la causante de la alteración 7.
En el caso descrito confluyen varias alteraciones que desencadenaron la arritmia ventricular, tales como: uso de glucantime, amiodarona y de hidroclorotiazida y la alteración renal por glucantime, produciendo hipocalemia. Es de anotar que la tor sades de pointes es más frecuente en bradicardia 15, la misma que la paciente presentaba al ingreso a la institución.
No existe tratamiento específico para la situación descrita, por lo que se debe dar en todos los casos manejo de soporte, evitar los fármacos que prolonguen el QT, normalizar los niveles de potasio y magnesio, aumentar la frecuencia cardiaca con isoproterenol y, en caso de ser requerido, colocar marcapaso transvenoso 6. No hay guías actuales de manejo, así como tampoco existen datos de pronóstico de las alteraciones, por la ausencia de estudios a gran escala de vigilancia.
En conclusión, conviene seguir la guía de atención a la leishmaniosis y solicitar fun ción renal, electrolitos y electrocardiograma a todos los pacientes antes del inicio con glucantime. Se debe recordar el seguimiento y las indicaciones de suspensión de la terapia si ocurren alteraciones en la química hepática, renal o alteraciones cardiacas.
Las arritmias por prolongación de QT son potencialmente amenazantes para la vida, por lo que es importante recordar que para el tratamiento antiarrítmico se deben evi tar medicamentos que prolonguen aún más el QT; igualmente, se deben normalizar las alteraciones hidroelectrolíticas (especialmente, potasio y magnesio) y realizar mo nitoreo electrocardiográfico continuo, con el que se vigile la sobre-estimulación car díaca temporal realizada con marcapasos, junto con el manejo beta-bloqueador.














