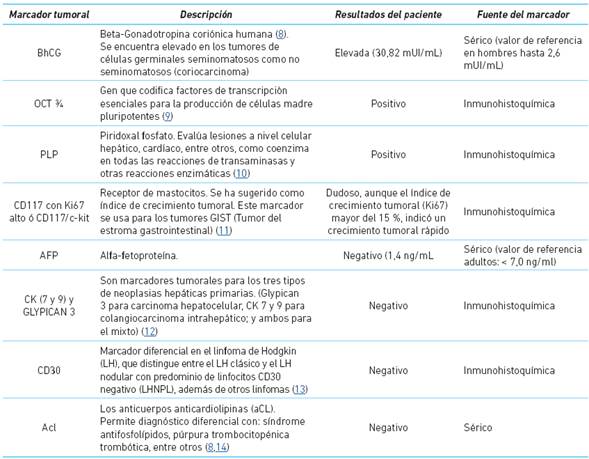
Introducción
Generalmente, la diseminación metastásica del seminoma ocurre por vía linfática hacia los ganglios retroperitoneales 1,2. Por otro lado, se ha evi denciado que un tercio de los pacientes con un tumor de tipo seminoma y no seminoma pueden manifestar la enfermedad con la aparición de una masa mediastinal asociada al desarrollo de malignidad hematológica 1.
La presentación de los tumores de células germinales extragonadales puede ser confusa, presentándose un crecimiento lento y poco sintomático o un crecimiento indoloro en el 90 % de los casos 3,4; sin embargo, el 10 % de los pacientes puede presentar dolor lumbar por metástasis a esa región 3,4.
Entre los síntomas más frecuentes, aunque inespecíficos, se reporta dolor, fiebre, pérdida de peso, disnea, tos y, en algunos casos severos, edema en esclavina por trombosis de las venas innominadas y por síndrome de vena cava superior 5,6. Estas neoplasias se presentan más frecuentemente en la adultez temprana, suelen ser agresivas y producir metástasis con mayor frecuencia a nivel regional que a distancia 5,7.
Presentamos un caso clínico de un paciente con seminoma clásico extragonadal que, por sus características de presentación clínica y semiológica, así como por su abordaje diagnóstico mediante marcadores moleculares y clasificación histo patológica e inmunohistoquímica, se considera diferente a lo usualmente descrito. Adicionalmente, su comportamiento evolutivo y el tratamiento precoz instaurado, difiere de las guías clínicas establecidas para el abordaje de la enfermedad.
Presentación del caso
Un paciente masculino de 19 años asistió a consulta ambulatoria de primer nivel por presentar en el cuello un ganglio de una semana de evolución. Había iniciado con dolor local que posteriormente se irradió a la axila y mitad del brazo izquierdo, así como al hemitórax izquierdo; además, acusaba edema del cuello ipsilateral. El paciente refirió que esporádicamente consumía una cajetilla de 10 cigarrillos y licor cada 15 días, negando otros antecedentes de relevancia.
Al examen físico se encontró, como único hallazgo importante, un edema supraclavi cular izquierdo. Una radiografía de tórax evidenció gran masa en el mediastino ante rior con relación hacia el hemitórax derecho. La Figura 1 muestra las radiografías de tórax, inicial (en la que se evidencia masa tumoral), y de control tomada a los nueve meses luego del inicio del tratamiento con quimioterapia, en la cual se observa au sencia tumoral radiológica.
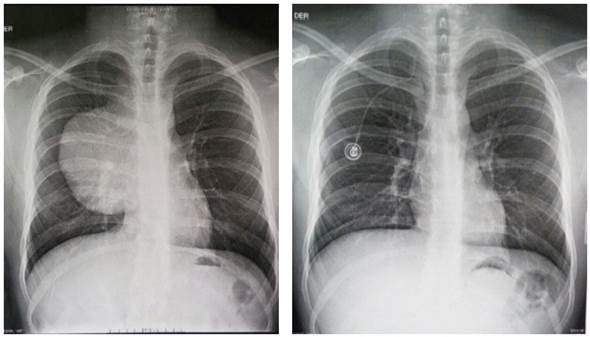
A. Mayo de 2016. Se visualiza una masa de bordes parcialmente defi nidos en el mediastino anterior con relación hacia el hemitórax dere cho de 145 x 134 mm. B. Febrero de 2017. Se visualiza catéter subclavio derecho. Ya no se observan signos radiológicos de masa en hemi tórax derecho.
Figura 1 Radiografías de tórax
La ultrasonografía evidenció trombosis subaguda de la venas subclavia, yugular interna y tronco braquiocefálico izquierdos, además de compresión de vena cava superior; por lo que se sospechó un posible síndrome de vena cava superior. El he mograma inicial era normal.
Por estos hallazgos fue remitido y hospitalizado en centro de tercer nivel para realizar estudios de la masa mediastinal. Una nueva evaluación no evidenció sig nos de dificultad respiratoria. Se solicitó una tomografía contrastada de tórax en la que se sospechó de un posible origen en un teratoma, timoma o linfoma. Para la confirmación diagnóstica se procedió a una biopsia por toracotomía para estudios moleculares e histopatológicos del tejido tumoral. En el Cuadro 1 se presentan las pruebas moleculares que aportaron al diagnóstico.
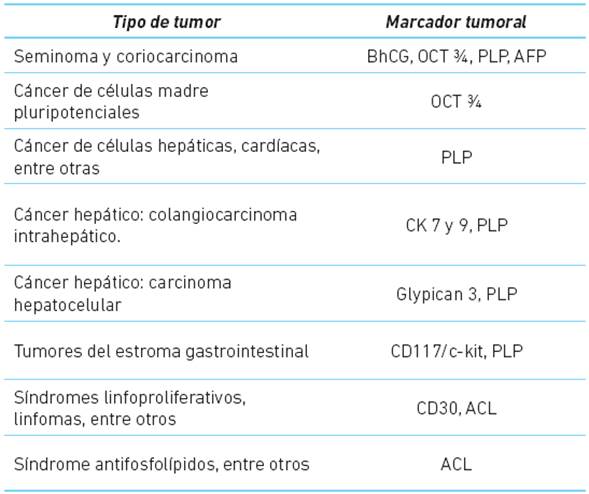
En este paciente se evidenció un proceso clínico e imagenológico inicial, posterior mente confirmado con marcadores tumorales moleculares, permitiendo descartar otros diagnósticos diferenciales a partir de la información recolectada en la historia clínica (Cuadro 2).
Cuadro 2 Diagnóstico diferencial de neoplasias con similares marcadores tumorales positivos tomados al paciente
Durante la hospitalización no se documentó fiebre ni hubo requerimiento de oxígeno y el paciente negó disnea, tos, expectoración, hemoptisis u otros síntomas respiratorios.
El Cuadro 3 resume los procedimientos diagnósticos y los tratamientos a los que fue sometido el paciente. El proceso requirió una confirmación histopatológica con pruebas moleculares. El esquema de tratamiento realizado tuvo una adecuada adhe rencia y una buena respuesta clínica.
Se instauró tratamiento anticoagulante con enoxaparina sódica a dosis de 80 mg por vía subcutánea cada 12 horas para tratamiento de la trombosis de la vena subclavia.
Se indicó el alta hospitalaria al paciente, una vez conocidos los resultados de pato logía y estudios moleculares, con diagnóstico de tumor germinal de tipo seminoma variante “clásico” extragonadal estadio III por compromiso mediastinal y supraclavi cular. El paciente egresó estable clínicamente y sin signos de trombosis subclavia o compresión clínica de vena cava superior. Posterior al egreso, se continuó ambula toriamente con igual esquema anticoagulante durante al menos cinco meses más.
Discusión
Las neoplasias testiculares se dividen en tumores de células germinales y de células no germinales. Los primeras se derivan de células espermatogénicas y constituyen el 95 % de las neoplasias testiculares, siendo en su mayoría malignas. Los tumores de células no germinales se originan del cordón sexual (células de Sertoli) y del estroma (células de Leydig) y constituyen el 4 a 5 % de las neoplasias testiculares y son malig nos en el 10 % de los casos, siendo el tumor de células de Leydig el más común 7,15. Basados en los hallazgos histológicos, los tumores de células germinales pueden cla sificarse como se presenta en el Cuadro 4.
Cuadro 3 Procedimientos diagnósticos y tratamientos realizados
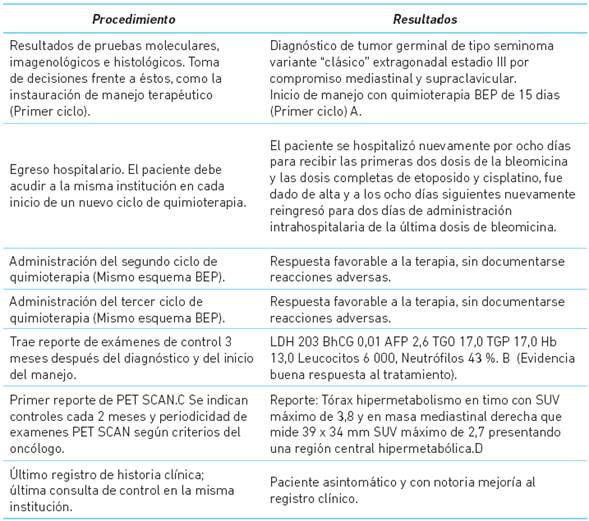
A Esquema BEP, compuesto por los medicamentos (con su respectiva posología utilizada en el paciente): Bleomicina sulfato solución inyectable x 15 UI con una dosis de 30 UI vía intravenosa en los días 1-8-15 en infusión de 40 minutos; Etopósido solución inyectable x 100mg/5ml con una dosis de 150 mg vía intravenosa en los días 1-2-3-4-5 en infusión de 50 minutos; y Cisplatino solución inyectable x 50 mg con una dosis de 35 mg intravenosos en los días 1-2-3-4-5 en infusión de 40 minutos.
B LDH (Deshidrogenasa Láctica), BhCG (Beta-Gonadotropina coriónica humana), AFP (Alfa-Feto Proteína), TGO (Transaminasa Glutámico-Oxaloacética), TGP (Transaminasa Glutámico-Pirúvica), Hb (Hemoglobina sérica).
C Tomografía por emisión de positrones.
D SUV (standard uptake value, por sus siglas en inglés), abreviatura de Valor de Captación Estándar. Es una medida semicuantitativa del grado de capta ción del radiofármaco en una región de interés, es utilizado para medir áreas de características malignas y diferenciarlas con las de comportamiento benigno.
Cuadro 4 Clasificación histopatológica de las neoplasias testiculares

Fuente: elaboración propia de los autores con base en las referencias 5 y 16.
Los seminomas representan aproximadamente el 50 % de todos los tumores de células germinales y aparecen más frecuentemente en la cuarta década de la vida si es “clásico”, y si es “espermatocítico” después de los 65 años (5). La variedad clá sica gonadal representa el 95 a 98 % de esos casos (inicia en las gónadas y realiza metástasis a otros sitios), mientras que la extragonadal lo hace en el 2 a 5 % (que tiene origen de células germinales, aunque el tumor no inicia en las gónadas sino en otras regiones anatómicas, siendo la región mediastinal y retroperitoneal las más frecuentes) 5.
Los tumores testiculares de células germinales representan menos del 2 % de los tumores malignos en general, siendo además las neoplasias malignas más frecuen tes en hombres de 15 a 34 años 5. Diversos son los factores que influyen en el desarrollo de la enfermedad, tales como raza blanca, antecedentes de criptorquidia, síndrome de Klinefelter, historia familiar en primer grado de cáncer de testículo, presencia de tumor contralateral, neoplasia intraepitelial testicular o infertilidad 16,17,18.
Histológicamente, los tumores de células germinales, tanto gonadales como extra gonadales, son iguales 7,15. Por su parte, los tumores no seminomatosos suelen ser más agresivos y se presentan con más frecuencia en la tercera década de la vida. La mayoría incluyen diferentes tipos de células, mientras que los seminomas generalmente se forman por un solo componente celular 5,7,15. Sin embargo, la presentación extragonadal del seminoma tiene mal pronóstico y resistencia al trata miento y no se encuentran protocolos de consenso estándar para su manejo 1,17.
Además de los seminomas, en el mediastino pueden localizarse teratomas o tumores no seminomatosos 19,20,21. Por lo anterior, se explica que el diagnóstico completo no es predominantemente clínico, debido a lo inespecífico de su presentación, por lo cual se deben efectuar estudios histopatológicos, imagenológicos y moleculares 5,18.
Como se evidenció en este caso, éstos últimos son muy importantes, pues permiten valorar la situación anatómica de la lesión y sus posibilidades diagnósticas y tera péuticas. En las radiografías de tórax o de abdomen pueden evidenciarse lesiones, aunque en muchas ocasiones pueden pasar desapercibidas o no observarse com pletamente; por lo que para determinar su tamaño, extensión, relaciones anatómicas, órganos comprometidos por vecindad y grado de actividad, son especialmente útiles el uso de escanografía de contraste y nuclear (PET-SCAN, tomografía por emisión de positrones), 5,18,22.
El uso rutinario de la resonancia nuclear magnética de tórax o de abdomen para estadificación es considerada por la Asociación Europea de Urología como costosa y de acceso limitado. No obstante, se subraya que puede resultar útil cuando la tomo grafía no es concluyente y está contraindicada por alergia a los medios de contraste, o cuando la dosis de radiación podría ser una preocupación 6,18.
Adicionalmente, se recomienda la ultrasonografía testicular bilateral para confirmar o descartar la presencia de masa escrotal concomitante 5,18,22. Por otro lado, debido a que los pacientes con estas lesiones tumorales pueden beneficiarse de tratamientos curativos mediante cirugía, quimioterapia u otros procedimientos, es indispensable obtener una biopsia de la lesión para realizar un diagnóstico histopa tológico que oriente al clínico sobre el tipo de tumor 5,18,22.
El principal diagnóstico diferencial con el seminoma es el coriocarcinoma, un tumor de células germinales de tipo no seminomatoso, altamente agresivo que, aunque menos frecuente que el seminoma, también afecta a hombres jóvenes 5,18,22. En el caso descrito, el diagnóstico histopatológico fue esencial, dado que el coriocar cinoma, a diferencia del seminoma, muestra diferenciación trofoblástica, lo que no se evidenció en el tejido de la biopsia extraída al paciente. Además, es muy poco frecuente que este tipo de tumor se origine de manera primaria en localizaciones extragonadales 5,18,22.
El marcador BhCG puede elevarse en ambos tipos de lesiones, lo que realza aún más la importancia de la diferenciación histológica, pese a que se ha reconocido que la elevación hormonal puede ser mayor en el coriocarcinoma, aunque otras investigaciones han demostrado que esta correlación no necesariamente siempre sucede, pues además del tipo de tumor influyen en su secreción otros factores como el tamaño de la lesión y el grado de diferenciación 5,18,22.
El marcador BhCG también permite evaluar la efectividad del tratamiento 5,18. Existen diferentes opciones de tratamiento, como la resección quirúrgica, la radiote rapia y la quimioterapia. Para determinar el tratamiento adecuado se requiere saber el estadio, mediante la clasificación TNM 18,23,24.
El manejo debe ser individualizado y, por lo general, los pacientes fallecen durante las etapas del diagnóstico o la instauración del manejo inicial 18,23,24, lo que no sucedió en este paciente, en el que se optó por el manejo quimioterápico de primera línea sobre el quirúrgico y el radioterápico, debido a su estadio avanzado (III). Al respecto, el tratamiento con quimioterapia primaria para el seminoma estadio IIC o superior tiene un grado de recomendación A de acuerdo con las guías colombianas y europeas de manejo 5,18.
A diferencia de otros reportes, en este paciente cabe destacar algunos contrastes clínicos importantes, tales como: la edad, pues el paciente tenía 19 años mientras que en otros casos descritos la edad de presentación es mayor, y la presentación fue extragonadal, a diferencia de la gran masa testicular descrita en otros casos 23,25. El uso de fibrobroncoscopia no se consideró en este paciente, al contrario de la literatura mencionada 25.
Otra diferencia importante radica en que el tratamiento no incluyó el manejo quirúrgico con orquiectomía, debido, justamente, a la presentación extragonadal del seminoma 23. Tampoco fue necesario la realización de cirugía pulmonar o mediastinal invasiva para resección de la masa tumoral, a diferencia de Guerra et al., quienes describen un paciente sometido a lobectomía 4. Por otro lado, la presentación clínica sindromática inicial coincide con los otros reportes, que también debutaron con síndrome de vena cava superior 6,25,26.
Este caso evidencia que las líneas de tratamiento empleadas, cuando son suministra das de forma oportuna y con el acertado estudio molecular e histológico, conllevan altas posibilidades de sobrevida 5,18. El tratamiento de referencia del seminoma en estadio IIA/B sigue siendo la radioterapia. En el estadio IIB o mayor, la quimioterapia (cuatro ciclos de etopósido y cisplatino EP o tres de BEP) constituye una alternativa a la primera, siendo la considerada en este paciente, acatando las recomendaciones internacionales. Al respecto, se ha evidenciado que cuatro ciclos de EP o tres de BEP pueden conseguir un grado similar de control de la enfermedad 3,20.
Se encontraron tres reportes en Colombia, de los cuales sólo uno debuta con trombo sis y colapso de la vena cava superior por masa mediastinal de células germinales, manifestado clínicamente con edema en esclavina 6; otro caso estuvo asociado a neoplasia hematológica como manifestación inicial 17, y otro más presentó localiza ción retroperitoneal 27, aunque este último, si bien tuvo componente de seminoma clásico, se caracterizó histopatológicamente como un tumor maligno de células ger minales mixto 27.
Conclusión
Los seminomas representan aproximadamente el 50 % de todos los tumores de cé lulas germinales. Los pacientes con seminoma de localización extragonadal presen tan una semiología variada y poco característica, planteando un desafío diagnóstico que requiere del buen juicio clínico al momento de evaluar los signos y síntomas para determinar cuáles serán las ayudas diagnósticas de imágenes y de laboratorio que confirmarán el diagnóstico. La sobrevida depende, en gran medida, del estadio diagnóstico inicial, siendo factores que contribuyen a la mortalidad el retraso en el diagnóstico definitivo, el abordaje inicial inadecuado y la resistencia al tratamiento.