Introducción
Streptococcus pneumoniae es una bacteria gram positiva, capsulada, con al menos 93 serotipos, de los cuales aproximadamente diez son los responsables del 62 % de las enfermedades neumocócicas invasivas globalmente 1-3). Antes de la introducción de las vacunas neumocócicas conjugadas era una causa común de enfermedad invasiva en niños, que incluye sepsis y meningitis, y el patógeno más aislado en la neumonía bacteriémica adquirida en la comunidad 1). También causa otras infecciones importantes de gravedad variable como osteoartritis, peritonitis y síndrome urémico hemolítico atípico. Más frecuentemente y en menor gravedad, es responsable de otitis media aguda, neumonía no bacteriémica adquirida en la comunidad, sinusitis, celulitis y bacteriemias aisladas. Inicialmente, suele colonizar la nasofaringe y puede persistir durante meses sin causar enfermedad, formando estructuras especializadas llamadas biopelículas 1,2).
Existen diferentes tipos de vacunas contra las enfermedades causadas por los neumococos, entre ellas se encuentra la vacuna de polisacáridos que incluye 23 serotipos de S. pneumoniae, la cual se recomienda para niños mayores de dos años y adultos mayores de 65 años. Las vacunas conjugadas, por su parte, están basadas en la unión de los antígenos polisacáridos con proteínas que son inmunogénicas e inducen una respuesta T dependiente con estimulación de los linfocitos B de memoria. Son las recomendadas para niños menores de dos años, además tienen la ventaja adicional de eliminar el estado de portador nasofaríngeo 3,4.
La Organización Mundial de la Salud (OMS) estima que las muertes por S. pneumoniae ocurren principalmente en países en vías de desarrollo, lo que ha impulsado a la vigilancia epidemiológica, enfatizando la caracterización de cepas de este microorganismo 5).
Esta revisión tiene como objetivo actualizar la información sobre los serotipos de S. pneumoniae causantes de enfermedad invasiva, en niños menores de cinco años residentes en Latinoamérica. Para este fin se hizo una revisión descriptiva de la información disponible en el último informe de la red SIREVA II (Sistema de Redes de Vigilancia de los Agentes Bacterianos Responsables de Neumonía y Meningitis), correspondiente a los de enero a diciembre de 2016, y que fue publicado por la Organización Panamericana de la Salud en diciembre de 2019.
Epidemiología
La neumonía neumocócica es responsable del 10 a 25 % de todas las neumonías, ocasionando alrededor de un millón de muertes anuales en todo el mundo 5,6). En cuanto a Latinoamérica y el Caribe se han reportado 1 600 000 casos de enfermedad invasiva por neumococo en niños menores de cinco años, con un estimado anual de 12 a 28 mil muertes 6).
Por todo ello, la neumonía neumocócica es considerada como una de las enfermedades más prevalentes y serias, tanto en los países desarrollados como en vías de desarrollo y afecta en primera instancia a los individuos con factores de riesgo como edad extrema o enfermedades cardiovasculares, pulmonares y hepáticas crónicas 7).
La vía de transmisión del neumococo es aérea, a través de gotas de saliva de portadores o de enfermos. Es un organismo sensible al calor, al frío y a la desecación, por lo tanto, la transmisión requiere de un contacto estrecho de persona a persona. Todas las edades, razas y sexos son susceptibles a esta enfermedad 8).
Serotipos
En 1957 se identificaron los primeros 80 serotipos de S. pneumoniae. En 1985 se descubrió el 16A y en 1995 los serotipos 10B, 10C, 12B, 25A y 33D. Actualmente, hay 93 serotipos reconocidos. La identificación se realiza utilizando la prueba de Quellung o hinchazón capsular, la cual es una reacción entre el antisuero específico y el antígeno del polisacárido capsular 8).
Vacunas antineumocócicas conjugadas
La primera vacuna antineumocócica conjugada (PCV, por sus siglas en inglés) fue PCV7 la cual se aprobó en el año 2000, ofreciendo protección contra siete serotipos (4, 6B, 9V, 14, 18C, 19F y 23F). Para 2015, PCV7 había sido reemplazada por PCV10 (PCV7 + los serotipos 1, 5, y 7F) o PCV13 (PCV10 + los serotipos 3, 6A, y 19A) en más de 130 países alrededor del mundo 9.
La inmunización con vacunas antineumocócicas conjugadas ha reducido significativamente los casos de enfermedades neumocócicas invasivas a nivel mundial por los serotipos incluidos en las mismas. La vacuna PCV13 contiene a los serotipos hallados con mayor frecuencia en Latinoamérica: 19F, 3, 14 y 1. Esta vacuna conjugada produce repuesta contra los serotipos vacunales; sin embargo, paralelamente se ha observado el fenómeno de enfermedad de reemplazo, al reportarse casos ocasionados por serotipos no vacunales 4,9,10. El fenómeno de enfermedad de reemplazo consiste en cambios capsulares de los neumococos que se encuentran colonizando la nasofaringe, de tal manera que pasan a predominar serotipos no vacunales 10).
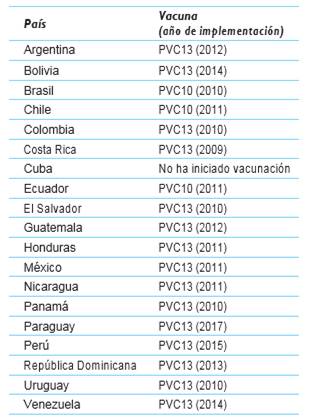
Actualmente, en Latinoamérica la vacuna PCV13 es la implementada por los programas públicos de vacunación de todos los países a excepción de Brasil, Chile y Ecuador en donde está implementada la PCV10 3,4,14. En Cuba no se ha iniciado la vacunación anti-neumococo, pero está actualmente en fase de evaluación clínica un candidato vacunal heptavalente que contiene los serotipos 1, 5, 6B, 14, 18C y 23F (PCV-TT) 12) (cuadro 1).
Serotipos más frecuentes circulantes en Latinoamérica
Para el año 2016, según los últimos datos disponibles en SIREVA II 17, existen diversidad de serotipos circulando en Latinoamérica. El país con mayor heterogeneidad fue Argentina. Sin embargo, el serotipo 19A fue el predominante en toda la región, aislándose con mayor frecuencia en Bolivia, Brasil, Chile, Colombia, Ecuador, Guatemala y Perú (figura 1 y cuadro 2).
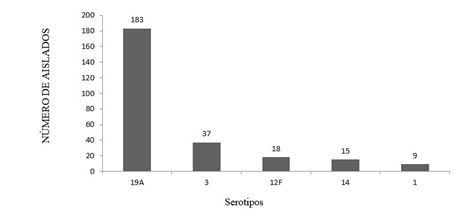
Figura 1 Serotipos de Streptococcus pneumoniae más frecuentes aislados en niños de Latinoamérica, año 2016. Fuente: referencia 17
Cuadro 2 Serotipos vacunales y no vacunales de Streptococcus pneumoniae aislados en niños de Latinoamérica, año 2016
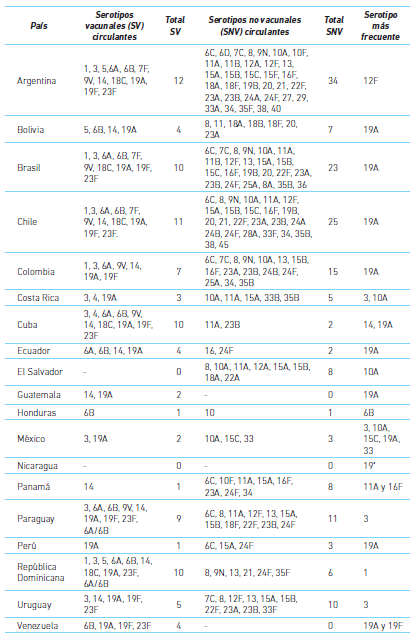
*: Tipificación parcial Fuente: referencia 17
Serotipo 19A
Es un serotipo asociado con enfermedad neumocócica invasiva y multirresistencia, aislado con frecuencia en líquido pleural 18. En países que incluyeron la vacunación con PCV y que no proporcionaba cobertura contra este serotipo, se observó un incremento progresivo de aislamientos del serotipo 19A 3. El serotipo 19A pasó a ser un serotipo vacunal con su incorporación en la vacuna PCV13. En el período 2010- 2015 el SIREVA II reportó que el 11,8 % (742 aislados) pertenecían al serotipo 19A. Haciendo contraste con el año 2016, el reporte de SIREVA II fue de 183 aislados de este serotipo, siendo el más prevalente en Latinoamérica para ese año, a pesar de que para el año 2015, ya 16 países de la región habían introducido la vacuna PVC13. Este dato lleva a inferir que la implementación de dicha vacuna ha sido baja o tiene algunas fallas 17,19.
Serotipo 3
El segundo serotipo más frecuente para 2016 en Latinoamérica fue el serotipo 3 con 37 casos. Al igual que el serotipo 19A se considera un serotipo vacunal causante de enfermedad neumocócica invasiva; sin embargo, existen casos documentados de neumonía necrosante pese a la vacunación con PVC13 20,21. Se ha inferido que el mecanismo de la neumonía necrosante por serotipo 3, es la acumulación rápida de los antígenos polisacáridos capsulares con reducción de la respuesta inmune humoral22
No puede descartarse la presencia de enfermedad invasiva por neumococo en niños vacunados, aunque tengan el esquema completo, porque un serotipo no vacunal pudiera ser el responsable de la infección. humoral 22).
Serotipo 12F
Actualmente es un serotipo no vacunal que se ha reportado en diversos países como consecuencia del fenómeno de reemplazo. Tiene alto potencial para causar enfermedad invasiva y en diversos estudios se ha encontrado ocasionando brotes 23,24. Fue el tercer serotipo más frecuente en Latinoamérica con 18 casos en 2016.
Serotipos 1 y 14
Ambos son serotipos vacunales presentes en PCV10 y PCV13. Para la región se reportaron quince casos del serotipo 14 y nueve casos del serotipo 1. Se ha descrito diseminación de clones internacionales del serotipo 14 resistentes a betalactámicos 25).
De manera interesante hay que destacar que en 2016 Argentina, Brasil y Chile presentaban más de veinte tipos de serotipos no vacunales en circulación; además, en Argentina es preocupante que el serotipo más frecuente sea un no vacunal (12F). Por su parte, en El Salvador todos los aislamientos correspondieron a serotipos no vacunales. Es muy probable que la elevada circulación de serotipos no vacunales en algunos países se deba al fenómeno de reemplazo mencionado anteriormente. En este sentido, no se puede descartar la presencia de enfermedad invasiva por neumococo en niños vacunados, aunque tengan el esquema completo, porque un serotipo no vacunal pudiera ser el responsable de la infección.
Es pertinente aclarar que un serotipo de reemplazo no necesariamente es invasivo o resistente a los antimicrobianos, muchos tienen un potencial invasivo menor. Las características de las cepas y serotipos circulantes varían en función de las áreas geográficas y de otras circunstancias epidemiológicas.
Conclusiones
La infección por S. pneumoniae se mantiene como la causa principal de la neumonía adquirida en la comunidad y de otras infecciones como meningitis, teniendo una alta incidencia en la mortalidad en Latinoamérica. La introducción de las vacunas conjugadas ha sido una buena estrategia para la inmunización en la población en riesgo y la eliminación de la portación nasofaríngea, además de contribuir indirectamente con la disminución de la resistencia antimicrobiana.
En Latinoamérica, la incorporación e implementación de la vacuna PCV13 sigue siendo una excelente opción debido a que proporciona cobertura frente a los serotipos más frecuentes 19A, 3, 14 y 1. Sin embargo, hay que resaltar que pese la introducción de la vacuna conjugada PCV13, el serotipo19A es el más frecuente en la región, por lo que se requiere evaluar si hay acceso adecuado a la vacuna. Por su parte, se ha evidenciado el fenómeno de enfermedad de reemplazo, comprobado en Latinoamérica con la circulación de diversidad de serotipos no vacunales, principalmente el 12F.
Es necesario realizar frecuentemente estudios epidemiológicos en los países latinoamericanos, a fin de monitorear las estrategias de vacunación y el efecto de las vacunas conjugadas en la región. Se requieren, además, investigaciones destinadas al diseño de nuevas vacunas dirigidas a otros antígenos del neumococo, por ejemplo, ciertas proteínas conservadas de superficie como la adhesina A, proteína A y proteína C, a fin de evitar el fenómeno de reemplazo capsular o vacunas que incorporen más serotipos como la 20vPnC 26 actualmente en fase 3, que incorpora los 13 serotipos de la PVC13 más los serotipos 8, 10A, 11A, 12F, 15B, 22F y 33F, ampliando así la cobertura hacia algunos serotipos que se están reportando en Latinoamérica como se describe en esta revisión, sobre todo el 12F de alto potencial invasivo.
Los autores de este manuscrito declaran no tener conflictos de interés.