Introducción
El cáncer de mama en la población colombiana se ha convertido en un verdadero reto para el sistema de salud. Se estima que en 2018 Colombia presentó cerca de 13 380 casos nuevos de cáncer de mama con una tasa estandarizada de 44,1 por 100 000 mujeres, convirtiéndose en el primer cáncer entre las mujeres colombianas (1).
Para el tratamiento avanzado, el tamoxifeno es el medicamento de elección dadas sus propiedades antagónicas; sin embargo, tiene un efecto estrogénico sobre el endometrio, que amerita su estrecha vigilancia, puesto que se ha reportado su asociación con cáncer endometrial de bajo grado en mujeres posmenopáusicas (2). Aun teniendo en cuenta esta relación y algunos otros efectos adversos frecuentes (3), sigue siendo de primera línea para el tratamiento del cáncer de mama debido a distintos factores, entre ellos su costo-efectividad y consideraciones positivas respecto al riesgo-beneficio, demostrando reducción del riesgo de recurrencia (34 % - 51 %) y mortalidad (24 %-37 %) (4).
Entre los factores que favorecen la aparición de hiperplasia endometrial se ha descrito un índice de masa corporal aumentado, síndrome de ovarios poliquísticos, terapia de reemplazo hormonal sistémica, diabetes, infertilidad e hipertensión. Otras condiciones predisponentes son la postmenopausia, nuliparidad, menopausia tardía, menarquía temprana y anovulación crónica (5-7).
Desde esta perspectiva, algunos autores proponen que aunque la supervivencia es el resultado buscado, no siempre se obtiene bajo los mejores escenarios dado el impacto en la calidad de vida del paciente y el deterioro en la calidad de vida de su núcleo familiar (8-10). Específicamente, en mujeres con hiperplasia endometrial se espera que estas se sometan a un tratamiento para esta nueva comorbilidad, bien sea progestágenos tanto orales como locales (sistema intrauterino liberador de levonorgestrel), ya que son eficaces para lograr la regresión de la hiperplasia endometrial sin atipia; mientras que en aquellas que la hiperplasia es atípica se ha recomendado la histerectomía total debido al riesgo de malignidad o progresión a cáncer (6).
El objetivo del presente estudio fue evaluar la relación de hiperplasia endometrial con el uso de tamoxifeno en pacientes con cáncer de mama en un centro de referencia oncológico de la ciudad de Barranquilla.
Materiales y métodos
Se realizó un estudio observacional analítico retrospectivo tipo casos y controles no pareados. La variable independiente fue definida como presencia o ausencia de hiperplasia endometrial posterior al inicio del tratamiento con tamoxifeno para cáncer de mama. Todas las participantes de este estudio tenían al menos 18 años. Los casos fueron definidos como pacientes con cáncer de mama como primer diagnóstico e hiperplasia endometrial diagnosticada mediante ecografía transvaginal posterior al inicio del tratamiento utilizado para combatir el cáncer de mama.
La definición de controles estuvo dada como pacientes con cáncer de mama como primer diagnóstico y no haber cursado con hiperplasia endometrial durante el tiempo posterior al inicio de tratamiento contra el cáncer de mama.
Con el fin de evaluar el periodo exacto de exposición, en la mayoría de los casos se encontró la fecha exacta del final del tratamiento; sin embargo, cuando no se pudo definir con certeza, se usó la última fecha reportada en la historia clínica donde se menciona el tratamiento. En las pacientes que recibieron el tratamiento en periodos no consecutivos, el tiempo total de uso se calculó sumando dichos períodos. Se excluyeron del estudio mujeres que previamente al inicio del tratamiento tuvieran hiperplasia endometrial o se les hubiera realizado histerectomía.
Se realizó un análisis descriptivo según la naturaleza cualitativa de las variables de estudio. Para evaluar la relación del tratamiento con tamoxifeno y la hiperplasia endometrial se calcularon la odds ratio (OR) y los intervalos de confianza (IC) del 95 % y se realizaron pruebas de tendencia. Se aplicó la prueba Chi-cuadrado o la prueba exacta de Fisher para el análisis bivariado. Posteriormente, se realizó un análisis multivariable tipo regresión logística multivariada incondicional; fueron considerados significativos valores de p menores o iguales a 0,05. Todos los análisis estadísticos fueron realizados usando SPSS v.25®.
Este estudio se acoge a la normatividad sobre investigación con seres humanos y fue presentado y aprobado por el Comité de Ética de la Universidad del Norte.
Resultados
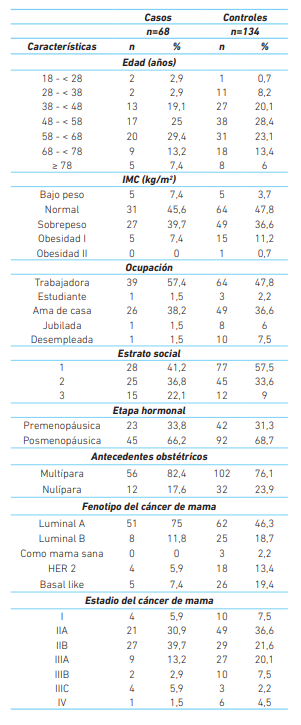
Fueron incluidos 68 casos y 134 controles. La mayoría de las participantes eran multíparas, de 48 años o mayores, posmenopáusicas, con un índice de masa corporal en rango de normalidad, de estrato socioeconómico bajo (estratos 1 y 2) y trabajadoras. El fenotipo del cáncer de mama predominante fue el luminal A (en 75 % de los casos y 46,3 % de los controles), siendo el estadio II el mas predominante en ambos grupos (cuadro 1).
De las 202 mujeres estudiadas, 33,7 % fueron diagnosticadas con hiperplasia endometrial secundaria al tratamiento antineoplásicos; de éstas, 59 (86,7 %) usaron tamoxifeno, la mayoría (37,2 %) por un lapso de 6-11 meses conllevando a una hiperplasia sin atipias en el 59,1 %. Nueve de los 68 casos (13,2 %) no usaron el medicamento.
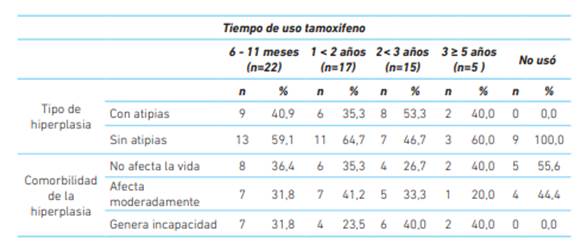
La hiperplasia endometrial con atipias fue mayor entre las usuarias de tamoxifeno a largo plazo (53,3 % en las usuarias de 2 -3 años) que, en las no usuarias, en quienes la hiperplasia sin atipias fue la única presente; sin embargo, la hiperplasia sí generó incapacidad en la mitad de las usuarias del medicamento de 4 - ≥ 5 años (50 %) (cuadro 2).
Cuadro 2 Características de pacientes con hiperplasia endometrial tras el diagnóstico de cáncer de mama en relación con la duración del tratamiento con tamoxifeno.
El 86,7 % de los casos y el 62,7 % de los controles usaron tamoxifeno, encontrándose el uso del tamoxifeno asociado a hiperplasia endometrial (OR=3,90; IC95 %: 1,781- 8,55). Las mujeres pertenecientes al estrato social 1 tuvieron 0,29 veces menos probabilidad de presentar hiperplasia endometrial que aquellas de un estrato más alto. Mientras que las mujeres que padecen de cáncer de mama de fenotipo luminal A presentaron 4,3 veces más riesgo de hiperplasia endometrial (IC95 %: 1,53- 11,94) que aquellas que presentan el fenotipo basal like (cuadro 3).
Tener receptores hormonales positivos individuales (RE o RP) o combinados (RE y RP) se identificó como factor asociado a hiperplasia endometrial, siendo mayor esta asociación cuando se portan de manera individual, pero siendo significativo solo para el receptor de estrógenos (p< 0,05). La mayoría de las pacientes presentó ambos receptores hormonales positivos (0R = 4,26; IC 95 %: 1,77-10,23) (cuadro 3).
De los 68 casos, el 32,35 % usó tamoxifeno en el intervalo de duración más corto evaluado (OR= 6,43, IC95 %: 2,52-16,44), y 5,88 %, estuvieron en el intervalo de duración mayor 4- ≥5 años (OR= 1,11, IC95 %: 0,31-4,02). Con respecto a los controles el 37,1 % no usó el medicamento; sin embargo entre quienes lo usaron el 77,48 % lo hicieron por mas de un año.
Se exploraron varios modelos de regresión logística evaluando el papel del uso del tamoxifeno con la hiperplasia endometrial. En cada uno de ellos se realizaron los ajustes correspondientes por covariables asociadas a hiperplasia endometrial y en todos se observó asociación de las variables en estudio (cuadro 4).
Cuadro 3 Asociación de hiperplasia endometrial con factores demográficos y clínicos. Barranquilla, 2012-2017.
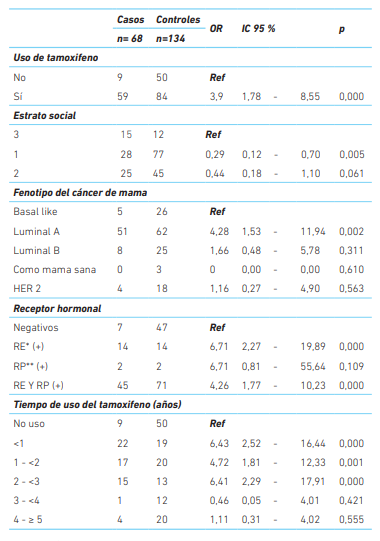
*Receptor estrógenos.
**Receptor progesterona. OR. Odds ratio
Cuadro 4 Modelos de regresión para hiperplasia relacionada con el uso de tamoxifeno.
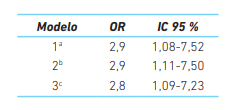
a Ajustado por: Edad, IMC, estrato social, antecedentes obstétricos, estadio del cáncer, radioterapia, quimioterapia, receptor hormonal y uso de tamoxifeno.
b Ajustado por: Tiempo de uso de tamoxifeno, edad, receptor hormonal, estadio del cáncer, radioterapia, quimioterapia y comorbilidades.
c Ajustado por: Tiempo de uso de tamoxifeno, edad, receptor hormonal, estadio del cáncer, radioterapia y quimioterapia.
Discusión
Este estudio corrobora la asociación entre el uso de tamoxifeno y el desarrollo de hiperplasia endometrial. Dicha asociación es similar a las publicadas por el estudio de Chalas et al. (11) que muestra un riesgo relativo de 2,06 para el desarrollo de hiperplasia endometrial en cualquier grupo de mujeres. Sin embargo, cabe destacar que este estudio corresponde a un ensayo clínico, en el cual las pacientes fueron seguidas cercanamente para lograr diagnóstico y monitoreo adecuado de cualquier cambio presentado a nivel ginecológico.
Los factores aquí estudiados y su relación con la hiperplasia en pacientes en tratamiento con tamoxifeno han sido previamente estudiados; entre ellos, se pueden destacar el hecho de ser posmenopáusica, nulípara e infértil; algunas comorbilidades como diabetes, hipertensión y obesidad también se asocian con un mayor riesgo, el tiempo de uso y la dosis acumulada también fueron factores de riesgo asociados a hiperplasias endometrial (12-14).
En cuanto al tiempo de uso, Dalbert et al., estudian 152 pacientes con cáncer de mama tratadas con tamoxifeno y encuentran que el tiempo de tratamiento influye desfavorablemente en la incidencia de afecciones endometriales, pues la mayor cantidad de pacientes con hiperplasia endometrial simple se presentaron luego de 24 meses de uso (15), lo que muestra gran diferencia con los resultados obtenidos en este estudio, donde el las participantes con menos de un año de uso obtuvo un probabilidad de desarrollar la hiperplasia seis veces mayor comparada con el resto de intervalos. Esto podría explicarse por dos razones: la primera es que muchas de las pacientes estuvieron en tratamiento con tamoxifeno de manera intermitente y los tiempos de uso totales fueron obtenidos de la suma total de los intervalos en los que estuvieron en tratamiento; en segundo lugar, una gran proporción de las pacientes que hicieron parte del grupo de casos estuvieron en tratamiento continuo en el tiempo indicado.
En el estudio de Swerdlow y Jones (16) el riesgo para desarrollar cáncer endometrial se incrementaba a medida que aumentaba el peso de las participantes, sobre todo en mujeres posmenopáusicas. En este estudio los puntos de corte para establecer IMC fueron similares, por lo que los resultados también lo fueron; sin embargo, la razón de disparidad (OR) obtenida no fue significativa. Otros estudios han mostrado resultados similares (17-19).
Aunque se ha evidenciado que la etapa hormonal (pre o posmenopáusicas) y los antecedentes obstétricos (ser multípara o nulípara) se relacionan con alteraciones del endometrio en pacientes tratadas con tamoxifeno (20), este estudio no encontró una asociación significativa de estas variables.
El estrato social más bajo demostró ser un factor protector significativo para el desarrollo del efecto adverso. Esto puede explicarse porque la mayoría de pacientes de los estratos más bajos tienen un menor acceso a los servicios del sistema de salud (21-23), con lo que podría pensarse que en esta población podría existir un subdiagnóstico de la hiperplasia endometrial asociada al tamoxifeno. De igual forma, la mayoría de las pacientes del estudio pertenecen a estratos bajos, dado que la institución participante cuenta con gran afluencia de usuarios de bajos recursos.
Otro de los resultados significativos del estudio fue la relación entre los distintos fenotipos reconocidos para cáncer de mama con el riesgo de desarrollo de hiperplasia endometrial, encontrándose asociación con el fenotipo Luminal A. Los tumores luminales han mostrado una mayor expresión de receptores hormonales positivos, por lo que está indicado tratamiento con un modulador selectivo de los receptores estrogénicos, como el tamoxifeno (24,25), más usado a nivel nacional para el cáncer de mama, y del cual sí se encontró asociación con la hiperplasia endometrial. Actualmente, no se ha descrito un tratamiento específico para pacientes con tumores con el fenotipo en mención, lo cual podría ser una nueva aproximación práctica para dicho tratamiento (26,27).
El uso de tamoxifeno es un factor de riesgo para el desarrollo de hiperplasia endometrial, incrementando 2,9 veces la probabilidad de padecerla en las usuarias, por lo cual sería ideal realizar seguimiento de las mujeres que reciban este tratamiento y aún más en las que presenten síntomas sugestivos de dicha complicación, como sangrado vaginal anormal o el manchado. Especial cuidado merecen aquellas mujeres con cáncer de mama con receptores hormonales positivos de estrógenos o con diagnóstico inmunohistoquímico de fenotipo Luminal A, puesto que presentan mayor riesgo que aquellas con fenotipo Basal like (25).
Este estudio mostró que no hay un gradiente biológico asociado al tiempo de uso del tamoxifeno, ya que el mayor riesgo se presentó en quienes fueron tratadas por tres años o menos, más concretamente en aquellas que lo usaron por 6 a 11 meses. Sin embargo, sí se relacionó una mayor duración del tratamiento con una mayor proporción en la generación de hiperplasia endometrial con atipias. Por lo mencionado, el médico debe sopesar cuidadosamente la relación riesgo-beneficio, pues a pesar de ser el tamoxifeno un efectivo medicamento de primera línea para el cáncer de mama, puede generar complicaciones incapacitantes y que disminuyan la calidad de vida.
Una potencial limitación de este estudio se relaciona con utilizar una base de datos proporcionada por un centro oncológico en donde el tratamiento estándar es el uso de tamoxifeno en la mayoría de mujeres con cáncer de mama que son elegibles para el uso del medicamento. Por lo tanto, efectos del uso del medicamento serán frecuentes es las pacientes evaluadas en el estudio, sin que estos exacerben el metabolismo normal del mismo en el organismo.