Introducción
El cáncer de próstata es la quinta causa de muerte en el mundo. Según las estimaciones de GLOBOCAN para el año 2018 se reportaron 1 276 106 casos nuevos a nivel mundial. Respecto a la epidemiología local, el análisis de la situación en salud en Colombia para el 2019 reporta que el cáncer de próstata es el segundo cáncer más común, el tercero en mortalidad con un 7,3 % y tasa de 15,34 por cada 100 000 hombres (1,2).
Diversas moléculas biológicas se han relacionado con la patogénesis del cáncer. Entre estas, se ha planteado que los microARN contribuyen al desarrollo de la neoplasia prostática, involucrándose en la proliferación celular, migración e invasión tisular, angiogénesis, metabolismo tumoral e invasión inmunológica.
Los microARN son pequeñas moléculas endógenas de ARN no codificante, compuestas por 18 a 22 nucleótidos, encargadas de regular la expresión génica.
La biogénesis de estas moléculas se compone de diferentes pasos. Inicialmente, los microARN se transcriben en el núcleo a partir de precursores largos de ARN llamados microARN primarios o (pri-microARN, del inglés primary transcritps) el cual es recortado posteriormente por la enzima Drosha (ribonucleasa ARN-específica doble-trenzada) en el núcleo para producir pre-miRNA con las estructuras específicas de la horquilla de 70 nucleótidos (también llamadas los precursores de la horquilla), este es exportado desde el núcleo al citoplasma por la exportina 5. En el citoplasma, la proteína Dicer y la proteína quinasa activadora dependiente de ARN de cadena doble inducible por interferón forman el complejo de procesamiento de los pre-microARN. Al ser exportados los pre-microARN al citoplasma son reconocidos por este complejo, el cual tiene como finalidad la formación de una cadena madura de microARN y su cadena complementaria, denominada la cadena pasajera. Posteriormente, el complejo se une a la proteína Argonauta 2, lo cual genera el complejo silenciador inducido por microARN (miRISC). Este complejo se encarga de seleccionar la cadena madura encargada de liderar el silenciamiento. El microARN se unirá a su blanco biológico de forma complementaria generando inhibición de la traducción o desestabilización del ARNm blanco (3).
Su papel en la carcinogénesis está vinculado a las diferentes mutaciones que ocurren en las células tumorales; la expresión desregulada de los microARN, ocurre a través de varios mecanismos, tales como amplificación o deleción de genes, cambios epigenéticos, regulación de los factores de transcripción o modificación postranscripcional. La expresión alterada, repercute en las características del cáncer, el mantenimiento de la señalización proliferativa, evasión de los supresores de crecimiento, resistencia a la muerte celular, activación de la invasión y metástasis, así como la inducción de angiogénesis. La identificación de los patrones de aumento o disminución de los microARN, podría tener utilidad para establecer el diagnóstico temprano, tratamiento y pronostico en el cáncer de próstata (4-8).
Esta revisión tiene como objetivo presentar y sintetizar la evidencia científica disponible a la fecha sobre la relación de los microARN y la patogénesis del cáncer de próstata.
Métodos
Se realizó una recolección de artículos en los idiomas inglés y español en PubMed, ScienceDirect, Medline complete, Cochrane, Scopus y UpToDate. Se seleccionaron publicaciones de los últimos seis años y se complementó la búsqueda mediante la selección de bibliografía referenciada en los textos identificados inicialmente, además de información encontrada en artículos con fecha anterior de publicación.
Generalidades
Los microARN son pequeñas secuencias de ARN no codificante, sintetizadas en el núcleo. Se encargan de regular el papel de los ARNm y su expresión génica al inhibir el proceso de traducción. La proteína resultante de la traducción del ARNm en específico se disminuye, por lo cual se ven afectados todos los procesos biológicos en los que participa. Específicamente, en el caso de las neoplasias, los microARN estimulan oncogenes -conocidos como oncomiRs-, o alteran el funcionamiento normal de los supresores tumorales. Los microARN se expresan de forma diferencial en las diferentes etapas del desarrollo de la neoplasia prostática (9,10).
Proliferación y crecimiento celular tumoral
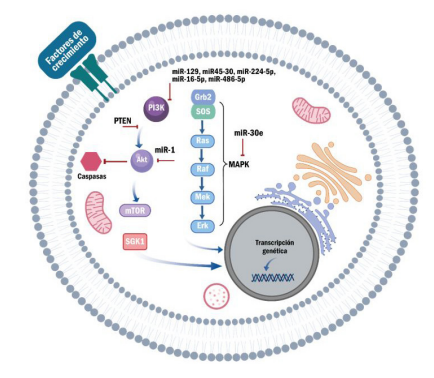
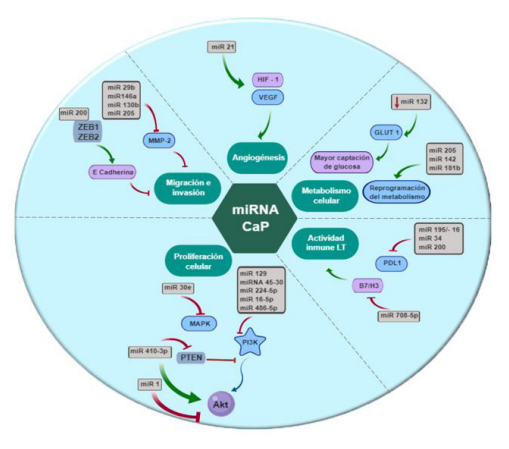
La activación anormal de la vía del PI3K (phosphatidylinositol 3-kinase por sus siglas en inglés) (figura 1) resulta en la alteración de los mecanismos que controlan el crecimiento celular, lo cual favorece la proliferación descontrolada. La vía de PI3K es fundamental en las diferentes neoplasias, entre estas el cáncer de próstata (11). Específicamente, miR-129, miR45-30, miR-224-5p, miR-16-5p y el miR-486-5p se han asociado a la supresión de la vía del PI3K al inhibir factores de transcripción miembros de la familia SMAD (segundo mensajero encargado de llevar información al núcleo celular) (12).
El miR-30e, a su vez, inhibe la activación de las MAPK (Mitogen-Activated Protein Kinases por sus siglas en inglés), impactando igualmente en la supervivencia tumoral. El miR-1 inhibe la proliferación celular al bloquear la señalización mediante el blanco AKT (proteína cinasa B, por sus siglas en inglés). Por el contrario, se ha reportado que la sobreexpresión de miR-410-3p promueve la proliferación de células tumorales prostáticas al estimular la señalización por AKT y disminuir la señalización por PTEN (phosphatidylinositol-3,4,5-trisphosphate 3-phosphatase, por sus siglas en inglés) (13-17) (cuadro).
Migración tumoral e invasión tisular
La E-cadherina evita la invasión tisular y disminuye la migración celular. Específicamente, la cadherina 11 se expresa de forma aberrante en las células cancerígenas prostáticas, facilitando la invasión del hueso por estas células (18-20). La familia miR200 se une a ZEB1 y ZEB2 (zinc finger E-box-binding homeobox 1 por sus siglas en inglés). Estas son moléculas que actúan como represores de la E-cadherina durante su transcripción, favoreciendo la invasión tumoral. En cuanto al microambiente tumoral se ha visto que la expresión de miR-29b, miR-146a, miR-130b y miR-205 (cuadro) pueden inhibir la actividad proteolítica de la MMP-2 (metaloproteinasa 2) disminuyendo la capacidad de la neoplasia para infiltrar tejidos adyacentes (21).
Inducción de la angiogénesis
La sobreexpresión de miR-21 en líneas celulares de cáncer de próstata induce angiogénesis, al estimular la expresión de HIF-1 (hypoxia inducible por sus siglas en inglés) y el VEGF (vascular endothelial growth factor, por sus siglas en inglés) (22).
Metabolismo celular en células tumorales
En lo referente a la participación de los microARN en el metabolismo celular en el cáncer de próstata, se ha reportado la interacción principalmente miR-205, miR-142 y miR-181b estimulando la captación y la utilización de glucosa. La disminución en la expresión del miR-132 se asocia con una regulación al alta de GLUT1 (glucose transporter 1, por sus siglas en inglés), lo que ocasiona una mayor captación de glucosa y secreción de lactato, favoreciendo el crecimiento tumoral (23).
Evasión inmunológica
La sobreexpresión de moléculas co-inhibitorias de la activación de células T como B7x, PD-L1 y B7-H3 en células tumorales prostáticas se asocia a una evolución tórpida de la enfermedad. El miR-708-5p controla la proliferación celular al bloquear directamente la molécula co-inhibitoria B7/H3. Por lo anterior, impide la evasión del sistema inmune y permite la activación de las células T (24).
El complejo PD-L1/PD1 es de vital importancia en el comportamiento y la evasión inmune de las células tumorales en el cáncer de próstata. Al unirse PD-L1 (programmed death-ligand 1, por sus siglas en inglés) con PD1 (programmed cell death protein 1 por sus siglas en inglés), se evita que las células T eliminen las células tumorales. Los microARN que se han asociado a la disminución en la expresión de PDL1, son miR-195/-16 y las familias de miR-34 y miR-200 (19,25). En consecuencia, al disminuirse la expresión de PDL1, las células T reconocen las células tumorales (figura 2).
MicroARN como biomarcadores prometedores en el cáncer de próstata
Los microARN se han medido en diferentes tejidos y líquidos corporales. En relación con el cáncer de próstata se ha identificado una sobreexpresión plasmática de miR-21, miR-125b, miR-126, miR-141, let -7, miR-205 y miR-375 (cuadro). De igual forma, en tejido prostático se ha encontrado sobreexpresión de miR-20a y en orina se evidencia un incremento de miR-21, miR-141 y miR-375 (26-28). La identificación de la sobreexpresión de estos microARN podría representar utilidad para el diagnóstico de la enfermedad (3,29-31).
Se sugiere que los microARN podrían tener relevancia al diferenciar las etapas de la enfermedad, entre ellas cáncer localizado o metastásico. Una sobreexpresión de miR-141, miR-200 y miR-375 ha sido reportada en cáncer de próstata avanzado. De igual forma, se han relacionado con la agresividad de la neoplasia prostática miR-17 y miR-192 (32,33).
Respecto a los microARN como biomarcadores en el tratamiento del cáncer de próstata se propone su capacidad de diferenciar entre cáncer de próstata sensible a la castración y resistente a esta. En este último, se encuentran disminuidos los miR-125b-2 y miR-708 y sobreexpresados el miR-375, miR-141, miR-143, miR-362-5p, miR-214, let-7i y miR-545 (27,29).
Se ha corroborado la utilidad de los microARN como moléculas tanto sensibilizantes, como asociadas al desarrollo de resistencia al tratamiento en cáncer de próstata. Se ha identificado la sobreexpresión de miR-34a, miR-205 y miR-31 asociada a la sensibilidad a los taxanos. De igual forma, se asocia la sobreexpresión de miR-106b con la resistencia a la radioterapia. Por el contrario la sobreexpresión de miR449a confiere mayor sensibilidad a esta (34-40).
Aplicabilidad clínica de los microARN
La importancia clínica del estudio de los microARN radica, no solo en la posibilidad del diagnóstico en etapas tempranas de la enfermedad, lo cual, lleva a un mejor pronostico; si no también el uso de estas moléculas para tratar la neoplasia.
La intervención terapéutica utilizando la transfección de microARN específicos se ha estudiado recientemente y el interés por conocer su utilidad es cada vez mayor. Según el mecanismo de acción conocido de los microARN, la terapia debe ser establecida mediante dos estrategias básicas. Una de ellas es reemplazar los microARN disminuidos por microARN sintéticos, la otra es añadir nucleótidos modificados generando mutaciones denominadas sin sentido, lo que se conoce como (anti-microARN). Actualmente se encuentran en desarrollo las terapias para el CaP utilizando microARN. Deben surgir más estudios que evalúen la respuesta a la terapia génica en humanos, ya que hasta ahora los anteriores se unen con colesterol, dextrano, fosfato de calcio, liposomas, dendrímeros, nanopartículas, entre otros compuestos, e ingresan a la célula mediante endocitosis. En relación a los mecanismos físicos, se puede transferir el microARN por medio de electroporación o microinyección (41, 42).
Respecto a la transfección, se ha visto que el mecanismo más eficaz de entrega de los microARN es mediante el uso de nanopartículas. Un estudio realizado demostró la efectividad experimental de este mecanismo, para la transfección in vitro del miR-145 a las células tumorales de próstata (43).
En la actualidad, se puede evidenciar cómo el conocimiento de los microARN, ha permitido el estudio de diferentes drogas experimentales que tienen como diana terapéutica estas biomoléculas, entre estos Miravirsen, el cual es un antimicroARN del miR-122, utilizado en el tratamiento de la hepatitis C, el cual se encuentra en estudios clínicos fase 2. Respecto al uso clínico de estas moléculas en cáncer, el MRX34, la cual es una reconstrucción sintética del miR-34a (44-46).
Conclusiones
Durante la revisión de los diferentes estudios se evidencia de una manera sólida la identificación mediante el uso de la técnica RT-qPCR de los microARN miR-129, miR-30e, miR-1, miR-410-3p, miR-205, miR-21 y miR-20a como potenciales biomarcadores del cáncer de próstata en estadio temprano.
La expresión diferencial de los microARN en el cáncer de próstata es un tema que aún continua en estudio. Colombia, aún no cuenta con estudios experimentales publicados y enfocados a la medición de la expresión diferencial de los microARN en población local con cáncer de próstata. Sin embargo, se encuentran disponibles revisiones de tema, en relación con la utilidad de estas moléculas en diferentes escenarios clínicos.
Las revisiones publicadas sugieren la relación de los microARN con la patogénesis del cáncer de próstata y su pertinencia como biomarcadores para el diagnóstico y tratamiento de la enfermedad. Evidenciando la necesidad de que la comunidad científica de Colombia inicié investigaciones en esta área en la población local con miras a su uso en la práctica clínica.