Introducción
Gracias a la terapia antirretroviral y políticas internacionales se ha logrado un descenso en la mortalidad por VIH desde 20051 que ha redundado en una población con VIH más envejecida. Por otro lado, el riesgo cardiovascular en esta población es mayor. Dicho riesgo fluctúa entre 40 % a 75 % más que la población general2,3 y se ha asociado a aterosclerosis, inflamación crónica, activación inmune y terapia antirretroviral4. El estudio Data Collection on Adverse Events of Anti‐HIV Drugs evidencia que los antirretrovirales son un factor individual para el incremento del riesgo cardiovascular5.
Los inhibidores de proteasa (IP) son los antirretrovirales que generan mayor alteración lipídica6. Por el contrario, los inhibidores de integrasa han mostrado un mejor comportamiento lipídico, particularmente dolutegravir7. En el intermedio están los inhibidores de transcriptasa inversa análogos de nucleósidos/nucleótidos (ITIAN) y no análogos (ITINN). Sin embargo, los inhibidores de entrada presentan el mejor comportamiento lipídico8.
Conocer el impacto en el perfil lipídico de cada antirretroviral puede ser clave al escoger el esquema de tratamiento, particularmente en pacientes con alto riesgo cardiovascular. Para esto, se hace necesaria la síntesis periódica de la evidencia. Entre las síntesis previas, se encuentran los metaanálisis de Patel et al.9 y de Snedecor et al.7, quiénes han confirmado el efecto benigno de los inhibidores de integrasa sobre el perfil lipídico, aunque estos han sido enfocados sobre pacientes naive. El presente estudio buscó evaluar la mejor evidencia disponible sobre el perfil lipídico en pacientes con VIH que hicieron cambio de su terapia antirretroviral hacia esquemas con inhibidores de integrasa, comparándolos con aquellos que no. Además de incluir evidencia relacionada con dolutegravir, raltegravir y elvitegravir, como los metaanálisis citados previamente, se incluyó también evidencia relacionada con bictegravir.
Materiales y métodos
Este estudio fue una revisión sistemática con intención metaanalítica siguiendo el manual Cochrane. El protocolo fue registrado en PROSPERO con código CRD42020147393. Se identificaron palabras clave a partir de la pregunta: “En pacientes mayores de 16 años con virus de inmunodeficiencia humana, los esquemas antirretrovirales que incluyen inhibidores de integrasa comparados con aquellos esquemas antirretrovirales que no los incluyen, ¿presentan cambios en el perfil lipídico?”. Las palabras clave utilizadas en la búsqueda de la literatura fueron: HIV, human immunodeficiency virus, integrase inhibitors, raltegravir, elvitegravir, dolutegravir, bictegravir, cholesterol, dyslipidemia, triglycerides, high density cholesterol, low density cholesterol, clinical trials, cohort, case and controls. Estas se organizaron en sintaxis de búsqueda adaptadas para cada repositorio. La búsqueda incluyó publicaciones desde 1997, año de inclusión del término Integrase Inhibitors en Medline, hasta 20 de diciembre de 2019, fecha de la última búsqueda. Esta se realizó en PubMed, Scopus, OVID, LILACS y CENTRAL aplicando terminología MeSH, DeCS y búsqueda libre de términos. También incluyó repositorios como Clinical Trials, y literatura gris en Google Scholar. Se incluyeron estudios en inglés, español, portugués, francés e italiano.
De los resultados, se seleccionaron artículos de estudios experimentales y observacionales que cumplieran los siguientes criterios de inclusión: población mayor de 16 años, con VIH y en terapia antirretroviral. Que evaluaran al menos uno de los siguientes parámetros: colesterol total, colesterol LDL, colesterol HDL o triglicéridos. Al menos dos mediciones: antes y durante el tratamiento, en mínimo 12 semanas. Fueron excluidos estudios sin valores de medición de lípidos. La selección se realizó por dos evaluadores de forma independiente. Las diferencias en esta fueron dirimidas por consenso. Los datos faltantes se solicitaron a los autores vía correo electrónico.
Posteriormente se caracterizaron los estudios. Dos investigadores de forma independiente evaluaron la calidad y riesgo de sesgo con las herramientas RoB 2.010 para estudios experimentales y ROBINS-I11 para estudios observacionales. Las diferencias en la evaluación fueron dirimidas por un tercer evaluador.
Las medidas reportadas en medianas se convirtieron a medias basándose en la técnica propuesta por Wan et al.12. Los errores estándar fueron convertidos a desviaciones estándar dividiéndolos entre la raíz cuadrada de la muestra. Las unidades reportadas en mmol/L se convirtieron a mg/dL así: para colesterol total, LDL y HDL el valor reportado se dividió entre 0,02586 y para triglicéridos entre 0,01129. En estudios con resultados en gráficas, los datos se extrajeron usando la herramienta WebPlotDigitizer 4.213.
Inicialmente, se hizo un análisis exploratorio con forest plot para identificar tendencias. Posteriormente, se realizó síntesis cuantitativa con aquellos estudios que fueran comparables entre sí. La evidencia se sintetizó por modelo de efectos aleatorios buscando manejar la heterogeneidad entre estudios que no fuera observable. Se estimó la medida de síntesis con intervalo de confianza del 95 % e intervalo de predicción del 95 %. La heterogeneidad entre estudios fue cuantificada por Tau de forma relativa e I² de forma absoluta. La síntesis cualitativa de la evidencia se realizó siguiendo la guía SMF-ICONS-Quant14. Para análisis de sensibilidad se usó la metodología de gráfico de embudo, teniendo como criterio de realización mínimo diez estudios por metaanálisis.
La aprobación ética y consentimiento informado de pacientes no fueron requeridos dada la naturaleza del presente estudio.
Resultados
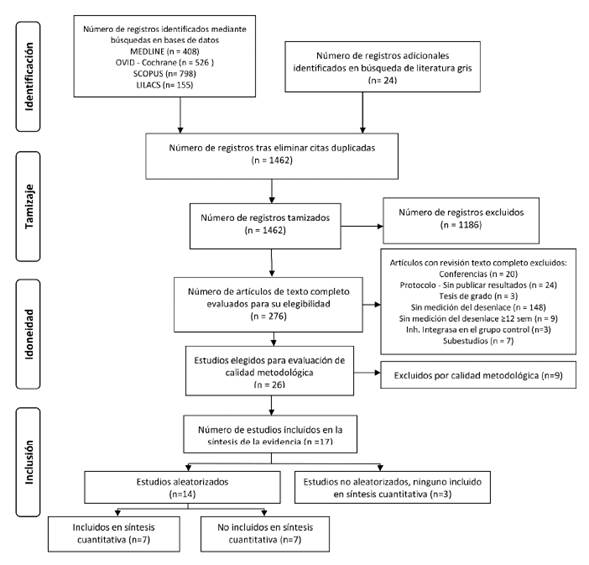
El diagrama de flujo de resultados de búsqueda y selección de la evidencia puede verse en la figura 1.
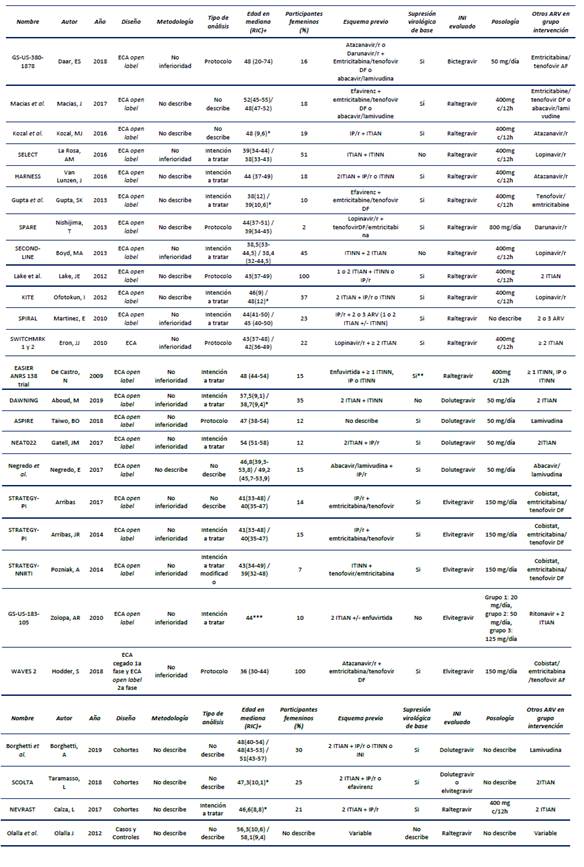
Los 26 estudios seleccionados para evaluación de calidad se publicaron entre 2009 y 2019, de los cuales 20 fueron ensayos clínicos aleatorizados abiertos, un ensayo clínico fue cegado y otro cegado en las primeras 48 semanas y abierto en semanas posteriores. Se identificaron tres estudios de cohorte y uno de casos y controles. Entre los ensayos clínicos, 14 fueron de no inferioridad, uno de superioridad y el resto no lo describió. Dentro de estos, 15 tuvieron un enfoque de análisis por intención a tratar y tres por protocolo, el resto no lo describió. En estos últimos, se buscó deducir el análisis utilizando el texto (ver anexo).
En 14 estudios evaluaron esquemas con raltegravir, seis con dolutegravir, cinco con elvitegravir y uno con bictegravir. La comparación más frecuente fue con esquemas con inhibidores de proteasa potenciados con ritonavir (IP/r) en 11 estudios, con ITINN en siete, IP/r+ITIAN en cinco, inhibidores de entrada en uno y el resto no lo describió. En 15 estudios se evaluaron parámetros lipídicos a las 48 semanas, 44 % reportó uso de hipolipemiantes como estatinas entre 0 % a 30 % y 56 % de los estudios no reportó dicho uso. La población de estos estudios estuvo entre 30 y 60 años. En 18 estudios se incluyó 2 % a 51 % de población femenina y sólo dos incluyeron población 100 % femenina, el resto no lo describió. El 80 % de los estudios garantizó supresión viral al ingreso, mientras que 16 % no lo garantizó y 4 % no lo describió.
Evaluación de calidad
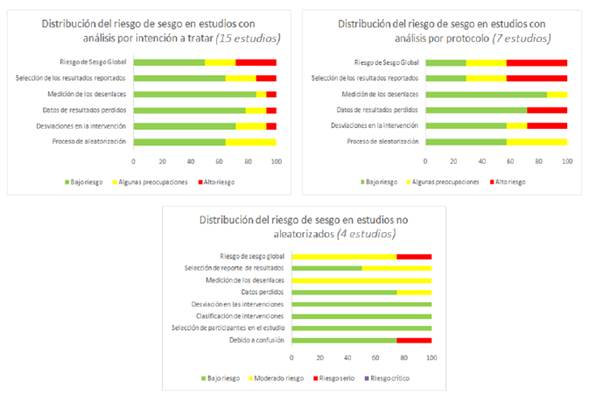
De los 15 estudios con análisis por intención a tratar, las principales fuentes de riesgo de sesgo fueron desviaciones en la intervención, datos de resultados perdidos y selección de resultados reportados (figura 2). Fueron excluidos cinco estudios por estas razones.
En los siete estudios con análisis por protocolo las principales fuentes de riesgo de sesgo fueron desviaciones en la intervención, datos de resultados perdidos y selección de resultados reportados (figura 2). Tres estudios fueron excluidos por estas razones. En los tres estudios de cohorte y en el de casos y controles, el principal riesgo de sesgo fue la selección en reporte de resultados (figura 2). Un estudio fue excluido por riesgo serio de sesgo por ausencia en la descripción del manejo de variables de confusión.
Los 17 estudios identificados con buena calidad sumaron una población de 5 683 participantes y en estos se exploró tendencias. Siete estudios fueron viables para síntesis cuantitativa de la evidencia incluyendo 2 878 participantes.
Raltegravir
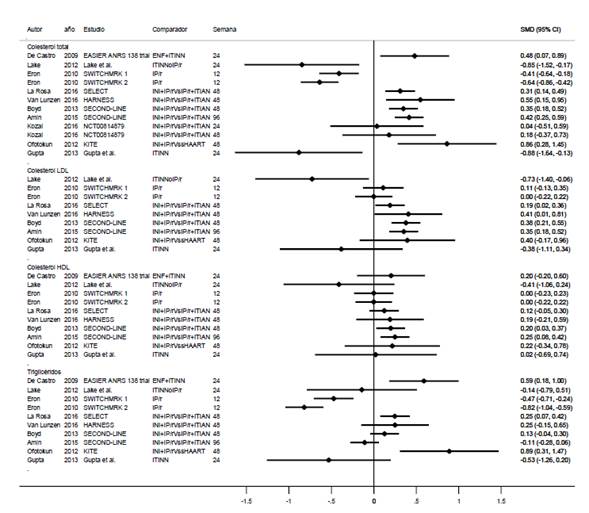
En los estudios de raltegravir15-24 se usó una dosis de 400 mg cada 12 horas. Hubo seis esquemas de comparación: dos estudios, SWITCHMARK 1 y SWITCHMARK 217, con comparaciones incluyendo IP/r, un estudio(24) con comparación con ITINN, un estudio16 evaluó los comparadores ITINN e IP/r, un estudio15 evaluó la comparación enfuvirtide+ITINN, tres estudios18-20 compararon raltegravir+IP/r con IP/r+ITIAN y un estudio comparó inhibidores de integrasa + IP/r con terapia antirretroviral estándar23.
Según figura 3, el colesterol total tiende a disminuir cuando se compara raltegravir con IP/r e ITINN, tiende a ser neutro o a incrementarse cuando se compara raltegravir+IP/r con IP/r+ITIAN, con la terapia antirretroviral estándar (sHAART) y con enfuvirtide+ITINN (ENF+ITINN). El colesterol LDL tiende a disminuir según Lake et al.16) y Gupta et al.24, tiene un comportamiento neutro cuando se compara con IP/r y a incrementarse en el resto de comparaciones. En cuanto al colesterol HDL, en todos los estudios tiende hacia comportamiento neutro. Para triglicéridos, hay tendencia hacia disminución en la comparación con IP/r e ITINN, tendencia al incremento en el resto de escenarios.
En el estudio de cohorte NEVRAST25 se comparó sustitución de terapia antirretroviral a esquemas con nevirapina o raltegravir comparándolos con rosuvastatina y evaluando el impacto sobre dislipidemia a 48 semanas. Cuando se realizó cambio hacia raltegravir o nevirapina hubo mejoría de parámetros lipídicos, especialmente triglicéridos. Sin embargo, con rosuvastatina la mejoría del colesterol total y LDL fue mayor que con raltegravir y nevirapina, pero no en colesterol HDL, donde raltegravir tuvo mejor desempeño.
En el estudio de casos y controles de Olalla 201226 en aquellos pacientes con terapia antirretroviral con raltegravir, tras seis meses, hubo un descenso del colesterol HDL y triglicéridos en los controles.
Dolutegravir
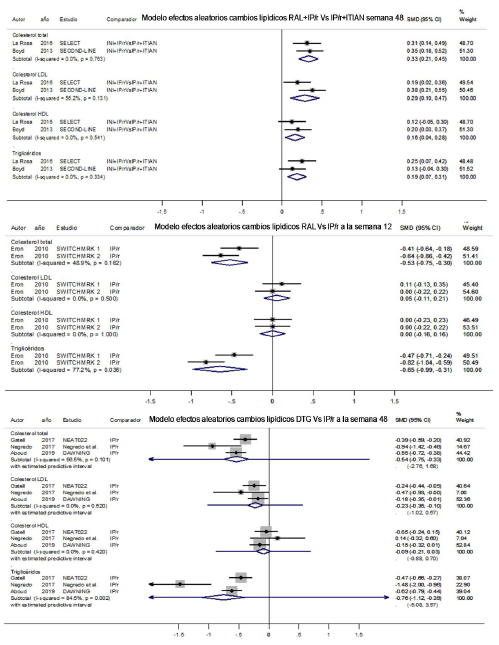
En estudios con dolutegravir27-29 la dosis usada fue de 50 mg/día. Se encontró que el colesterol total, colesterol LDL y triglicéridos disminuyeron para dolutegravir comparado a IP/r (figura 4); sin embargo, en el metaanálisis para colesterol total y triglicéridos, se encontró una alta heterogeneidad y un intervalo de predicción amplio (figura 5). Para colesterol HDL, en el estudio de Aboud 201929 se evidenció un leve incremento al inicio de la terapia manteniéndose en equilibrio. En el metaanálisis sobre este parámetro no se identificó una tendencia (figura 5).
El estudio de cohorte SCOLTA30 dividió a su población en dos grupos: cambio desde ITINN (efavirenz) +2 ITIAN y desde IP/r+2 ITIAN. A la vez, cada grupo se subdividió en tres subgrupos: terapia con dolutegravir, elvitegravir o rilpivirina. En relación a dolutegravir, hubo tendencia a disminución de colesterol total, colesterol LDL y triglicéridos, pero la rilpivirina presentó mejor perfil.
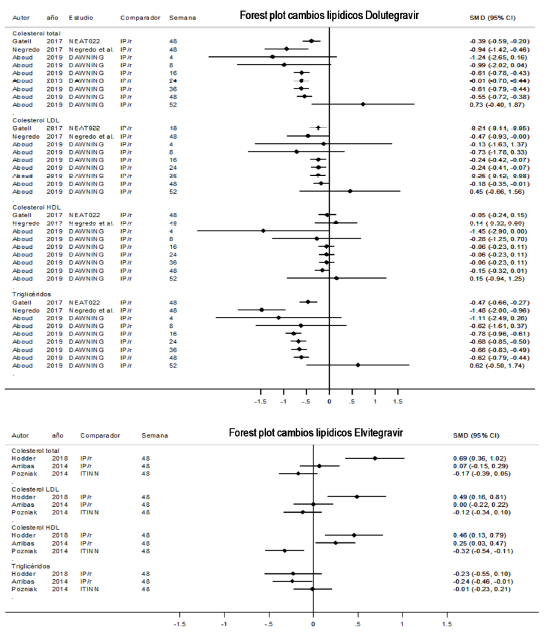
Figura 4 Forest plot de cambios en los lípidos de dolutegravir y elvitegravir vs otros antirretrovirales
Elvitegravir
En los estudios incluidos 31,32,33 el elvitegravir se combinó con cobicistat y se usó a dosis de 150 mg/día. En la comparación con ITINN, hubo tendencia hacia disminución del colesterol total, LDL y HDL y un comportamiento neutral para triglicéridos a semana 48. Cuando se comparó elvitegravir con IP/r, hubo una tendencia al incremento del colesterol total, LDL y HDL y una tendencia hacia disminución de triglicéridos (figura 4). En el estudio de Taramasso en 2018(30), el colesterol total y LDL tendieron hacia la neutralidad, mientras que los triglicéridos tendieron al incremento. Rilpivirina presentó un mejor perfil lipídico que elvitegravir.
Bictegravir
Sólo se encontró un estudio para bictegravir34. En este, se usó dosis de 50 mg/día y el colesterol total fue más bajo en el grupo de intervención que en el de comparación a la semana 48. Esto mismo pasó con colesterol LDL. En cuanto a colesterol HDL, hubo una leve tendencia hacia el incremento. Por otro lado, se identificó una disminución de triglicéridos para el grupo con bictegravir.
Discusión
En el escenario de comparación inhibidores de integrasa con IP/r, dolutegravir es aquel inhibidor de integrasa con mejor perfil lipídico, seguido por raltegravir, bictegravir y elvitegravir. Sin embargo, en el escenario de comparación inhibidores de integrasa con ITINN, raltegravir presenta mejor perfil lipídico, seguido de elvitegravir y dolutegravir, sin evidencia para bictegravir. Por otro lado, la combinación de inhibidores de integrasa + IP/r posee un pobre perfil lipídico cuando se compara con IP/r+ITIAN, haciendo poco recomendable dicha combinación.
Los hallazgos del presente estudio van en consonancia con metaanálisis previos7,9,35. En el metaanálisis en red de Patel et al. de 20149, dolutegravir mostró una disminución significativa en incrementos de colesterol total, LDL y HDL, comparado con efavirenz, elvitegravir/cobicistat y atazanavir, lopinavir y darunavir potenciados con ritonavir. Sin embargo, dichos cambios no difirieron a lo encontrado con raltegravir y rilpivirina.
Quercia et al. en 201535 realizan un análisis comparativo a partir de los estudios SPRING-136, SPRING-237,38, SINGLE39 y FLAMINGO40. En este se concluye que un efecto ampliamente neutral sobre lípidos apoya aún más la recomendación de incluir dolutegravir en la terapia antirretroviral inicial.
Snedecor et al. en 20197, realizan búsqueda sistemática y metaanálisis en red comparando dolutegravir con otros antirretrovirales en pacientes naive. Incluyó 36 estudios. Dolutegravir mostró una supresión viral más alta que los inhibidores de proteasa y que los ITINN y similar a los ITIAN. Dolutegravir tuvo mejor perfil lipídico en colesterol total, LDL y triglicéridos comparándose con efavirenz, elvitegravir/cobicistat y atazanavir, lopinavir y darunavir potenciados con ritonavir, pero no superior a rilpivirina, raltegravir y bictegravir. En cuanto a colesterol HDL, dolutegravir no mostró mejor comportamiento.
Lo anterior, puede hacer recomendable que en el contexto de un paciente con trastornos en su perfil lipídico y con esquema con IP/r, se considere cambio hacia un esquema que incluya inhibidores de integrasa como parte del abordaje de su riesgo cardiovascular, el cual debería combinarse con dos ITIAN como tenofovir/emtricitabina. Sin embargo, dicha conducta no debería reemplazar otras como el uso de estatinas.
Limitaciones
El presente estudio incluyó artículos en idiomas inglés, español, francés, portugués e italiano, excluyendo los de otros idiomas. Hay poca evidencia sobre bictegravir. Muchos de los estudios encontrados no tenían reporte de resultados en sus artículos ni en otras fuentes. Adicionalmente, muchos estudios no reportaban sus resultados en la misma métrica. Finalmente, no fue posible evaluar sesgo de publicación o análisis de sensibilidad por metarregresión dada la poca cantidad de estudios incluidos en metaanálisis.
En conclusión y en base a la evidencia encontrada, dolutegravir es el inhibidor de integrasa con mejor perfil metabólico cuando la comparación se hace con IP/r, seguido de raltegravir, bictegravir y elvitegravir. El raltegravir es el inhibidor de integrasa que mejor perfil metabólico tiene cuando la comparación se hace con ITINN, seguido de elvitegravir y dolutegravir.