Introducción
La consulta por enfermedades benignas de la mama constituye hasta el 90 % de la patología mamaria. La mastitis es una afección común en el periodo de la lactancia, aunque puede afectar otros periodos de la vida1, pero no deben olvidarse los procesos inflamatorios benignos no asociados a la lactancia, puesto que el establecer un diagnóstico preciso permite un tratamiento adecuado y evita un daño en la función o la estructura mamaria que deje secuelas permanentes. El propósito de esta revisión es presentar la información disponible sobre la patogénesis, epidemiología, presentación clínica, diagnóstico y tratamiento de la mastitis periductal con absceso subareolar no puerperal y sus complicaciones, que son de relevancia para los médicos de atención primaria y especialistas involucrados en la atención de las afectaciones mamarias. Para ello el objetivo de exponer los aspectos más relevantes y actualizados sobre esta enfermedad se realizó una búsqueda de artículos científicos más recientes en PubMed, Google Scholar y SciELO para esta revisión narrativa.
Mastitis periductal
La mastitis se define como la inflamación del seno y comprende un grupo complejo de enfermedades inflamatorias de la mama, con un diagnóstico difícil por su similitud en la clínica, a la vez que debe excluirse malignidad2. Se puede clasificar como mastitis infecciosa (dividida a su vez en lactacional o puerperal y no lactacional o no puerperal). Por su parte, la mastitis no infecciosa puede ser por inflamación granulomatosa o secundaria a necrosis o trauma, entre otros, y de acuerdo al tiempo en su presentación clínica puede ser aguda o crónica (cuadro 1)2,3.
La mastitis periductal y la ectasia del conducto se consideran que hacen parte del mismo proceso inflamatorio. Se cree que este es causado por obstrucción del conducto lactífero, por hiperplasia o metaplasia escamosa que lleva a obliteración del conducto, con acumulación de residuos y la formación de abscesos y fístulas crónicas3.
Epidemiología
La mastitis no puerperal, que usualmente se asocia al absceso subareolar, es conocida como la enfermedad de Zuska5. Se trata de una enfermedad benigna, poco frecuente, con una prevalencia del 1-2 %6. La ectasia del conducto galactóforo, que hace parte de la etiopatogenia, ocurre en el 5-9 % de las mujeres no lactantes6.
La mastitis no asociada a la lactancia puede complicarse con la formación de un absceso, que corresponde a una colección de material purulento localizada dentro del seno. Los abscesos en las mujeres no lactantes se presentan con más frecuencia en los últimos años de la vida reproductiva, en promedio a los 40 años7.
Los abscesos no puerperales pueden clasificarse según su ubicación: central (región periareolar) o periférico, y aunque la primera forma clínica es la más frecuente (90 %), sigue siendo rara pues representa apenas del 1 al 2 % de las enfermedades mamarias sintomáticas8. Los restantes tipos de abscesos mamarios no lactacionales son causados por raras etiologías granulomatosas, bacterianas o fúngicas. Las fístulas mamarias, que pueden ser una complicación de la infección mamaria, se presentan en 1-2 % de las mujeres con mastitis y pueden imitar el cáncer inflamatorio de mama9.
Etiopatogenia
Aunque varios casos de mastitis periductal y absceso subareolar han sido descritos, es a Zuska et al. a quienes se acredita la enfermedad. En 1951 publicaron los hallazgos clínicos y patológicos de cinco pacientes con mastitis no puerperal complicada con absceso y fístula recurrente de los conductos lactíferos; todos los casos se asociaron a masa subareolar y telorrea patológica. Encontraron varios hallazgos microscópicos principales que incluyen inflamación aguda y crónica del conducto lactífero, dilatación del conducto, estasis y queratinización descamativa del epitelio en la luz del conducto. Concluyeron que la enfermedad estaba asociada a estasis de secreciones dentro del conducto, que conduce a dilatación e inflamación o infección que llevan a la formación de abscesos y que su ruptura a través de la piel resulta en la formación de un trayecto fistulos5. Estos abscesos tienen un curso crónico, a menudo con obstrucción recurrente de los conductos por tapones de queratina y tienden a formar fístulas. En general, los abscesos son de localización central, peri o subareolar10.
En un estudio se identificó el sobrepeso / obesidad y el inicio tardío de la menarquia como factores de riesgo independientes para la mastitis periductal. La infección bacteriana y el aumento de la expresión de algunas citocinas proinflamatorias estaban asociadas a su patogenia11. Se cree que el consumo de tabaco podría tener un efecto tóxico directo sobre los conductos galactóforos retro areolares o un efecto indirecto a través de estimulación hormonal de la secreción mamaria. Ambas hipótesis podrían explicar el carácter recurrente de la enfermedad. En un estudio se encontró el riesgo de desarrollar absceso mamario fue de 6,1 (IC 95 %: 2,6-14,3)12. No existe relación entre el absceso periareolar y la anticoncepción hormonal y no está contraindicada en caso de antecedentes de absceso mamario2.
Hallazgos histopatológicos
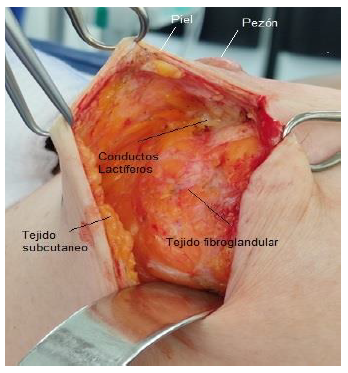
El seno es una glándula sudorípara modificada que produce secreción láctea en el periodo posparto, producida en múltiples acinos que drenan dentro de un lóbulo y convergen a través del tejido mamario mediante 15 a 20 conductos lactíferos principales que se unen y se abren en el ápice del pezón, tiene una dilatación leve que forma una ampolla que permite ayudar en el almacenamiento y eyección de leche13 (foto 1).
En un conducto lactífero normal el epitelio escamoso se extiende desde la piel hasta 1 a 2 mm dentro del pezón; posteriormente, hay un cambio brusco del epitelio escamoso a una doble capa de epitelio coloidal o columnar bajo. En el absceso subareolar no puerperal la capa normal de células del epitelio cuboidal se transforma en epitelio escamoso que produce grandes cantidades de queratina, formando tapones que obstruyen el conducto principal y haciendo que su secreción se acumule y se produzca una dilatación con adelgazamiento progresivo del epitelio, hasta la ruptura y salida de queratina, que ocasiona una reacción inflamatoria por cuerpo extraño en el tejido mamario, con infiltrado de linfocitos, plasmocitos, histiocitos y células gigantes de tipo cuerpo. La invasión de bacterias pueden conducir al desarrollo de un absceso subareolar13.
El absceso puede drenar espontáneamente formando una fístula que generalmente se ubica en el borde areolar, que puede recurrir por la obstrucción persistente del conducto distal.
Microbiología
La mastitis no infecciosa puede ser el resultado de una ectasia del conducto subyacente y mastitis periductal14. La sobreinfección bacteriana en la mastitis infecciosa y los abscesos mamarios son causados predominantemente por bacterias que colonizan la piel. Varios estudios retrospectivos que incluyeron abscesos, en su mayoría no puerperales, evaluaron su perfil microbiológico y los cultivos fueron positivos en el 61-83 % de los casos. S. aureus fue el germen más encontrado en 32 a 79 %, de los cuales 8,6 a 58 % fueron resistentes a la meticilina. Los episodios recurrentes a menudo tienen flora mixta, incluidos los organismos anaerobios15.
Hasta el 40 % de los abscesos mamarios pueden ser polimicrobianos y pueden aislarse gérmenes aerobios como Staphylococcus, Streptococcus, Enterobacteriaceae, Corynebacterium, Escherichia coli, Pseudomonas y, ocasionalmente, anaerobios. En los casos crónicos recurrentes otros gérmenes aislados son Peptostreptococcus, Propionibacterium, Bacteroides16.
Presentación clínica
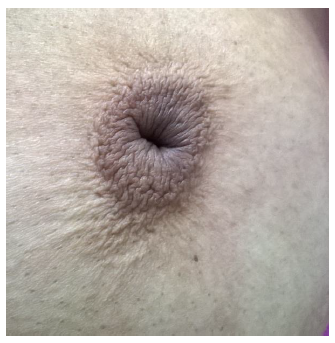
La mastitis no puerperal tiene una variedad de presentación clínica, según la evolución de la enfermedad y la sobre infección. La ectasia ductal es un trastorno que precede el cuadro clínico y consiste en la dilatación de los conductos galactóforos en la región subareolar y fibrosis e inflamación periductal. El diámetro normal de un conducto suele ser inferior a 2 mm y en esta enfermedad el diámetro del ducto es superior a 3 mm17. Al dilatarse el ducto se acumulan secreciones y restos celulares que pueden salir por el pezón, provocando telorrea, inflamación y a veces sobreinfección. Usualmente, es asintomática, aunque es la causa más frecuente de telorrea después de los 55 años. Se presenta como telorrea viscosa, espesa y retracción del pezón (umbilicación o inversión) y es más frecuentemente bilateral (foto 2)18.
El diagnóstico de mastitis o absceso mamario es clínico. La galactoforitis o infección de los conductos mamarios se presenta en etapas iniciales y puede ser aguda o crónica, pues se presenta en un periodo entre cinco días y seis meses. Se produce la formación de una barrera de tejido de granulación alrededor que se convierte en la cápsula del absceso, el cual se llena de pus. Se presenta dolor y enrojecimiento del complejo areola-pezón con calor y edema de la piel que lo recubre, puede ser fluctuante, con decoloración y necrosis de la piel. A la palpación, las masas pueden estar mal definidas, el tejido adyacente por la fibrosis puede ocasionar retracción del pezón, lo que simula un carcinoma19.
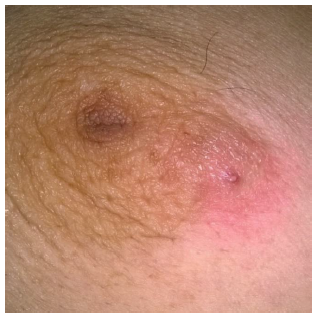
Típicamente, los abscesos no lactacionales se encuentran en una ubicación periareolar o subareolar (foto 3). Se producen abscesos periféricos no puerperales con poca frecuencia y se asocian con trauma, acné, quistes epidérmicos y afecciones crónicas como diabetes y artritis reumatoide. El 15-20 % de las pacientes presentan telorrea de color y consistencia variable20. La tasa reportada de recurrencia es del 50 % y a menudo requieren múltiples drenajes o fistulectomía21.
Pueden presentarse desde la adolescencia hasta los 80 años, con incidencia máxima a los 40 años22. Se han reportado algunos casos en varones. Son más comunes en pacientes obesos y hay fuerte correlación con el tabaquismo: alrededor del 90 % de las mujeres con esta entidad fuman comparado con el 38 % en la población general23.
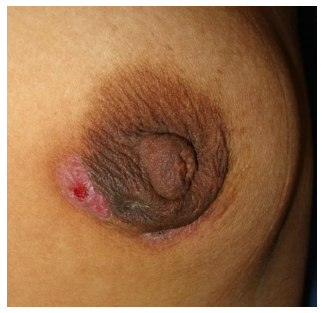
La fístula mamaria es una afección crónica que representa el paso final en el trastorno inflamatorio asociada al conducto mamario. Las fístulas se presenta en el 30 % de los casos y se extienden desde la cavidad del absceso o conducto dilatado hacia el pezón o el borde de la areola20. El tiempo medio transcurrido para la formación de la fístula es de unos 14 meses. Hasta dos tercios de los casos de fístula se producen después de un procedimiento de aspiración o drenaje, son de índole infecciosa, crónica y recidivante24 (foto 4).
Imagenología
La mamografía tiene un limitado valor en la evaluación aguda de la mastitis y de los abscesos mamarios. Puede ser muy dolorosa realizarla si hay un absceso y los hallazgos mamográficos de infección y absceso mamario no son específicos como, por ejemplo, distorsión, arquitectónica, masa espiculada, engrosamiento o retracción de la piel, microcalcificaciones, densidad focal o difusa aumentada. A menudo, los hallazgos mamográficos imitan el cáncer o puede no encontrarse, por lo que se recomienda realizarla después de que la fase aguda se haya resuelto25. Todas las mujeres mayores de 40 años y aquellas con presentaciones complicadas o atípicas o donde se sospeche malignidad deben realizarse una mamografía en la resolución de la fase aguda25.
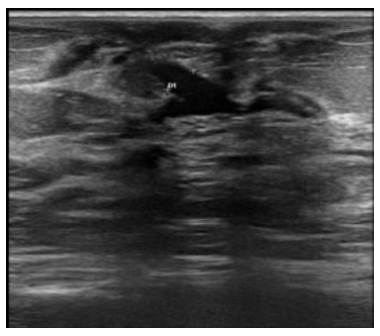
La ecografía es la prueba más utilizada en el diagnóstico y como guía para procedimientos. Los hallazgos ecográficos son sugestivos revelando dilatación de los conductos localizados radialmente alrededor del pezón (foto 5).
Ocasionalmente, puede demostrarse el trayecto fistuloso que comunica el conducto galactóforo y la superficie cutánea. Generalmente, se observa un engrosamiento de la piel adyacente a la fístula o por encima del absceso. También un aumento difuso de la ecogenicidad del área afectada que, en presencia de abscesos, colecciones hipoecoicas, con ecos internos y márgenes mal definidos, los hallazgos incluyen lesiones quísticas complejas, masas hipoecoicas heterogéneas hasta en el 50 % de casos25. Mediante Doppler color y angio-Doppler se puede poner de manifiesto la presencia de vascularización periférica en el área inflamatoria estudiada.
El diagnóstico diferencial más importante es el carcinoma localmente avanzado o el carcinoma inflamatorio de la mama. Los hallazgos clínicos que comparten incluyen el engrosamiento de la piel y masa subareolar, por lo que es importante diferenciar algunas características. Usualmente, el carcinoma exhibe una masa sólida a diferencia del absceso visto en la mastitis. A pesar de estas diferencias, el diagnóstico final e indispensable debe ser histológico26.
Tratamiento
Antibioticoterapia
En adultos con baja sospecha de estafilococo meticilino resistente y sin alergia a la penicilina, la terapia de primera línea debe ser con una penicilina anti estafilocócica oral (por ejemplo, dicloxacilina 500 mg por vía oral cada seis horas, o cefalexina 500 mg por vía oral cada seis horas). Si se aísla o sospecha estafilococo meticilino resistente y no hay alergia a la penicilina debe comenzarse con un antibiótico anti-betalactamasa (por ejemplo, ampicilina sulbactam tableta 750 mg por vía oral dos veces al día). En pacientes con alergia puede administrarse trimetoprim / sulfametoxazol (160/800 mg por vía oral dos veces al día) o clindamicina (300 mg por vía oral cuatro veces al día). La vancomicina (15 mg/kg por vía intravenosa cada 12 horas) se puede usar en casos más graves o en pacientes hospitalizados con sospecha de estafilococo meticilino resistente adquirido en el hospital. La duración del tratamiento estará guiada por la respuesta clínica, pero generalmente es de 7 a 10 días. La elección de comenzar con antibióticos por vía intravenosa u oral debe guiarse por la gravedad de la afección y el juicio clínico2.
Será necesario reevaluar el tratamiento si no hay respuesta a los antibióticos dentro de las 48 horas. Si se aíslan bacilos gramnegativos, se puede usar una quinolona (por ejemplo, ciprofloxacina). Alternativamente, se puede usar una cefalosporina de tercera generación (por ejemplo, ceftriaxona). Las medidas de apoyo incluye analgesia, si fuera necesario. Como la mastitis periductal se asocia casi exclusivamente con el abuso del tabaco, se debe dar a estos pacientes consejos para dejar de fumar20.
Cirugía
Rara vez los abscesos mamarios se resuelven con antibióticos solos y en general requieren drenaje. La aspiración con aguja (calibres 18 a 21) con anestesia local con o sin guía ecográfica es una opción en los abscesos distantes de la piel y menores de 3 cm, evitando el drenaje abierto y se obtiene un mejor resultado cosmético27. Si la piel que recubre el absceso está comprometida, es delgada y brillante, se debe realizar una mini incisión en la piel que recubre el absceso, con una cuchilla número 11 sobre el punto de máxima fluctuación28. El material purulento debe enviarse para estudios de microbiología.
Algunos autores recomiendan la intervención quirúrgica temprana con escisión del absceso, de la vía fistulosa y de la porción terminal del conducto subareolar, debido a la alta tasa de recurrencia con antibióticoterapia exclusiva29,30. Otros consideran que el manejo médico, que incluye la antibióticoterapia y el drenaje son suficientes y que la cirugía se reservará para casos en los que el manejo médico falla 7,22. Se han reportado tasas de éxito del 81 % para abscesos mamarios no puerperales tratados con drenaje ecoguiado31. Berná-Serna et al. informan similares tasas de éxito en dos estudios separados; sin embargo, enfatizan que en abscesos crónicos el tratamiento de elección es la escisión quirúrgica, debido a que se requieren múltiples procedimientos de aspiración y drenaje32.
Se han reportado tres técnicas quirúrgicas principales: Meguid et al. describen el uso de una incisión transversal desde la mitad del pezón que incluye el conducto enfermo y lateralmente a través de la areola hasta el borde de la areola. Hadfield et al. proponen realizar una incisión circunferencial en el borde inferior de la areola que incluya la apertura de la fístula y, Urban et al. describen la incisión orientada radialmente con elipse de piel que se extiende desde la base del pezón a la zona afectada, y posterior cierre del defecto con un colgajo mamario de vecindad que de soporte al pezón y la areola33.
Conclusión
La mastitis no puerperal es un trastorno inflamatorio de la mama, benigno, frecuentemente complicado con sobreinfección y la formación de absceso subareolar, poco frecuente, con tendencia a la cronicidad y recurrencia, que requiere un diagnóstico adecuado para el inicio oportuno del tratamiento. Estos incluyen antibióticoterapia, drenaje ecoguiado y escisión quirúrgica. De esta manera se reduce la morbilidad. Se requiere hacer diagnóstico diferencial con carcinoma localmente avanzado y carcinoma inflamatorio de mama.