Introducción
Se estiman aproximadamente tres millones de especies de hongos, de los cuales cerca de 300 causan infecciones en humanos1. Las interacciones entre bacterias, archaeas, virus y hongos mantienen el equilibrio en el huésped y hacen parte de diversos procesos vitales como nutrición y defensa contra patógenos. La diversidad de hongos que hacen parte del microbioma se conoce como micobiota o micobioma.
En comparación con el microbioma, el estudio del micobioma es incipiente, en especial las comunidades fúngicas en individuos sanos. Esta revisión tiene como objetivo recopilar los estudios que se han realizado sobre las comunidades fúngicas en humanos sanos, las diferencias de diversidad y densidad en comparación con individuos enfermos y hacer la distinción entre los grupos y especies de hongos propios de cada zona del cuerpo. En el cuadro 1 se resumen los géneros y especies de hongos reportados como parte del micobioma en los seres humanos.
Metodología
Para esta revisión de tema se realizó una búsqueda de artículos científicos y de revisión publicados desde 1996 hasta 2020 (y un artículo de 1984 también fue incluido), en las bases de datos bibliográficas disponibles en Internet: PubMed/Medline, ScienceDirect, Scopus y Google Scholar. Se usaron los términos de búsqueda mycobiome, intestinal fungi, skin mycobiome, vaginal mycobiome, fungal microbiome. La búsqueda incluyó las publicaciones en todos los idiomas, aunque las referencias resultantes se limitaron a artículos en inglés y español. Los resultados se presentan como una revisión narrativa.
Paso del micobioma de madre a hijo
La transmisión de micobioma de piel y tracto gastrointestinal es vía vaginal durante el parto, en su mayoría compuesta por Candida albicans 2. Se sugiere que Malassezia spp. se transmite por esta vía, aunque existe controversia si la transmisión se inicia desde la placenta3. Por lo tanto, la diversidad fúngica de piel e intestino en los niños proviene del micobioma materno4.
Bacterias y hongos presentes en la leche materna actúan como probióticos y favorecen el desarrollo del micobioma. La diversidad de microorganismos en leche materna se asocia con la ubicación geográfica, modo de parto, dieta, edad y peso corporal de la madre5. Lemoinne et al.6 demuestran que Basidiomycota y Ascomycota son phyla dominantes en la leche materna. Malassezia y Dividiella son los géneros más prevalentes, seguidos por Sistotrema y Penicillium5,6 y están presentes en el tracto gastrointestinal de los infantes2,4,7. Por otro lado, Debaryomyces hansenii y Saccharomyces cerevisiae, hacen parte del micobioma de origen materno y están presentes durante la lactancia y el destete, respectivamente5.
Tracto gastrointestinal
Nash et al.8 proponen la presencia de un microbioma fúngico core. Sin embargo, es muy alta la variabilidad de comunidades fúngicas entre individuos sanos9. Los phylum Basidiomycota y Ascomycota predominan en el tracto intestinal de individuos sanos, así como en piel, vagina y cavidad oral. En general, la diversidad fúngica en el intestino es menor en comparación con la diversidad bacteriana. Contrastan un reporte de 2013 con 66 géneros fúngicos en materia fecal10 con uno reciente en el que identificaron 15 géneros8 (cuadro 1).
Tanto los microorganismos comensales de la boca que ingresan por deglución, como los presentes en los mismos alimentos, contribuyen a enriquecer el micobioma intestinal. Candida spp. es comensal en tracto digestivo de individuos sanos7, relacionada positivamente con dietas ricas en carbohidratos y negativamente con dietas altas en aminoácidos, proteínas y grasas10. Otros microorganismos de origen ambiental o alimenticio no colonizadores son Penicillium y Debaryomyces spp., presentes en alimentos fermentados; S. cerevisiae en algunos probióticos y Aspergillus spp. que son hongos ubicuos7.
Existe una correlación entre la disminución de diversidad fúngica y enfermedad. La relevancia de la disbiosis intestinal y la predominancia de algunos géneros oportunistas se evidencia en estudios que correlacionan el micobioma con enfermedades oculares como la uveítis. Esta enfermedad se relaciona con Apergillus gracilis, Candida glabrata, Malassezia globosa y M. restricta9. También se ha asociado la disbiosis micótica intestinal con colangitis esclerosante primaria6.
Tracto respiratorio
Diversos hongos colonizan el tracto respiratorio y posiblemente ingresan por la inhalación de esporas ambientales. Ha sido más estudiado el micobioma en individuos enfermos que sanos, así como en las vías respiratorias inferiores y de la mucosa nasal. Es difícil establecer las comunidades fúngicas exclusivas de la cavidad nasal de sujetos sanos, puesto que el micobioma es un reflejo de la exposición a los hongos ambientales11.
La concentración de hongos ambientales se relaciona con el clima y la región geográfica, aunque no se ha establecido la variación fúngica nasal de acuerdo con estos factores12. Sellart-Altisent et al.11 encontraron que los géneros predominantes en la mucosa nasal fueron Cladosporium, Penicillium, Aspergillus y Alternaria. Mientras que las especies más comunes fueron C. herbarum y C. cladosporioides, que son frecuentes en el aire. Esto destaca tanto la influencia del ambiente tanto en periodos de enfermedad como en estados de salud normales. Candida y Aureobasidium se encontraron en sujetos sanos; en contraste, Chrysonilia y Stemphylium en individuos alérgicos. Muchos hongos ambientales son causantes de micosis alérgicas broncopulmonares, algunos se encuentran asociados a material particulado en el aire13,14.
Aspergillus es predominante en pacientes con enfermedades respiratorias15, así como Malassezia, Curvularia, Schizophyllum, y Neocosmospora16,17. Otros reportan la prevalencia de Malassezia en la cavidad sinonasal de individuos sanos y una menor proporción de Aspergillus y Alternaria17. Se puede relacionar la presencia de Malassezia en la nariz, porque es un patobionte común de la piel15,17.
Debe destacarse la baja diversidad y densidad fúngica en sujetos enfermos comparado con sujetos sanos11, aunque pocos estudios han abordado la diferencia entre hongos colonizadores accidentales, hongos ambientales y micobioma normal del tracto respiratorio. En pacientes con rinosinusitis crónica se ha reportado poca cantidad de Aspergillus, Alternaria, Fusarium y Saccharomyces15. Estos resultados contrastan con el hecho de que Aspergillus es el agente causal de aspergilosis broncopulmonar alérgica y afecta pacientes con fibrosis quística, empeorando la función pulmonar. Se sugiere que la menor densidad fúngica en enfermos se debe a la eliminación de los elementos fúngicos, por la insuficiencia nasal, la rinorrea y el uso de pañuelos11.
Piel
Es el primer mecanismo de defensa contra los microorganismos infecciosos y el medio de contacto con el exterior. Tanto factores intrínsecos como externos pueden alterar la dinámica de las comunidades componentes del microbioma de la piel y causar enfermedades. La disbiosis en la microbiota y el micobioma intestinal se relaciona con algunas enfermedades inflamatorias cutáneas18, aparte de los trastornos propios de la diversidad microbiológica cutánea.
La piel contiene gran variedad de organismos fúngicos comensales. Un estudio examinó el micobioma cutáneo de las comunidades indígenas amazónicas y resalta la ausencia de Malassezia spp en esta población19, aunque en otras poblaciones es uno de los géneros predominantes en tronco, brazos y zonas sebáceas como cuero cabelludo y frente20; además se asocia con dermatitis seborreica en ciertas zonas del cuerpo. M. restricta predomina en cabeza y cara, y M. globosa en tronco20.
Se sugiere que M. globosa, M. restricta, M. sympodialis y M. furfur habitan la piel de individuos sanos y con dermatitis atópica y psoriasis21,22. Sugita et al.21 reportan mayor diversidad fúngica en individuos enfermos, pero otros estudios relacionan a M. globosa y M. restricta con las fases graves de la dermatitis23. La diversidad fúngica más importante está en las comunidades diferentes a Malassezia y Candida en los individuos sanos23 (cuadro 1).
Algunas dermatofitosis son más comunes en niños que en adultos y viceversa, dependiendo de factores predisponentes como hábitos, ocupación y edad. El micobioma cutáneo cambia a medida que el ser humano crece. Por ejemplo, M. globosa, Aspergillus, Cryptococcus, Epicoccum y Phoma son comunes en los niños; mientras que en la pubertad, aumenta la densidad y diversidad de Malassezia spp debido a la exacerbación de las glándulas sebáceas24.
Oído
La otitis media es causada por patógenos que ascienden desde la nasofaringe, lo cual lleva a pensar que algunos hongos del tracto respiratorio causan enfermedades en el oído. Existe controversia si Candida también es agente causal de otomicosis, pues los estudios difieren en los resultados. Algunos la consideran parte de la microbiota cutánea normal de la cavidad auditiva y otros la reportan como agente etiológico predominante de la otomicosis25.
En individuos sanos, Malassezia es comensal en el oído externo, aunque las especies varían. Kaneko et al. reportaron M. slooffiae como predominante en canal auditivo externo de personas sanas26, mientras que Ruslan et al. reportaron M. furfur y otros hongos (C. albicans, C. parapsilosis y Aspergillus).
Superficie ocular
Las técnicas moleculares ofrecen más detalle de la diversidad y la densidad de microorganismos comparado con métodos convencionales de cultivo. En individuos sanos se identificaron por cultivo cuatro hongos filamentosos: Penicillium citrinum, Aspergillus niger, Phialophora y Trichoderma. En contraste, mediante secuenciación identificaron 94 géneros dentro de los phylum Basidiomycota y Ascomycota. Los géneros centrales fueron Malassezia, Rhodotorula, Davidiella, Aspergillus y Alternaria28. La salud ocular está relacionada tanto con el contacto con componentes fúngicos ambientales como con el equilibrio del organismo. Diversas enfermedades oculares se han asociado a la disbiosis del microbioma intestinal9. Conocer dichas relaciones puede servir como objetivo potencial para las terapias alternativas, menos invasivas como cambios en la dieta, probióticos o trasplantes de materia fecal.
Cavidad oral
Ghannoum et al.29 caracterizaron el micobioma oral de individuos sanos e introdujeron el concepto de micobioma oral saludable core, con 74 géneros de hongos cultivables y 11 no cultivables, pero el estudio no contó con suficientes participantes para dar una lista de hongos comensales. Candida fue la más frecuente, seguida de Cladosporium, Aureobasidium, Aspergillus, Fusarium y Cryptococcus29. Algunos son patógenos orales mientras que otros pueden asociarse a hongos ambientales o ingeridos con los alimentos.
Aspergillus, Fusarium y Cryptococcus no son colonizadores comunes, siendo identificados como patógenos. En individuos sanos es posible que la patogenicidad de estos hongos sea controlada por la interacción y el equilibrio poblacional con otros hongos comensales como Candida. El micobioma de sujetos con candidiasis está dominado por C. albicans al igual que el micobioma de las personas sanas. Esto sugiere que los síntomas clínicos se deben a un desbalance en la carga fúngica en la cavidad oral30. Otro caso es en pacientes con enfermedad periodontal, donde Candida y Aspergillus son abundantes en comparación con sujetos sanos, así como Penicillium, Schizophyllum, Rhodotorula, y Gibberella31.
Los estudios de micobioma oral se han realizado principalmente de saliva o lavados orales, mostrando una gran diversidad. C. albicans es predominante en cavidad oral de individuos sanos, mientras que C. parapsilosis, C. tropicalis, C. khmerensis y C. metapsilosis son menos frecuentes29. Candida spp. colonizan los tejidos orales desde edades tempranas, cerca de 28 % de los niños menores de dos años, la presentan como micobioma oral normal32 (cuadro 1).
Vagina
En 2013 se realizó un estudio para caracterizar el micobioma vaginal de mujeres estonianas caucásicas sin antecedentes de candidiasis vaginal33. Se reportó una prevalencia de C. albicans, Pichia kudriavzevii y C. parapsilosis; otros géneros con menor abundancia relativa son Saccharomycetales, Davidiellaceae sp, Cladosporium perangustum, Eurotium amstelodami, Alternaria alternata y Rhodotorula sp33. Tres de cada cuatro mujeres experimentan al menos un episodio de candidiasis vaginal, mientras que el 20 % de las mujeres sanas están colonizadas asintomáticamente con Candida34. Es importante conocer las interacciones intra e inter-especie en el tracto genitourinario para diseñar estrategias de tratamiento contra la candidiasis vulvovaginal, como los probióticos.
Cuadro 1 Géneros y especies de hongos encontrados como parte del micobioma.
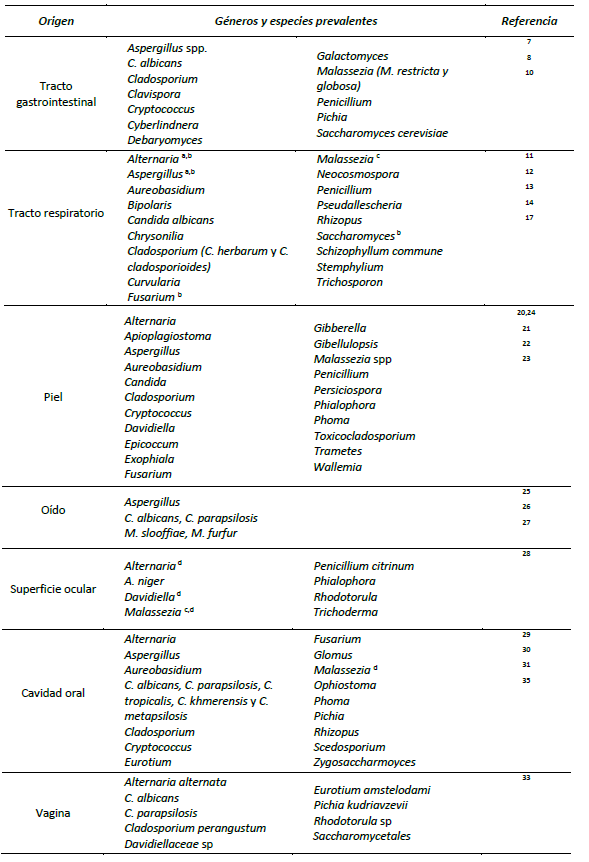
a. Son géneros controversiales, se sugiere baja prevalencia en individuos sanos y enfermos.
b. En pacientes con rino-sinusitis crónica existe una baja abundancia.
c. Se puede relacionar su prevalencia porque es un patobionte de la piel.
d. Identificadas por secuenciación.
Conclusión
Si bien los hongos cumplen un papel importante en la patofisiología de algunas enfermedades, también ayudan a mantener el equilibrio con otros microorganismos y por tanto la salud. Aunque la diversidad y densidad del micobioma varían en el tiempo, algunos estados de enfermedad se relacionan con una disminución en la diversidad y el oportunismo de organismos patógenos. La diversidad y la densidad fúngica reportadas varía según la metodología de identificación, así la aproximación con técnicas moleculares ofrece resultados más detallados de la diversidad y densidad fúngica que otras técnicas como el cultivo. La variedad de estudios sobre micobioma muestran una clara influencia de los microorganismos gastrointestinales sobre las comunidades microbianas del resto del cuerpo.
El estudio del micobioma sigue siendo incipiente, así la investigación de genética, micobioma core, ecología de comunidades fúngicas, bacterianas y víricas, podría guiar los futuros tratamientos para las infecciones por hongos, desde la modulación de la dieta, los probióticos y los trasplantes de micobioma. Por último, tanto la densidad y diversidad del micobioma humano se relaciona no sólo con estados de salud o enfermedad, sino con factores predisponentes como calidad del ambiente, ubicación geográfica, raza, edad, hábitos alimenticios, ocupación y estilo de vida, que merecen ser considerados en la práctica médica como investigativa.














