Introducción
Helicobacter pylori (H. pylori) es el causante de la infección bacteriana crónica más común en los seres humanos. Afecta a casi la mitad de la población mundial y por lo menos al 80 % de la población en Colombia 1. Es el principal responsable de gastritis crónica, úlcera péptica y cáncer gástrico (2, este último constituyendo el cáncer de mayor mortalidad en Colombia (3. Para prevenir estas complicaciones se hace necesario que médicos generales y especialistas clínicos conozcan las ventajas y limitaciones de los diferentes esquemas terapéuticos. Este artículo revisa las pautas de tratamiento para la erradicación de H. pylori.
Generalidades
H. pylori es una bacteria gram-negativa, microaerofílica y en forma de espiral. Bioquímicamente, se define como catalasa, oxidasa y ureasa positiva, siendo esta última vital para su supervivencia y colonización, constituyendo el 10 % del peso total de proteínas del microorganismo, además de ser el fundamento de varias pruebas invasivas y no invasivas para su diagnóstico 4.
La transmisión se da de persona a persona a través de exposición fecal/oral u oral/oral 5. El riesgo de contraer la infección se relaciona con múltiples variables, entre ellas, el nivel socioeconómico y las condiciones de vida a una edad temprana. Factores como hacinamiento, pobre higiene, falta de agua potable o bajo nivel educativo se han asociado con una mayor tasa de adquisición de infección por H. pylori6.
El espectro de manifestaciones clínicas de la infección es amplio. A nivel gastroduodenal destacan la gastritis crónica, la úlcera péptica, la dispepsia, el linfoma de tejido linfoide asociado a mucosas (por sus siglas en inglés, MALT) gástrico y el cáncer gástrico. Entre las manifestaciones extradigestivas se han reportado alteraciones hematológicas (anemia ferropénica, trombocitopenia inmune y anemia por deficiencia de vitamina B12), pólipos colónicos, cáncer de colon e infarto agudo de miocardio 7.
Las indicaciones para la búsqueda activa de infección por H. pylori se resumen en el cuadro 1. El diagnóstico puede hacerse con pruebas invasivas o no invasivas. Si hay una indicación de hacer endoscopia digestiva superior, adicional a la búsqueda de H. pylori, o si se requiere evaluar el estado de la mucosa gástrica, se prefieren los métodos invasivos con toma de biopsia para prueba de ureasa rápida, el estudio histológico, el cultivo o las pruebas moleculares, según disponibilidad. De lo contrario, el diagnóstico se hará con métodos no invasivos como la prueba de antígenos fecales con anticuerpos monoclonales o la prueba de urea en el aliento 8.
Tratamiento de la infección por H. pylori
¿Tratar o no tratar?
Se han descrito efectos adversos derivados de la erradicación de H. pylori, como desarrollo de enfermedades atópicas, aumento de peso, alteración del microbioma y aparición de cepas resistentes; además de los efectos secundarios propios de los antibióticos 11. Sin embargo, los beneficios de curar la infección superan los potenciales riesgos (cuadro 2). Por lo tanto, se debe dar tratamiento siempre que se haga diagnóstico de infección por H. pylori en las circunstancias mencionadas en el cuadro 1.
Principios de la terapia
El esquema terapéutico está basado en la utilización de un inhibidor de bomba de protones y de antibióticos. Entendiendo que ningún esquema es infalible se han propuesto al menos siete esquemas avalados tanto por el Colegio Americano de Gastroenterología y el Consenso Maastricht V, como por las guías colombianas 7,9,10,12. El tratamiento que se escoja debe tener una eficacia de mínimo el 90 % 11 y una duración de 10 a 14 días 7,9,10. Se han notificado efectos secundarios leves hasta en el 50 % de los pacientes, pero en menos del 10 % se requiere interrumpir el tratamiento 13.
Esquemas de tratamiento
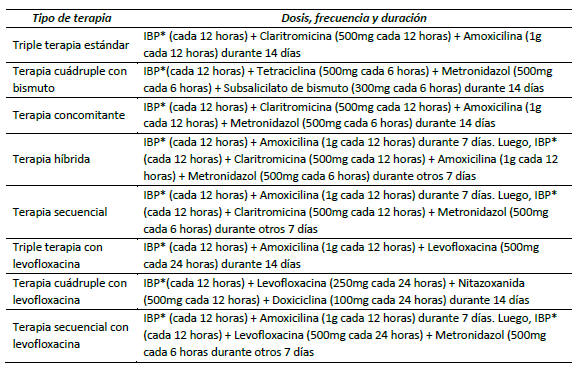
Son múltiples los esquemas avalados para la erradicación de H. pylori (cuadro 3). A continuación, se describen las características más importantes de cada uno.
Triple terapia estándar: consiste en un régimen de claritromicina, amoxicilina y un inhibidor de bomba de protones, todos administrados dos veces al día. En alérgicos a penicilinas se puede sustituir amoxicilina por metronidazol 10,14). Se ha descrito una eficacia del 62 al 78 %, pero en presencia de resistencia a claritromicina puede reducirse al 22 % 15.
Terapia cuádruple con bismuto: consiste en subsalicilato de bismuto, metronidazol, tetraciclina y un inhibidor de bomba de protones. Si no se dispone de tetraciclina se puede sustituir por doxiciclina (100 mg dos veces al día), sin disminución en la eficacia o tolerabilidad 16. Esta terapia ha presentado tasas de erradicación incluso mayores que la terapia triple estándar 17. La resistencia al metronidazol tiene un impacto negativo en la tasa de éxito, pero puede superarse aumentando la dosis, la duración o la frecuencia de la terapia 18.
Terapia concomitante: consiste en claritromicina, amoxicilina, un nitroimidazol (tinidazol o metronidazol) y un inhibidor de bomba de protones. Si bien su efectividad puede verse afectada por la resistencia al macrólido o al nitroimidazol, ha mostrado tasas de erradicación significativamente más altas al compararlo con la triple terapia estándar (90 % y 78 %, respectivamente) 19.
Terapia híbrida: consiste en amoxicilina y un inhibidor de bomba de protones durante siete días, seguidos de amoxicilina, claritromicina, un nitroimidazol y un inhibidor de bomba de protones durante otros siete días. No se ha comparado directamente con la terapia triple, pero se ha sugerido como una alternativa teniendo una eficacia y tolerabilidad comparable a la terapia concomitante, con una tasa de erradicación del 89 % 20,21. Sin embargo, la complejidad del régimen ha limitado su uso como tratamiento de primera línea.
Terapia secuencial: consiste en amoxicilina y un inhibidor de bomba de protones durante cinco días, seguidos de claritromicina, nitroimidazol y un inhibidor de bomba de protones durante otros cinco días. Dada la complejidad del régimen y la falta de superioridad frente a la terapia triple estándar, no ha sido aprobada uniformemente por las guías como terapia de primera línea 7,22.
Triple terapia con levofloxacina: consiste en levofloxacina, amoxicilina y un inhibidor de bomba de protones. Esta terapia tiene tasas de erradicación que van del 75 % hasta el 84 % 21.
Terapia cuádruple con levofloxacina: consiste en levofloxacina, omeprazol, nitazoxanida y doxiciclina. Los pacientes aleatorizados a esta terapia durante siete o diez días tuvieron tasas de erradicación significativamente más altas en comparación con la triple terapia con claritromicina durante 10 días (89, 90 y 73 %, respectivamente)23.
Terapia secuencial con levofloxacina: consiste en amoxicilina y un inhibidor de bomba de protones durante cinco a siete días, seguida de levofloxacina, un nitroimidazol y un inhibidor de bomba de protones durante cinco a siete días. Este régimen ha mostrado tasa de erradicación significativamente mayor en comparación con la terapia secuencial o la triple estándar (88 contra 71 por ciento) 24.
¿Cuál esquema elegir de primera línea?
Además de tener en cuenta la alergia a las penicilinas, en cuyo caso se deben utilizar regímenes que no contengan amoxicilina, el factor más importante para la elección del esquema terapéutico es la resistencia antimicrobiana. Según las guías nacionales, el tratamiento de primera línea debería elegirse teniendo en cuenta pruebas de susceptibilidad; esta aproximación ha demostrado mayor efectividad al compararse con el manejo empírico 7,25. Infortunadamente, el cultivo y las pruebas moleculares no están ampliamente disponibles y por lo tanto, lo usual es dar un tratamiento empírico, cuya elección está basada en el patrón de resistencia local a los antibióticos.
Cuando la resistencia a claritromicina es menor de 15 %, se recomienda utilizar la terapia triple estándar 7,9,10,11. De lo contrario, se preferirá la terapia cuádruple con bismuto o la triple terapia con levofloxacina 11. Si la resistencia a levofloxacina es mayor al 20 %, se debe construir una terapia cuádruple con bismuto (levofloxacina + amoxilicina + bismuto + inhibidor de bomba de protones). Si la resistencia a metronidazol es mayor de 40 %, se aconsejan las terapias cuádruples con bismuto 7.
¿Cuál esquema elegir de primera línea en Colombia?
Basada en la reciente publicación "Descripción de la resistencia de Helicobacter pylori a seis antibióticos de uso frecuente en Colombia"26), el metronidazol se destaca con una resistencia en Bogotá entre 72 y 93 % y en el Eje Cafetero de 88 %. La claritromicina en el caso de Bogotá entre 13,6 y 60 %, en Armenia y Pereira 2,2 y 3,8 % respectivamente, mientras que en Antioquia fue del 18,8 %. De igual forma, la resistencia a la amoxicilina se evaluó en Bogotá presentando cifras entre 3,8 y 7 %. Con respecto a la levofloxacina se encontró una cifra entre 11,8 y 27,3 %. Y, asimismo, la resistencia a la tetraciclina en Bogotá fue del 85,7 %.
Basado en estos hallazgos la guía de práctica clínica nacional recomienda evitar la terapia triple combinada de amoxicilina, claritromicina y metronidazol o levofloxacina como tratamiento de primera línea 7). Y, por el contrario, se debe partir desde la epidemiología local para sugerir un tratamiento ajustado y evitar una falla terapéutica. Por lo tanto, en nuestro país se recomienda iniciar como primera línea una terapia cuádruple con bismuto, terapia híbrida o terapia concomitante 11).
¿Luego de completar la terapia, el paciente está curado?
Asumir que siempre que se trata la infección se consigue la erradicación es un error frecuente, al igual que creencias populares como que H. pylori hace parte de la microbiota y no se erradica porque “todo el mundo lo tiene” 11. Cuando se da tratamiento para H. pylori es necesario confirmar que se erradicó mediante una prueba de urea en el aliento, una prueba de antígeno fecal o una endoscopia digestiva alta. Para evitar falsos negativos la prueba en el aliento se debe hacer por lo menos dos semanas después de suspender el inhibidor de bomba de protones y por lo menos 4 semanas después de completar 9.
¿Qué hacer si no se logra la erradicación?
Aproximadamente el 20 % de los pacientes fracasan en el intento inicial de erradicación de H. pylori29. Si la bacteria persiste debe utilizarse un segundo esquema con al menos dos antibióticos diferentes a los prescritos inicialmente. Si a pesar de esto la infección continúa, la próxima terapia debe guiarse de acuerdo con las pruebas de sensibilidad determinadas en el cultivo 7,9-11. Finalmente, si no se logra la erradicación con el tercer esquema o si no se dispone de pruebas de sensibilidad, se han planteado regímenes de salvamento:
Esquema con rifabutina. Dada la excelente actividad in vitro de la rifabutina contra H. pylori, se ha planteado el siguiente esquema: rifabutina 150 mg dos veces al día + amoxicilina + inhibidor de bomba de protones por 10 días 22,27; el cual ha mostrado tasas de erradicación entre el 66 y el 79 % 30. Debe tenerse en cuenta que es un medicamento costoso, poco disponible y que no es inocuo: el 22 % de los pacientes presenta efectos adversos, siendo el más alarmante la mielotoxicidad, lo que obliga a una vigilancia estrecha del cuadro hemático 27. Adicionalmente, tiene el potencial de aumentar la prevalencia de micobacterias resistentes a rifampicina, un aspecto a tener en cuenta en un país endémico como Colombia.
Esquema con furazolidona. Consiste en una terapia cuádruple con inhibidor de bomba de protones, bismuto, amoxicilina o tetraciclina y furazolidona a una dosis de 100 mg tres veces al día por 14 días 28. Alcanza tasas de erradicación de hasta el 95,2 % 29. Se ha especulado que podría tener efectos oncogénicos 30, pero no hay evidencia clínica de ello, en cambio, sí hay en cuanto a su seguridad 31.
Terapia dual a dosis altas. Consiste en amoxicilina (1g cada seis horas) e inhibidor de bomba de protones (cada seis horas) durante 14 días. La tasa de erradicación con el régimen de rescate fue del 78 % en tres ensayos aleatorizados realizados en Europa y Asia 9.
Inhibición de la secreción de ácido
Una de las causas asociadas al fallo terapéutico es una inadecuada supresión de ácido clorhídrico (11,32. Donde además de la falta de adherencia y la subdosificación de los inhibidores de bomba de protones, el genotipo metabolizador de cada individuo sobre estos condicionan su efectividad; entendiendo que polimorfismos del CYP2C19 pueden presentar tanto “metabolizadores rápidos”, que metabolizarán velozmente los inhibidores de bomba de protones evitando lograr una acción óptima del medicamento, como los “metabolizadores lentos” que permiten mayor tiempo de acción del inhibidor de bomba de protones, logrando así una mayor supresión ácida 32.
Esto es de especial importancia en Colombia, ya que, según datos en Bogotá y el Eje Cafetero se ha identificado que la prevalencia de “metabolizadores rápidos” es del 76 % y 83,6 % respectivamente 33. Por lo tanto, se recomienda preferencialmente el uso de inhibidores de bomba de protones como el rabeprazol y esomeprazol, siendo los de menor dependencia del metabolismo por el CYP2C19 32. Por otro lado, cada vez más se populariza el uso de bloqueadores de ácido competidores de potasio como el vonoprazán, el cual, con un mecanismo de acción diferente, ha mostrado excelente eficacia sin condicionarse por polimorfismos CYP2C19 32,34.
Terapias adyuvantes
Experimentalmente, se han evaluado algunas terapias adyuvantes para la erradicación de H. pylori, aunque se necesitan estudios adicionales para respaldar su uso:
Estatinas: la adición de la terapia con estatinas como adyuvante a la terapia triple se ha asociado a un aumento en las tasas de erradicación de H. pylori35.
Probióticos: el uso concomitante sugiere tasas de curación más altas y una reducción en la incidencia de efectos secundarios 36.
Vonoprazán: en lugar de un inhibidor de bomba de protones, el vonoprazán puede aumentar las tasas de erradicación de H. pylori. Sin embargo, no está disponible en Colombia y los datos sobre seguridad son limitados 37.
Vitaminas C y E: la adición de 500 mg de vitamina C más 200 unidades de vitamina E dos veces al día durante 30 días al régimen de triple terapia se ha asociado con una mayor tasa de erradicación de H. pylori38.
Conclusión
Se deben conocer las indicaciones y los métodos para hacer una búsqueda activa de Helicobacter pylori. Una vez identificado, el esquema de tratamiento que se escoja debe tener una eficacia de al menos el 90 %. En Colombia se recomiendan la terapia cuádruple con bismuto, la híbrida o la concomitante. Posterior al tratamiento es necesario evaluar si se logró la erradicación. Los pacientes que persisten con la infección deben ser remitidos a Gastroenterología para definir el mejor esquema de segunda o tercera línea.