Introducción
Según sus raíces griegas las pseudomicosis son definidas como: “pseudo”: falso y “mykes”: hongo, refiriéndose a infecciones generadas por microorganismos que parecen hongos, pero que no lo son. Las pseudomicosis que trataremos en esta revisión son caracterizadas como oportunistas, dado que sus agentes etiológicos son gérmenes que bajo condiciones normales no son patógenos o son microorganismos patógenos de manera circunstancial; es decir, una vez se dé un desbalance en los mecanismos inmunitarios del hospedero se desarrolla la infección y son gérmenes patógenos altamente virulentos1.
Como característica general, la actinomicosis, botriomicosis, nocardiosis y prototecosis se presentan con mayor frecuencia en individuos con algún grado de inmunosupresión2. Se proponen dos mecanismos que explican cómo producen enfermedad: el primero es cuando la infección se adquiere de manera exógena, es decir, secundaria a inoculación por trauma o aspiración; el segundo mecanismo es el endógeno, en el cual un germen que hace parte del microbioma normal de piel, mucosas o tracto gastrointestinal, se vuelve patógeno2.
Etiología
La actinomicosis es producida por bacterias del género Actinomyces. El principal agente etiológico es Actinomyces israelii que se encuentra en la cavidad oral, específicamente en dientes cariados, placa dentaria y criptas amigdalinas3. La botriomicosis es producida por bacterias aerobias, principalmente Staphylococcus aureus, causante hasta del 40 % de las infecciones. Un 20 % está dado por Pseudomonas aeruginosa y el 40 % restante por estafilococo coagulasa-negativo, Streptococcus spp, Proteus spp. y Escherichia coli. Dichos agentes hacen parte del microbioma de piel y mucosas y se vuelven infectantes al darse una solución de continuidad de la barrera cutánea4.
La nocardiosis es producida por especies del género Nocardia. Son bacterias Gram positivas, aerobias, parcialmente ácido alcohol resistentes, que se encuentran como saprófitos en arena, aire, agua y vegetación en descomposición5. Se clasifican según su susceptibilidad antibiótica así: Nocardia asteroides, N. farcinica, N. abscessus, complejo Nocardia brevicatena-paucivorans, complejoNocardia novay complejo Nocardia transvalensis. Recientemente, se descubrió que Nocardia cyriacigeorgicano hace parte del complejo Nocardia astereoides y representa un porcentaje importante de infecciones6.
La prototecosis es producida por algas unicelulares, heterótrofas y aclóricas. Las especies del género Prothoteca son saprofitas en agua, arena contaminadas y en algunas plantas en descomposición7. Hasta el momento, hay descritas ocho especies, aunque solo las mencionadas a continuación se han reportado causando infección en el humano: Prototheca wickerhamii, P. zopfii, P. blaschkeae, P. cutis y P. miyajii8.
Epidemiología
La actinomicosis suele darse entre la cuarta y quinta década de la vida y es más frecuente en hombres. Los individuos con enfermedad dentaria preexistente, mala higiene oral y alcoholismo tienen una tendencia aumentada a desarrollar infecciones por Actinomycetos9. La botriomicosis, por su parte, es rara, afecta también más a hombres y suele presentarse entre la tercera y cuarta década de la vida2,4.
Los climas tropicales favorecen las infecciones por Nocardia y Prothoteca. Nocardia prefiere climas cálidos y áridos; mientras que Prothoteca tiene predilección por áreas con alto grado de humedad. Dado lo anterior, los sembradores de arroz, granjeros y pescadores tienen mayor riesgo de adquirir la infección2,10. Adicionalmente, los pacientes con algún grado de inmunosupresión como diabetes mellitus, malnutrición, malignidades y terapia con corticoesteroides, tienen mayor riesgo de desarrollar cualquiera de las entidades mencionadas2.
Clínica
La actinomicosis tiene múltiples y variadas presentaciones dependiendo del órgano afectado. Cérvico-facial: representa el 50-70 % de los casos11. Compromete mejillas, mentón y mandíbula, generando masas induradas e indoloras, que evolucionan a abscesos con excreción de “gránulos de azufre” (figura 1). También hay reportes de afectación de sitios raros como lengua, laringe, senos paranasales, oído medio9, hueso mandibular12 y glándula tiroides13.

Tomado de: Bonifaz A. Micología Médica. Cuarta edición. Mexico, D.F.; 2012. Pg.478, imagen 33-2. Con autorización del autor
Figura 1 Actinomicosis cérvico-facial unifistulada.
Tracto respiratorio: producido por aspiración del microorganismo desde la cavidad oral11. Produce síntomas similares a otras infecciones respiratorias como disnea, tos productiva, hemoptisis y dolor torácico; se acompaña de fiebre, sudores nocturnos y pérdida de peso9. Puede diseminarse a la pared del tórax, pleura y pericardio3. Puede confundirse o coexistir con tuberculosis o malignidades pulmonares14,15.
Tracto digestivo: se relaciona con cirugías abdominales, diverticulitis, apendicitis perforada e ingestión de cuerpos extraños3. Los síntomas dependen de la localización de la infección: en caso de disfagia es posible que la infección se localice en el esófago; el dolor en hipocondrio derecho y asociado a ictericia indican compromiso hepático; la presencia de masa palpable con dolor abdominal hará sospechar que la infección se encuentre en colon, ciego o apéndice9. Puede acompañarse de pérdida de peso, náuseas, vómito y fiebre3.
Pélvico-uterina: se relaciona con la utilización por tiempo prolongado de tampones o dispositivos intrauterinos. Suele presentarse con sangrado o secreción vaginal, dolor abdominal en hipogastrio y masa pélvica3,11.
Otras: se han descrito presentaciones más raras como la del sistema nervioso central, la cutánea y la diseminada3,9.
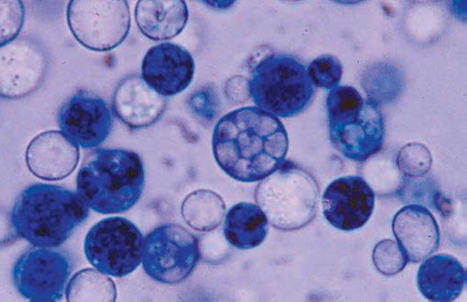
La botriomicosis puede presentarse de dos formas: cutánea y visceral. La cutánea es más común y tiene una amplia morfología, que incluye nódulos, abscesos y úlceras, con formación de fístulas (figura 2). En ocasiones se acompaña de exudado de gránulos que, a simple vista, pueden ser indistinguibles de los gránulos de la actinomicosis. Suele afectar manos, pies, cabeza y cuello4, aunque hay reportes de presentaciones en sitios raros como la lengua16.

Tomado de: Bonifaz A. Micología Médica. Cuarta edición. Mexico, D.F.; 2012. Pg.488, imagen 34-3. Con autorización del autor
Figura 2 Fístula de botriomicosis.
La forma visceral se dá posterior a estancias hospitalarias prolongadas o cirugías. La fibrosis quística es uno de los factores de riesgo más importante (17) . El órgano más afectado es el pulmón, con síntomas inespecíficos como disnea, tos y dolor pleurítico4,9. También pueden afectarse el hígado, riñón, tracto gastrointestinal, corazón y cerebro; las manifestaciones clínicas dependerán del órgano comprometido4.
La nocardiosis tiene presentaciones variadas. La forma cutánea suele darse en inmunocompetentes10. La presentación cutánea primaria se asocia con inoculación por trauma local y se manifiesta como una infección linfocutánea o cutánea superficial, que incluye nódulos, abscesos y gomas (figura 3)2. La forma cutánea secundaria es más frecuente que la anterior, ocurre a partir de una infección pulmonar y se presenta con pústulas, nódulos y abscesos2,10.
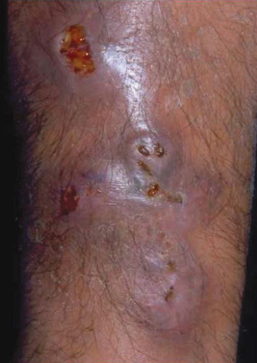
Tomado de: Bonifaz A. Micología Médica. Cuarta edición. Mexico, D.F.; 2012. Pg.494, imagen 35-4. Con autorización del autor
Figura 3 Nocardiosis cutánea primaria por N. asteroides.
La forma pulmonar es la más común. Como en actinomicosis y botriomicosis los síntomas son inespecíficos e indistinguibles de otras infecciones respiratorias: tos, disnea y fiebre6. La infección por Nocardia se ha encontrado en pacientes con enfermedades pulmonares como asma, bronquitis crónica o sarcoidosis10; además, ha sido reportada como causa de exacerbación de enfermedad pulmonar obstructiva crónica18.
La nocardiosis diseminada afecta el sistema nervioso central y produce abscesos intracerebrales que se manifiestan con cefalea, náuseas, vómito, alteración de la consciencia e incluso convulsiones6. La mayoría de pacientes con la forma diseminada tienen inmunosupresión por malignidad o trasplantes, pero no es frecuente en pacientes con infección por VIH19,20,28.
Las manifestaciones clínicas de la prototecosis son inespecíficas. Se han reportado tres diferentes presentaciones: cutánea, bursitis del olécranon y diseminada. La forma cutánea es la más común. Suele darse después de inoculación traumática o heridas quirúrgicas. Las lesiones son diversas: placas, pápulas, eritema, nódulos, úlceras y abscesos, incluso lesiones hipopigmentadas y atróficas7,21,22. Lo más común es una lesión vesículo-ampollosa única, que se ulcera y se acompaña de secreción purulenta, en áreas expuestas como dedos, muñecas, dorso de manos y antebrazos8,21 (figura 4).
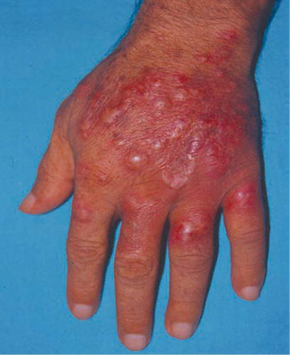
Tomado de: Bonifaz A. Micología Médica. Cuarta edición. Mexico, D.F.; 2012. Pg.502, imagen 36-1. (cortesía de Muñoz VF, Sinaloa, México). Con autorización del autor
Figura 4 Prototecosis subcutânea.
La bursitis del olécranon está precedida de trauma repetitivo en el codo. Se manifiesta con induración, eritema, sensibilidad, con o sin exudado serohemático7. La forma diseminada es rara21 y afecta pacientes inmunocomprometidos7. Se relaciona con estados posoperatorios, diálisis peritoneal, intubación orotraqueal o cateterismos. La infección se disemina a partir de foco primario como piel hacia tracto respiratorio, urinario, hígado, meninges y endocardio2 (tabla 1).
Diagnóstico
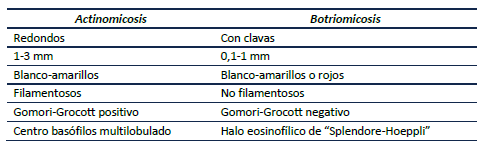
El diagnóstico es difícil, sus hallazgos clínicos son inespecíficos y pueden ser confundidos con otras enfermedades. Generalmente, las pruebas microbiológicas y la biopsia son necesarias para hacer un diagnóstico definitivo3,10,22. En la actinomicosis el examen directo permite visualizar los “gránulos de azufre”, filamentosos, apelotonados, blanco-amarillos. Es de resaltar que la botriomicosis también tiene gránulos que pueden verse en el examen directo, pero éstos son redondos no filamentosos, además varían entre blanco-amarillo y rojo (figura 5). La tinción de Gomori-Grocott es negativa en el caso de la botriomicosis y positiva en la actinomicosis (tabla 2).
Tabla 2 Diferencias macro y microscópicas de los gránulos de actinomicosis y botriomicosis.
Adaptado de ref. 2
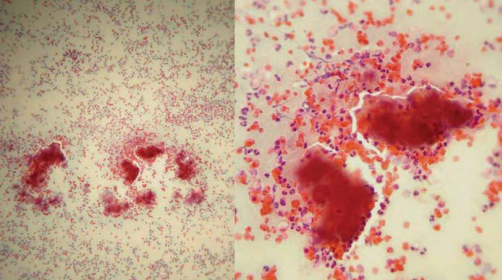
Tomado de: Bonifaz A. Micología Médica. Cuarta edición. Mexico, D.F.; 2012. Pg.488, imagen 34-4. (Cortesía de: González-Mena L, México, DF.)
Figura 5 Granos de botriomicosis. Citopatología (10X, 40X).
La biopsia ayuda a diferenciar estas entidades: en la botriomicosis se observa un halo eosinofílico, con un centro más basófilo llamado “ fenómeno de Splendore-Hoeppli”; en la actinomicosis se observan gránulos basófilos multilobulados2 (tabla 2). En el diagnóstico de las infecciones por Nocardia, es útil la tinción de Ziehl-Neelsen modificado en el tejido, que permite visualizar las pseudo hifas micro sifonadas, septadas, gram positivas, ácido alcohol resistentes, asociadas a reacción inflamatoria con neutrófilos y células gigantes. El cultivo debe realizarse en agar sangre de cordero al 5 %, agar chocolate y tripticasa soya agar. En su crecimiento se observan colonias acuminadas, secas y rugosas, con apariencia de “palomitas de maíz”, blancas o naranja dependiendo de la especie aislada2.
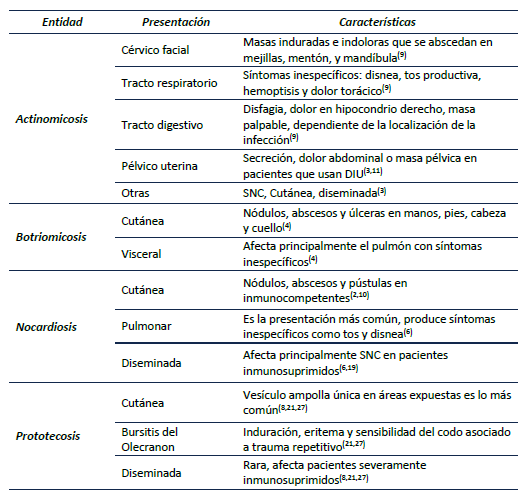
En el cultivo de prototecosis las colonias tienen apariencia de levadura, color amarilla o salmón grumosa y brillante. Estos microorganismos crecen en medios de cultivo habituales como agar Sabouraud dextrosa2. Al examen microscópico se pueden observar las imágenes en forma de “mórula” que corresponden a los esporangios en esporulación con las endosporas (figura 6). La tinción de ácido peryódico de Schiff (PAS) permite ver mejor estas estructuras. El estudio histopatológico permite visualizar una hiperplasia pseudoepiteliomatosa asociada a un infiltrado inflamatorio granulomatoso, compuesto por plasmocitos, linfocitos y eosinófilos7.
Tratamiento
El manejo de la actinomicosis debe ser farmacológico y quirúrgico. El régimen farmacológico es con penicilina intravenosa por dos a seis semanas y, posteriormente, pasar a terapia oral por seis a doce 12 meses3. Existen reportes con el uso de amoxicilina oral con eficacia similar2. La cirugía está indicada para drenaje de abscesos, fístulas recalcitrantes o tractos sinuosos11.
Los pacientes con botriomicosis se tratan con antibióticos, de acuerdo a la susceptibilidad del agente causal. La mayoría de los microorganismos causantes de la botriomicosis responden a trimetoprim-sulfametoxazol, minociclina, cefalosporinas y eritromicina y la duración del tratamiento debe ser prolongada. Los gérmenes anaerobios suelen responder al manejo con metronidazol o clindamicina. En ciertos casos se recomienda el drenaje y escisión quirúrgica de las lesiones4.
Al igual que para las entidades anteriores, en la nocardiosis el rápido inicio de la terapia antibiótica puede evitar la necesidad del tratamiento quirúrgico. El antibiótico de elección es el trimetoprim-sulfametoxazol5. Existen otros regímenes que incluyen aminoglucósidos, carbapenémicos, tetraciclinas y quinolonas, con efectividad variable dependiendo de la especie23,26,28. En 2011, Larruskain et al. publican un artículo que reporta la efectividad de 20 antibióticos contra nueve especies de Nocardia, encontrándose sensibilidad a amikacina y linezolid en todas las especies estudiadas y, resistencia al TMP-SMX de algunas cepas de N. flavorosea, N. carnea y N. farcinica24.
Las especies del género Prothoteca poseen ergosterol en su membrana, lo que las hace similares estructuralmente a los hongos, y por lo tanto sensibles al tratamiento con antimicóticos2. Dado el número limitado de casos reportados, no existe hasta ahora evidencia suficiente para hacer una recomendación terapéutica estándar, por lo que se debe individualizar cada caso25. La escisión quirúrgica se reserva para lesiones cutáneas pequeñas y localizadas7. En pacientes con bursitis del olecranon se recomienda bursectomía, asociado a tratamiento farmacológico, con anfotericina B o azoles22. La terapia sistémica con anfotericina B en infección diseminada es la más efectiva. Entre los azoles, el fluconazol y el itraconazol tienen mejores tasas de respuesta8 (tabla 3).
Conclusión
Las pseudomicosis por oportunistas son raras, pero su frecuencia aumenta bajo ciertas condiciones climáticas y el estado inmunológico de los pacientes. El diagnóstico representa un reto, dada la variedad de signos y síntomas, y su similitud con otras entidades. El tratamiento es difícil y usualmente requiere largos períodos de tiempo.