Introducción
La prevalencia de la diabetes mellitus tipo 2 (DT2) continúa aumentado a nivel mundial y es una enfermedad que afecta a países desarrollados y en vía de desarrollo. Según los últimos datos de la Federación Internacional de Diabetes para el año 2021 se estimó una prevalencia de diabetes a nivel mundial de un 10.5% correspondiente a un total de 536.6 millones de personas entre 20 y 79 años y se estima que para el año 2045 más de 783 millones de personas en el mundo tendrán DM2. 1 Colombia tiene una prevalencia de diabetes del 9.9% en la población de 20 - 79 años, equivalente a 3.4 millones de personas con este diagnóstico (1,2.
La estrategia actual de manejo se basa en las características individuales de los pacientes teniendo como meta cumplir 5 objetivos: lograr el nivel óptimo individualizado de hemoglobina glicada (HbA1c), control de la presión arterial, tratamiento de la dislipidemia según la meta establecida, evitar eventos de hipoglucemia e impactar en la pérdida de peso 3.
El objetivo de esta revisión de la literatura (es realizar un enfoque práctico e individualizado de los pacientes con DT2 según el escenario clínico en el que se encuentren, basados en la evidencia científica actualizada que permita tomar las mejores decisiones para el tratamiento de los pacientes con DT2.
Inicio de la terapia farmacológica
Las preguntas que el clínico debe plantearse antes de iniciar el manejo farmacológico de los pacientes con diabetes mellitus tipo 2 son:
¿Mi paciente tiene alto riesgo cardiovascular?.
¿Mi paciente tiene enfermedad cardiovascular establecida?.
¿Mi paciente tiene falla cardíaca?.
¿Mi paciente tiene enfermedad renal crónica?.
¿Mi paciente tiene exceso de tejido adiposo?.
¿Cuál es la HbA1c de mi paciente? ¿tiene falla de célula β (síntomas o signos de catabolismo) o glucemia en ayunas ≥ 300 mg/dL?.
¿La meta de HbA1c de mi paciente es <1.5% a su HbA1c actual?.
¿La meta de HbA1c de mi paciente es ≥1.5% a su HbA1c actual?.
¿La HbA1c de mi paciente es ≥ 9% y <10%?.
¿Mi paciente tiene glucemia en ayunas ≥ 300 mg/dL, síntomas o signos de catabolismo o hiperglucemia y/o HbA1c ≥10%?.
A continuación, se dan respuesta a las preguntas previamente expresadas:
¿Cuál es el riesgo cardiovascular de mi paciente?
La diabetes mellitus tipo 2 es una enfermedad que aumenta el riesgo de complicaciones macrovasculares como enfermedad coronaria (HR 2.0; IC 95% 1.83 - 2.19), enfermedad cerebrovascular isquémica (HR 2.27; IC 95% 1.95 - 2.65) y muertes relacionadas a enfermedad vascular (HR 1.73; IC 95% 1.51 - 1.98) 4.
Dado la alta carga de morbilidad y mortalidad cardiovascular que acarrea la diabetes mellitus tipo 2, se han realizado un sin número de ensayos clínicos con el objetivo de demostrar beneficio en alguna de las moléculas estudiadas, no sólo en pacientes con enfermedad cardiovascular establecida, sino también en prevención primaria en pacientes con alto riesgo cardiovascular.
1. a. ¿Mi paciente tiene alto riesgo cardiovascular?
Es importante reconocer que el paciente con diabetes mellitus tipo 2 por múltiples mecanismos fisiopatológicos cuenta con la plausibilidad biológica de tener alto riesgo cardiovascular entre los que se destaca disfunción vascular con mayor rigidez arterial, hipercoagulación con mayor actividad plaquetaria, disfunción endotelial y mayor estrés oxidativo; sin dejar de lado que son pacientes con mayor riesgo de dislipidemia aterogénica que contribuye a la enfermedad cardiovascular, además si se suman factores ambientales como la malnutrición, sedentarismo, tabaquismo y obesidad se completa el conjunto funesto de la génesis de la enfermedad cardiovascular en estos pacientes 5.
Una vez reconocido el riesgo de enfermedad cardiovascular en los pacientes con DT2 es necesario preguntarse si el paciente al cual se está enfrentando tiene riesgo cardiovascular alto o muy alto pues esto modificará la conducta. Múltiples sociedades científicas (3, 6, 7) han definido este riesgo de diferentes maneras; los autores recomiendan para población colombiana, definirlo con base a las recomendaciones de la Sociedad Colombiana de Cardiología y Cirugía Cardiovascular (SCC), la Asociación Colombiana de Endocrinología (ACE), la Asociación Colombiana de Nefrología (ASOCOLNEF) y la Asociación Colombiana de Medicina Interna (ACMI) del año 2020 7 (Tabla 1).
Tabla 1 Definición de riesgo cardiovascular.
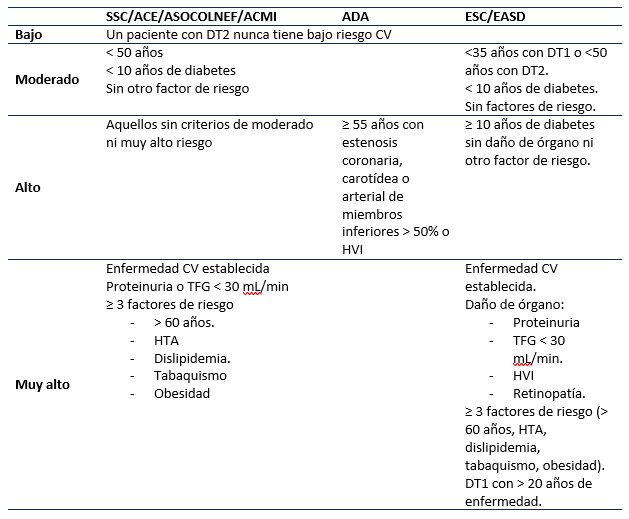
CV: Cardiovascular; HTA: Hipertensión Arterial; TFG: Tasa de Filtración Glomerular; HVI: Hipertrofia Ventricular Izquierda.
Desde el año 2019 las guías europeas de cardiología 6 recomiendan el uso de iSGLT-2 y de AR-GLP1 con evidencia en disminución eventos macrovasculares en prevención primaria; recomendación que se mantiene por la Asociación Americana de Endocrinólogos Clínicos en el 2020 8 y que se refuerza por la Asociación Americana de Diabetes en el 2022 3;en Colombia se tiene las Recomendaciones para el manejo del riesgo cardiorrenal del paciente con diabetes mellitus tipo 2 realizadas por SCC, ACE, ASOCOLNEF, ACMI 7 que dan validez externa a esta conducta en dicho país, soportando el uso de los iSGLT-2 y AR-GLP1 en prevención primaria y secundaria.
Al analizar el desenlace de eventos cardiovasculares adversos mayores (MACE) en el subgrupo de población con alto riesgo cardiovascular (prevención primaria) a partir de metaanálisis 9, los estudios esenciales de los iSGLT-2 10,11) y AR-GLP1 12-16 no han logrado demostrar beneficio cardiovascular desde el punto de vista estadístico como si lo han demostrado en prevención secundaria.
El estudio STENO-2 (17 fue un estudio en pacientes con DT2 y microalbuminuria en el que se demostró como el tratamiento intensivo, con cambios en el estilo de vida y control de variables como HbA1c, presión arterial y lípidos, disminuye el MACE en prevención primaria, desenlace evidenciado luego de un tiempo total de seguimiento de 13.3 años. Los estudios esenciales de estas moléculas tienen un tiempo de seguimiento entre 1.9 a 5.4 años. Luego de realizar un análisis crítico de la literatura de los estudios descritos 9-17 se puede concluir que es probable que si se logra tener un tiempo de seguimiento mayor como en el STENO-2 17 se demostraría la significancia estadística para el MACE en prevención primaria. En el congreso de la ADA año 2021 se presentaron resultados parciales del GRADE Trial (NCT01794143) que da luz a que los AR-GLP1, puntualmente liraglutida, puede disminuir el MACE en prevención primaria con significancia estadística al tener un mayor tiempo de seguimiento (entre 4 - 7 años), datos a confirmar en un futuro cuando se libere la totalidad de los datos. En la Figura 1 se representa lo expuesto en este apartado.

Figura 1 Tratamiento de los pacientes con diabetes mellitus tipo 2 y riesgo Cardiovascular (CV) alto o muy alto; enfermedad cardiovascular establecida, Enfermedad Renal Crónica (ERC) o Falla Cardíaca (FC). Adaptada de referencia 3.
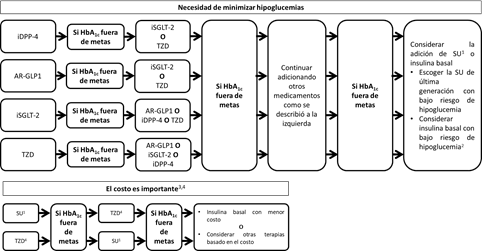
Se debe evaluar el control glucémico a los 3 meses de haber iniciado la terapia. En caso de que no se haya logrado la meta de HbA1c, la intensificación debe continuar usando AR-GLP1 sí inicialmente se eligió el iSGLT-2, o el iSGLT-2 de haberse usado en primera instancia un AR-GLP1. Es necesario tener presente que si se está usando AR-GLP1 no debe usarse de forma concomitante los inhibidores de la dipeptidil peptidasa 4 (iDPP-4).
1.b. ¿Mi paciente tiene enfermedad cardiovascular establecida?
La metformina sigue siendo la terapia de primera línea por su bajo costo, tiempo de uso y la evidencia del UK Prospective Diabetes Study (UKPDS) 18 donde en un análisis post-hoc se encontró que los pacientes que recibieron metformina tuvieron reducciones de riesgo en mortalidad asociada a diabetes en 42% y disminución de infarto agudo de miocardio (IAM) en 39%, comparado con pacientes con sobrepeso en el grupo de terapia convencional (dieta); sin embargo, al comparar los mismos desenlaces con otros hipoglucemiantes, no se encontró diferencias en desenlaces clínicamente relevantes. Fue sólo hasta el año 2015 con el estudio EMPAREG OUTCOME 19 y en el 2016 con los estudios LEADER 12 y SUSTAIN-6 13 que se logró evidenciar disminución de mortalidad y complicaciones macrovasculares en pacientes con enfermedad cardiovascular establecida y alto riesgo cardiovascular, tras añadir un antidiabético al manejo estándar, empagliflozina, liraglutida y semaglutida respectivamente.
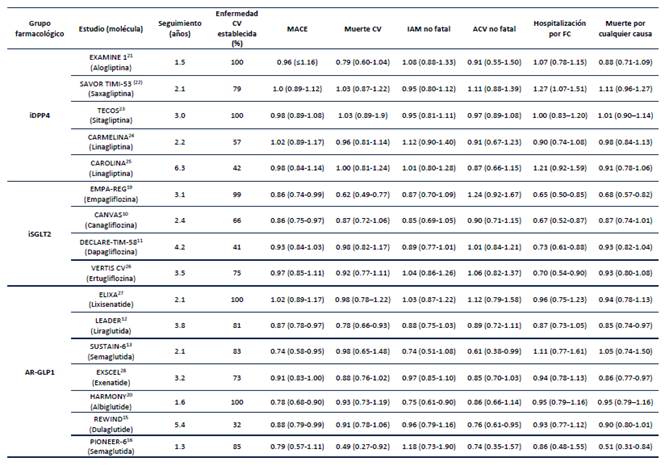
La propuesta actual es que los pacientes con enfermedad cardiovascular establecida deben recibir tratamiento con AR-GLP1 o iSGLT-2 (Figura 2) que hayan demostrado tener seguridad y beneficio cardiovascular (Tabla 1). Los estudios esenciales de los iSGLT-2 (10, 11, 19) y de los AR-GLP1 12-16,20 definieron en el protocolo que para demostrar seguridad cardiovascular, el desenlace MACE debe tener como límite superior del intervalo de confianza un valor inferior a 1.3; como se puede evidenciar en la Tabla 2, todas las moléculas estudiadas han demostrado ser seguras a nivel cardiovascular. El beneficio en desenlaces cardiovasculares, entendiendo beneficio como reducción de estos eventos, lo han demostrado la empagliflozina 19 y la canagliflozina 10 en el grupo de los iSGLT-2 y la liraglutida 12 semaglutida subcutáneo 13 (el estudio con desenlace primario MACE con semaglutide oral está aún en proceso NCT03914326), dulaglutida 15 y albiglutida 20. Canagliflozina y albiglutida no están disponibles en Colombia.
A continuación, se plantean algunas consideraciones de los estudios primarios:
El EMPA-REG OUTCOMES 19 fue un estudio realizado con empagliflozina en el cual el 99% de la población tenía enfermedad cardiovascular establecida. Además de reducir el MACE en un 14%, demostró reducir muerte cardiovascular en un 38%.
El CANVAS 10 realizado con canagliflozina demostró reducir el MACE en un 14%; sin embargo, al evaluar cada desenlace de forma independiente, no hubo significancia estadística. Aquí es muy importante considerar que la muestra de los ensayos clínicos es estimada para el desenlace primario (MACE), es por esto por lo que no se puede concluir que la canagliflozina no disminuya uno o varios de los desenlaces que conforman el MACE; para poder conocer esto se deberían realizar estudios cuya muestra sea calculada para cada desenlace.
El DECLARE-TIMI 58 11 con dapagliflozina no logró demostrar disminuir el MACE; sin embargo, es importante considerar que el 59% de la población fue de prevención primaria, no tenían enfermedad cardiovascular establecida y es por esto que la regresión a la media en este estudio no era una opción. De este análisis pueden salir hipótesis, v.g la inclusión de la misma población del EMPA-REG OUTCOMES 19, potencialmente se hubieran tenido resultados similares considerando un posible efecto de grupo, pero hasta no tener un ensayo clínico que lo demuestre, se deberá considerar la empagliflozina sobre dapagliflozina si el objetivo es reducir MACE.
De los AR-GLP1 tanto el LEADER12 con liraglutida, SUSTAIN-6 13 con semaglutida, HARMONY 20 con albiglutida y REWIND15 con dulaglutida demostraron disminuir MACE en un 13%, 26%, 22% y 12% respectivamente.
Liraglutida 12 disminuyó la mortalidad CV en un 22% y mortalidad por todas las causas en un 15%.
Semaglutida 13 subcutáneo de administración semanal disminuyó en un 39% el Accidente Cerebrovascular (ACV).
Albiglutida 20 (no disponible en Colombia) disminuyó en un 25% el infarto agudo de miocardio no fatal.
Dulaglutida 15 disminuyó en un 24% el ACV. Es de resaltar la población del REWIND en la que sólo el 32% tenían enfermedad CV establecida, es decir que el 68% eran de prevención primaria y a pesar de esto se logró demostrar disminuir MACE y ACV.
El estudio PIONEER-6 16 realizado con semaglutida oral no disminuyó MACE; sin embargo, fue un estudio cuyo diseño metodológico fue con el objetivo de demostrar seguridad CV (cumpliendo este objetivo). El estudio cuyo diseño metodológico se realizó para valorar MACE con esta molécula se llama SOUL (NCT03914326) y se estima que finalizará el 29 de julio del 2024.
Si bien el PIONEER-6 16 demostró reducción en un 51% la mortalidad CV y en un 49% la mortalidad por todas las causas no cumplió con la significancia estadística para el desenlace primario (MACE) y por esto sólo se puede plantear estos resultados como hipótesis, no como verdad.
Al momento de elegir un medicamento sobre otro es necesario considerar otras variables como lo es el acceso al medicamento, su precio, el beneficio sobre otros desenlaces (falla cardíaca, obesidad, enfermedad renal) y la preferencia del paciente (terapias por vía oral o incluso la aplicación semanal de algunos AR-GLP1).
De la misma forma que los pacientes con alto riesgo cardiovascular, se debe evaluar el control glucémico a los 3 meses de haber iniciado la terapia. En caso de que no se logre alcanzar la meta de HbA1c, la intensificación debe continuar usando AR-GLP1 en caso tal de que se hubiera elegido inicialmente el iSGLT-2 o el iSGLT-2 en caso de que primero se hubiera usado el AR-GLP1. Si luego de añadir un segundo medicamento con beneficio CV el paciente persiste con HbA1c fuera de metas, la intensificación debe continuarse considerando el riesgo de hipoglucemia, ganancia de peso y el costo de cada terapia. En la Figura 1 se expresa lo mencionado previamente.
2. ¿Tiene alguna comorbilidad que implique un tratamiento antidiabético específico?
En los ensayos clínicos con los AR-GLP1 12-16 y los iSGLT-2 10,11,19 se han identificado comorbilidades en los que estos medicamentos tienen un beneficio adicional como lo son la falla cardíaca, enfermedad renal crónica y exceso de tejido adiposo; a continuación se desglosa cada una:
2.a. ¿Mi paciente tiene falla cardíaca?
Se estima una prevalencia mundial de diabetes de al menos un 8%, de estos, un 9 - 22% tendrán falla cardíaca y se estima una prevalencia mundial de falla cardíaca entre el 1 al 2%, y de estos, el 20 - 45% tienen diabetes (29 por lo cual es muy frecuente encontrar pacientes con el binomio diabetes y falla cardíaca; en este orden de ideas, cuando se identifique una, se debería validar si cuenta con la otra enfermedad.
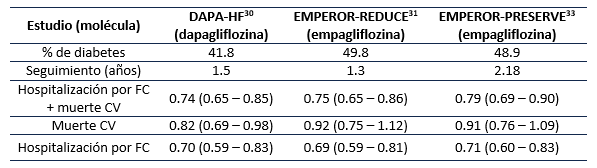
Se cuenta con 2 ensayos clínicos realizados en población con falla cardíaca con fracción de eyección reducida (FEVI <40%) con y sin diabetes, el DAPA HF 30 realizado con dapagliflozina y el EMPEROR-REDUCE 31 con empagliflozina. Estos dos medicamentos disminuyeron el desenlace primario compuesto por muerte de causa cardiovascular y hospitalización por falla cardíaca en un 26% para dapagliflozina y en un 25% para empagliflozina (Tabla 3). Si bien aún no se cuenta con estudios en población exclusiva de falla cardíaca para canagliflozina y ertugliflozina, como podemos evidenciar en la Tabla 2 y en múltiples metaanálisis, 9,32) el efecto de los iSGLT-2 sobre el desenlace de hospitalización por falla cardíaca es un efecto de clase.
La evidencia no se limita sólo al paciente con falla cardíaca y FEVI <40%, sino que ya se cuenta con evidencia sólida del beneficio de la empagliflozina en pacientes con FEVI ≥40% (Tabla 3). En el estudio EMPEROR-PRESERVE 33 se demostró que la empagliflozina disminuye el desenlace primario compuesto por muerte de causa cardiovascular y hospitalización por falla cardíaca en un 21%.
Los AR-GLP1 han demostrado ser seguros para el desenlace de falla cardíaca; por ahora no han demostrado un beneficio adicional (Tabla 2); sin embargo, hay que recordar que los estudios fueron diseñados para valorar MACE no para evaluar un desenlace puntual de falla cardíaca como si lo fueron el DAPA-HF 30 y el EMPEROR-REDUCE 31 y EMPEROR-PRESERVE 33. Los iDPP-4 21,23-25 han demostrado ser seguros (Tabla 2) excepto la saxagliptina pues en el estudio SAVOR-TIMI 53 22 se encontró que este medicamento incrementa el riesgo de hospitalización por falla cardíaca.
Por lo mencionado previamente y con base en recomendaciones de guías de práctica clínica, el medicamento a elegir en esta población son los iSGLT-2, puntualmente dapagliflozina y empagliflozina por su respaldo con ensayos clínicos (Figura 1).
2.b. ¿Mi paciente tiene enfermedad renal crónica?
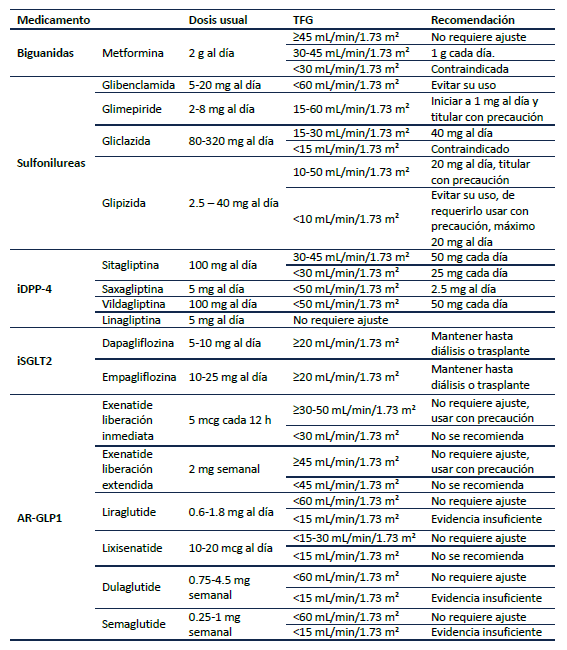
Hay que tener presente que la definición de enfermedad renal crónica (ERC) no sólo es a partir de un punto de corte de tasa de filtración glomerular (TFG) < 60 mL/min/1.73 m2 sino que la presencia de albuminuria por más de 3 meses hace considerar este diagnóstico 27, complicación frecuente en los pacientes con DT2 por compromiso microvascular. El paciente con DT2 y ERC requiere por recomendaciones de ADA 3 y KDIGO 34 el uso de metformina más el iSGLT-2 como primera línea de manejo. Las recomendaciones colombianas7 proponen el uso de los iSGLT-2 como segunda línea luego de metformina, aunque hay que considerar que estas recomendaciones son previas a las publicadas por KDIGO 34 y ADA 3 y según el juicio clínico se podría usar de forma concomitante la metformina + iSLGT-2 como primera línea en los pacientes con ERC.
El beneficio de los iSGLT-2 en ERC está dado por disminución en la caída de la tasa de filtración glomerular, además, disminuyen la proteinuria y la progresión a ERC-G5 10,11,31,35-38. En caso de no lograr el control glucémico se debe considerar añadir a la terapia los AR-GLP1 por disminución de la macroalbuminuria 39, desenlace que se correlaciona con mayor riesgo cardiovascular 40). Además, en el arsenal terapéutico de los pacientes con DT2 y albuminuria debe estar el uso del antagonista del receptor mineralocorticoide no esteroideo finerenone 34, pues en el estudio FIDELIO-DKD (41 y FIGARO-DKD (42 se demostró como este medicamento disminuye la progresión de ERC y eventos cardiovasculares. En la Tabla 4 se representan las dosis de los medicamentos según la TFG.
2.c. ¿Mi paciente tiene exceso de tejido adiposo?
Lo primero a mencionar es que se debe evitar el uso del término obesidad, esta palabra deriva del latín obesitas (od + edere) que significa “gordura” o “comer en exceso”, término que no guarda correlación con el mecanismo fisiopatológico y estigmatiza a la persona que la padece; la recomendación de la AACE desde el 2014 es que se use el término “exceso de tejido adiposo” para designar esta patología (43.
Desde el año 1937 se ha reconocido el término “diabesidad” ya que el Dr. Ethan Allen Sims desde esta época lo introdujo al correlacionar el binomio diabetes y exceso de tejido adiposo, una condición que es indispensable identificar y que se debe evitar a toda costa pues el incremento de peso en los pacientes con diabetes mellitus tipo 2 incrementa el riesgo de las “4 M” (complicaciones Metabólicas, Mecánicas, Mentales y Malignas) 44, esta última se ha convertido en la principal causa de muerte en los pacientes con diabetes 45.
Es por esto por lo que en los pacientes con diabetes y exceso de tejido adiposo se debe brindar un tratamiento que haya demostrado disminuir peso; la mayor evidencia para este desenlace lo tienen los AR-GLP1 46, sin embargo, no se puede menospreciar el efecto de los iSGLT-2 pues como se encontró en el SUSTAIN-8 47, los AR-GLP1 (semaglutida) a dosis de diabetes pueden disminuir hasta 5.3 Kg mientras que los iSGLT-2 (canagliflozina) hasta 4.2 Kg, siendo una pérdida de peso para nada despreciable.
Se debe hacer la salvedad de dosis de diabetes y dosis de obesidad, pues el efecto de reducción de peso con lo AR-GLP1 es dosis dependiente. Se cuenta con aprobación de dos AR-GLP1 a dosis de obesidad en población con diabetes respaldado en los estudios SCALE-Diabetes 48 con liraglutida y STEP-2 49 con semaglutida en los que se encontró una reducción de peso del 6% hasta un 9.64% con liraglutide 3.0 mg al día y semaglutida 2.4 mg semanal, respectivamente. Por esto, las moléculas a utilizar con el propósito de disminuir peso deberían ser liraglutida o semaglutida por aprobación soportada en ensayos clínicos, pero no se puede olvidar de que el efecto en reducción de peso de los AR-GLP1 es un efecto de clase 46. Quizás en un futuro se introduzca un nuevo grupo farmacológico para la reducción de peso en los pacientes con diabetes y son los agonistas dual GIP y GLP-1 por lo encontrado en el SURPASS-2 50, en el que el uso de terzipatida disminuye más kilogramos en comparación con semaglutida.
Por lo expuesto previamente si el objetivo es pérdida de peso se recomienda el uso de los AR-GLP1 o los iSGLT-2 (Figura 2), prefiriendo los primeros por su mayor efecto en dicho desenlace.
¿Cuál es la HbA1c de mi paciente? ¿tiene falla de célula β o glucemia en ayunas ≥ 300 mg/dL?
Sí el paciente que se está valorando no tiene alto o muy alto riesgo cardiovascular, enfermedad cardiovascular establecida, falla cardíaca, enfermedad renal crónica ni exceso de tejido adiposo; es necesario retomar el enfoque glucocéntrico basado en el punto de corte de HbA1c para determinar la conducta a seguir. Hay que tener presente que si la HbA1c es ≥ 9%, hay síntomas o signos de falla de célula β o la glucemia en ayunas es ≥ 300 mg/dL, es necesario valorar las preguntas 1 y 2 en paralelo a las preguntas 3.c. y 3.d. como se explica a continuación.
3.a. ¿La meta de HbA1c de mi paciente es <1.5% a su HbA1c actual?
Para dar respuesta a esta pregunta, primero hay que establecer la meta de HbA1c la cual se determina de forma individual partiendo de un punto de corte común de 7.0% siendo más o menos estrictos con base en las comorbilidades, expectativa de vida, riesgo de hipoglucemias, complicaciones vasculares, tiempo de duración de la diabetes y preferencia del paciente 51.
Si la diferencia entre la meta de Hba1c del paciente y su HbA1c actual es <1.5%, se recomienda iniciar el tratamiento con monoterapia 52. La metformina debe ser la terapia de inicio a menos que exista alguna contraindicación para su uso; es segura y de bajo costo. Se puede utilizar hasta una tasa de filtración glomerular (TFG) de 30 ml/min/1.73 m2; sin embargo, es indispensable el ajuste de dosis según la TFG (Tabla 4). Los eventos adversos más comunes son los síntomas gastrointestinales. Se debe iniciar con dosis bajas e ir titulando cada 1 a 2 semanas para mejorar la tolerabilidad; además, se recomienda que se administre con las comidas para mejorar la tolerancia 53. Si el paciente tiene intolerancia o contraindicaciones a la metformina se puede considerar utilizar cualquiera de las demás moléculas, individualizando cada paciente como se expresa en la Figura 3. Si después de 3 meses el paciente no está en metas se debe adicionar otro medicamento teniendo en cuenta el costo y el riesgo de hipoglucemia. Cada 3 meses debe reevaluarse el tratamiento y las metas, adicionando un nuevo fármaco de ser necesario evitando la inercia terapéutica (Figura 3). En Colombia no hay disponibilidad de tiazolidinedionas.
3.b. ¿La meta de HbA1c de mi paciente es ≥1.5% a su HbA1c actual?
Se debe considerar el inicio de terapia combinada en todo paciente cuya HbA1c sea ≥ 1.5% por encima de la meta establecida. Se puede iniciar con cualquier combinación teniendo en cuenta la preferencia del paciente, las comorbilidades, el peso, costo de la terapia y el riesgo de hipoglucemia. Cada 3 meses debe reevaluarse el tratamiento y las metas, adicionando un nuevo fármaco de ser necesario evitando la inercia terapéutica (Figura 3).
3.c. ¿La HbA1c de mi paciente es ≥ 9% y <10%?
En este caso se recomienda terapia inyectable sea esta un AR-GLP1 o insulina, prefiriendo iniciar con el AR-GLP1. En el próximo apartado se explica el uso de insulina.
3.d. ¿Mi paciente tiene glucemia en ayunas ≥ 300 mg/dL, síntomas o signos de catabolismo o hiperglucemia y/o HbA1c ≥10%?
Se debe considerar el inicio de insulina en todo paciente con HbA1c ≥ 10%; glucemia basal ≥ 300 mg/dL o ante la presencia de síntomas o signos catabólicos (pérdida de peso) o de hiperglucemia 3. En estos pacientes se debe iniciar concomitantemente metformina. Después de que se termine la glucotoxicidad (1-3 meses de tratamiento) se debe intentar desmontar la insulina y agregar otros agentes orales ahorradores de insulina 54.
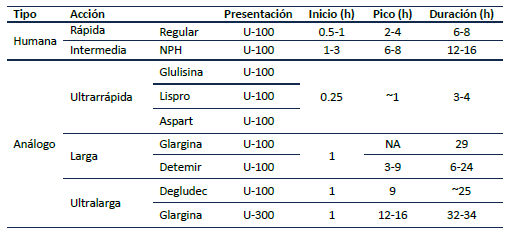
La terapia con insulina debe comenzar con insulina basal a dosis de 0.1 - 0.2 UI/Kg/día o 10 UI/día y titular 10 - 15% o 2 - 4 UI cada 3 días 3, teniendo como meta una glucemia en ayunas entre 80 - 130 mg/dL3. En caso de que no se logre la meta o si se identifica un patrón de hiperglucemia postprandial (glucometría > 180 mg/dL 2 horas luego de la ingesta), se debe instaurar un esquema basal plus en el cual se agrega un bolo de insulina de acción rápida con la comida principal, a dosis de 4 UI o 0.1 UI/kg 3. Si a pesar de esto no se logran metas, se debe implementar un esquema basal bolo en el cual se agregan 2 o más bolos de insulina de acción rápida a la misma dosis de lo anteriormente mencionado o según conteo de carbohidratos en caso de que el paciente esté entrenado para esto. Se debe titular la dosis hasta lograr meta de glucemia 2 horas postprandial <180 mg/dL 3. En la Tabla 5 se describen las insulinas disponibles en Colombia.
Otra opción de terapia inyectable es la combinación de insulina basal más AR-GLP1 en un mismo dispositivo; esta terapia tiene la ventaja de sólo requerir la glucometría en ayunas para realizar el proceso de titulación y su administración es sólo una vez al día, en comparación con el esquema basal/plus o basal/bolo que requerirá más glucometrías y más administraciones de insulina por vía subcutánea 56.
En Colombia se tienen disponibles 2 presentaciones de combinación de insulina basal + AR-GLP1. IDegLira (Xultophy Degludec/Liraglutide) se inicia a dosis de 10 UI (que contiene 0.36 mg de liraglutide) en pacientes de novo y a dosis de 16 UI (que contiene 0.576 mg de liraglutide) en pacientes que estuvieran en tratamiento con insulina o AR-GLP1 57. iGlarLixi (Soliqua Glargina U100/Lixisenatide) se inicia a dosis de 15 UI (que contiene 5 mcg de lixisenatide) en los pacientes de novo, usuarios de AR-GLP1 o que se encontraran con insulina basal < 30 UI/día y a dosis de 30 UI/día (que contiene 10 mcg de lixisenatide) en los pacientes con insulina basal entre 30 - 60 UI/día 58. La titulación se hace similar a la planteada con la insulina basal.