Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.26 no.1 Bogotá Jan./Mar. 2010
Artículo original
Evaluación de la mutación A3243G del ADN mitocondrial en pacientes con diferentes subtipos de migraña
Assessment of mitochondrial DNA A3243G mutation in patients with different subtypesof migraine
María Isabel Montes Gaviria, Paula Andrea Millán Giraldo, María Victoria Parra,
Rodrigo Isaza Bermúdez, Sandra Patricia Isaza Jaramillo,
Dagoberto Cabrera Hemer, William Cornejo Ochoa
María Isabel Montes Gaviria. Neuróloga IPS, universitaria y profesora cátedra UdeA.
Paula Andrea Millán Giraldo. Neuróloga HPTU y profesora cátedra UdeA.
María Victoria Parra. Magíster en Biología del Laboratorio – Grupo GENMOL.
Rodrigo Isaza Bermúdez. Neurólogo HPTU.
Sandra Patricia Isaza Jaramillo. Neuróloga y profesora ocasional UdeA.
Dagoberto Cabrera Hemer. Neuropediatra y profesor asociado UdeA.
William Cornejo Ochoa. Neuropediatra y profesor asociado UdeA. Sección de Neurología y Laboratorio GENMOL, Facultad de Medicina, Universidad de Antioquia (UdeA) y Hospital Pablo Tobón Uribe (HPTU), Medellín, Colombia.
Correo electrónico: wcornejochoa@gmail.com.
Recibido: 2/02/10. Revisado: 15/02/10. Aceptado: 25/02/10.
RESUMEN
Introduccción. En algunos subtipos de migraña se ha demostrado la existencia de hiperexcitabilidad cortical y metabolismo energético cerebral anormal debido probablemente a disfunción mitocondrial. En estos pacientes es alta la sospecha sobre la existencia de mutaciones en el ADN mitocondrial que están implicados como mecanismos fisiopatológicos en esta entidad.
Objetivo. Identificar la mutación A3243G del ADN mitocondrial en pacientes con complicaciones de la migraña, y la migraña hemipléjica esporádica, basilar y retinal.
Material y Métodos. Se realizó un estudio descriptivo-prospectivo en una serie de pacientes de consulta externa neurológica de la ciudad de Medellín, con diagnóstico de los diferentes subtipos de migraña, desde agosto de 2006 a diciembre de 2007.
Resultados. Se incluyeron en el estudio 19 pacientes, 14 mujeres y 5 hombres, con edad promedio de 33,4 ± 13,5 años. De los diferentes subtipos la hemipléjica fue la más prevalente (11 pacientes), seguida de la migraña basilar (3 pacientes), el estado migrañoso (2 pacientes), la migraña retinal (2 pacientes) y el aura prolongada (1 paciente). La mutación A3243G en el ADN de leucocitos de sangre periférica, que fue la única evaluada en el estudio, no estuvo presente en ninguna de las muestras analizadas.
Conclusiones. La mutación A3243G del ADN mitocondrial no está relacionada con la presentación de los diferentes subtipos en la población estudiada. Futuros estudios con mayor número de pacientes de cada subtipo de migraña permitirán ampliar el conocimiento sobre el papel de ésta y otras mutaciones mitocondriales en este trastorno.
PALABRAS CLAVES. Cefalea, disfunción mitocondrial, migraña, migraña con aura, migraña sin aura, mutación.
SUMMARY
Introduction. Some kind of migraine has been prove the existence of cortical hyperexcitability and abnormal brain energy metabolism probably due to mitochondrial dysfunction. In these patients is high suspicion of mutations in mitochondrial DNA that are implicated as pathophysiologic mechanisms in this entity.
Objective. To identify the A3243G mutation of mitochondrial DNA in patients with complications of migraine, sporadic hemiplegic migraine, basilar type migraine, retinal migraine.
Materials and Methods. . A prospective descriptive study of a series of neurological patients in an outpatient of the city of Medellin, with a diagnosis of that subtypes, from August 2006 to December 2007.
Results. The study included 19 patients, 14 women and 5 men with mean age 33.4 ± 13.54 years. Of the different subtypes hemiplegic was the most prevalent (11 patients), followed by basilar migraine (3 patients), migraine status (2 patients), retinal migraine (2 patients) and prolonged aura (1 patient). The A3243G mutation in the DNA of peripheral blood leukocytes, which was only evaluated in the study, was not present in any of the samples.
Conclusions. The mitochondrial DNA A3243G mutation is not related to the presentation of different subtypes in the population studied. Future clinical trials, with a representative number of patients for each subtypes, may draw conclusions about whether the mitochondrial dysfunction caused by this and other mutations associated with the clinical presentation of this type of migraine.
KEY WORDS. Headache, migraine disorders, migraine with aura, migraine without aura, mitochondrial disorder, mutation.
INTRODUCCIÓN
Algunos subtipos de migraña se asocian con síntomas sensitivos y motores de duración y presentación variables, como la migraña hemipléjica esporádica (MHE), la migraña retinal y basilar, y en pacientes con complicaciones de la migraña (el estatus migrañoso, el aura persistente sin infarto, el infarto migrañoso, la migraña crónica y convulsiones desencadenadas por migraña), según la clasificación de la Sociedad Internacional de Cefalea (SIC) de 2004 (1, 2).
En diferentes subtipos de migraña se ha demostrado la existencia de hiperexcitabilidad cortical y metabolismo energético cerebral anormal debido probablemente a disfunción mitocondrial (3). En estos pacientes es alta la sospecha sobre la existencia de mutaciones en el ADN mitocondrial (ADNmt) implicados como mecanismos fisiopatológicos en esta entidad. Son muchas las mutaciones que se han asociado, pero con resultados contradictorios; estas mutaciones afectan toda la síntesis de proteínas codificadas por el genoma mitocondrial, y por ende la producción de ATP en la célula (4). La transición A3243G en el RNA de transferencia (rNAt) de leucina ha sido descrita en pacientes con disfunción mitocondrial como los casos de MELAS (mitochondrial Myopathy, Encephalopathy, Lactic Acidosis, and Stroke-like episodes), familiares de pacientes con MELAS oligosintomáticos para cefalea y en migraña (5). Dadas las características propias de la mitocondria, como son la heteroplasmia y la segregación mitótica, entre otras, la presentación clínica de estas citopatías es muy heterogénea; es así como la mutación A3243G en el tRNA de leucina, que explica más del 80% de los casos de MELAS, puede además estar implicada en otras enfermedades asociadas a citopatías mitocondriales, como en la migraña (6, 7). Cualquier déficit enzimático que afecte la función de la cadena respiratoria afectará marcadamente el metabolismo celular, limitando la cantidad de ATP intracelular; por esto los tejidos más afectados son los que mayor demanda energética tienen, como el cerebro y la retina (8). Los fenotipos de las enfermedades mitocondriales pueden ser diversos y sobreponerse; así, una misma mutación presenta diversos fenotipos, o un fenotipo puede deberse a varias mutaciones. Además, los patrones de herencia pueden ser materno, mendeliano, o una combinación de éstos (9).
Ensayos bioquímicos de actividad enzimática mitocondrial en plaquetas y músculo han revelado alteración sistémica en el metabolismo energético en migraña y disminución de la actividad de las enzimas de la cadena respiratoria en pacientes con aura prolongada y episodios de infarto migrañoso. Se sugiere que el metabolismo cerebral oxidativo reducido puede representar un factor predisponente en los pacientes migrañosos de desarrollar déficits neurológicos transitorios o permanentes bajo condiciones de demanda metabólica aumentada (9). Montagna y otros concluyen que el metabolismo energético cerebral podría ser anormal en todos los subtipos de migraña, durante y entre los ataques (10).
El efecto de A3243G en la función mitocondrial se produce básicamente a nivel del complejo I de la cadena respiratoria que posee gran cantidad de residuos de leucina, eso se ha evidenciado por la deficiencia de este complejo en pacientes con la mutación (12). Una deficiencia en los complejos I podría alterar el gradiente electroquímico a través de la membrana mitocondrial interna y llevar a una disminución de la respiración y de la síntesis de ATP (13). Al parecer la mutación A3243G afecta la síntesis de proteínas al permitir la sustitución de leucina por fenilalanina en las proteínas mitocondriales, o a una terminación prematura de la traducción (14).
La relación entre MELAS y migraña, y la consideración de herencia familiar con preferencia de línea materna han sugerido elementos comunes en estas dos entidades (15). Diferentes mutaciones mitocondriales se han estudiado en pacientes con migraña como: A3243G, C3256T, T3291C, A5814G, T8356C, T9957C, G13513A, A13514G y A4336G, con resultados contradictorios, evidenciando la necesidad de más estudios para establecer una posible relación entre mutaciones tipo MELAS y migraña (6, 13, 16). La cefalea algunas veces es la única característica clínica en familiares maternos oligosintomáticos de pacientes con MELAS, creciendo la consideración de la migraña como una forma monosintomática en pacientes con citopatías mitocondriales (13, 15). Según un estudio realizado por nuestro grupo en pacientes con MELAS se encontró en miembros de la genealogía de un paciente positivo para la mutación A3243G, una asociación entre cantidad de ADNmt mutado y migraña, llevándonos a plantear la pregunta si en pacientes con esta entidad podrían tener mitocondrias con la mutación A3243G (17).
Debido a la heterogeneidad de la expresión fenotípica de las citopatías mitocondriales la identificación molecular de las mutaciones permite una mejor clasificación de esta enfermedad, al conocer su base fisiopatológica.
En el presente estudio se seleccionaron pacientes que, según las clasificaciones de 1988 y 2004, presentaran MHE, migraña retinal, basilar, y complicaciones de la migraña (estatus migrañoso, aura persistente sin infarto, infarto migrañoso, migraña crónica y convulsiones desencadenadas por migraña), al plantear la hipótesis de que aquellos individuos con déficit neurológico reversible o permanente en el contexto de un cuadro migrañoso, habría mayor posibilidad de encontrar mutaciones del ADNmt como causa de disfunción del metabolismo cerebral oxidativo. Se estudió la mutación A3243G por ser la más frecuente en citopatías mitocondriales que tienen como manifestación clínica cuadros de cefalea migrañosa e infartos cerebrales.
El objetivo del estudio fue el de identificar la mutación A3243G del ADN mitocondrial en pacientes con MHE, migraña retinal, basilar, y complicaciones de la migraña (estatus migrañoso, aura persistente sin infarto, infarto migrañoso, migraña crónica y convulsiones desencadenadas por migraña), y describir sus características clínicas y demográficas.
MATERIAL y MÉTODOS
Se realizó un estudio descriptivo en pacientes de consulta externa neurológica de la ciudad de Medellín, con diagnóstico de MHE, migraña retinal, basilar, y complicaciones de la migraña (estatus migrañoso, aura persistente sin infarto, infarto migrañoso, migraña crónica y convulsiones desencadenadas por migraña), entre agosto de 2006 a diciembre de 2007, los cuales fueron remitidos por neurólogos que habían realizado este diagnóstico. Posteriormente, se evaluaron por dos de los investigadores, quienes verificaban el cumplimiento de los criterios de inclusión; cada paciente debía disponer de neuroimagen y cumplir con los criterios de la SIC de 2004.
Las definiciones, según la SIC de 1988 y 2004, de cada subtipo de migraña, son las siguientes:
- Migraña retinal: escotomas monoculares o ceguera de al menos una hora acompañada de cefalea, excluyendo trastornos vasculares y oculares.
- Migraña hemipléjica esporádica (MHE): cefalea con déficit motor, sensitivo (disestesias y tinnitus) y disfasia reversible, acompañada de aura de al menos 5 minutos y no más de 24 horas.
- Migraña basilar: aura originada en el tallo cerebral que afecta ambos hemisferios, mayor a 5 minutos y menor a una hora, sin déficit motor.
- Migraña crónica: 15 días o más al mes, por más de 3 meses en ausencia de abuso de medicación.
- Estado migrañoso: ataque de cefalea severa y debilitante que dura más de 72 horas.
- Aura persistente sin infarto: síntomas de aura por más de una semana.
- Infarto migrañoso: aura migrañosa; asociado a lesión cerebral isquémica, demostrado por neuroimagen.
- Convulsiones desencadenadas por migraña: migraña con aura asociada a una convulsión que ocurre durante o dentro de la hora siguiente al aura migrañosa.
El estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Antioquia. Se obtuvo consentimiento informado previo a la toma de la muestra de sangre. Se recolectó un volumen de 5 ml de sangre en tubos Vacutainer® con EDTA. Todas las muestras fueron almacenadas a –20 °C hasta su procesamiento.
Se excluyeron los pacientes con cefalea secundaria (trauma, neuroinfección, enfermedad psiquiátrica, hidrocefalia, malformaciones cerebrales y dolores referidos), MELAS, y aquellos que no aceptaron participar en el estudio.
Las variables incluidas en el estudio hacían referencia a datos demográficos, características clínicas de la migraña, medicamentos profilácticos y abortivos empleados y hallazgos en las neuroimágenes.
Para el análisis de los datos se usó el programa SPSS versión 16, con ayuda del cual se calcularon para las variables cuantitativas la media y desviación estándar o mediana y percentiles, de acuerdo a la distribución normal o no de los datos. La determinación de la distribución normal o no, se realizó con la prueba de Shapiro-wilk (por ser una muestra menor a 50 sujetos), además se hizo la prueba de homogeneidad de varianzas con la prueba F de Levene. Cuando las varianzas eran iguales se usó la prueba de T para comparar las medias, y cuando eran diferentes se utilizó la prueba welch. Las variables cualitativas se presentaron como proporciones y se calculó la diferencia de éstas. A cada una de las medidas de comparación se les calculó el valor de p y el respectivo intervalo de confianza del 95%. Para la p de la diferencia de proporciones se empleó el test chi cuadrado de Pearson o el test de Fisher si alguna de las frecuencias esperadas era menor a 5. Un valor de p significativo menor de 0,05 se utilizó para rechazar las hipótesis nulas planteadas.
Genotipificación
En todas las muestras se extrajo el ADN utili zando el método modificado de fenol-cloroformo. La integridad de la molécula se probó por electroforesis en agarosa (0,8%), coloreada con bromuro de etidio, 0,5 μg/ml.
Para la identificación de mutaciones en el gen mitocondrial que codifica para el RNAtLeu(UUR) se procedió de la siguiente manera: se amplificó la región de ADNmt entre los nucleótidos 3162 y 3680, que contiene el gen del rNAtLeu(UUr) y parte del gen NAD deshidrogenasa 1, empleando los siguientes cebadores: F 5´CGCCTTCCCCCGTAAATGAT 3´ y R 5´GCCGATCAGGGCGTAGTTTG 3´. El producto de amplificación esperado es de 537 pb. Las reacciones de amplificación se realizaron en 25 μl bajo las siguientes condiciones: 2,5 μl de Buffer, 10X, Gibco BRLμ; 1,25 μl de cada cebador, 10μM; 0,75 μl de MgCl2, 50 mM; 0,5 μl de dNTPs, 10 mM; 0,125 μl de Taq polimerasa, Gibco BRLμ, 5 U/μl; 2 μl de ADN, 8 μg/ml, y se completaron los 25 μl con agua ultrapura. El perfil térmico para las amplificaciones fue el siguiente: 10 m a 94 °C, 30 ciclos (94 °C, 30 s; 56 °C, 30 s; y 72 °C, 30 s), 72 °C, 10 m. El producto de esta amplificación se probó por electroforesis en gel de agarosa 1% teñida con 0,5 μg/ml de bromuro de etidio. Para la detección de la mutación A3243G se utilizó el método PCr-rFLP (reacción en cadena de la polimerasa – fragmentos de restricción de longitud polimórfica) considerando que el cambio de A por G genera un sitio de restricción para la enzima Apa I. El producto de la PCR (537 pb) se sometió a digestión con dicha enzima (Promega) con las siguientes condiciones: 0,2 μl de Apa I (10 U/μl), 0,2 μl de BSA, 100X, 2 μl de Buffer y 20 μl del amplificado durante 12 horas. Los productos de las digestiones se analizaron por electroforesis en garosa al 1,5%, teñida con bromuro de etidio; la generación de dos fragmentos (456 y 81 pb) indicaba la existencia de la mutación. Se cuantificó la cantidad de ADNmt mutado por densitometría usando un control de ADN con concentración conocida, en un analizador de imágenes de Biorad con el programa Quantity One.
RESULTADOS
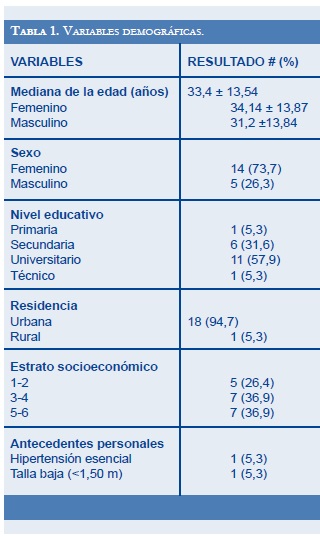
Se incluyeron en el estudio 19 pacientes, cuyos datos demográficos se exponen en la tabla 1. El nivel educativo mínimo en el grupo de pacientes fue la primaria incompleta. No hubo pacientes con antecedente personales de diabetes, sordera neurosensorial ni retardo mental.
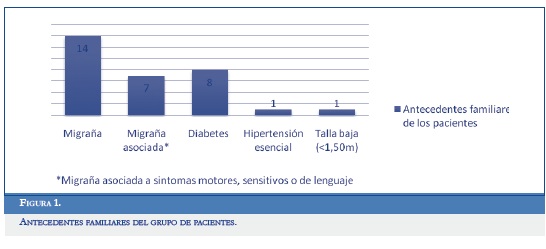
De toda la población incluida en el estudio, el 73,68% de los pacientes tenían antecedentes familiares de migraña (en primer grado de consanguinidad) y el 36,84% de migraña asociado a síntomas motores, sensitivos o del lenguaje (Figura 1).
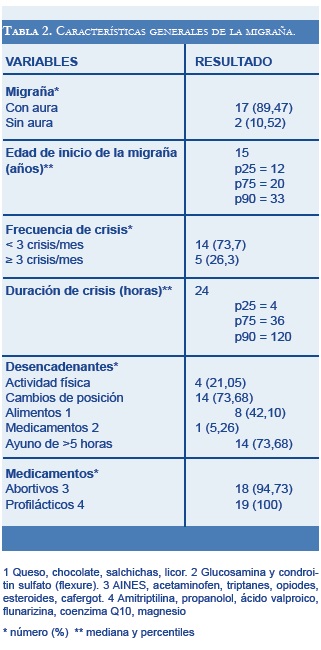
Las características generales de la migraña, como frecuencia de crisis, presencia de aura, desencadenantes y tratamiento médico recibido, se enuncian en la tabla 2.
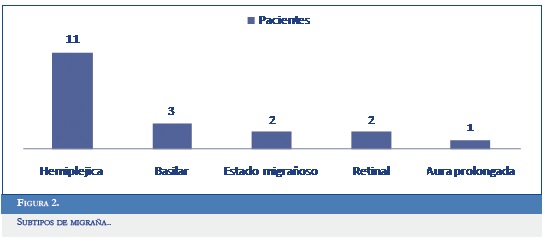
De los diferentes subtipos de migraña, la MHE fue la más prevalente. El paciente con aura prolongada también presentaba en ocasiones episodios de estado migrañoso. Ningún paciente del estudio había presentado infarto migrañoso, migraña crónica ni episodios convulsivos asociados a migraña (Figura 2).
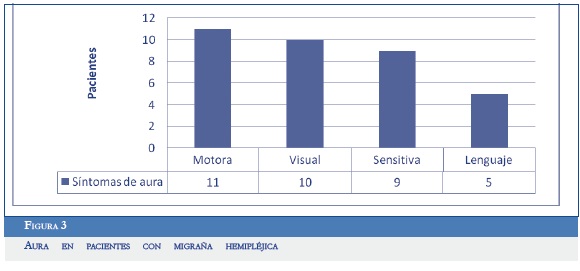
Dentro de los pacientes con MHE todos tenían aura motora y al menos otra aura diferente (sensitiva, visual o del lenguaje) (Figura 3). Sólo siete de los pacientes recordaron tener la cefalea del mismo lado del déficit motor. Además de los síntomas motores, siete pacientes con MHE (63,6%) referían tener síntomas sensitivos acompañantes en el mismo lado del compromiso motor (hipoestesia y parestesias).
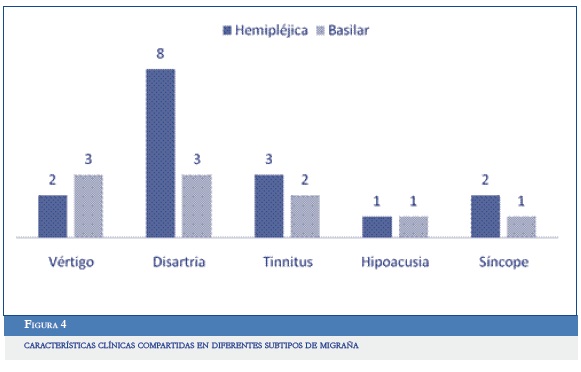
De los diferentes subtipos de migraña, la MHE y la basilar compartían diferentes características clínicas (Figura 4).
Es de anotar que dos pacientes con migraña basilar presentaban alteración sensitiva (parestesias) de manera bilateral, predominando en miembros superiores, mientras que los síntomas sensitivos de la MHE eran hemicorporales con déficit motor posterior (siete pacientes).
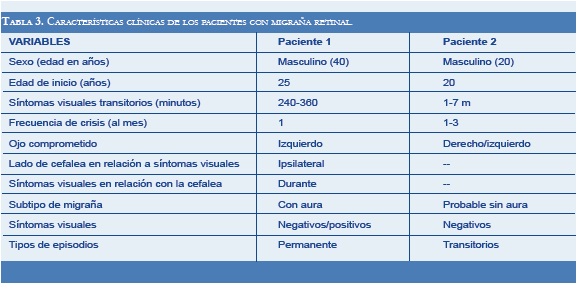
Los pacientes con migraña retinal eran hombres jóvenes sin factores de riesgo vascular; sólo uno tenía antecedente de migraña con aura y presentó déficit visual permanente (escotoma temporal inferior izquierdo) como secuela (Tabla 3).
Todos los pacientes del estudio tenían neuroimagen previa; trece, resonancia magnética (rM) de encéfalo, y seis, tomografía computarizada de cráneo, con reporte normal, a excepción de una paciente con MHE que presentaba hiperintensidades de sustancia blanca e infarto lacunar de corona radiada en el frontal izquierdo. En un paciente hubo hallazgo incidental de lipoma en el vérmix cerebeloso.
La mutación A3243G en el ADN de leucocitos de sangre periférica, que fue la única evaluada en el estudio, no fue encontrada en ninguna de las muestras analizadas.
Se consideraron como variables cuantitativas la edad y la duración de las crisis; se analizó la diferencia de medias de cada una de estas variables con cada una de las características clínicas interrogadas en el estudio, encontrándose una diferencia estadísticamente significativa al comparar la duración de la crisis en el grupo de hombres y mujeres [p = 0,018; (IC 95% de la diferencia de medias 7-65)], y en el grupo de personas que presentaron o no parestesias [p = 0,045; (IC 95% de la diferencia de medias -1,59 a -109,92)].
Como era de esperarse, se determinó una diferencia estadísticamente significativa en la duración de la crisis de migraña, al comparar el estado migrañoso con la MHE [p = 0,000 (IC 95% de la diferencia de medias -57,41 a -137,41)], retinal [p = 0,007; (IC 95% de la diferencia de medias -60,22 a -74,67)], y basilar [p = 0,003; (IC 95% de la diferencia de medias -60,03 a -144,63)].
Se observó una diferencia estadísticamente significativa (p = 0,04; IC 95% 0,57-22,76) entre quienes refirieron haber estado hospitalizados (37,67 ± 14,32 años) y quienes no (26 ± 8,58 años), respecto a la edad, como se espera que ocurra en enfermedades crónicas.
Al comparar las proporciones de las variables cualitativas (demográficas: sexo, estrato socioeconómico, nivel educativo y ocupación; y clínicas: frecuencias de crisis, presencia de aura y desencadenantes de la cefalea), no se evidenció que la diferencia entre éstas tuviera significancia estadística.
DISCUSIÓN
En la genealogía de los pacientes con MELAS que tienen la mutación A3243G, sus familiares de la línea materna han sido reportados como oligosintomáticos para cefalea (17, 18). Sin embargo, la mutación A3243G en el ADNmt de leucocitos de sangre periférica no había sido estudiada en pacientes con MHE, migraña retinal y basilar, y en pacientes con complicaciones de la migraña (estatus migrañoso, aura persistente sin infarto, infarto migrañoso, migraña crónica y convulsiones desencadenadas por migraña). Diversos estudios han descrito una posible disfunción mitocondrial en estos subtipos de migraña (3, 19-21); por lo tanto, se esperaba encontrar la mutación en este grupo. La búsqueda de la mutación en los pacientes del estudio fue negativa a pesar de que cumplían con los criterios de la SIC de 1988 y 2004, y se aplicó una técnica estandarizada de laboratorio para detectar la mutación. Así, la mutación A3243G del ADNmt parece no estar asociada con estos subtipos de migraña según los resultados obtenidos en este estudio, ni con otros subtipos de migraña con y sin aura y cefalea cluster de acuerdo con reportes previos (19-23). El no haber encontrado la mutación está acorde con la ausencia de hallazgos clínicos que sugirieran disfunción mitocondrial (diabetes, sordera y talla baja).
En la literatura revisada sólo se hallaron reportes de caso de complicaciones de la migraña, series de caso de migraña retinal y MHE y hemipléjica familiar. Analizamos una serie de casos de pacientes captados prospectivamente y donde se incluyeron diferentes subtipos de migraña con aura (MHE, basilar y retinal) y complicaciones de la migraña según clasificación de la SIC de 1988 y 2004 (1, 2).
De los diferentes subtipos de migraña incluidos en el estudio la mayoría tenían MHE, seguido de migraña basilar, estado migrañoso, migraña retinal y aura prolongada sin infarto. No hubo casos de infarto migrañoso, migraña crónica y convulsiones desencadenadas por migraña.
Los dos pacientes con migraña retinal eran hombres, lo contrario a lo reportado en la literatura, donde la mayoría de los casos son mujeres. Generalmente son personas jóvenes, sin factores de riesgo vascular, como nuestros pacientes. Los criterios definidos por la SIC del 2004 (1), donde se incluyen migraña con aura, fenómenos visuales reversibles y examen oftalmológico normal entre crisis, difiere de lo encontrado en nuestros pacientes. Uno de ellos presentó probable migraña sin aura y el otro anormalidad visual permanente (escotoma). Sin embargo, fueron incluidos en el estudio dado que estas características pueden estar presentes en algunos pacientes con migraña retinal, como lo planteado por Grosberg y colaboradores en el 2006 (24), quienes proponen un nuevo nombre a esta entidad: “migraña con síntomas visuales monoculares”, con criterios más flexibles, incluyendo dos grandes grupos: migraña con síntomas visuales monoculares transitorios y defecto o pérdida visual monocular permanente; en estos criterios la cefalea puede ser migraña con o sin aura, y estar presente antes, durante o después de los síntomas visuales. Igualmente, el examen oftalmológico es anormal en los casos permanentes donde se puede evidenciar alteración vascular retinal o del nervio óptico.
Dentro del estudio, una mujer de 47 años sin factores de riesgo vascular y antecedente de migraña con aura presentaba episodios de hemiparesia alternante transitoria con disartria, que mostró en una rM cerebral realizada en una fase asintomática de la enfermedad, sin tener imágenes previas de comparación, un pequeño infarto subcortical frontal izquierdo, por lo cual no fue catalogado como infarto migrañoso sino como MHE; además, el infarto no estaba localizado en un área relevante, según los criterios del SIC de 2004. Sin embargo, publicaciones diferentes han reportado que el infarto migrañoso no tiene un patrón definido, pudiendo comprometer cualquier territorio vascular; en las neuroimágenes pueden ser únicos, múltiples, corticales, subcorticales y de diferentes tamaños (25-27).
El infarto migrañoso es el 0,5-1,5% de todos los eventos isquémicos y de 10-14% de los infartos en gente joven (25, 28). Un reciente metaanálisis (29) confirmó incremento del riesgo de infarto cerebral en migraña, con riesgo relativo (rr) de 2,88 para migraña con aura y para mujeres menores de 45 años, características presentes en la paciente que tenía el infarto cerebral. Aunque los criterios del SIC son clínicos y no llenaba estrictamente los criterios de infarto migrañoso, hace parte del espectro de las complicaciones de la migraña consideradas consecuencia directa de una severa e inusual hipoperfusión por vasoespasmo (25). Igualmente, el uso de medicamentos que puedan producir vasoespasmo al parecer aumentan el riesgo de infarto migrañoso; en el caso de nuestra paciente, ella tomó propanolol como profiláctico, sin embargo no fue posible establecer una relación temporal entre un evento clínico, el infarto cerebral y el uso de propanolol (25, 30).
La paciente ya referida, presentaba además en la RM cerebral múltiples hiperintensidades de sustancia blanca, que han sido descritas en pacientes con migraña con aura; en la literatura se han encontrado lesiones hiperintensas en T1 y T2 transitorias, que pudieran ser explicadas por cambios inflamatorios y disfunción neuronal reversible (31, 32).
De los pacientes con MHE, todos tenían antecedente previo de migraña con aura y al menos dos manifestaciones de aura distintas, en el 100% de los casos eran los síntomas motores y la siguiente en frecuencia, aura visual (90,9%) o sensitiva (81%). Sólo cinco pacientes exhibían compromiso del lenguaje (afasia). Lo anterior apoya lo descrito previamente en la literatura, donde el aura motora nunca estuvo aislada sino que siempre iba acompañada de otros síntomas (sensitivos, visuales o del lenguaje), siendo el aura visual el más frecuente (33, 34). Los pacientes con MHE, según la literatura, pueden cumplir criterios de migraña basilar, esto ocurrió en 6 de nuestros casos (54,5%), inferior a lo reportado en la literatura (72%), lo que pudo estar influenciado por el sesgo de recuerdo. La asociación entre MHE y basilar puede ser explicada porque el fenómeno de la depresión cortical extendida (aura) puede comprometer no solamente hemisferios cerebrales sino también tallo cerebral, originando secuencialmente, si alcanza la corteza, los síntomas visuales (origen del aura a nivel occipital), seguidos por el compromiso motor, sensitivo y del lenguaje, o producir vértigo, disartria, diplopía, tinnitus, hipoacusia y síncope si compromete el tallo cerebral (33, 34).
Al parecer los pacientes con MHE tienen un umbral de aura más bajo que los de migraña con aura y por lo tanto se presenta con mayor frecuencia la cascada de síntomas visuales, motores, sensitivos y del lenguaje, los cuales incluso tienen mayor duración (33). En el presente estudio no fue posible cuantificar el tiempo de cada síntoma, pero sí el total de la crisis, y éste fue superior a la máxima duración considerada por los criterios de migraña con aura según la SIC del 2004.
De los factores desencadenantes, la actividad física se ha visto frecuentemente asociada a episodios de MHE, en nuestro estudio sólo el 36% de los pacientes refirieron este desencadenante (33).
En el grupo de pacientes evaluado la duración de la crisis de migraña fue más prolongada en las mujeres que en los hombres. Esto puede estar relacionado con lo publicado respecto a la restricción en la actividad laboral mayor en las mujeres (˜2,7 millones de días por año en hombres y 18,8 millones de días por año en mujeres) (35-37). Faltan estudios que permitan identificar la causa de esta diferencia.
En la literatura se reporta que los pacientes con MHE, el aura sensorial y su duración, es mayor que los de migraña con aura (33). Sin embargo, en el grupo analizado quienes no tenían parestesias sufrían mayor duración de la crisis, lo cual podría ser explicado por características propias de nuestros pacientes.
En el grupo de pacientes evaluado la migraña basilar se observó en tres pacientes, quienes poseían características similares a las reportadas en la literatura: ser del sexo femenino, iniciar síntomas muy jóvenes, entre 12 y 26 años; dos pacientes describieron crisis con aura típica y las crisis de dolor limitaban la actividad habitual (38). Llama la atención que el número de personas con MHE en el estudio fue alta comparada con la prevalencia reportada de 0,005% en otros países (39) a pesar de lo exigente en la aplicación de los criterios diagnósticos al momento de la inclusión de los pacientes, interrogándolos exhaustivamente para diferenciar síntomas sensitivos de motores que pudieran generar confusión entre MHE y migraña con aura típica. Sin embargo, esto puede ser explicado por la selección de la muestra.
CONCLUSIONES
La mutación A3243G del ADNmt no está relacionada con la presentación de MHE, migraña retinal, basilar y complicaciones de la migraña en el grupo de pacientes, apoyando los resultados de estudios previos. Sin embargo, con este trabajo no se puede rechazar la hipótesis de que la disfunción mitocondrial producida por mutaciones del ADNmt esté asociada a la presentación clínica de los subtipos de migraña estudiados; porque la muestra fue pequeña, no seleccionada de forma aleatoria, probablemente hubo sesgo de recuerdo y se buscó una sola mutación, las conclusiones obtenidas en este estudio son limitadas e impiden la generalización de los resultados de él.
REFERENCIAS
1. Headache Classification Subcommittee of the International headache Society. The International Classification of Headache Disorders 2a edition. Cephalalgia 2004; 24(supl. 1): 8-152. [ Links ]
2. The International Classification of Headache Disorders. Cephalalgia 1988; 8 (Supl. 7):1-96. [ Links ]
3. Sparaco M, Feleppa M, Lipton RB, Rapoport AM, Bigal ME. Mitochondrial dysfunction and migraine: evidence and hypotheses. Cephalalgia 2005; 26: 361 -372. [ Links ]
4. Heddi A, Stepien GM, Benke PJ, Wallace DC. Coordinate induction of energy gene expression in tissues of mitochondrial diseases patients. J Biol Chemistry 1999; 274: 22968-22976. [ Links ]
5. Buzzi M, Di Gennaro G, D'Onofrio M, Ciccarelli O, Santorelli F, Fortini D et al. ADNmt A3243G MELAS mutation is not associated with multigenerational female migraine. Neurology 2000; 54(4): 1005-1007. [ Links ]
6. Farrel MA, Brett FM, Droogan O, Murphy S, Burke M, McEntagart M. Family tree phenotype, based on clinical history and mitochondrial encephalopathy with lactic acidosis and stroke-like episodes (MELAS) in a Donegal Kindred-clinical and molecular genetics analysis. Irish Medical Journal 1997; 90(4). [ Links ]
7. Rossignol R, Malgat M, Mazat JP, Thierry Letellier T. Threshold effect and tissue specificity: implication for mitochondrial cytopathies. J Biol Chemistry 1999; 274: 33426-33432. [ Links ]
8. Galán-Ortega A, Coll-Canti J, Padrós-Fluvià A, Arambarri-Hervias M, Pintos G. Estrategias diagnósticas de las enfermedades mitocondriales. Rev Neurol 1999; 29: 52-58. [ Links ]
9. Chinnery PF, Howell N, Andrews RM, Turnbull DM. Clinical mitochondrial genetics. J Med Genet 1999; 36: 425-436. [ Links ]
10. Montagna P, Cortelli P, Barbiroli B. A case of cluster headache associated with mitochondrial DNA deletions. Muscle Nerve 1998; 1(1): 127-129. [ Links ]
11. Di Gennaro G, Buzzi MG, Ciccarelli O, Santorelli FM, Pierelli F, Fortini D, D'Onofrio M et al. Assessing the relative incidence of mitochondrial DNA A3243G in migraine without aura with maternal inheritance. Headache 2000; 40(7): 568-571. [ Links ]
12. Goto Y, Horai S, Matsuoka T, Koga Y, Nihei K, Kobayashi M et al. Mitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like episodes (MELAS): a correlative study of the clinical features and mitochondrial DNA mutation. Neurology 1992; 42: 545-550. [ Links ]
13. Finnilä S. Detection of mutations in patients with occipital stroke. In: Oulu University Library, editor. Phylogenetic analysis of mitochondrial DNA. Oulu: 2000; p. 1-71. [ Links ]
14. Jacobs HT, Holt IJ. The np 3243 MELAS mutation: damned if you aminoacylate, damned if you don't. Hum Mol Genet 2000; 9(4): 463-465. [ Links ]
15. Finnila S, Autere J, Lehtovirta M, Hartikainen P, Mannermaa A, Soininen H, Majamaa K. Increased risk of sensorineural hearing loss and migraine in patients with a rare mitochondrial DNA variant 4336A>G in trNAGln. J Med Genet 2001; 38(6): 400-405. [ Links ]
16. Rozen TD, Shanske S, Otaegui D, Lu J, Young WB, Bradley K, DiMauro S et al. Study of mitochondrial DNA mutations in patients with migraine with prolonged aura. Headache 2004; 44(7): 674-677. [ Links ]
17. Parra M, Cornejo W, Carrizosa J, Bedoya G, Ruiz A. Características clínicas y moleculares en dos familias colombianas con la mutación A3243G (MELAS) del ADNmt. [En fase de publicación] [ Links ].
18. Ciafaloni E, Ricci E, Shanske S et al. MELAS: clinical features, biochemistry, and molecular genetics. Ann Neurol 1992; 31: 391-398. [ Links ]
19. Cortelli P, Zacchini A, Barboni P, Malpassi P, Carelli V, Montagna P. Lack of association between mitochondrial trNA Leu(UUr) point mutation and cluster headache. Lancet 1995; 345: 1120-1121. [ Links ]
20. Uncini A, Lodi R, Di Muzio A, Silvestri G, Servirei S, Lugaresi A et al. Abnormal brain and muscle energy metabolism shown by 31P-MRS in familial hemiplegic migraine. J Neurol Sci 1995; 129: 214-222. [ Links ]
21. Klopstock T, May A, Seibel P, Papagiannuli E, Diener HC, Reichmann H. Mitochondrial DNA in migraine with aura. Neurology 1996; 46: 1735-1738. [ Links ]
22. Buzzi MG, Di Gennaro G, D'Onofrio M, Ciccarelli O, Santorelli FM, Fortini D et al. MtDNA A3243G MELAS mutation is not associated with multigenerational female migraine. Neurology 2000; 54: 1005-1007. [ Links ]
23. Di Gennaro G, Buzzi MG, Ciccarelli O, Santorelli FM, Pierelli F, Fortini D et al. Assessing the relative incidence of mitochondrial DNA A3243G in migraine without aura with maternal inheritance. Headache 2000; 40: 568-571. [ Links ]
24. Grosberg BM, Solomon S, Friedman DI, Lipton RB. Retinal migraine reappraised. Cephalalgia 2006; 26: 1275-1286. [ Links ]
25. Bousser MG, Welch KM. Relation between migraine and stroke. Lancet Neurol 2005; 4: 533-542. [ Links ]
26. Ziegler D, Batnitzky S, Barter R, McMillan JH. Magnetic resonance imaging abnormalities in migraine with aura. Cephalalgia 1991; 11: 147-150. [ Links ]
27. Osborn RE, Alder DC, Mitchell CS. Mr imaging of the brain in patients with migraine headaches. Am J Neuroradiol 2003; 12: 521-524. [ Links ]
28. Henrich J, Sandercock P, Warlow C, Jones L. Stroke and migraine in the Oxfordshire Community Stroke Project. J Neurol 1986; 233: 257-262. [ Links ]
29. Etminan M, Takkouche B, Isorna FC, Samii A. Risk of ischaemic stroke in people with migraine: systematic review and meta-analysis of observational studies. BMJ 2005; 330: 63-65. [ Links ]
30. Agostoni E, Fumagalli L, Santoro P, Ferrarese C. Migraine and stroke. Neurol Sci 2004; 25: S123-125. [ Links ]
31. Mateo I, Foncea N, Vicente I, Gómez M, García-Monco JC. Migraine-associated seizures with recurrent and reversible magnetic resonance imaging abnormalities. Headache 2004; 44(3): 265-270. [ Links ]
32. Ter Berg HW. Migraine-associated seizure: a case of reversible MrI abnormalities and persistent nondominant hemisphere syndrome. Headache 2001; 41: 326-328. [ Links ]
33. Thomsen L, Olesen J. Sporadic hemiplegic migraine. Cephalalgia 2004; 24: 1016-1023. [ Links ]
34. Thomsen L, Ostergaard E, Olesen J, Russell MB. Evidence for a separate type of migraine with aura: sporadic hemiplegic migraine. Neurology 2003; 60: 595-601. [ Links ]
35. Stang TE, Osterhaus JT. Impact of migraine in the United States: data from national health interview survey. Headache 1992; 33: 29-35. [ Links ]
36. Osterhaus JT, Gutterman DL, Plachetka JR. Health care resource and lost labor: cost of migraine headache in the United States. PharmacoEconomics 1992; 2: 67-76. [ Links ]
37. Mathew NT. Pathophysiology, Epidemiology, and Impact of Migraine. Clinical Cornerstone 2001; 4(3): 1-17. [ Links ]
38. D'Onofrio F, Cologno D, Petretta V, Casucci G, Bussone G. Basilar Type migraine responsive to lamotrigine: Three case reports. Neurol Sci 2007; 28: S239-S241. [ Links ]