Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.26 no.4 Bogotá Oct./Dec. 2010
Alteraciones de la memoria episódica verbal en fases preclínica y temprana de la enfermedad de Alzheimer familiar precoz por mutaciónE280A en PS1
Verbal episodic memory at the preclinical and early phases of familiar early - onset Alzheimer disease caused by E280A mutation at PS1
Sara Julieta Romero Vanegas, Psicóloga. Claudia Marcela Valencia Marín, Psicóloga. Daniel Camilo Aguirre Acevedo, Epidemiólogo.
Investigadores. Grupo de Neurociencias.Universidad de Antioquia. Medellín, Colombia. Herman Buschke, Neurólogo. Department of
Neurology, Albert Einstein College of Medicine, Bronx, New York. Francisco Lopera, Neurólogo. Coordinador del Grupo de Neurociencias de Antioquia. Medellín, Colombia. Grupo de Neurociencias. Universidad de Antioquia. Medellín, Colombia.Correo eléctronico: flopera@une.net.co
Recibido: 18/06/10. Revisado: 2/06/10. Aceptado: 3/09/10.
RESUMEN
INTRODUCCION. Obtener un diagnóstico temprano o preclínico es uno de los mayores retos en la investigación de demencias. Hasta el momento se han descrito varios marcadores cognitivos; sin embargo, la memoria episódica verbal (MEV), no ha sido ampliamente estudiada en poblaciones con marcadores biológicos.
OBJETIVO. Determinar si existen alteraciones tempranas en la MEV, en una muestra de participantes con riesgo de desarrollar Enfermedad de Alzheimer familiar precoz, al ser comparados con un grupo control en dos pruebas de MEV, el MIS (Memory Impairment Screen) y el MCT (Memory capacity test).
MATERIALES Y MÉTODOS. La muestra estuvo conformada por 14 portadores asintomáticos, 11 portadores con deterioro cognitivo leve (DCL) y 23 sujetos sanos no portadores. Para la selección, se utilizó el Minimental, las escalas: EDG (Escala de Deterioro Global de Reisberg), FAST (Functional Assessment Staging de Reisberg) y la escala de quejas subjetivas de memoria. Posteriormente, se administraron el MIS y el MCT. Se analizaron las variables de recuerdo libre y facilitado.
RESULTADOS. Se encontraron diferencias significativas entre los grupos de portadores, evidenciando que el grupo con DCL tiene una alteración en la MEV, originada en la fase de codificación. Sin embargo, en el grupo portador asintomático se observó, que dicha alteración yace en la fase de evocación.
CONCLUSIONES. El MIS y MCT fueron de utilidad para discriminar entre portadores con DCL y portadores sanos. Estos test se caracterizan por ser breves, fáciles de administrar y de bajo costo. Se sugiere que sean empleados en protocolos de evaluación neuropsicológica, destinados a evaluar demencias y fase preclínica. Finalmente, se sugiere validar los test al contexto colombiano, y aumentar el tamaño de la muestra.
PALABRAS CLAVES. Diagnóstico precoz, Enfermedad de Alzheimer, Pruebas neuropsicológicas, Demencia presenil de Alzheimer, Presenilina-1.
SUMMARY
INTRODUCTION. Early pre-clinical diagnosis is the greatest challenge faced by researchers into dementia. Despite several reported cognitive markers, the episodic verbal memory has not been widely studied in populations with biological markers.
OBJETIVE. The aim of this study was determine the possible alterations in early episodic verbal memory in a two groups of participants at the risks of developing Early Familial Alzheimer's disease, when was compared with a control group in two test: the MIS (Memory Impairment Screen) and the MCT (Memory capacity test).
MATERIALS AND METHODS. The sample group consisted of 48 participants who were genotyped for the E280A PS1 mutations. They were further divided into three groups: 14 asymptomatic carriers, 11 carriers subjects with MCI (Minimal cognitive impairment) and 23 healthy non-carriers. The selection process was performed using the Minimental and the GDS (Global deterioration scale), FAST(Functional Assessment Staging de Reisberg) scales and scale subjective memory complaints. The samples were subsequently administered the MIS and the MCT and variables such as free recall were recorded.
RESULTS. Significant differences between groups of carriers, obtaining evidence MCI group that has an alteration in the episodic verbal memory, originated in the encoding phase. However, in asymptomatic carrier group it was observed that the alteration is in the evocation phase.
CONCLUTION. The MIS and MCT were useful to discriminate between carriers with MCI and healthy carriers. These tests are characterized by short, easy administer ability, and low cost. It is proposed that this method is used in neuropsychological assessments protocols, in order to effectively assess pre-clinical dementia. It is also suggested to use a larger sample group, to validate the test applied to the Colombian context.
KEY WORDS. Early diagnosis, Alzheimer disease psicological, Neuropsychological test, Presenilin-1.
INTRODUCCIÓN
La Enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa, caracterizada por la pérdida de los procesos cognitivos. Es la primera causa de demencia en el mundo y la cuarta causa de muerte en países desarrollados (1). Se conjetura que para el 2040 la cifra aumentará a 81 millones (2), por tanto, es necesario disponer de herramientas neuropsicológicas que faciliten su diagnóstico en fases tempranas o previas a la Enfermedad, y que permitan implementar los tratamientos farmacológicos y no farmacológicos que han demostrado retraso o desaceleración de las alteraciones cognitivas.
En Colombia, se ha identificado la población más grande en el mundo con Enfermedad de Alzheimer familiar precoz (EAFP) asociada a la mutación E280A en el gen de la presenilina-1 (PS1) en el cromosoma 14. Esta mutación tiene penetrancia del 100% (3), en consecuencia, quien sea portador de esta mutación desarrollará inevitablemente la Enfermedad. Por lo anterior, es necesario realizar estudios con esta población en sus fases previas, ya que otros estudios no pueden asociar directamente los déficit encontrados en sus investigaciones, a síntomas propios de la EA.
Actualmente no existe un marcador único para el diagnóstico temprano de la EA. Pero se ha postulado como el primer marcador cognitivo, la alteración de la memoria episódica (ME) (4- 9) y especialmente, la memoria episódica verbal (MEV), pues se ha reportado, que las pruebas empleadas para medir este proceso, requieren un mayor esfuerzo de procesamiento de la información, de emplear diversas vías para su codificación. Por tal motivo, muchos investigadores se han centrado en estudiar diferentes aspectos de la MEV, tales como la evocación libre (10), el reconocimiento (11), los tipos de errores (intrusiones) en la evocación de palabras (12, 13) y la evocación facilitada por medio de claves semánticas (5,6,14-23).
Dentro de las pruebas de MEV, una de las más utilizadas es el Test de Aprendizaje Verbal de California (TAVEC), el cual se ha aplicado principalmente en pacientes con deterioro cognitivo leve (DCL), encontrando, un patrón caracterizado por aprendizaje reducido, rápida tasa de olvido, aumento de los errores de intrusión (23), interferencia proactiva (24), dificultades en la adquisición y empleo de estrategias seriales y semánticas (categorías) (25), esto puede originarse en un déficit de la fase de codificación, lo cual afecta, tanto las fases de almacenamiento como de evocación. Adicionalmente, Lange et al (26) y Backman et al (4) en sus estudios, hallaron que la MEV no solo se encuentra deteriorada antes de la aparición de la demencia, sino que este deterioro se da de forma sutil y, sólo se muestran cambios significativos en etapas posteriores de la demencia. Sin embargo, estos resultados deberían interpretarse con precaución, ya que en los estudios, no se tenían datos sobre el rendimiento cognitivo previo de los participantes, la muestra poblacional no fue significativa y no contaban con un marcador biológico con penetrancia del 100%.
En cuanto a los estudios realizados en poblaciones asintomáticas portadoras de la mutación E280A se han encontrado recientemente marcadores tempranos en memoria semántica y lenguaje, sin embargo, no se ha estudiado la MEV, con test específicos, diseñados para coordinar la adquisición y la recuperación de información mediante el uso de señales para controlar el aprendizaje y obtener un recuerdo efectivo (27- 30), además de tener bajos costos, y ser de rápida y fácil administración, como el Memory Impairment Screen (MIS), el cual es un test de tamizaje, ampliamente utilizado en poblaciones con DCL, EA y otras demencias en diferentes contextos. Se ha demostrado que el test tiene una sensibilidad del 95% y una especificidad del 81%, para DCL (6, 9, 17, 21, 28).
Adicionalmente, la validez del MIS, se ha soportado mediante estudios posmortem, encontrando características neuropatológicas específicas de la EA (31). Complementario a esto, los investigadores han coincidido en afirmar que tanto sujetos sanos como afectados, obtienen un mejor desempeño cuando se les otorga una clave semántica durante la adquisición de la información, pues se garantiza la atención, se induce la transformación semántica, y se optimiza la codificación específica, lo cual favorece la evocación (6), aunque, el desempeño de los sujetos afectados no es muy significativo cuando se compara con los sujetos sanos (17, 26).
Otra prueba con las mismas características es el Memory Capacity Test (MCT), que parece ser de mayor utilidad, no solo porque es la versión extensa del MIS, sino porque permite medir más componentes de la MEV. No obstante, en la literatura aún no se reportan estudios con este test, sin embargo, existen unos resultados presentados en el congreso de la Sociedad Latinoamericana de Neuropsicología SLAN) en el 2006 (27), donde se demostró que tiene un alto nivel predictivo para demencia.
En torno a lo anterior, surge el interés por postular la administración del MIS y el MCT, como herramientas para identificar el déficit en la MEV en una población Colombiana con riesgo de presentar EA y determinar en qué fase del proceso de MEV se dan las alteraciones.
MATERIALES Y MÉTODOS
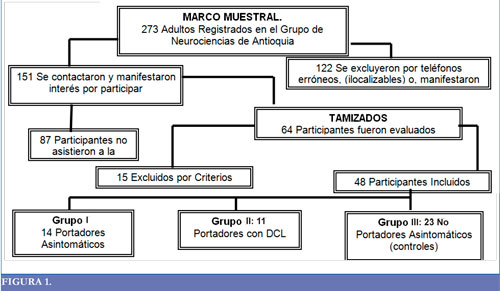
El estudio fue descriptivo, experimental, con diseño comparativo y de corte transversal y fue realizado con 3 grupos de participantes. En la figura 1 se puede observar la división de la muestra (Figura 1).
Todos los participantes tenían su historia clínica registrada en la base de datos del Grupo de Neuro- ciencias de Antioquia y una evaluación neurológica y neuropsicológica completa que no superaba los 18 meses.
Criterios generales de inclusión
1. Estar genotipificados. 2. Tener una edad entre 30 y 55 años. 3. Escolaridad igual o superior a primero de básica primaria y, 4. No cumplir criterios clínicos de demencia según el DSM IV (32).
Criterios específicos de inclusión para los grupos de estudio.
Grupo I: portadores asintomáticos de la mutación E280A en el gen de la presenilina-1 en el cromosoma 14.
1. Genotipificación positiva de la mutación E280A en el gen de la presenilina-1 en el cromosoma 14. 2. Minimental mayor o igual a 23 (32). 3. Escala de Deterioro Global (EDG) y 4. Functional Assessment Staging (FAST) con puntuación menor o igual a 2 (33). 5.) Escala de trastornos de memoria de quejas personales (QP) menor o igual a 19. 6. No cumplir con los criterios de DCL según Pertersen (35).
Grupo II: portadores de la mutación E280A en el gen de la presenilina-1 en el cromosoma 14 con DCL.
1. Genotipificación positiva de la mutación E280A en el gen de la presenilina 1 en el cromosoma 14. 2. Cumplir criterios de DCL según Petersen (35). 3. FAST y 4. EDG con puntuación menor o igual a 3 (34). 5. Escala de trastornos de memoria con QP mayor a 19.
Grupo III: sanos no portadores (controles) 1. Genotipificación negativa de la mutación E280A en el gen de la presenilina-1 en el cromosoma 14. 2. Minimental mayor o igual a 23 (33). 3. EDG y FAST con puntuación igual a 1 (34). 4. Escala de trastornos de memoria con QP menor o igual a 19. 5. No cumplir con los criterios para DCL de Pertersen (35).
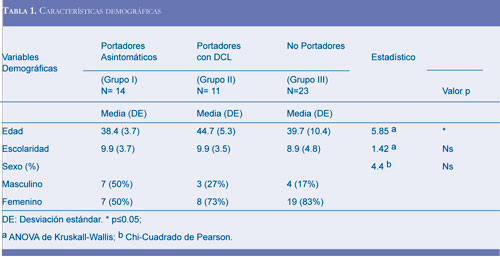
En la tabla 1, se muestran las características demográficas de los tres grupos de participantes, en los cuales, no se encontraron diferencias estadísticamente significativas en ninguna de las variables, excepto en edad. Específicamente, esta diferencia se observa en la comparación del grupo I y II, indicando que el grupo II es mayor en edad promedio (7 años) respecto al grupo I. En general, los participantes de este estudio tienen un nivel educativo medio y en todos los grupos la proporción de mujeres fue mayorInstrumentos.
Instrumentos utilizados para la selección de la muestra
Minimental State Examination (MMSE) de Folstein Instrumento sencillo y de breve aplicación, normatizado al contexto colombiano por Ardila, Roselli y Puente (35); se utiliza sobre todo, para detectar y evaluar la progresión del trastorno cognitivo asociado a enfermedades neurodegenerativas. Explora 5 áreas cognitivas: orientación, fijación, concentración y cálculo, memoria y lenguaje. Su puntuación total máxima es 30.
Escala de Deterioro Global de Reisberg (EDG)
Escala que permite valorar los niveles de funcionalidad del paciente en la vida diaria. Va desde el nivel 1 (normal, no demente) hasta el nivel 7 (demencia tardía) (34).
Functional Assessment Staging de Reisberg (FAST)
Escala que permite valorar los niveles de funcionalidad del paciente en la vida diaria. Es una ampliación de la EDG. Así mismo, es útil para ver el curso de los casos de EA que siguen una evolución natural. Sirve para evaluar la duración de la Enfermedad en cada uno de los estados y para determinar el orden deérdida funcional de los pacientes hasta llegar a la demencia. La puntuación de la escala corresponde al ítem en el cual se encuentra el paciente: 1, 2, 3, 4, etc, hasta 16 (34).
Escala de trastornos de memoria
Instrumento que permite cuantificar el funcionamiento de la memoria cotidiana del paciente y a la vez que éste la valore (metamemoria). La escala se realiza al sujeto y a un familiar. Consta de 15 preguntas cada uno con 4 opciones de respuesta así: nunca (0) rara vez (1) a veces (2) y casi siempre (3).El sujeto debe establecer con qué frecuencia ocurre cada una de las 15 preguntas fórmuladas. 17 es el punto de corte con máxima puntuación de 45. La encuesta contestada por el paciente se denomina QP y QF la contestada por su familiar.
Instrumentos Empleados para la Evaluación de la METV
Memory Impairment Screen (MIS)
Es una prueba breve de trastornos de memoria que utiliza técnicas de aprendizaje controlado y recuerdo selectivamente facilitado para optimizar los procesos de codificación. Consta de cuatro palabras que deben ser leídas e identificadas con la categoría a la que corresponda (Ej: domino, juego). Se prosigue con una tarea de interferencia no semántica (dígito símbolo) durante 120 segundos, se realiza, a fin de prevenir la repetición y probar el recuerdo de la memoria secundaria. Finalmente, el sujeto debe recordar las cuatro palabras aprendidas previamente en cualquier orden (recuerdo libre). En caso de no hacerlo, se emplean las claves semánticas (categorías) que se emplearon en el aprendizaje, con el objetivo de facilitar el recuerdo de los ítems que no se lograron evocar libremente. La puntuación se calcula mediante la siguiente fórmula (MIS total = (recuerdo libre × 2) + (recuerdo selectivamente facilitado)) concediendo 1 punto por cada palabra correctamente evocada en ambos ensayos. El rango de puntuaciones queda repartido de ésta forma para las tres puntuaciones: recuerdo libre (0-8), recuerdo selectivamente facilitado (0-4) y recuerdo total (0-8). El punto de corte es 4 (6).
Memory capacity test (MCT)
Es la versión extensa del MIS. Emplea técnicas de aprendizaje controlado y recuerdo selectivamente facilitado para optimizar los procesos de codificación. Consta de dos listas con 16 palabras cada una, las cuales se presentan en cuatro láminas de cuatro palabras cada una. Cada palabra hace parte de una categoría específica, la cual el sujeto debe asociar (Ej: tipo de árbol: pino).
La puntuación del MCT para el recuerdo facilitado resulta de la sumatoria del total de palabras evocadas para una y otra lista. El total de la subprueba de recuerdo libre se obtiene sumando las palabras evocadas correctamente que pertenece a ambas listas (29).
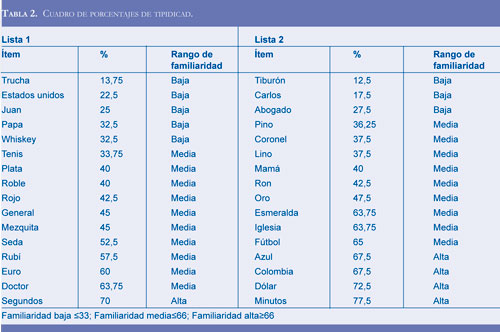
Como el test, no contaba con una adaptación, ni validación en contexto hispanoparlante, se realizó la traducción y adaptación de inglés a español de las palabras, la cual fue autorizada por el autor original Herman Buschke, Instituto de Medicina Albert Einstein de Bronx, New York), para administrarla en el contexto colombiano. Para la adaptación, se conservaron las claves semánticas. Los cambios en las palabras, fueron realizados en base a una encuesta administrada a 80 personas de algunas regiones del país (Antioquia, Santander, Norte de Santander, Cundinamarca y Santa Marta), de diferentes edades y niveles educativos. Los datos fueron tabulados en una base de datos, se calculó la moda, y se escogieron las palabras correspondientes a cada categoría que fueron de mayor producción por los participantes, adicionalmente, se analizó estadísticamente el porcentaje de tipicidad de cada palabra según las categorías semánticas, donde se clasificaron según los rangos de familiaridad (alta, media y baja), de acuerdo al percentil 33.66 (Tabla 2).
Procedimiento
Se tomaron pacientes genotificados, que cumplían los criterios de inclusión, y tenían una evaluación neurológica y neuropsicológica inferior a 18 meses. Se les aplicó previa firma del consentimiento informado, en el que los participantes aceptaban que la información se usara para posteriores estudios. El consentimiento, fue aprobado por el comité de ética de la Universidad de Antioquia. Posteriormente, se administró el protocolo de METV, el cual fue aplicado por un evaluador en una sesión. En ningún momento el evaluador tuvo conocimiento del status genético de los participantes.
De la prueba del MIS se tuvieron en cuenta las variables de lectura, identificación, recuerdo libre y recuerdo facilitado; del MCT se observó el recuerdo facilitado lista 1, recuerdo facilitado lista 2, total evocación facilitada de categorías semánticas, puntuación global del recuerdo libre, recuerdo libre lista 1, recuerdo libre lista 2 y número de pares en el recuerdo libre.
Análisis de datos
Se compararon los grupos con relación a la edad y escolaridad mediante un análisis de varianza (ANOVA) no paramétrico de Kruskall-Wallis y según sexo con la prueba Chi Cuadrado de homogeneidad. Para el análisis de los desempeños en las pruebas, se tuvo en cuenta, además de la condición clínica (No Afectado - Afectado), la genética (No Porta- dor - Portador), organizando los siguientes grupos: Grupo I (portadores asintomáticos de la mutación E280A en el gen de la PS1 en el cromosoma 14); Grupo II (portadores con DCL de la mutación E280A en el gen de la PS1 en el cromosoma 14); y, Grupo III o Grupo Control (sanos no portador). También se empleó la prueba de Dunn's –prueba no paramétrica- para comparaciones múltiples entre los grupos. Para éstas pruebas estadísticas se estableció como nivel de significación, p<0.05.
Finalmente, se calculó el tamaño del efecto (TE) cuando se compararon los grupos, considerando diferencias importantes para un TE superior a 0.75 (37). Los análisis se realizaron con con el paquete estadístico SPSS (Statistical Package for Social Sciences) versión 15.0® (38), y el programa GrapPad PRISMA versión 5.0® (39).
RESULTADOS
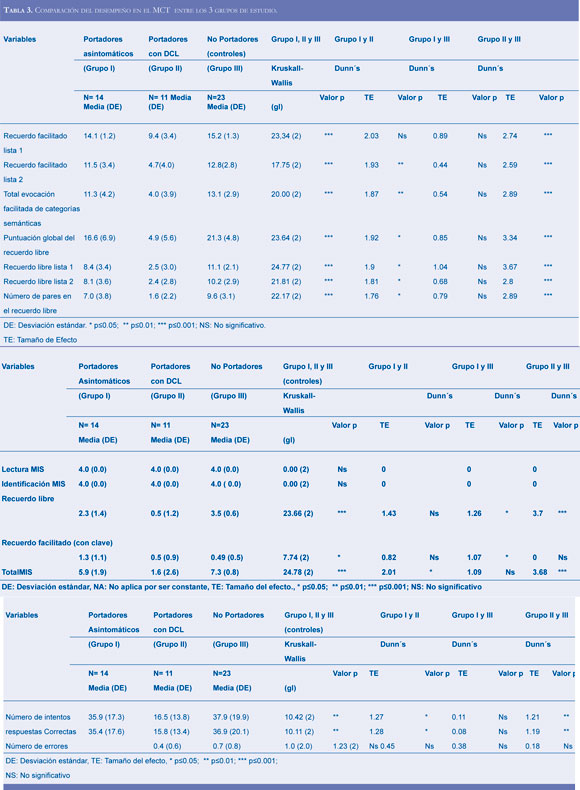
La tabla 3 presenta el desempeño en las pruebas del MCT en los tres grupos de estudio. Se encon- traron diferencias significativas (p<0,05) entre los grupos según el ANOVA de Kruskall-Wallis. Seguidamente se realizó la prueba de Dunn para las comparaciones entre los grupos. Se encontrarondiferencias significativas entre portadores asinto- máticos y portadores con DCL mostrando TE para todas las pruebas superiores a 0,75 (entre 1,47 y 2,25). La comparación entre portadores con DCL y no portadores mostró diferencias significativas con TE altos en las variables de recuerdo facilitado lista 1, recuerdo facilitado listos 1 y 2, puntuación global del recuerdo libre, recuerdo libre lista 1 y número de pares en el recuerdo libre. En el resto de las variables, el tamaño del efecto fue inferior a 0,75 y no significativo. En la comparación entre portadores con DCL y no portadores, las diferencias encontradas fueron en todas las variables con TE altos entre 2,10 y 3,67.
En la tabla 4 se muestran las diferencias en las variables de recuerdo libre y puntuación total de MIS en los tres grupos de estudio. Los portadores asintomático comparados con los portadores con DCL y los no portadores mostraron diferencias significativas en el desempeño del MIS. Los pacientes portadores con DCL y no portadores, no mostraron diferencias en el recuerdo facilitado con clave. Finalmente, la tabla 5 muestra los resultados en la prueba de dígito símbolo. Los portadores asintomáticos en comparación con los portadores con DCL mostraron diferencias significativas con TE >0,75 en el número de intentos y de respuestas correctas al igual que los portadores con DCL y los no portadores. Los portadores asintomáticos y los no portadores, no mostraron diferencias en las variables de la prueba dígito símbolo.
DISCUSIÓN
Determinar si existen déficits en la memoria episódica verbal, en una población con riesgo de desarrollar Enfermedad de Alzheimer familiar precoz (EAF) en Antioquia, evaluada por medio del MIS y el MCT fue el objetivo principal del estudio. En este estudio, las variables sociodemográficas y clínicas fueron factores para la comparación de los grupos; cabe destacar que la muestra fue estadística- mente homogénea, en razón a que los participantes presentaron un nivel educativo y socioeconómico similar; además, las diferencias en cuanto a género no fueron significativas. Sin embargo, se presentaron diferencias en edad, entre los grupos I y II, pues el grupo I, tuvo una edad promedio de 38.4, en cambio, el grupo II una edad de 44.7. Esta diferencia en edad era esperable, ya que según lo reportado por Lopera et al (3), la EAF tiene una edad de inicio a
los 47 años, por tanto, los pacientes del grupo II, ya se encontraban en el período crítico, es decir, donde se comienzan a manifestar los primeros síntomas clínicos de la EA. Cabe señalar, que la presencia de la mutación E280A en el gen de la PS1 en el cromosoma 14, presenta una penetrancia del 100%, lo cual garantiza que quien sea portador de dicha mutación, inevitablemente desarrollará la Enfermedad.
De manera general, cuando se compararon los tres grupos, se evidenciaron diferencias estadísticamente significativas en todas las variables del MCT analizadas. Esta diferencia se generó debido a que el grupo II, obtuvo los desempeños más bajos. Éstos resultados son consistentes con los referenciados en la literatura, demostrando que en sujetos con DCL existe una pérdida de METV, alteración que se origina porque existe una neurodegeneración en estructuras hipocampales y parahipocampales (41- 43), las cuales se extienden a medida que progresa a la EA.
Por otra parte, algunos investigadores han evidenciado que en sujetos portadores asintomáticos de la mutación E280A, existe una leve alteración en la MEV (12, 43), hallazgo también observado en este estudio, y aunque no se mostró a nivel estadístico, sí lo fue a nivel clínico, debido a que los TE fueron significativos para la variable de recuerdo facilitado de la lista 1 en el MCT, mostrando que el grupo portador I evocó un menor número de palabras con clave semántica pertenecientes a la lista 1, cuando se comparó con la variable de recuerdo facilitado de la lista 2.
Dicha diferencia podría indicar que, aunque se dió un registro o codificación adecuada, es posible que la dificultad para evocar las palabras con clave de la lista 1 se deba a que dicha clave no fue lo suficientemente útil para lograr su aprendizaje o almacenamiento (44); y por ende puede que la información o se haya olvidado, o que se halle almacenada en alguna parte de la memoria, pero no se puede acceder a ella por medio de este tipo de recuerdo. Esta diferencia, también puede explicarse con base en los análisis de tipicidad de los ítems, pues se demostró que aquellos que pertenecían a la lista 1, en su mayoría eran de familiaridad baja y media, es decir, tienen una menor frecuencia de uso en comparación con los ítems de la lista 2 que, en mayor proporción, correspondían a una familiaridad media y alta, por tanto, el grupo I evocó menor cantidad de palabras de la lista 1 comparado con los resultados del grupo III. Otro aspecto, por el cual este grupo no pudo evocar la información de la lista 1, es porque también podrían existir algunas alteraciones leves en el aprendizaje y memorización de la información, o un déficit en las habilidades atencionales, pues sólo se observó una diferencia en el recuerdo facilitado de la lista 1 y no en el recuerdo facilitado de la lista 2. Esta noción se deriva de lo reportado por Linn et al (18), Buschke et al (46), Estévez-González et al (47), y Rapp & Reischies (48), en sus estudios sobre la fase preclínica de la EA.
Además de la diferencia en el recuerdo facilitado de la lista 1, también se hallaron diferencias en los TE del grupo I y III en las siguientes variables del MCT: puntuación global de recuerdo libre, indicando que el grupo I evocó un menor número de palabras correctas en la tarea de recuerdo libre; recuerdo libre de la lista 1, la cual señala que este grupo I evocó un menor número de palabras de la lista 1 durante la tarea del recuerdo libre, y número de pares en el recuerdo libre, en donde se evidenció que el grupo I evocó un menor número de pares de palabras pertenecientes a la misma categoría en la tarea de recuerdo libre. Estas diferencias, en el recuerdo libre se podrían explicar sugiriendo que en el grupo I quizás se presenta una dificultad en la fase de evocación, específicamente en la forma como se evoca la información, pues en las variables de recuerdo facilitado su desempeño fue muy similar al del grupo III. Las diferencias en las variables de evocación libre, también se perciben en los estudios de Lange et al (10) y Backman et al (4), pues los autores encontraron diferencias de p <0,001, en dicha variable pero en un test de metodología similar (TAVEC). Las diferencias estadísticas observadas en estas variables y no en las de recuerdo facilitado, sugieren que el recuerdo facilitado por medio de claves semánticas, es una herramienta de utilidad para codificar y retener la información (48). No obstante, como las diferencias son muy sutiles el MCT pierde sensibilidad para discriminar entre los grupos I y III.
Adicionalmente, cuando se hizo la comparación entre los grupos I y II, se encontraron diferencias estadísticas y en el TE en casi todas las variables delMCT, menos en el recuerdo facilitado de la lista 1, donde se evidenció que ambos grupos de portadores presentaron un rendimiento similar en dicha variable, aunque cuando se analizó el TE, sí se percibieron diferencias en la clínica, hallazgo que permite sugerir que el grupo I quizás tenga dificultades para evocar palabras de baja y mediana frecuencia de uso, o también, se puede manifestar que en este grupo pueda presentarse una leve dificultad atencional, idea que se soporta según lo reportado por Linn et al. (18), Buschke et al. (45), Estévez-González et al. (46), y Rapp & Reischies, (47), en sus estudios en fases iniciales de la EA.
En lo pertinente al grupo II, se observó que, en comparación con el grupo III, existen diferencias en las tareas de recuerdo facilitado y de recuerdo libre del MCT, aunque en relación a la variable de recuerdo facilitado del MIS no se encontraron diferencias estadísticas ni en el TE, hallazgo que podría explicarse porque la naturaleza de las pruebas es diferente, pues en el MCT el recuerdo facilitado se realiza inmediatamente después de la identificación de las palabras, lo cual hace que el sujeto parezca optimizar de una forma más adecuada la evocación de las palabras. Asimismo, a pesar de que el rendimiento del grupo II fue inferior en comparación con los grupos I y III, se observó que el rendimiento de este grupo fue diferente en las dos pruebas administradas, pues en el MIS el desempeño fue menor que en el MCT, hallazgo que probablemente se deba a que, en el MIS, la información administrada es susceptible a interferencia, pues en dicho test se lleva a cabo una tarea interferente (dígito-símbolo) antes de realizar las tareas de evocación.
Otro aspecto a considerar es que el mejor desempeño del grupo II en el MCT, en relación al MIS, podría explicarse basándose en un estudio de Small & Herlitz (48), quienes administraron el TAVEC, en una población con DCL, encontrando que los sujetos con DCL se benefician de un apoyo contextual o asociativo (48), pero dicho apoyo debe emplearse tanto para codificar como para evocar la información, aspecto que se contempla en el MCT mas no en el MIS. Esto se apoya en Lipton et al. (19), Tulving (49), y Gabrieli, Keane, Stanger, Kjelgaard, Corkin & Growdon (50), quienes observaron que los sujetos con DCL aumentan su desempeño en tareas de METV, a medida que aumenta el nivel de apoyo en la codificación, aunque en menor proporción que en sujetos sanos.
Ahora bien, en lo concerniente a la naturaleza del MIS, el recuerdo facilitado se llevó a cabo sólo cuando el sujeto no pudo evocar libremente las palabras; por tanto, como se observó, los sujetos sanos recuerdan libremente casi todas las palabras del MIS, mientras que los sujetos con DCL, a pesar de que se les otorgue la clave semántica, presentan una incapacidad para beneficiarse de las pistas semánticas durante la evocación, teoría que se ha relacionado con una alta probabilidad de desarrollar EA entre sujetos con DCL, según lo postulado por Petersen et al (35) y Tierney et al (51). Sin embargo, este hallazgo contradice lo reportado por Small & Herlitz (48), Lipton et al. (19), Tulving (44) y Gabrieli et al. (50), quienes manifiestan que las claves semánticas, como apoyo cognitivo, sí son de utilidad en sujetos con DCL; sin embargo, al compararlos con sujetos sanos, el rendimiento es notablemente inferior. Dados los diferentes puntos de vista de los investigadores men- cionados, fue que se administraron instrumentos que permitieran observar tanto el recuerdo libre como el facilitado, con el objetivo de contrastar sus hipótesis con los hallazgos encontrados en esta investigación; así, pues, se administró el MIS, que ha demostrado en diversas poblaciones una alta sensibilidad y especificidad. Adicionalmente, tanto el MIS como el MCT, por ser pruebas de tipo verbal, requieren un mayor esfuerzo de procesamiento de la información que las tareas de tipo no verbal (19). De igual forma, según lo reportado por Buschke et al (6), Lipton et al (19), Peña-Casanova et al (22), Sliwinski et al (9), Verghese et al (32), Böhm et al (20), Buschke et al (17), Barrero-Hernández et al (5), han sido útiles para discriminar entre sujetos sanos y enfermos. Estos autores, en sus investigaciones con sujetos sanos y pacientes con DCL, encontraron diferencias significativas (p≤0.05) en las variables de recuerdo libre, facilitado y puntuación total del MIS, tomando como punto de corte cuatro, resultados que dan más soporte al presente estudio, pues se encontró un valor p≤0,001; cuando se compararon los grupos II y III, es decir, los resultados estadísticos presentan un nivel de confianza de 99.9%.
De igual forma, al contrastar los grupos I y II, se observaron diferencias estadísticas, y en TE las variables de recuerdo facilitado y libre del MCT; no obstante, en la variable de recuerdo libre de la lista 1, a pesar de no hallarse diferencias estadísticas, sí se encontraron diferencias en el TE, lo cual puede estar indicando en la clínica que en el grupo II quizás se esté evidenciando un deterioro mayor que en el grupo I. Por otro lado, es importante resaltar también la diferencia estadística, ya que demostró que estos grupos tienen desempeños similares, una diferencia que no debería pasarse desapercibida, ya que podría dar algún indicio de deterioro en el grupo I, y que posiblemente sea debido a algún déficit atencional o de procesamiento de información, como se planteó anteriormente.
Con respecto al MIS, no se evidenciaron diferencias estadísticas en las variables de recuerdo libre y facilitado, lo cual indica que los rendimientos en estos grupos son análogos, demostrando que tanto los grupo I y II no se están beneficiando de la clave semántica empleada para codificar la información, lo cual se soporta en lo postulado por Buschke et al (6), Menor et al (30) y Arango-Lasprilla et al (43), quienes manifiestan que la dificultad yace en la incapacidad de los sujetos para utilizar estrategias de asociación o de categorización que les impide registrar o codificar la información; esta dificultad se asume como un déficit semántico. Por otra parte, en cuanto a los TE sí se encontraron diferencias que indican que en la clínica el grupo II presenta un menor desempeño que el grupo I. Esta diferencia se pudo observar en la variable total del MIS, donde se ilustraron diferencias estadísticas, y en TE, resultado que puede explicarse porque el grupo I evocó libremente un mayor número de palabras en comparación con el grupo II; aunque no fue significativo en la variable de evocación libre, sí se evidenció en la puntuación total.
Por otro lado, en lo que respecta a los grupos I y III, en las variables de recuerdo facilitado y libre del MCT no se observaron diferencias estadísticamente significativas, mostrando con ello que estos grupos son semejantes; sin embargo, sí se presentaron diferencias en los TE de recuerdo facilitado de la lista 1, y en casi todas las variables de recuerdo libre, a excepción del recuerdo libre de la lista 2, lo cual sigue soportando la idea de que los sujetos portadores presentan dificultades para evocar palabras de tipicidad correspondiente a baja familiaridad..
Una de las razones, por las cuales el grupo I presentó diferencias clínicas en el ecuerdo libre, puede deberse a la naturaleza de la prueba y soportarse según lo postulado por Tulving (49), quien manifiesta que en las tareas de recuerdo libre no se proporcionan indicios, por tanto, el sujeto debe reproducir los ítems presentados con anterioridad en el orden que desee y sin ayuda externa, lo cual implica mayor dificultad en el procesamiento cognitivo a diferencia del recuerdo facilitado, donde se proveen las claves que se relacionan contextualmente con los ítems y, de esta forma, el sujeto asocia y puede evocar la información más fácilmente. Grober et al (11), postulan que el recuerdo facilitado es una herramienta eficaz para la medida de la memoria, porque evidencia un aprendizaje que no se evidencia en el recuerdo libre, ya que da un indicio de la capacidad máxima del almacenamiento e identifica alteraciones en el recuerdo debidas a un déficit en la evocación libre; por tal motivo, tanto el almacenamiento como la evocación pueden evaluarse de forma precisa (45), aspecto con el que cuentan las pruebas empleadas. Asimismo, se podria manifestar que el bajo rendimiento en la tarea de recuerdo libre parece relacionarse con una alteración en la forma como se evoca la información; es decir, el déficit quizás se halla en la forma como los sujetos acceden a la información, pues cuando se emplearon las claves semánticas en el recuerdo facilitado el rendimiento fue análogo con el grupo III, a excepción de la variable mencionada anteriormente. Este buen rendimiento en las tareas de recuerdo facilitado evidenció que los sujetos presentan buena capacidad para codificar y retener la información; además, este aprendizaje controlado se coordinó para producir el recuerdo. Según Tulving (49), el aprendizaje con claves semánticas asegura la focalización de la atención en los ítems a aprender y muestra la capacidad para identificar cada ítem con su clave semántica asegurando un procesamiento para todos los ítems, de tal forma que induce a todos los sujetos a procesar los elementos de la misma forma.
Por otra parte, se pudo observar que los tres grupos de estudio mostraron un mejor desempeño en las variables de recuerdo facilitado de la lista 1, en relación a la variable de recuerdo facilitado de la lista 2. Estos desempeños se observaron pese a que la mayoría de las palabras de la lista 1 corresponde a una tipicidad de familiaridad baja y media, en comparación con la lista 2, cuyas palabras pertenecen en mayor proporción a una familiaridad media y alta.
En relación a la variable de recuerdo facilitado de la lista 2, dado el desempeño de los 3 grupos de estudio y condición clínica correspondiente, se logró comprobar que el grupo II evocó un menor número de palabras pertenecientes a esta variable que el grupo I y III, hallazgo que corrobora lo manifestado por Ebert & Anderson (24) en su estudio sobre METV, estos autores estudiaron por medio del TAVEC, los fenómenos de interferencia retroactiva y proactiva, en un grupo de adultos mayores, adultos jóvenes y sujetos con deterioro cognitivo leve de tipo amnésico –DCLa-, hallando que no existían diferencias estadísticas en la medida de la interferencia retroactiva entre el grupo de adultos mayores y el grupo con DCLa, ya que evidenciaron un nivel de interferencia similar, pero, en relación a la interferencia proactiva, se observó que fue mayor en el grupo con DCLa, seguida por el grupo de adultos mayores y el grupo de adultos jóvenes. Por tanto, los autores concluyeron que el fenómeno de interferencia proactiva puede observarse en sujetos con DCLa, característica que podría ser de utilidad para la detección temprana de la EA.
Esta interferencia proactiva o asociativa (49), hallada en los grupos de estudio, no se relaciona con los grados de familiaridad baja y media, puesto que las palabras de la lista 2 son de familiaridad media y alta y fueron evocadas en menor proporción en todos los grupos. Así pues, la diferencia entre los grupos puede estar relacionada con una alteración en el aprendizaje de una nueva información, generada por la contaminación ejercida por la información precedente (44), lo cual se observó en los tres grupos de estudio.
Para explicarlo con mayor detalle, el grupo I sólo evidenció diferencias significativas en el TE, mas no alcanzó a mostrar evidencias estadísticas en la variable de recuerdo facilitado de la lista 1 cuando se comparó con el grupo II. Al mismo hallazgo se llegó cuando se comparó con el grupo III, demostrando que, probablemente el grupo I tenga una leve dificultad en el aprendizaje de nueva información, como se postuló anteriormente. Adicionalmente, quedó demostrado que los 3 grupos evocaron más palabras de la lista 1 que de la lista 2; asimismo, en la variable de recuerdo libre también se demostró que, aunque no se presentaron diferencias estadísticas, sí presentaron un TE significativo en la variable de recuerdo facilitado de la lista 1, indicando con elloque el grupo I evocó menos palabras de la lista 1 que el grupo III, mostrando a la vez que el rendimiento en la tarea de recuerdo libre del grupo I fue similar en las listas 1 y 2; es decir, que evocaron la misma cantidad de palabras pertenecientes a una categoría específica al igual los sujetos del grupo III, quienes también mostraron un desempeño similar cuando se analizaron las evocaciones de las dos listas; en suma, las diferencias en los TE, en las variables de recuerdo facilitado de la lista 1, pueden indicar que en los sujetos del grupo I existe una vulnerabilidad a la interferencia proactiva, noción apoyada por Ebert& Anderson (24), quienes afirman que este tipo de interferencia puede ser considerado como una manifestación precoz de un proceso de demencia temprana, postulado que puede ser de utilidad en el futuro para predecir la progresión de la misma.
Conforme a lo expuesto anteriormente, se pudieron confirmar y soportar los planteamientos hechos en las hipótesis, donde se esperaba encontrar que los sujetos del grupo I y los del grupo II, evidenciaran alteraciones en las pruebas de METV, a diferencia de los sujetos del grupo III, quienes no presentaron alteraciones. Asimismo, se lograron confirmar los hallazgos soportados en la literatura, donde se postula que en sujetos con DCL se encuentra alterada la codificación, además de otras fases del sistema de METV, lo cual quedó evidenciado con el bajo rendimiento en las tareas de evocación con clave del MCT. Por otra parte, también se logró evidenciar que el grupo I mostró un bajo desempeño en la tarea de recuerdo libre en las pruebas del MIS y del MCT, circunstancia que, si bien no fue estadísticamente significativa en comparación con los sujetos del grupo III, sí lo fue en la clínica, dato derivado del análisis de los TE. Además, en relación con el MIS, se pudo demostrar que fue de gran utilidad para discriminar entre sujetos sanos, y portadores con DCL, ya que, como se describió en su momento, los sujetos con DCL no lograron beneficiarse de las claves semánticas, a diferencia de los sujetos del grupo III; sin embargo, tanto el MIS como el MCT, perdieron sensibilidad cuando se compararon los desempeños entre los grupos I y III, pues estadísticamente no hubo diferencias significativas, por tanto, se puede manifestar que estos test son de utilidad solo para detectar déficit en etapas iniciales a la EA, como el DCL y no para diferenciar entre sujetos en fases preclínicas de sanos.
Un aspecto no mencionado anteriormente, y que concierne al MIS, es que en las variables de lectura e identificación se halló un efecto techo, el cual también se observó por Barrero-Hernández et al (5), Böhm et al (20), Buschke et al (6), Lipton et al (19), Peña-Casanova et al (22). Este hallazgo podría explicarse porque los participantes de estos estudios contaban con una escolaridad superior al quinto primaria; además, el nivel socioeconómico era bajo-medio, por tanto, sabían leer y agrupar correctamente el ítem con la categoría dada. Por otro lado, estas variables (lectura e identificación) en todos los grupos se interpreta estadísticamente como error porque la varianza es 0; es decir, es constante su variabilidad en 0, al igual que la media y la desviación estándar. Por tales motivos el valor p, es 1.000, lo cual corrobora la carencia de diferencias estadísticas, y el hecho de que hubiese sido prudente no realizar la prueba de Dunn´s, debido a que la prueba de Kruskall-Wallis no evidenció diferencias significativas, por tanto, no había motivos que justificaran realizar una comparación por pares.
Ahora bien, en lo referente al tamaño de la muestra, se dice que cuanto más grande es el tamaño muestral mayor es la precisión, y que la variabilidad explicada por el azar disminuye. Por tales razones, sería conveniente aumentar para futuros estudios la muestra de participantes portadores asintomáticos y con DCL, de ser posible, ya que el grupo de portadores con mutación E280A en el gen de la PS1 en el cromosoma 14, aunque hacen parte del grupo poblacional más grande del mundo en el que se presenta EAF, no es tarea fácil aumentar la muestra de participantes, debido a que no todas las personas identificadas con la mutación colaboran en los estudios; además, constituye un gran reto manipular las condiciones necesarias para soportar metodológicamente el estudio de la fase preclínica de esta Enfermedad.
Una de las grandes ventajas de esta investigación, fue el hecho de contar con un grupo de participantes portadores de una mutación genética, la cual se sabe es la causante del desarrollo de la EAFP, así mismo constituye una ventaja en relación a otras investigaciones pues la gran mayoría de estudios realizados sobre la fase preclínica en la EA se han efectuado con personas que no tenían plena garantía de desarrollar esta Enfermedad o en poblaciones con factores de riesgo poco determinantes para desarrollar EA; de igual forma, varios estudios sobre la fase preclínica han tenido un carácter retrospectivo y, en muchas ocasiones, dejan dudas sobre las metodologías empleadas. Por tales motivos, se puede asegurar que en la presente investigación todos los participantes portadores de la mutación E280A en la PS1, con certeza van a desarrollar en un futuro la EAF. Además, todos los sujetos eran relativamente jóvenes (38 años de edad promedio) al momento de la evaluación de METV, lo que permite hacer un análisis independiente del deterioro de la memoria asociado al envejecimiento, una variable de confusión en la mayoría de los estudios desarrollados en pacientes con la EA.
Pese a que el estudio contó con un control metodológico, cabe destacar que los resultados deben ser interpretados con cautela, debido a los siguientes aspectos metodológicos: todos los participantes (tanto portadores asintomáticos, portadores con DCL y no portadores) eran de un nivel de escolaridad medio-bajo; por ende, se deben tener precauciones a la hora de generalizar estos resultados a poblaciones con niveles educativos altos; los participantes son portadores de una mutación genética específica en el cromosoma 14. Y, puesto que se han reportado más de 170 diferentes mutaciones causantes de la EA, los resultados pueden no generalizarse para portadores de otras mutaciones. No obstante, en razón a que las características clínicas, neuropatológicas y neuropsicológicas de los afectados por la EA, que resulta de la mutación E280A en la PS1, son similares a la EA de tipo esporádico (3,43), es posible que estos resultados puedan contrastarse con sujetos que desarrollan la Enfermedad de forma esporádica; el tamaño de la muestra no es representativo; la edad de los grupos de portadores presentó una diferencia de 6.3 años; por tanto, su comparación presenta sesgos, pues el grupo II, por ser mayor, es posible que presente alteraciones, a diferencia del grupo I, sujetos más jóvenes y con alteraciones más sutiles. Tanto el MIS como el MCT fueron prueba que se aplicaron por primera vez, tanto en Colombia como en esta población con riesgo a desarrollar EAF. Por tanto, no se tienen datos sobre su confiabilidad y validez en este contexto; en la adaptación del MCT se emplearon los resultados de las encuestas realizadas a 80 personas, pero hubo dificultades para establecer que todas las palabras fueran de tipicidad media por el numero limitado de la muestra, por tanto deben replantearse las palabras de la prueba.
Por otro lado, es importante señalar que la mayoría de los estudios que se han realizado sobre la fase preclínica en personas con EA, han reportado la presencia de cambios sutiles en la memoria como la principal característica de esta etapa (Backman et al. (4); Estévez-González et al (46); Lange et al, (26)). Otras investigaciones han hallado alteraciones en diversos procesos cognitivos, como los realizados por Estévez González et al (46), quienes evidenciaron en su estudio una alteración en los procesos atencionales; también Rapp & Reischies (47) y Small et al (48), todos ellos encontraron déficit en la función ejecutiva. De igual forma, Small et al (48) hallaron dificultades en las capacidades visoespaciales, y más recientemente Arango-Lasprilla et al (43), hallaron alteraciones en el lenguaje. En suma, al parecer estas funciones cognitivas se empiezan a deteriorar, incluso, varios años antes de que se haga un diagnóstico clínico de la enfermedad, motivo por el cual se abre una ventana de esperanza que permitirá a futuro la posibilidad de diagnosticar cuanto antes a los sujetos con riesgo, y así implementar oportunos tratamientos cognitivos o farmacológicos que puedan detener o, al menos, desacelerar la progresión de la Enfermedad.
Con base en lo expuesto, podría manifestarse que el perfil de deterioro de la METV en fases preclínicas a presentar la EA puede tener su génesis en la evocación, pues el grupo I, presentó dificultades para evocar algunas de las palabras, en relación a los sujetos del grupo III; esto pudo deberse a que los índices o pistas de recuperación fueron inadecuados y, por tanto, su desempeño resultó menor, aunque sólo se evidenció clínicamente en la medida del TE. Por otro lado, en el grupo II se halló que la fase de codificación se encuentra alterada, dado a que este grupo presentó dificultades para agrupar la información en forma semántica, razón por la cual su desempeño fue inferior en comparación con los demás grupos. Adicionalmente, se encontró un fenómeno de interferencia proactiva que no se había identificado en poblaciones con riesgo de desarrollar la EA; pero estas diferencias en METV encontradas en los participantes portadores aún no tienen impacto en la vida diaria; sin embargo, resultan muy interesantes, debido a que podrían ser considerados como indicadores o características tempranas de la METV para EAF. Adicionalmente, si bien se han reportado cambios en este sistema de memoria en fases previas a la EA, estos resultados deben verse con cautela, pues en dichos estudios no se contó con un factor de riesgo altamente determinante; por ello, el presente estudio es el primero en reportar la presencia de déficit de METV, específicamente en la fases previas a la EAF.
Para complementar lo anterior, cabe manifestar que las tareas del MIS y el MCT han mostrado ser sensibles en la detección de alteraciones en la METV, en sujetos con DCL, por tal motivo, se recomienda incluirlas en los protocolos que pretendan diagnosticar fases previas a la EA. Asimismo, se ha reportado que las tareas de METV involucran diferentes zonas cerebrales, entre ellas: la formación hipocampal (giro dentado, hipocampo, subículo, presubículo, parasubículo y corteza entorrinal), y otras estructuras adyacentes como la corteza perirrinal y el giro parahipocampal (47, 50). Por tales razones, si se realizan estudios de neuroimagen en etapas preclínicas quizás podrían verse alteraciones leves en dichas estructuras.
Finalmente, en lo referente a alteraciones en la METV, varios autores (4, 26, 47) han reportado que estos déficit no tienen una progresión rápida, sino que el deterioro se mantiene estable en los individuos con DCL y se hace evidente en fases clínicas de la EA, es decir, el deterioro es constante pero, cuando se realiza el diagnóstico de la Enfermedad, por lo general, ya existe una alteración perceptible en mayor proporción de la que fue observada en evaluaciones neuropsicológicas previas; motivo por el cual se podría sugerir que se realice un seguimiento de este tipo de memoria en la población con riesgo de presentar EAF, a fin de detectar cualquier alteración temprana y para tomar las medidas de tratamiento requeridas, con objeto de retrasar la progresión del cuadro clínico.
REFERENCIAS
1. PAPPOLLA MA. La Neuropatología y la Biología Molecular de la Enfermedad de Alzheimer. En: Cruz- Sánchez FF. Neuropathologia. Diagnóstico y Clínica. Ed Madrid: Edimsa. 2000;543-553. [ Links ]
2. FERRI CP, PRINCE M, BRAYNE C, BRODATY H, FRATIGLIONI L, GANGULI M, ET AL. Global prevalence of dementia: a Delphi consensus study. Lancet. 2005;366: 2112-2117. [ Links ]
3. LOPERA F, TOBON N, ARCOS-BURGOS M, VARGAS S, GUTIÉRREZ JE, ROSSELLI M, ET AL. Image characterization of Alzheimer's disease associated with the E280A-PS1 mutation. Case-control study: MRI findings. Rev.Neurol. 1999;29:6-12. [ Links ]
4. BACKMAN L, SMALL BJ, FRATIGLIONI L. Stability of the preclinical episodic memory deficit in Alzheimer's disease. Brain. 2001;124: 96-102. [ Links ]
5. BARRERO-HERNANDEZ FJ, VIVES-MONTERO F, MORALES-GORDO B. Evaluation of the Spanish version of the Memory Impairment Screen. Rev.Neurol. 2006;43:15-19. [ Links ]
6. BUSCHKE H, KUSLANSKY G, KATZ M, STEW ART WF, SLIWINSKI MJ, ECKHOLDT HM, ET AL. Screening for dementia with the memory impairment screen. Neurology. 1999;52:231-238. [ Links ]
7. KUSLANSKY G, BUSCHKE H, KATZ M, SLI- WINSKI M, LIPTON RB. Screening for Alzheimer's disease: the memory impairment screen versus the conventional three-word memory test. J Am Geriatr Soc. 2002;50:1086-1091. [ Links ]
8. PALMER K, BACKMAN L, WINBLAD B, FRATI- GLIONI L. Detection of Alzheimer's disease and dementia in the preclinical phase: population based cohort study. BMJ. 2003;326-245. [ Links ]
9. SLIWINSKI MJ, HOFER SM, HALL C, BUSCHKE H, LIPTON RB. Modeling memory decline in older adults: the importance of preclinical dementia, attrition, and chronological age. Psychol Aging. 2003;18:658-671. [ Links ]
10. LANGE RT, CHELUNE GJ. Application of new WAIS-III/WMS-III discrepancy scores for evaluating memory functioning: relationship between intellectual and memory ability. J Clin Exp Neuropsychol. 2006;28:592-604. [ Links ]
11. GROBER E, LIPTON RB, HALL C, CRYSTAL H. Memory impairment on free and cued selective reminding predicts dementia. Neurology. 2000;54:827-832. [ Links ]
12. TIRADO V, MOTTA M, AGUIRRE-ACEVEDO DC, PINEDA DA, LOPERA F. Analysis of intrusive errors in a memory test as possible pre-clinical marker of familial Alzheimer disease, in E280A presenilin-1 mutation carrier. Rev.Neurol. 2088;47:290-294. [ Links ]
13. DELIS DC, FREELAND J, KRAMER JH, KAPLAN E. Integrating clinical assessment with cognitive neuroscience: construct validation of the California Verbal Learning Test. J Consult Clin Psychol. 1988;56:123-130. [ Links ]
14. BOHM P, PEÑA-CASANOVA J, MANERO RM, TERRÓN C, GRAMUNT N, BADENAS S. Preliminary data on discriminative validity and normative data for a Spanish version of the Memory Impair ment Screen (MIS). Int Psychogeriatr. 2003;15(Suppl2):248. [ Links ]
15. PEÑA-CASANOVA H. Memory Impairment Screen (MIS) vs memoria de textos como prueba de screening para demencia tipoAlzheimer (DTA). Neurología. 2003;18:632. [ Links ]
16. BACKMAN L, SMALL BJ. Influences of cognitive support on episodic remembering: tracing the process of loss from normal aging to Alzheimer's disease. Psychol Aging. 1998;13:267-276. [ Links ]
17. BUSCHKE H, SLIWINSKI MJ, KUSLANSKY G, KATZ M, VERGHESE J, LIPTON RB. Retention weighted recall improves discrimination of Alzheimer's disease. J Int Neuropsychol Soc. 2006;12:436-440. [ Links ]
18. LINN RT, WOLF PA, BACHMAN DL, KNOEFEL JE, COBB JL, BELANGER AJ, ET AL. The 'preclinical phase' of probable Alzheimer's disease. A 13-year prospective study of the Framingham cohort. Arch Neurol. 1995;52:485-490. [ Links ]
19. LIPTON RB, KATZ MJ, KUSLANSKY G, SLI-WINSKI MJ, STEWART WF, VERGHESE J, ET AL. Screening for dementia by telephone using the memory impairment screen. J Am Geriatr Soc. 2003; 51: 1382-1390. [ Links ]
20. BÖHM P, PEÑA-CASANOVA J, MANERO RM, TERRÓN C, GRAMUNT N, BADENAS S. Versión española del Memory Impairment Screen (MIS): datos normativos y de validez discriminativa. Rev Neurol. 2005;20:402-411. [ Links ]
21. ROJAS G. Versión Argentina del memory impairment screen (MIS) y métodos de detección en demencia: análisis comparativo de curvas ROC. Revista Neurológica Argentina. 2008;33:33-39. [ Links ]
22. PEÑA-CASANOVA H. Memory Impairment Screen (MIS) vsmemoria de textos como prueba de screening para demencia tipoAlzheimer (DTA). Nev Neurol. 2003;18: 632. [ Links ]
23. GREENAWAY MC, LACRITZ LH, BINEGAR D, WEINER MF, LIPTON A, MUNRO C. Patterns of verbal memory performance in mild cognitive impairment, Alzheimer disease, and normal aging. Cogn Behav Neurol. 2006;19:79-84. [ Links ]
24. EBERT P, ANDERSON N. Proactive and retroactive interference in young adults, healthy older adults, and older adults with amnestic mild cognitive impairment. Journal of the International Neuropsychological Society. 2009;15:83-93. [ Links ]
25. RIBEIRO F, GUERREIRO M, DE MA. Verbal learning and memory deficits in Mild Cognitive Impairment. J Clin Exp Neuropsychol. 2007;29:187-197. [ Links ]
26. LANGE KL, BONDI MW, SALMON DP, GALASKO D, DELIS DC, THOMAS RG, ET AL. Decline in verbal memory during preclinical Alzheimer's disease: examination of the effect of APOE genotype. J Int Neuropsychol Soc. 2002;8:943-955. [ Links ]
27. BACKMAN L. Memory and cognition in preclinical dementia: what we know and what we do not know. Can J Psychiatry. 2008;53:354-360. [ Links ]
28. P ÉREZ-MARTÍNEZ DA, BAZTÁN JJ, GONZÁLEZ-BECERRA M, SOCORRO A. Evaluación de la utilidad diagnóstica de una adaptación española del Memory Impairment Screen de Buschke para detectar demencia y deterioro cognitivo. Rev Neurol. 2005;40:644-648. [ Links ]
29. BUSCHKE H. Detecting Memory Impairment. In: SLAN Congress. Buenos Aires, Argentina. 2006. [ Links ]
30. MENOR J, PERAITA H, ELOSÚA R. Características generales y diferenciales de los trastornos cognitivos leves en el envejecimiento normal y en la Enfermedad de Alzheimer. In S.A.Trotta (Ed.), Trastornos de la Memoria en la Enfermedad de Alzheimer. 2001: 13-27. [ Links ]
31. VERGHESE J, BUSCHKE H, KUSLANSKY G, KATZ MJ, WEIDENHEIM K, LIPTON RB, ET AL. Antemortem memory impairment screen performance is correlated with postmortem Alzheimer pathology. J Am Geriatr Soc. 2003;51:1043-1045. [ Links ]
32. American Psychiatric Association Diagnostic and Statistical Manual of Mental Disorders. (4 ed.) DSM- IV; Washington; 1994. [ Links ]
33. FOLSTEIN MF, FOLSTEIN SE, MCHUGH PR. Mini-Mental State. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975;12:189-198. [ Links ]
34. AUER S, REISBER B. The GDS/FAST staging system. Int Psychogeristr. 1997;9:167-171. [ Links ]
35. PETERSEN RC, SMITH GE, WARING SC, IVNIK RJ, TANGALOS EG, KOKMEN E. Mild cognitive impairment: clinical characterization and outcome. Arch.Neurol. 1999;56:303-308. [ Links ]
36. ARDILA A, ROSSELLI M, PUENTE A. Neuropsychological assessment of the spanish speaker. New York. Plenum Press. 1994. [ Links ]
37. COHEN J. Statistical Power Analysis for the Behavioral Sciences. (2nd ed.) Hillsdale, NJ: Erlbaum; 1988. [ Links ]
38. SPSSBase for Windws/1999 NT. London: Prentice Hall; 1998. [ Links ]
39. GraphPad Software, Inc. GraphPad Prism Version 4.0. para Windows xp® 2003. [ Links ]
40. MARTÍN-CARRASCO M, BULBENA-VILARRASA M. Diagnóstico precoz de la Enfermedad de Alzheimer. Psiquiatr Biol. 2003;10:119-32. [ Links ]
41. NAGY Z, HINDLEY NJ, BRAAK H, BRAAK E, YILMAZER-HANKE DM, SCHULTZ C, ET AL. The progression of Alzheimer's disease from limbic regions to the neocortex: clinical, radiological and pathological relationships. Dement Geriatr Cogn Disord. 1999;10:115-120. [ Links ]
42. BRAAK H, BRAAK E. Alzheimer's disease affects limbic nuclei of the thalamus. Acta Neuropathol. 1991;81:261-268. [ Links ]
43. ARANGO-LASPRILLA JC, CUETOS F, VALENCIA C, URIBE C, LOPERA F. Cognitive changes in the preclinical phase of familial Alzheimer's disease. J Clin Exp Neuropsychol. 2007;29:892-00900. [ Links ]
44. TULVING E. Episodic memory: from mind to brain. Annu Rev Psychol. 2002;53:1-25. [ Links ]
45. BUSCHKE H, SLIWINSKI MJ, KUSLANSKY G, LIPTON RB. Diagnosis of early dementia by the Double Memory Test: encoding specificity improves diagnostic sensitivity and specificity. Neurology. 1997;48:989-997. [ Links ]
46. ESTÉVEZ-GONZÁLEZ A, KULISEVSKY J, BOLTES A, OTERMIN P, GARCIA-SANCHEZ C. Rey verbal learning test is a useful tool for differential diagnosis in the preclinical phase of Alzheimer's disease: comparison with mild cognitive impairment and normal aging. Int J Geriatr Psychiatry. 2003;18:1021-1028. [ Links ]
47. RAPP MA, REISCHIES FM. Attention and executive control predict Alzheimer disease in late life: Results from the Berlin Aging Study (BASE). Am J Geriatr Psychiatry. 2005;13:134-141. [ Links ]
48. SMALL BJ, HERLITZ A, FRATIGLIONI L, ALMKVIST O, BACKMAN L. Cognitive predictors of incident Alzheimer's disease: a prospective longitudinal study. Neuropsychology. 1997;11:413-420. [ Links ]
49. TULVING E, THOMSON D. Encoding specificity and retrieval processes in episodic memory. Psychological Review. 1973;80:352-373. [ Links ]
50. GABRIELI JD, KEANE MM, STANGER BZ, KJELGAARD MM, CORKIN S, GROWDON JH. Dissociations among structural-perceptual, lexical-semantic, and event-fact memory systems in Alzheimer, amnesic, and normal subjects. Cortex. 1994;30:75-103. [ Links ]
51. TIERNEY MC, SZALAI JP, SNOW WG, FISHER RH, NORES A, NADON G, ET AL. Prediction of probable Alzheimer's disease in memory-impaired patients: A prospective longitudinal study. Neurology. 1996;46:661-665. [ Links ]