Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.27 no.1 Bogotá Jan./Mar. 2011
Coriorretinitis por Toxoplasma gondii en contexto de un síndrome de reconstitución inmunológica inflamatorio en un paciente con síndrome de inmunodeficiencia adquirida SIDA
Chorioretinitis by Toxoplasma Gondii in context of immune reconstitution inflammatory syndrome in an AIDS patient
Francisco Bernal-Cano, MD, Jorge O Suárez, MD, MSc, Carlos A. Álvarez, M.D, MSc, DTHM Ellen Lowenstein, MD, Sandra L. Valderrama, MD, Carlos H. Gómez, MD, Jose R. Tamara, MD. Unidad de Infectología. Hospital Universitario San Ignacio. Bogotá D.C., Colombia.
Correspondencia: bernal.f@javeriana.edu.co
Recibido: 14/06/10. Revisado: 14/07/10. Aceptado: 07/02/11.
RESUMEN
El síndrome de reconstitución inmunológica inflamatorio (SRII) en pacientes con infección por el virus de inmunodeficiencia humana (VIH), es una entidad clínica rara caracterizada por un aumento de linfocitos T CD4+ (CLTCD4+) y disminución de la carga viral servirá del VIH, que aparece corto tiempo después de iniciar terapia antirretroviral de gran actividad (TARGA). Usualmente se manifiesta con un deterioro paradójico del estado del paciente secundario a una reactivación de procesos infecciosos oportunistas.
Caso clínico: hombre con diagnóstico de toxoplasmosis cerebral en el curso de infección por VIH, quien posterior al inicio de la TARGA desarrollo coriorretinitis. El paciente experimento mejoría poco tiempo después de haber suspendido la TARGA y de administrar esteroides.
Conclusión: La incidencia del SRII ha aumentado en los pacientes VIH que cursan con alta carga antigénica y CLTCD4+ bajo. Su patofisiología genera incertidumbre debido a que los biomarcadores diagnósticos y pronósticos no se conocen del todo. El tratamiento propuesto lo constituye en algunos casos la suspensión temporal de la TARGA con administración de esteroides, no obstante es necesaria la realización de más estudios.
Palabras claves. Coriorretinitis; VIH; Síndrome de inmunodeficiencia humana; Síndrome de reconstitución inmunológica inflamatoria; Terapia antirretroviral de gran actividad; Toxoplasmosis (DeCS).
SUMMARY
Immune reconstitution inflammatory syndrome (IRIS) in context of severe immunosupression secondary to human immunodeficiency virus (HIV), is characterized by a dramatic rise of T lymphocyte CD4+ count in addition to a HIV viral load drop in, typically it is manifested by a paradoxical clinical impairment due to reactivation opportunistic of infectious processes previously under immune surveillance.
A 36 years old male with cerebral toxoplasmosis in context of HIV infection developed chorioretinitis 8 weeks after commencing HAART. Workup laboratories only showed a marked T Lymphocyte CD4+ count increase with a HIV viral load lower than 40 copies/ml and other possible causes of chorioretinitis were excluded. After cessation of HAART and establishing corticosteroid therapy clinical improvement of this condition was documented.
IRIS incidence has increased among AIDS patients especially with high antigenic burden and very low CD4 + T lymphocyte count. However its mechanism is still unclear due to biomarkers for diagnosis and prognosis are not completely known at all. In order to validate and refine diagnostic criteria and therapeutic approaches of IRIS more studies are needed.
Key Words. Acquired Immunodeficiency Syndrome; Antiretroviral Therapy, Highly Active; Chorioretinitis; HIV;Immune Reconstitution Inflammatory Syndrome; Toxoplasmosis (MeHS).
INTRODUCCIÓN
Hasta 40% de los pacientes con SIDA presentan lesiones retinianas infecciosas (1,2). Un alto porcentaje de pacientes con SIDA y toxoplasmosis presenta compromiso retiniano (3-7). La introdcucción de la terapia antirretroviral de alta efectividad (TARGA) ha disminuido la mortalidad de los enfermos de SIDA y se ha asociado con el síndrome de reconstitución inmune (8).
Presentación del caso. Paciente masculino de 36 años con diagnóstico reciente de toxoplasmosis cerebral e infección por VIH, con CLTCD4+ de 22 células/μL y carga viral para VIH en suero mayor de 100.000 copias/ml, inicio tratamiento antibiótico con trimetoprim-sulfametoxazol 320/160mg cada 8 horas por 6 semanas, con mejoría de los síntomas, dos meses después recibió terapia antirtetroviral de gran actividad (TARGA) con: ritonavir, atazanavir, tenofovir y emtricitabina. Siete semanas después asistió de nuevo a urgencias del Hospital Universitario San Ignacio por cuadro clínico de una semana de evolución de visión borrosa. Los únicos hallazgos anormales al examen físico lo constituyeron una agudeza visual de bilateral 20/200, opacidad de medios transparentes de ambos ojos, bordes mal definidos del disco óptico derecho y dilatación con severa tortuosidad del sistema venoso retiniano bilateral. Con base en lo anterior se propuso el diagnóstico de corioretinitis probablemente asociada a infección por citomegalovirus (CMV) versus toxoplasmosis, (Figura 1), después de solicitar exámenes para diagnósticos diferenciales: hemograma, CLTCD 4+, CD8+, prueba de reagina plasmática rápida (RPR), panel de anticuerpos antinucleares (ANAS), calcio sérico, análisis de liquido cefalorraquideo (LCR) con reacción en cadena de la polimerasa (PCR) para detección de CMV, virus varicella zoster (VZV), Toxoplasma gondii, virus Epstein Barr (EBV) y citología. Se formuló valganciclovir para iniciarlo tan pronto se realizara la punción lumbar. Por razones no claras el paciente después de haberse realizado los exámenes no inicio el tratamiento con valganciclovir y suspendió la TARGA. 45 días después asistió a control de infectología manifestando mejoría sostenida de la agudeza visual y dio a conocer los reportes de los estudios solicitados: hemograma con leucopenia, RPR no reactivo, ANAS 1/80 patrón moteado, CLTCD4+ 144 células/μL, carga viral en suero para VIH menor de 40 copias/ml, PCR en LCR para CMV, EBV, VZV, bacilo tuberculoso y Toxoplasma gondii negativa. El examen oftalmológico aunque continuó mostrando opacidad de medios transparentes con bordes mal definidos del nervio óptico derecho, lesiones hipopigmentadas perivasculares y envainamiento venoso bilateral, en general mostró mejoría con respecto al examen previo (Figura 2). Se concluyó que estos hallazgos fueron compatibles con vasculitis bilateral secundaria a un síndrome de reconstitución inmunológica inflamatoria en el contexto de toxoplasmosis recientemente tratada. Se decidió iniciar prednisolona via oral 50mg dia por 2 semanas con posterior disminución gradual a 1 mg día y 30 días después reinicio de la misma TARGA con trimetoprim-sulfametoxazola dosis de 160/800mg 3 dosis por semana. El paciente continuó con mejoría clínica de su agudeza visual y su siguiente CLTCD4+ fue de 153 células/μL, manteniendo la carga viral para VIH en rango no detectable.
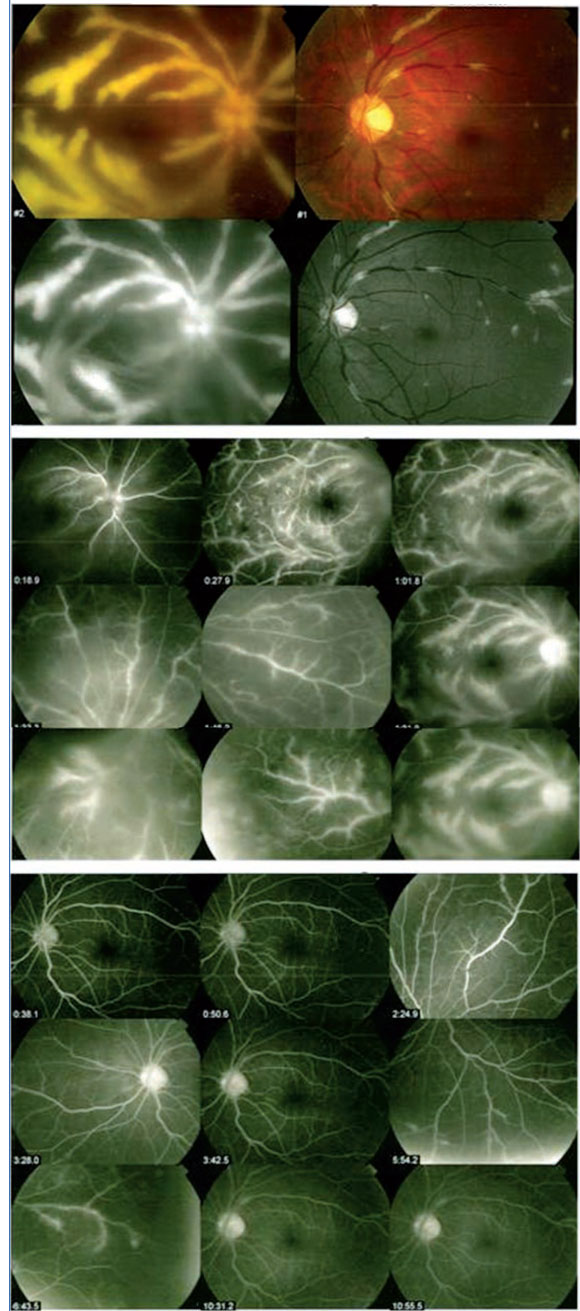
FIGURA 1. Descripción de fondo de ojo. Los segmentos a color muestran bordes discales mal definidos en ojo derecho (OD) y bien definidos en el ojo izquierdo (OI), coloración amarillo naranja de la papila con palidez temporal en OI. En el polo posterior de OD se aprecia dilatación y leve tortuosidad con envainamiento venoso generalizado. En OI se aprecia envainamiento vascular pero en menor grado. Los segmentos libre de rojo muestran ll enamiento homogéneo del contraste observándose hiperfluorescencia transmitida peripapilar por esclerosis coroidea. En ambos ojos se aprecia escape periflebitico mas intenso en OD. Se aprecian áreas de no perfusión capilar retiniana en la media periferia de OD. En las fases medias y tardías se aprecia aumento de la fluorescencia en disco óptico de OD.
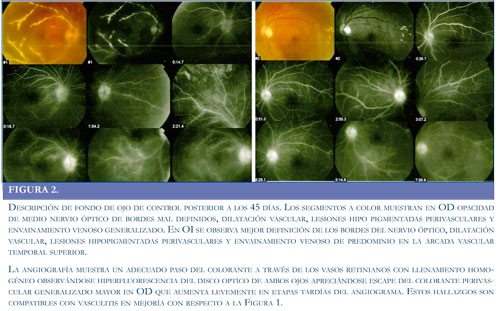
Descripción de fondo de ojo de control posterior a los 45 días. Los segmentos a color muestran en OD opacidad de medio nervio óptico de bordes mal definidos, dilatación vascular, lesiones hipo pigmentadas perivasculares y envainamiento venoso generalizado. En OI se observa mejor definición de los bordes del nervio óptico, dilatación vascular, lesiones hipopigmentadas perivasculares y envainamiento venoso de predominio en la arcada vascular temporal superior. La angiografía muestra un adecuado paso del colorante a través de los vasos retinianos con llenamiento homogéneo observándose hiperfluorescencia del disco optico de ambos ojos apreciándose escape del colorante perivascular generalizado mayor en OD que aumenta levemente en etapas tardías del angiograma. Estos hallazgos son compatibles con vasculitis en mejoría con respecto a la Figura 1.
DISCUSIÓN
En los pacientes con diagnóstico de SIDA las manifestaciones oculares secundarias al compromiso de cualquiera de las estructuras del segmento posterior del ojo se presentan en más del 40% de los casos (1, 2). La coriorretinitis secundaria solamente al VIH y a la infección por CMV son las causas infecciosas más comunes seguidas por las causadas por varios microorganismos tales como virus de la familia herpes, Toxoplasma Gondii, Treponema pallidum, Pneumocistis Jirovecci y criptococo, entre otros. El daño retiniano que generalmente termina en necrosis se atribuye principalmente al efecto citopático directo sobre el endotelio vascular, depósito de complejos inmunes, acción del complemento y liberación de interleucinas secundaria a una perdida de la regulación del sistema inmunológico local (3). En el caso de la infección por Toxoplasma gondii, la coriorretinitis representa entre el 28 al 50% de todos los casos de uveitis posterior (4). El acceso del Toxoplasma gondii a la retina y al cerebro se realiza a través del libre transporte por el plasma partiendo del lumen intestinal o por transferencia leucocitaria hacia el endotelio. Los estudios experimentales han demostrado la afinidad de los monocitos CD11b y de las células dendríticas por el taquizoito el cual al tener contacto con las células endoteliales genera lisis mediada por lisosomas ocasionando inflamación y necrosis; ambos fenómenos potenciados por la actividad citotóxica de los linfocitos T cuando entran en contacto con los antígenos del gérmen (5). En pacientes inmunocompetentes el compromiso ocular por toxoplasmosis es autolimitado y usualmente las lesiones mejoran entre la 6 y 8 semanas posteriores al inicio de los síntomas: visión borrosa, escotomas, dolor y fotofobia. El examen oftalmológico puede revelar lesiones multifocales bilaterales de predominio en el polo posterior, vitreitis que puede estar acompañada de uveítis anterior y neovascularizacion (6). Desafortunadamente, la recurrencia es frecuente y se atribuye a la reactivación de los quistes tisulares en el contexto de disfunción inmunológica celular o daño directo del sistema humoral entre otros (7).
Con el advenimiento de la TARGA se ha generado una importante disminución de la frecuencia de infecciones oportunistas entre los pacientes con infección por VIH, lo que se ha reflejado en reducción de la mortalidad asociada a estas patologías. Sin embargo; un subgrupo de pacientes que recibe TARGA puede presentar un deterioro paradójico a pesar de lograr un control satisfactorio sobre la replicación del VIH y un aumento en el CLTCD4+. Este escenario clínico conocido como síndrome de reconstitución inmunológico (SRII) es el resultado de una respuesta inflamatoria excesiva dirigida generalmente contra antígenos de procesos infecciosos con estabilidad clínica y usualmente ocurre cuando el CLTCD4+ de base se encuentra por debajo de 100 células/μL (8). Entre las manifestaciones clínicas del SRII sobresalen exacerbaciones de toxoplasmosis, tuberculosis, linfadenitis secundaria al complejo Mycobacterium avium, criptococosis meníngea y leucoencefalopatia multifocal progresiva entre otros (9, 10).
Alrededor del 25 al 35% de los pacientes con infección por VIH que inician TARGA desarrollan un SRII, el cual se presenta en la mayoría de los casos dentro de los primeros 60 días de tratamiento (11-13). Actualmente no existe un consenso estandarizado acerca de la definición y diagnóstico del SRII, sin embargo; las definiciones propuestas por grupos de expertos incluyen los siguientes criterios: (10-13) caso confirmado de infección por VIH, asociación temporal entre el desarrollo de SRII y el inicio de TARGA, respuesta clara del huésped al inicio de TARGA, representada en un incremento del CLT CD4+ y supresión de la carga viral del VIH en suero al menos 1 log10, deterioro clínico caracterizado por un proceso inflamatorio, exclusión de otras causas que puedan generar un escenario clínico similar y de otras causas tales como: resistencia o toxicidad asociada a la TARGA, mal absorción de los medicamentos, falta de adherencia al tratamiento, súper infección por otros patógenos, terapia antimicrobiana inadecuada del proceso infeccioso preexistente y desarrollo de complicaciones no infecciosas.
Antes de la llegada de la TARGA la retinitis por CMV era diagnosticada en estadios de inmunosupresión severa usualmente con CLTCD4 + por debajo de 50 células/μL y las manifestaciones clínicas comprendían reacciones inflamatorias leves en la cámara anterior y en el humor vítreo. La ausencia de vitreitis franca era explicada en parte por la escasez de LTCD4+ circulantes en el humor acuoso (14), pero al iniciarse la TARGA el compromiso ocular por CMV puede generar un proceso inflamatorio sustancial denominado uveítis por recuperación inmunológica (URI) estrechamente relacionado con una recuperación del estado inmunológico. Entre los hallazgos patológicos de esta entidad se mencionan vitreitis moderada a severa, edema macular, formación de membranas epiretinianas neovascularizacion de la retina o del disco óptico y sinequias (15, 16). El paciente presentó corioretinitis cuya fisiopatología podría compartir los mismos mecanismos de la uveítis por recuperación inmunológica. El antecedente reciente de toxoplasmosis supone la presencia de antígenos circulantes que potencialmente tienen la capacidad de generar una respuesta inflamatoria en el contexto de un rápido aumento de los CLTCD4+ posterior al inicio de TARGA. Varios reportes sugieren que la suspensión transitoria de la TARGA con el inicio de corticosteroides puede mejorar el pronóstico de la enfermedad (17-19) se ha demostrado que la continuación de tratamiento antitoxoplasma en este estado inmunológico no es necesaria ya que la población celular T disponible podría contrarrestar la progresión del compromiso oftalmológico (14,17).
CONCLUSIÓN
La historia natural del SIDA ha cambiado desde la introducción de la TARGA con lo cual ha disminuido la incidencia y morbimortalidad de infecciones oportunistas gracias a la recuperación del sistema inmunológico. No obstante, en ocasiones el restablecimiento de la función inmune puede llevar a un SRII cuya incidencia ha aumentado especialmente entre los pacientes que cursan con una alta carga antigénica y CLTCD4 + bajo. Aunque la manifestación ocular mas frecuente del SRII es la URI asociada a CMV el fenómeno de coriorretinitis también puede observarse en contexto de infección por otros agentes como se demostró en este caso. Desafortunadamente la fisiopatología del SRII aún genera muchos interrogantes debido a que los biomarcadores para su diagnóstico y pronóstico no se conocen del todo. El tratamiento propuesto hasta el momento lo constituye en algunos casos la suspensión temporal de la TARGA o la administración de esteroides pero es necesaria la realización de más estudios con el fin de validar y refinar los criterios diagnósticos y las pautas de tratamiento para esta entidad.
REFERENCIAS
1. Lewallen S, Courtright P. HIV and AIDS and the eye in developing countries. Arch Ophthalmol 1997;115:1291-1295. [ Links ]
2. Holland GN. AIDS and Ophthalmology: The First Quarter Century American. J Ophthalmol 2008;145:397-408. [ Links ]
3. Pérez-Blázquez EE, Redondo M, García T. AIDS and ophthalmology: a contemporary view. An Sist Sanit Navar 2008;31(Suppl 3):69-81. [ Links ]
4. Gilbert RE, Dunn DT, Lightman S. Incidence of symptomatic toxoplasma eye disease: aetiology and public health implications. Epidemiol Infect 1999;123:283-289. [ Links ]
5. Courret N, Darche S, Sonigo P. CD11c and CD11b-expressing mouse leukocytes transport single Toxoplasma gondii tachyzoites to the brain. Blood 2006; 107:309-316. [ Links ]
6. Commodaro AG, Belfort RN, Rizzo LV, Muccioli C, Silveira C, et al. Ocular toxoplasmosis: an update and review of the literature. Mem Inst Oswaldo Cruz. 2009;104:345-350. [ Links ]
7. Vallochi AL, Goldberg AC, Falcai A, Ramasawmy R, Kalil J, Silveira C et al. Molecular markers of susceptibility to ocular toxoplasmosis, host and guest behaving badly. Clin Ophthalmol 2008;2:837-848. [ Links ]
8. Beatty GW. Immune reconstitution inflammatory syndrome. Emerg Med Clin North Am 2010;28:393-407. [ Links ]
9. Müller M, Wandel S, Colebunders R, Attia S, Furrer H, Egger M; IeDEA Southern and Central Africa. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a systematic review and meta-analysis. Lancet Infect Dis 2010;10:251-261. [ Links ]
10. Tsang CS, Samaranayake LP. Immune reconstitution inflammatory syndrome after highly active antiretroviral therapy: a review. Oral Dis 2010;16:248-256. [ Links ]
11. Müller M, Wandel S, Colebunders R, Attia S, Furrer H, Egger M. Immune reconstitution inflammatory syndrome in patients starting antiretroviral therapy for HIV infection: a systematic review and metaanalysis. Lancet Infect Dis 2010;10:251-261. [ Links ]
12. French MA, Price P, Stone SF. Immune restoration disease after antiretroviral therapy. AIDS 2004;18:1615-1627. [ Links ]
13. Ratnam I, Chiu C, Kandala NB, Easterbrook PJ. Incidence and risk factors for immune reconstitution inflammatory syndrome in an ethnically diverse HIV type 1-infected cohort. Clin Infect Dis 2006;42:418-427. [ Links ]
14. Goldberg DE, Smithen LM, Angelilli A, Freeman WR. HIV-associated retinopathy in the HAART era. Retina 2005;25:633-649. [ Links ]
15. Zegans ME, Walton RC, Holland GN. Transient vitreous inflammatory reactions associated with combination antiretroviral therapy in patients with AIDS and cytomegalovirus retinitis. Am J Ophthalmol 1998;125:292-300. [ Links ]
16. Karavellas MP, Lowder CY, Macdonald JC. Immune recovery vitritis associated with inactive cytomegalovirus retinitis: A new syndrome. Arch Ophthalmol 1998;116:169-175. [ Links ]
17. Zeller V, Truffot C, Agher R, et al. Discontinuation of secondary prophylaxis against disseminated Mycobacterium avium complex infection and toxoplasmic encephalitis. Clin Infect Dis 2002;34:662-667. [ Links ]
18. French MA, Price P, Stone SF. Immune restoration disease after antiretroviral therapy. AIDS 2004;18:1615-1627. [ Links ]
19. Sendi P, Sachers F, Drechsler H, Graber P. Immune recovery vitritis in an HIV patient with isolated toxoplasmic retinochoroiditis. AIDS 2006;20:2237-2238. [ Links ]