Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.27 no.3 Bogotá Sept./Nov. 2011
Impacto de las pruebas rutinarias en el diagnóstico de los pacientes con quejas cognitivas
Impact of routine testing in the diagnosis of patients with cognitive complaints
Mauricio Rueda-Sánchez. Neurólogo, Centro Médico Clínica Bucaramanga, Bucaramanga.
Correo electrónico: maorueda@hotmail.com.
Recibido: 2/05/11. Revisado: 16/05/11. Aceptado: 4/06/11.
RESUMEN
Introducción: se recomienda realizar pruebas diagnósticas a los pacientes con quejas cognitivas; sin embargo, el rendimiento de éstas no se ha evaluado.
Objetivo: determinar el rendimiento estimado de las pruebas diagnósticas en pacientes con demencia y déficit cognoscitivo mínimo.
Materiales y Métodos: se evaluaron neuroimagenes, electroencefalograma, hemograma, VSG, VDRL, glicemia, creatinina, transaminasas, tiempo de protrombina, perfil lipídico, sodio, calcio, niveles séricos de vitamina B12 y ácido fólico y TSH; y se evaluó si las pruebas cambiaron el diagnóstico inicial. Se calculó el rendimiento diagnóstico estimado para cada prueba. Se estimó la razón de disparidad (OR) para evaluar la asociación de las variables estudiadas con patología vascular o neuroimágenes anormales.
Resultados: se incluyeron 97 de 229 pacientes con demencia y 40 de 160 pacientes con trastorno cognitivo. El rendimiento estimado de los exámenes diagnósticos varía entre el 0% (encefalograma, creatina, tiempo de protrombina, HDL, triglicéridos y niveles séricos de ácido fólico) y el 40,5% (Resonancia magnética). No hay diferencias en el rendimiento estimado entre pacientes con demencia y deterioro cognitivo leve. La glicemia, el colesterol total, el LDL, el género, los antecedentes de diabetes mellitus, hipertensión o hipercolesterolemia no estuvieron asociados a patología vascular nueva o neuroimágenes anormales.
Conclusiones: el rendimiento de pruebas diagnósticas es similar en pacientes con deterioro cognitivo leve y demencias. No se detectó ninguna variable predictora de patología vascular o neuroimágenes anormales, en la muestra estudiada.
PALABRAS CLAVES. Demencia, Enfermedad de Alzheimer, Deterioro Cognitivo Leve (DCL), Diagnóstico por Imagen, Pruebas Diagnósticas de Rutina (DeCS).
SUMMARY
Introduction: it is recommended to achieve diagnostic test to the patients with cognitive complaints; however, the yield of these tests has not been evaluated.
Objective: to determine the estimated yield of the diagnostic tests in patient with cognitive complaints, in patiens with dementia and subjects with mild cognitive impairment.
Materials and methods: the efficiency of, electroencephalogram, complete blood count, VDRL, glucose, creatinine, aminotransferases, prothrombin time, lipid profile, sodium, calcium, serum vitamin B12 and folic acid and TSH; and it was evaluated if the tests changed the initial diagnosis. The estimated diagnostic yield was calculated for each test. Odds ratio was used in order to evaluate the association of the variables studied with vascular pathology or abnormal images.
Results: 97 out of 229 patients with dementia and 40 out of 97 with mild cognitive impairment were included. The estimated yield of the diagnostic test were 0% (electroencephalogram, creatinine, prothrombin time, HDL, triglycerides and serum folic acid) and 40,5% (Magnetic Resonance). There ware no differences in the estimated yield among patient with dementia and mild cognitive impairment. The glucose, total cholesterol, LDL, sex, medical history of diabetes mellitus, hypertension or hipercholesterolemia did not were associated to new vascular pathology or abnormal images.
Conclusions: the yield of diagnostic tests is similar in patient with mild cognitive impairment and dementia. It was not detected any predict variable of vascular pathology or abnormal images, in these patients.
KEY WORDS. Dementia, Alzheimer Disease, Electroencephalography, Diagnostic Tests, Routine, Memory (MeSH).
INTRODUCCIÓN
La demencia tipo Alzheimer tiene una prevalencia del 3% entre personas de 65 a 75 años y llega hasta el 47% para mayores de 85 años (1) genera gran discapacidad y costos para el individuo, la familia y la sociedad. La mayoría de las demencias son debidas a enfermedades neurodegenerativas como la enfermedad de Alzheimer (2, 3); sin embargo, entre el 9-23% de las demencias son causadas por enfermedades para las cuales existen tratamientos etiológicos o son prevenibles (4-7); adicionalmente, el 20.3% tienen una etiología vascular, la cual es potencialmente prevenible (7). Considerando las consecuencias de las demencias, se recomienda descartar enfermedades tratables y prevenibles mediante una serie de pruebas diagnósticas (8); sin embargo, el rendimiento de éstas solo se ha evaluado en pocos estudios (3). El rendimiento estimado de una prueba diagnóstica es el porcentaje de pacientes a quienes se les aplicó la prueba y cuyo resultado cambia el diagnóstico o pronóstico.
El deterioro cognitivo leve (DCL) es un síndrome que puede presentar déficit cognitivos más allá de lo que se esperaría para la edad y el nivel cultural del paciente y que no cumple los criterios diagnósticos de demencia; en la hipótesis del continuum cognitivo, el DCL representa un estado intermedio entre la declinación cognitiva propia de la edad y la demencia (9-10).
El objetivo de este estudio fue determinar el rendimiento diagnóstico estimado de las pruebas diagnósticas entre pacientes que consultan al neurólogo con quejas cognitivas, establecer su utilidad en etapas evolutivas tempranas (DCL) y tardías (demencia) y determinar las variables predictoras de resultados anormales de neuroimágenes o patología vascular.
MATERIAL Y MÉTODOS
Se realizó un estudio de impacto diagnóstico (Before-after study) en una población de pacientes referidos a un consultorio de neurología general para evaluación de problemas cognitivos en el cual los pacientes, después de una evaluación tal cual se realiza en la práctica clínica, fueron diagnosticados como demencia o DCL; después se les realizó una serie de exámenes diagnósticos y finalmente se evaluó si la prueba diagnóstica cambió el diagnóstico inicial.
Población a estudio: la población consistió en todos los pacientes referidos a un consultorio de neurología general para evaluación de trastornos cognitivos entre junio de 2006 y febrero de 2011. Mediante un muestreo por conveniencia, se incluyeron todos los pacientes con intención de diagnosticar con sospecha diagnóstica inicial de demencia tipo Alzheimer o DCL. Se consideró el diagnóstico de demencia tipo Alzheimer de acuerdo a los criterios diagnósticos del DSM IV-TR (11); en esencia, el paciente debe tener deterioro de memoria y alguna otra alteración cognoscitiva que causan un deterioro funcional significativo con un curso progresivo. El diagnóstico de DCL se estableció de acuerdo a los criterios modificados de Petersen (12); brevemente, el paciente debe tener una queja de memoria u otra queja cognitiva, documentarse en el examen neurológico las alteraciones en la memoria u otra alteración cognitiva, pero no tener demencia ni compromiso en las actividades de la vida diaria. Se excluyeron a los pacientes referidos para tratamiento, seguimiento u otras indicaciones diferentes a la intención de diagnosticar. Se excluyeron los pacientes con encefalopatía metabólica que explicara el trastorno cognitivo.
Exámenes diagnósticos estudiados: los exámenes solicitados a todos los pacientes incluyeron una neuroimagen (tomografía axial computarizada o resonancia magnética cerebral), electroencefalograma (EEG), cuadro hemático, velocidad de sedimentación globular, VDRL, glicemia, creatinina, transaminasas (SGOT y SGPT), tiempo de protrombina, colesterol total, LDL, HDL, triglicéridos, sodio, calcio, niveles séricos de vitamina B12 y ácido fólico y TSH. Todos los exámenes, incluyendo el EEG, el calcio y las pruebas de función hepática, se solicitaron con la intensión de diagnosticar enfermedades tratables o prevenibles que pudieran estar causando las quejas cognitivas independientemente que se sospechara epilepsia, hipercalcemia o hepatopatía (independientemente de la probabilidad previa al examen de tener un resultado positivo o negativo); en el caso del perfil lipídico, la indicación fue diagnosticar una comorbilidad frecuente en este grupo de población y posible factor de riesgo.
Impacto diagnóstico: se consideró que un examen era positivo si, y solo sí, se cambió el diagnóstico como consecuencia del resultado del examen; por ejemplo, una glicemia mayor de 126 mg/dl se consideraba positiva si, y solo sí se establecía un diagnóstico nuevo de diabetes mellitus; si el paciente ya tenía el diagnóstico de diabetes mellitus, una glicemia mayor de 126 se consideraba como un examen negativo ya que no contribuyó al diagnóstico.
Dado que el objetivo del estudio es determinar el impacto de la información adicional del examen diagnóstico sobre la decisión clínica del médico, los resultados de los exámenes no fueron enmascarados.
Variables de confusión y modificadoras de la agudeza diagnóstica: se consideraron como variables modificadoras de la agudeza diagnóstica del examen y variables de confusión a los antecedentes de diabetes mellitus, hipertensión arterial, hipercolesterolemia o hipotiroidismo, además de variables demográficas como la edad y el sexo. Se consideró que un factor modificaba la agudeza diagnóstica si su presencia alteraba la probabilidad pre-prueba de tener un examen diagnóstico positivo o negativo, por ejemplo la edad joven disminuye la probabilidad pre-prueba de tener enfermedad de Alzheimer o el antecedente de hipotiroidismo aumenta la probabilidad pre-prueba de tener resultados anormales del perfil lipídico. Adicionalmente se consideraron como variables de confusión a los factores de riesgo compartidos por dos o más entidades nosológicas, por ejemplo, el antecedente de diabetes mellitus es un factor de riesgo de enfermedad de Alzheimer pero también es un factor de riesgo de demencia vascular.
Tamaño de muestra: se estima que el 9-23% de los pacientes con demencias tienen alguna patología tratable, para efecto de calcular el tamaño de muestra se asumió una prevalencia promedio de 15%; se consideró un error tipo I del 5% y un poder del estudio del 80%; se consideró una relación 1:2 entre DCL y demencia; se calculó un tamaño de muestra de 48 pacientes con trastorno cognitivo y 97 pacientes con demencia.
Análisis de los resultados: para cada prueba se calculó el rendimiento estimado (estimated yield), es decir el porcentaje de pacientes en el cual el resultado de la prueba cambió el diagnóstico, con el intervalo de confianza del 95%. Mediante la prueba exacta de Fisher se estimaron las diferencias de los rendimientos estimados de las pruebas entre los pacientes con demencias y trastornos cognitivos leves. Los modificadores de la agudeza del test y factores de confusión fueron controlados mediante regresión logística. Se estimaron razones de disparidad (OR) con el intervalo de confianza del 95% entre los pacientes con neuroimágenes positivas y negativas y entre pacientes con y sin diagnóstico nuevo de patología vascular para determinar si alguna variable predecía el resultado anormal de las neuroimágenes o el diagnóstico de patología vascular. Se utilizó el programa estadístico de EPI-Info.
Consideraciones éticas: los pacientes y sus cuidadores consultaron en forma voluntaria con el neurólogo tratante y aceptaron voluntariamente la realización de los procedimientos diagnósticos. Tanto la consulta como los procedimientos diagnósticos fueron realizados en forma rutinaria en el contexto de la práctica neurológica general; ningún procedimiento diagnóstico fue experimental. La obtención e interpretación de la información de los resultados de los procedimientos diagnósticos fue prospectiva pero la agrupación y análisis de los datos fue retrospectiva preservando la confidencialidad de la información.
RESULTADOS
Se estudiaron 229 pacientes con diagnóstico de demencia y 160 pacientes con trastorno cognitivo, de los cuales se incluyeron para este estudio 97 pacientes con demencia y 40 con DCL con intensión de diagnosticar.
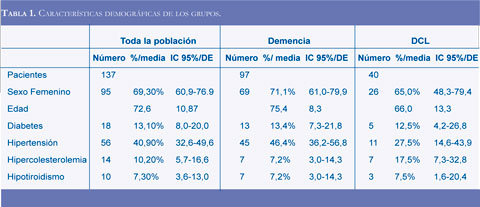
El 69.3% de los pacientes fueron mujeres, con una edad promedio de 72,6 años. El 13.1% de los pacientes tenían antecedente de diabetes mellitus, 40,9% hipertensión arterial, 10,2% hipercoleste-rolemia y 7.3% hipotiroidismo. No se encontraron diferencias significativas entre las características demográficas y comorbilidades entre los pacientes con demencia y DCL (Tabla 1).
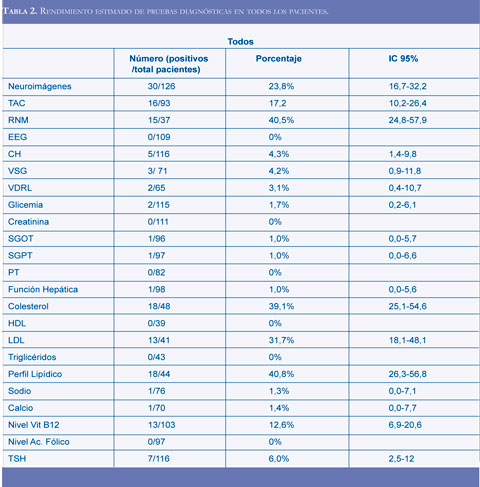
El rendimiento estimado de los exámenes diagnósticos varió entre el 0% (encefalograma, creatina, tiempo de protrombina, HDL, triglicéridos y niveles séricos de ácido fólico) y el 40,5% (Resonancia magnética cerebral) como puede verse en la tabla 2.
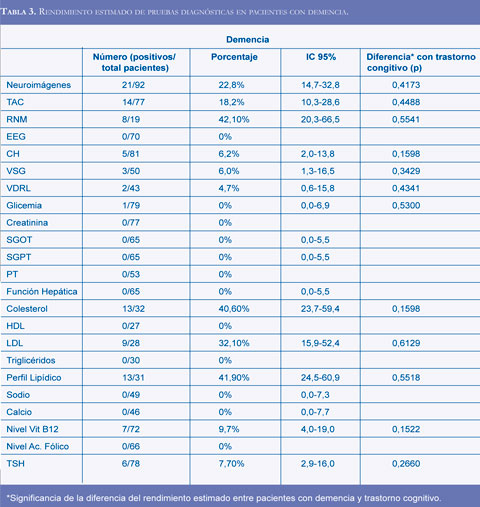
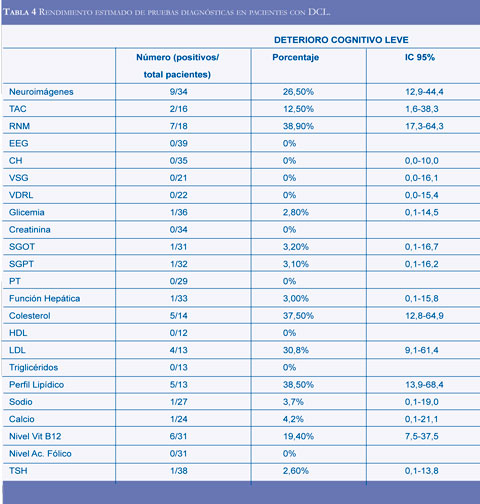
El solapamiento de los intervalos de confianza indica que no hay diferencia estadísticamente significativa en el rendimiento estimado entre pacientes con demencia y pacientes con DCL (Tablas 3 y 4), observación que fue confirmada realizando diferentes modelos de regresión logística sin necesidad de introducir variables de confusión o modificadoras de agudeza diagnóstica.
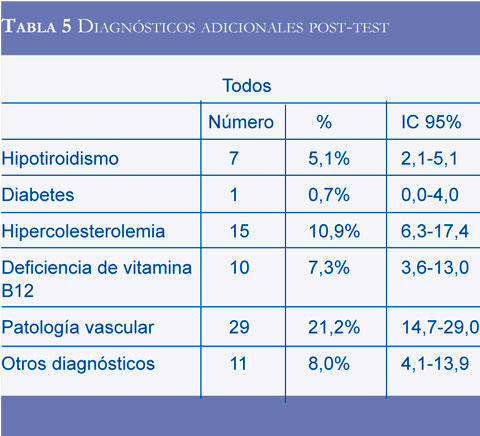
Los diagnósticos nuevos realizados después de los exámenes fueron patología vascular cerebral (infartos lacunares, leucoencefalopatía isquémica subcortical o infartos corticales no detectados previamente), otros diagnósticos (hidrocefalia de presión normal, hipocalcemia, anemia megalobástica, pancitopenia, hiponatremia, hidrocefalia obstructiva, neurosífilis y hepatopatía), deficiencia de vitamina B12, hipercolesterolemia, hipotiroidismo y diabetes mellitus (Tabla 5).
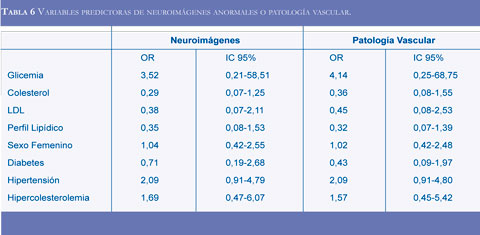
Ninguna variable analizada (glicemia, colesterol total, colesterol LDL, sexo, antecedentes de diabetes mellitus, hipertensión o hipercolesterolemia) fue asociada al resultado de las neuroimágenes o a una patología vascular nueva (Tabla 6).
DISCUSIÓN
Los resultados de este estudio muestran un rendimiento diagnóstico estimado de los diferentes exámenes paraclínicos solicitados en pacientes con trastornos cognitivos que varía entre el 0 y el 40,5% para los diferentes exámenes estudiados.
No encontramos diferencias en las variables demográficas entre los pacientes con demencia y DCL; sin embargo, hay una tendencia de los pacientes con demencia a tener más antecedentes de hipertensión arterial y menor de tener hipercolestero-lemia. La hipertensión arterial ya se ha identificado como factor de riesgo de demencia y enfermedad de Alzheimer (13). La hipercolesterolemia también se ha asociado como factor de riesgo de de enfermedad de Alzheimer pero sólo cuando ocurre 20-30 años antes del inicio de la demencia (1) y actúa como factor protector al inicio de la enfermedad (14) este hecho podría explicar porqué el antecedente de hipercolesterolemia es más frecuente en los pacientes con DCL que con demencia; una hipótesis alterna es un sesgo de selección en el que los pacientes con DCL tengan más antecedentes de hipercolesterolemia porque buscan más atención médica.
Las pruebas diagnósticas con mejores rendimientos fueron las neuroimágenes; las neuroimágenes cambiaron o adicionaron un diagnóstico en el 17,2% de los pacientes a quienes se les solicitó un TAC y el 40,5% de los pacientes a quienes se les solicitó una RM cerebral. Las neuroimágenes en el estudio de un paciente con trastorno cognitivo tienen el propósito de detectar causas tratables o reversibles del trastorno cognitivo, enfermedad cerebrovascular y cambios atróficos (15); la realización del examen se justifica ante la probabilidad de no diagnosticar una hidrocefalia, hematoma subdural o tumor cerebral como causa del trastorno cognitivo, sin embargo, es posible que los hallazgos anormales al examen físico modifiquen la probabilidad pre-prueba de un examen positivo y ayude a seleccionar los pacientes que requieren una neuroimagen y sea una estrategia más costo-efectiva. Las neuroimágenes detectaron enfermedad cerebrovascular en el 21,2% de los pacientes estudiados, una cifra que concuerda con la reportada en la literatura (15).
La glicemia, los electrolitos, el encefalograma y las pruebas de función hepática y renal tuvieron los rendimientos más bajos; a pesar de este bajo rendimiento diagnóstico, estos exámenes ayudan a detectar enfermedades tratables, prevenibles o potencialmente fatales como en la hipercalcemia que puede producir un síndrome demencial que se confunde con la enfermedad de Alzheimer (16) independientemente de la causa de la hipercalcemia (hiperparatiroidismo, mieloma múltiple o enfermedad metastásica) y es potencialmente fatal sin tratamiento.
En dos estudios previos, el rendimiento de las pruebas diagnósticas en pacientes con demencias fue muy bajo (3), sin embargo, dado que el criterio de utilidad fue que la demencia fuera reversible, tan sólo el 0.4% de los pacientes tuvieron una demencia totalmente reversible con el tratamiento. Este criterio desconoce la utilidad de modificar alteraciones detectadas por los exámenes diagnósticos, por ejemplo un hipotiroidismo, aunque no revierta el trastorno cognitivo.
El rendimiento diagnóstico estimado de un examen no necesariamente refleja la utilidad global del examen; por ejemplo, una glicemia en un paciente conocido con diabetes ya no contribuye al diagnóstico pero si ayuda al seguimiento, tratamiento y control del paciente. Por el contrario, una TSH mayor de 10 contribuye al diagnóstico de hipotiroidismo en un paciente con quejas cognitivas pero no necesariamente significa que el trastorno cognitivo sea consecuencia del hipotiroidismo o que el tratamiento del hipotiroidismo vaya a mejorar el trastorno cognitivo. En los dos ejemplos, tanto la glicemia como la TSH anormales modifican el tratamiento y el pronóstico del paciente independientemente que contribuyan o no al diagnóstico de la queja cognitiva. Un parámetro más amplio sería el rendimiento pronóstico estimado del examen, el porcentaje de pacientes en los que el examen cambió el pronóstico al paciente; sin embargo, habría dificultades metodológicas para determinar el pronóstico y el cambio del pronóstico generado por el examen en pacientes con trastorno cognitivo.
Otro caso que merece una consideración especial son las pruebas de función hepática y renal. Si bien contribuyen muy poco al diagnóstico, podrían ser de utilidad tener una documentación inicial y hacer seguimiento a la función hepática y renal para hacer ajustes de dosificación y detectar toxicidad medicamentosa ya que la población con trastornos cogniti-vos usualmente es de mayor edad y están expuestos a múltiples medicaciones y a polifarmacia con mayor riesgo de toxicidad medicamentosa.
Una situación similar ocurre con el perfil lipídico, no contribuye al diagnostico del trastorno cognitivo pero ayuda a detectar una comorbilidad frecuente y posible factor de riesgo (17) entre la población con trastornos cognitivos.
Se deben tener dos precauciones con el manejo del rendimiento estimado; la primera es no confundir este estimado con la capacidad discriminatoria de una prueba diagnóstica, que involucra estimados como la sensibilidad, especificidad, valores predictivos, razones de probabilidad, razones de disparidad (ORs) o curvas ROC; todos estos estimados de la capacidad discriminatoria de una prueba no significan que la prueba sea útil (18). Por ejemplo, la utilidad diagnóstica del encefalograma no se ve reflejada con el rendimiento diagnóstico estimado; el encefalograma tiene indicación específica en el diagnostico de pacientes con trastornos cognitivos ante la sospecha de enfermedad de Jakob-Creutzfeldt o si se sospecha una etiología epiléptica como causa del trastorno cognitivo (19); adicionalmente, los pacientes con demencias pueden tener lentificaciones focales temporales o difusas, sin embargo, estos hallazgos no son específicos y no hacen el diagnóstico de una enfermedad determinada. No obstante, la presencia de los hallazgos electroencefalográficos anormales puede orientar el diagnóstico hacia una lesión estructural o descartar otras patologías como podría ser el caso del trastorno cognitivo asociado a trastornos afectivos (pseudodemencia). Adicionalmente, el 7-21% de los pacientes con Enfermedad de Alzheimer esporádica pueden tener crisis epilépticas y algunos casos de episodios de desorientación amnésica en la Enfermedad de Alzheimer están asociados con actividad epileptiforme (20); en estos casos, el EEG puede ser de utilidad diagnóstica aunque no contribuya al diagnóstico del trastorno cognitivo.
Una segunda precaución es que el rendimiento estimado de una prueba diagnóstica no debe confundirse con el costo-efectividad de la prueba (21). Una prueba diagnóstica como las neuroimágenes, puede tener un buen rendimiento estimado pero ser muy costosa y sobrepasar el beneficio; o por el contrario, una prueba como la serología puede tener un mal rendimiento estimado pero ser muy barata y el beneficio sobrepasar el costo. Para determinar el costo-beneficio de las pruebas diagnósticas en los trastornos cognitivos se debe diseñar otro tipo de estudio.
El segundo objetivo principal de este estudio era el determinar el rendimiento estimado de las pruebas diagnósticas en etapas iniciales (DCL) y tardías (demencia) del trastorno cognitivo. Sin incluir la patología vascular, del 9-23% de las demencias son ecológicamente tratables, pero sólo el 0.6-5.8% mejoran con el tratamiento (6-7, 22). El puntaje promedio del minimental en los pacientes con demencias revertidas en el estudio de Freter y cols fue de 26, indicando una trastorno leve (6); adicionalmente, se ha sugerido que las demencia potencialmente reversibles o revertidas se presentan en pacientes más jóvenes o en aquellos con un inicio más reciente del trastorno cognitivo (7); de esta manera se puede suponer que las demencias etiológicamente tratables sean más reversibles si se tratan en etapas tempranas (DCL) o que incluso sean prevenibles si el trastorno etiológico se detecta temprano en una fase pre-clínica del trastorno cognitivo. Por otro lado, el poder discriminatorio de las pruebas diagnósticas varía dependiendo del espectro de la enfermedad; generalmente las pruebas diagnósticas tienen menor sensibilidad y especificidad en las etapas tempranas de los trastornos que pretenden diagnosticar. Un hallazgo interesante de este estudio es que el rendimiento estimado de los exámenes diagnósticos es similar en el DCL y en la demencia y que el espectro de severidad del trastorno cognitivo no afecta el rendimiento estimado de las pruebas. Este hallazgo sustenta la realización de las pruebas diagnósticas en las etapas tempranas de la evolución, cuando son de mayor utilidad dado que un tratamiento etiológico en etapas tempranas podría ser más efectivo en prevenir el desarrollo de una demencia.
Finalmente, ninguna de las variables analizadas (glicemia, colesterol total, colesterol LDL, sexo, antecedentes de diabetes mellitus, hipertensión o hipercolesterolemia) estuvieron asociadas al resultado de las neuroimágenes o a una patología vascular nueva; esta afirmación se sustenta en el hecho que los límites de los intervalos de confianza de las razones de disparidad (ORs) están por encima y debajo del uno. La razón por la cual los factores de riesgo de enfermedad cardiovascular no predicen una patología vascular en la población de pacientes con quejas cognitivas es que son factores de riesgo compartidos con las demencias (23-25).
Este estudio tiene limitaciones metodológicas; el tamaño de la muestra pudo ser pequeño para detectar alguna diferencia significativa entre los grupos como puede deducirse por el tamaño de los intervalos de confianza. Si bien, el tamaño de la muestra se acerca al tamaño de la muestra calculado, no todos los pacientes se realizaron todas las pruebas diagnósticas y este hecho disminuyó el tamaño utilizado de la muestra.
Además del tamaño de muestra, este estudio tiene otras dificultades metodológicas. Un problema es el sesgo de selección de las muestras de pacientes; se incluyeron pacientes remitidos para valoración por neurología por un trastorno cognitivo, los casos con un diagnóstico evidente no fueron remitidos a la consulta o se excluyeron del estudio y es probable que en la población general la prevalencia de trastornos cognitivos prevenibles o etiológicamente tratables sea mayor (7); por otro lado, muchos pacientes no se realizaron todos los exámenes solicitados, los exámenes fueron realizados por diferentes laboratorios clínicos y es posible que los pacientes con exámenes anormales fueran más adherentes al seguimiento que los pacientes con exámenes normales. Sin embargo, este estudio refleja la realidad del ejercicio clínico en un consultorio de neurología en Colombia y los resultados de este estudio solamente se pueden extrapolar a esta práctica clínica.
En conclusión, la investigación diagnóstica de los pacientes con trastornos cognitivos incluye una neuroimagen (la resonancia magnética tiene un mayor rendimiento estimado que la tomografía cerebral), electroencefalograma, cuadro hemático, velocidad de sedimentación globular, VDRL, glicemia, creatinina, transaminasas (SGOT y SGPT), tiempo de protrombina, colesterol total, LDL, HDL, triglicéridos, sodio, calcio, niveles séricos de vitamina B12 y ácido fólico y TSH. No hay diferencias en el rendimiento de estos exámenes cuando se realizan en pacientes con DCL y demencias ya establecidas por lo cual sería recomendable hacerlos en etapas tempranas de la enfermedad cuando el trastorno cognitivo probablemente sea reversible o prevenible. No se detectó ninguna variable predictora de un resultado de neuroimágenes anormal o de patología vascular nueva; sin embargo, estos resultados se deben considerar como preliminares y se deben confirmar con estudios que involucren una muestra mayor, posiblemente multicéntricos. Adicionalmente se deben realizar estudios de costo-efectividad para evaluar que estrategia diagnóstica es la más recomendable.
Agradecimientos: el autor agradece al Dr. Federico A. Silva Sieger por la revisión del manuscrito y sus invaluables comentarios.
REFERENCIAS
1. MAYEUX R. Alzheimer'disease:epidemiology. In Duyckaerts C, Litvan I eds. Handbook of Clinical Neurology. Elsevier 2008:195-205. [ Links ]
2. FELDMAN H, LEVY AR, HSIUNG G-Y, ET AL. A Canadian Cohort Study of Cognitive Impairment and Related Dementias (ACCORD):study methods and baseline results. Neuroepidemiology 2003;22:265-74. [ Links ]
3. SEMPERE AP, CALLEJO-DOMÍNGUEZ JM, GARCÍA-CLEMENTE C, RUIPÉREZ-BASTIDA MC, MOLA-CABALLERO DE RODA S, GARCÍA-BARRAGÁN N, ET AL. Rentabilidad del estudio diagnóstico de la demencia en una consulta extra-hospitalaria de Neurología. Rev Neurol 2004;39:807-10. [ Links ]
4. SENTÍES-MADRID H, ESTAÑOL-VIDAL B. Demencias reversibles y demencias tratables. Rev Neurol 2006;43:101-12. [ Links ]
5. HEJL A, H0GH P, WALDEMAR G. Potentially reversible conditions in 1000 consecutive memory clinic patients. J Neurol Neurosurg Psychiatry 2002;73:390-394. [ Links ]
6. FRETER S, BERGMAN H, GOLD S, CHERT-KOW H, CLARFIELD AM. Prevalence of potentially reversible dementias and actual reversibility in a memory clinic cohort. CMAJ 1998;159:657-62. [ Links ]
7. CLARFIELD AM. The Decreasing Prevalence of Reversible Dementias. An Updated Meta-analysis. Arch Intern Med 2003;163:2219-2229. [ Links ]
8. FELDMAN H, JACOVA C, ROBILLARD A, GARCIA A, CHOW T, BORRIE M, SCHIPPER HM, BLAIR M, KERTESZ A, CHERTKOW H. Diagnosis and treatment of dementia:2. Diagnosis. CMAJ 2008;178:825-36. [ Links ]
9. PETERSEN RC. Mild Cognitive Impairment. N Engl J Med 2011;364:2227-34. [ Links ]
10. SÁNCHEZ-RODRÍGUEZ JL, TORRELLAS-MORALES C. Revisión del constructo deterioro cognitivo leve:aspectos generales. Rev Neurol 2011;52:300-5. [ Links ]
11. American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4th ed., Text revised: DSM-IV-TR. Washington, D.C.: American Psychiatric Association; 2000. [ Links ]
12. PETERSEN RC. Mild Cognitive Impairment:Current Research and Clinical Implications. Semin Neurol 2007;27:22-31. [ Links ]
13. KIVIPELTO M, NGANDU T, FRATIGLIONI L, VIITANEN M, KAREHOLT I, WINBLAD B, HELKALA E-L, TUOMILEHTO J, SOININEN H, NISSINEN A. Obesity and Vascular Risk Factors at Midlife and the Risk of Dementia and Alzheimer Disease. Arch Neurol 2005;62:1556-1560. [ Links ]
14. MIELKE MM, ZANDI PP, SJÖGREN M, GUS-TAFSON D, ÖSTLING S, STEEN B, SKOOG I. High total cholesterol levels in late life associated with a reduced risk of dementia. Neurology 2005;64:1689-1695. [ Links ]
15. FRISONI G B. Structural imaging in the clinical diagnosis of Alzheimer1 s disease: problems and tools. J Neurol Neurosurg Psychiatry 2001;70:711-718. [ Links ]
16. PAPAGEORGIOU SG, CHRISTOU Y, KONTAXIS T, BONAKIS A, ANAGNOSTOULI M, POTAGAS C, KALFAKIS N. Dementia as presenting symptom of primary hyperparathyroidism:Favourable outcome after surgery. Clin Neurol Neurosurg 2008;110:1038-1040. [ Links ]
17. PATTERSON C, FEIGHTNER JW, GARCIA A, HSIUNG G-Y, MACKNIGHT C, SADOVNICK AD. Diagnosis and treatment of dementia:1. Risk assessment and primary prevention of Alzheimer disease. CMAJ 2008;178:548-56. [ Links ]
18. KNOTTNERUS JA, VAN WEEL C, MURIS JWM. Evidence base of clinical diagnosis. Evaluation of diagnostic procedures. BMJ 2002;324:477-80. [ Links ]
19. EGGENBERGER E. Prion Disease. Neurol Clin 2007;25:833-842. [ Links ]
20. PALOP JJ, MUCKE L. Epilepsy and Cognitive Impairments in Alzheimer Disease. Arch Neurol 2009;66:435-440. [ Links ]
21. GOODACRE S, MCCABE C. An introduction to economic evaluation. Emerg Med J 2002;19:198-201. [ Links ]
22. PÉREZ-MARTÍNEZ DA, DE TOLEDO-HERAS M, SAIZ-DIAZ RA, CALANDRE L, BERMEJO E. Demencias reversibles en la consulta neurológica extrahospitalaria. Rev Neurol 1999;29:425-8. [ Links ]
23. CRAET S. The Role of Metabolic Disorders in Alzheimer Disease and Vascular Dementia. Two Roads Converged. Arch Neurol 2009;66:300-305. [ Links ]
24. YAFFE K, WESTON AL, BLACKWELL T, KRUEGER KA. The Metabolic Syndrome and Development of Cognitive Impairment Among Older Women. Arch Neurol 2009;66:324-328. [ Links ]
25. HELZNER EP, LUCHSINGER JA, SCARMEAS N, COSENTINO S, BRICKMAN AM, GLYMOUR MM, STERN Y. Contribution of Vascular Risk Factors to the Progression in Alzheimer Disease. Arch Neurol 2009;66:343-348. [ Links ]