Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Neurológica Colombiana
versión impresa ISSN 0120-8748
Acta Neurol Colomb. vol.27 no.4 Bogotá oct./dic. 2011
Síndrome de opsoclonus-mioclonus-ataxia (OMA) parainfeccioso secundario a infección por citomegalovirus
Opsoclonus myoclonus ataxia syndrome secondary to a parainfectious process by cytomegalovirus
Luis Zarco, Profesor asistente, Facultad de Medicina, Departamento de Neurociencias, Unidad de neurología. Correo electrónico: lazarco@javeriana.edu.co
Laura Gil, Residente de Neurología. Sonia Patricia Millán, Residente de Neurología. Felipe Pretelt. Jefe Unidad de Neurología Clínica. Pontificia Universidad Javeriana, Hospital Universitario San Ignacio. Colombia.
Recibido: 1/07/11. Revisado: 27/09/11. Aceptado: 25/10/11.
RESUMEN
A continuación, se presenta un paciente de 66 años con alteración en los movimientos oculares, asociado a mioclonías, disartria y ataxia cerebelosa, secundario a un proceso parainfeccioso por citomegalovirus. Posteriormente, se revisa la fisiopatología del síndrome de opsoclonus - mioclonus- ataxia, las etiologías del mismo y las opciones terapéuticas disponibles. Esta es una etiología poco frecuente del síndrome, pues sólo se encontró un caso reportado de opsoclonus mioclonus ataxia asociado a citomegalovirus.
PALABRAS CLAVES. Ataxia, Citomegalovirus, Síndromes paraneoplásicos (DeCS).
SUMMARY
This paper reported a 66 years old patient, with eye movements alteration associated to myoclonus, cerebellar ataxia and dysarthria, secondary to a parainfectious process by cytomegalovirus. The physiopathology of the opsoclonus myoclonus ataxia syndrome, its etiologies and the available therapeutic options were checked, and turned out that it is not very common since only one previous published case associated to cytomegalovirus was found.
KEY WORDS. Ataxia, Cytomegalovirus, Paraneoplastic Syndrome (MeSH).
INTRODUCCION
El síndrome de opsoclonus mioclonus ataxia (OMA), también conocido en la literatura médica con el nombre de síndrome de los ojos bailarinos - piés bailarinos, encefalopatía mioclónica de la infancia y síndrome de Kinsbourne (2, 3) es poco común y se caracteriza por el desarrollo agudo o subagudo de sacadas involuntarias, arrítmicas, caóticas y multidi-reccionales que constituyen el opsoclonus, sacudidas mioclónicas del tronco y las extremidades y ataxia cerebelosa (4). Es importante reconocer esta triada, puesto que en un porcentaje importante se asocia a neoplasias: en niños principalmente neuroblastoma oculto y en adultos carcinoma de células pequeñas de pulmón entre otros tumores. La fisiopatología del trastorno todavía está en discusión pero se considera que es secundaria a una lesión que compromete el tallo cerebral y el cerebelo.
PRESENTACIÓN DEL CASO
Hombre de 66 años, sin antecedentes de importancia, quien consultó por cuadro clínico de cinco días de evolución consistente en movimientos oculares rápidos en todas las direcciones, visión borrosa y temblor de intención generalizado. Dos semanas antes del inicio del cuadro clínico presentó fiebre y malestar general.
Al examen físico se encontraron signos vitales normales sin otras alteraciones. Al examen neuro-lógico se evidenciaron sacadas multidireccionales involuntarias, arrítmicas y caóticas con componente horizontal, vertical y torsional. Igualmente, se observó miorritmia mandibular sin otras alteraciones en los pares craneanos. Desde el punto de vista motor, no había compromiso en la fuerza, el tono muscular o en los reflejos. Se observaron sacudidas de las extremidades que empeoraban con la intención. Además, se documentó disartria cerebelosa leve, dismetría y temblor de las extremidades. No se encontraron alteraciones en la esfera mental.
Se consideró que el paciente cursaba con sacado-mania (opsoclonus), mioclonus y hallazgos compatibles con alteración cerebelosa, lo cual constituía la triada de OMA y se inicio la búsqueda de neoplasia oculta y de lesión estructural como causa del cuadro clínico.
Al ingreso, se tomó resonancia cerebral simple sin encontrar lesión estructural Además, dado que la principal causa de este síndrome en los adultos es paraneoplásica, se realizó una búsqueda de neoplasia oculta, practicando tomografía de tórax y abdomen simple y contrastadas. Adicionalmente, se tomó una ecografía testicular. Todos estos estudios fueron normales.
La punción lumbar mostró un líquido cefalorraquídeo (LCR) aséptico: 0 leucocitos, glucosa 39/102 y proteínas de 41, dado que el paciente había presentado malestar general y fiebre dos semanas antes, se decidió buscar etiología infecciosa, se realizó PCR CMV que fue positiva. Con base en este resultado, se concluyó que la etiología del síndrome de opsoclonus-mioclonus-ataxia en este paciente fue parainfecciosa por CMV, secundaria a un mecanismo inmunitario.
Se inició tratamiento con metilprednisolona 1 gramo cada día por cinco y con gabapentina y clonazepam como manejo sintomático. Con esto el paciente tuvo una mejoría progresiva de los síntomas neurológicos, especialmente en la sacado-manía, el mioclonus y la dismetría cerebelosa. En el seguimiento clínico un mes después del egreso hospitalario, el paciente se encontraba asintomático.
DISCUSIÓN
El síndrome de opsoclonus mioclonus ataxia (OMA) es un trastorno neurológico poco frecuente y se estima que hay aproximadamente 500 casos reportados en la literatura mundial (5). En un estudio prospectivo que incluyó 20 centros de pediatría en el Reino Unido durante dos años, se reclutaron 16 casos, calculando una incidencia de 0.18 casos por millón de habitantes, siendo más frecuente en niños, con una edad media de 18 meses (6).
El opsoclonus es una alteración de los movimientos oculares caracterizado por sacadas multidireccionales, involuntarias y caóticas con componente horizontal, vertical y torsional, sin intervalo intersa-cádico. Estos movimientos oculares están acompañados por contracciones breves y súbitas de grupos musculares del tronco y las extremidades (sacudidas mioclónicas) y movimientos incoordinados (ataxia y temblor cerebelosos) (2, 4).
El mioclonus aparece principalmente con la acción o la intención y se puede presentar en forma de sacudidas al sentarse o levantarse. Todo esto conduce a una alteración importante en la funcionalidad, limitando los cambios de posición y la marcha, aunque rara vez genera incapacidad para comer, respirar o hablar. Hasta en el 58% de los casos pueden observarse signos y síntomas de encefalopatía, ansiedad, somnolencia, malestar o irritabilidad, especialmente en aquellos casos relacionados con enfermedad paraneoplásica (2-4, 8, 7).
Es importante hacer diagnóstico diferencial con cerebelitis postinfecciosa dado que ésta última tiene muy buen pronóstico neurológico al contrario del OMA (4). La distinción es clínica dado que los pacientes con cerebelitis no cursan con sacadomania (opsoclonus), siendo éste un signo clínico patogno-mónico de OMA.
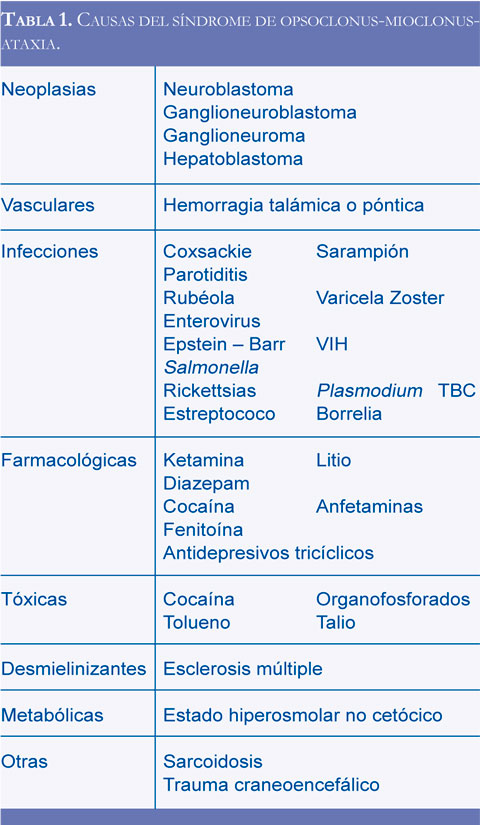
La etiología de este síndrome es variada (Tabla 1). En la población pediátrica el 50% de los casos son paraneoplásicos y los tumores más frecuentemente involucrados son los tumores derivados de la cresta neural: neuroblastoma, ganglioneuroblastoma, gan-glioneuroma y hepatoblastoma (7- 9, 12, 11). En los adultos la principal causa es paraneoplásica (20%), clásicamente el carcinoma pulmonar de células pequeñas, cáncer de mama y neoplasias ginecológicas (4, 12).
Este síndrome también se ha asociado a condiciones metabólicas como estado hiperosmolar no cetósico, exposición a tóxicos y medicamentos como anestésicos (Ketamina), antidepresivos tricíclicos, litio, cocaína, anfetaminas, entre otros.
Otras causas son infecciosas (parainfecciosas o postinfecciosas), los agentes reportados en la literatura son: virus Coxsackie, sarampión, parotiditis, rubéola, Varicela Zoster, enterovirus, virus Epstein-Barr, VIH, Salmonella, Estreptococo Pyogenes, Rickettsias, Plasmodium, Borrelia, TBC y CMV (1, 2, 9, 10,13). En estudio prospectivo de Pang et al. En el grupo de OMA que no fue secundario a neuroblastoma (donde estaban incluidas las causas diferentes a paraneoplasia) se encontró mayor incidencia de fiebre y síntomas respiratorios altos, sin embargo, la sintomatología neurológica fue igual en ambos grupos, por lo que el diagnóstico de las etiologías infecciosas o parainfecciosas solo puede realizarse con el estudio de serología y PCR de LCR de los posibles agentes etiológicos (4).
Se realizó búsqueda en la literatura médica a través de PubMed, conjugando los términos de búsqueda de OMA y CMV, obteniendo sólo tres artículos; uno de los cuales fue publicado por Zaganas et al (1) y expone un caso de OMA asociado a encefalitis por CMV, otro caso publicado por Toorn et al (14) quienes presentan una paciente de once meses con HIV que desarrolla OMA secundaria a reconstitución inmunológica por terapia antirretro-viral altamente efectiva, a quien se le practicaron estudios de serología y PCR demostrando negatividad para diferentes virus, incluyendo el CMV y un tercer artículo de revisión de OMA (15). Por lo cual se concluye que el OMA secundario a CMV es una etiología poco frecuente que debe tenerse en cuenta en el estudio diagnóstico en los pacientes con esta triada.
El mecanismo patogénico del OMA parece ser inmunológico e involucra tanto la inmunidad humoral como la celular. Hay estudios que evidencian alteración en la función de linfocitos T, especialmente CD 19 (16).
Aunque se han demostrado numerosos anticuerpos antineuronales en diversas series de pacientes pediátricos y adultos, la mayoría de los pacientes son seronegativos para los anticuerpos conocidos. En la literatura se han reportado casos de OMA de etiología paraneoplásica con positividad para los anticuerpos anti Ri en pacientes con cáncer de mama, ovario o pulmón, también hay reportes de positividad para anticuerpos anti-Hu, Anti-Ma, anti-neurofilamento, anti decarboxilasa del ácido glutámico y anti-NMDA (4, 8, 12, 17).
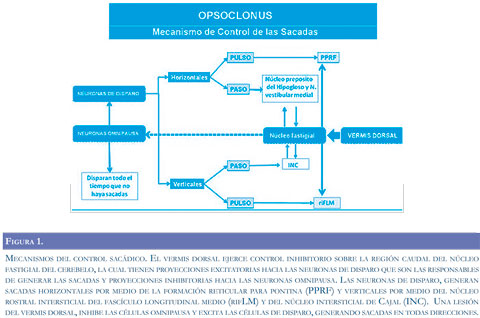
Inicialmente, se creía que el daño a las células omnipausa localizadas en el núcleo del rafe dorsal en el IV ventrículo, eran responsable del opsoclonus, debido a que éstas son inhibidas al generarse una sacada. Sin embargo, estudios de autopsia en pacientes con OMA no han demostrado daño en la región de las células omnipausa. Por el contrario, se han encontrado las lesiones en las células de Purkinje del vermis cerebeloso dorsal. Además, lesiones generadas experimentalmente a las neuronas omnipausa, no producen opsoclonus sino enlentecimiento de las sacadas (18). Aunque, el mecanismo fisiopatoló-gico exacto responsable del opsoclonus permanece incierto, la mayoría de evidencia actual apunta hacia el núcleo fastigial del cerebelo (4, 19). Actualmente, se considera que la generación del opsoclonus es el resultado de la desinhibición del núcleo fastigial, específicamente la región oculomotora del mismo.
Se considera que hay una alteración en el funcionamiento de las células de Purkinje gabaérgicas del cerebelo y sus vías (20).
La porción posterior del vermis (lóbulo VII) y la porción caudal del núcleo fastigial (región oculomo-tora) contienen neuronas relacionadas con el funcionamiento de las sacadas; estas neuronas se proyectan a las neuronas en estallido o descarga (burst neurons) excitatorias e inhibitorias, que son las responsables de la generación de las sacadas, incrementando su tasa de descarga, también se proyectan a las células omnipausa inhibiendo su descarga (19) (Figura 1). Al activarse la región oculomotora del vermis, se inhibe la porción oculomotora del núcleo fastigial durante las sacadas lo que permite la fijación visual. Sí el vermis se lesiona, se desinhibe el núcleo fastigial cuyas proyecciones excitan las células generadoras de sacadas (células de disparo excitatorias e inhibitorias) generando las sacadas en todas las direcciones, además, inhiben a las células omnipausa (18, 20).
Un estudio con resonancia magnética funcional confirma esta hipótesis al demostrar activación exagerada de los núcleos fastigiales en dos pacientes con opsoclonus (21). Igualmente, los estudios con resonancia magnética funcional sugieren la pérdida del control inhibitorio de las células de Purkinje sobre el núcleo fastigial (20).
Con respecto al diagnóstico, éste se establece clínicamente. Las imágenes cerebrales suelen ser normales. Debido a que la etiología más común es el cáncer, se debe iniciar una búsqueda exhaustiva de neoplasia oculta. Así mismo, debe realizarse punción lumbar con el fin de descartar infecciones (8). En nuestro paciente, la punción lumbar evidenció una PCR positiva para citomegalovirus y un LCR sin signos de inflamación por lo cual se consideró que el mecanismo no era infeccioso directo sino inmunológico (parainfeccioso o postinfeccioso). Se descartaron neoplasias ocultas con una amplia búsqueda en tórax, abdomen y testículo, e igualmente, se descartaron otras infecciones.
El tratamiento en los casos asociados a neoplasia consiste en la resección del tumor con el fin de frenar la respuesta inmunológica. En caso contrario, se deben administrar tratamientos inmunomoduladores como metilprednisolona o inmunoglobulina (7, 9). En casos refractarios hay reportes de mejoría sintomática al dar manejo con ciclofosfamida, rituximab (22) y plasmaféresis (8). Como opciones de tratamiento sintomático para la sacadomanía y el mioclonus están gabapentín, clonazepam y ácido valpróico (7, 20) (Tabla 2). Dado que este trastorno es muy raro, ninguno de los tratamientos aquí descritos tiene nivel de evidencia. Hasta el momento, no se han realizado estudios controlados para evaluar la efectividad de los tratamientos y todo se basa en reportes de casos.
Se estima que los niños con OMA asociado a neuroblastoma tienen un buen pronóstico: 90% de sobreviva a dos años. Las recaídas están asociadas con la presencia de recaída tumoral, tratamiento de neoplasias o a cambios en medicamentos. Crónicamente, la enfermedad puede tener un curso fluctuante o remitir espontáneamente (3, 20). Existen reportes que evidencian mejoría espontánea entre los 9 y los 24 días posteriores al inicio de los síntomas en los casos de OMA secundarios a infecciones (23).
REFERENCIAS
1. ZAGANAS, PRINIANAKIS G, XIROUCHAKI N, MAVRIDIS M. Opsoclonus-myoclonus síndrome associated with cytomegalovirus encephalitis. Neurology. 2007; 68: 1636. [ Links ]
2. BARRAGÁN-PÉREZ E, VEÑARDE-ESPINOSA S, GARZA-MORALES S, HERNÁNDEZ-AGUILAR J. Causas no oncológicas del Síndrome de Kins-bourne. Bol Med Hosp Infant Mex. 2005; 62. [ Links ]
3. GABALDÓN-TORRES L, FERNÁNDEZ-DOMÍNGUEZ J, SALAS-FELIPE J, CAMI-NOA-LIZARRALDE A, PALOMA-FERRER F, GUTIÉRREZ-MOLINA M, BASTOS-MORALES C, SARRIÁ-LUCAS MJ, ARPA-GUTIERREZ FJ. Síndrome de Opsoclono-mioclono-ataxia: dos casos anatomoclínicos. Rev Neurol 2009; 48: 137-140. [ Links ]
4. PANG K, DE SOUSA C, ANG B, PIKE M. A prospective study of the presentation and management of dancing eye síndrome/opsoclonus-myoclonus síndrome in the United Kingdom. EJPN. 2010; 14: 156-161. [ Links ]
5. DÁVILA-GUTIERREZ G, PALACIOS-ACOSTA J, GUZMÁN-MARTÍNEZ A, RODRÍGUEZ-ABARCA F, SHALKOW-KLINCOVSTEIN J, CARRASCO-DAZA D. Síndrome de Opsoclonos mioclonos causado por un neuroblastoma. Informe de un caso. Actapediatr mex. 2010; 31: 36-41. [ Links ]
6. LEWIS M, HARTMANN L, LACHANCE D, JIMENEZ R. Opsoclonus as a suspected paraneo-plastic syndrome of endometrial cancer. Rare Tumors 2020; 2: e42. [ Links ]
7. BIER S, HILE D. Clinical Communications: Adults. Emergency department presentation of a rare neurological disorder. The Journal of Emergency Medicine. 2010; 38: 452-455. [ Links ]
8. KORNAL I, VORA J. Case report. Dancing eyes-dancing feet. lancet 1999; 354:390. [ Links ]
9. AGUILERA S, BOTELLA M, SALADO C, BOSQUE A, MONTIANO J. Sindiome opsoclono-mioclono-ataxico paraneoplasico. An Sist Sanit Navar. 2009; 32: 91-95. [ Links ]
10. FITZPATRICK AS, GRAY OM, MCCONVILLE J, MCDONNELL GV. Clinical Notes Opsoclonus-Myoclonus Syndrome Asociated with bening ovarian teratoma. Neurology. 2008; 70: 1289-1293. [ Links ]
11. MATSUMOTO H, UGAWA Y. Paraneoplastic Opsoclonus-Myoclonus Syndrome a review. Brain and nerve. 2010; 62: 365-369. [ Links ]
12. WONG A, MUSALLAM S, TOMLINSON RD, SHANNON P, SHARPE J. Opsoclonus in three dimensions: oculographic, neuropathologic and modeling correlates. Journal of the Neurological Sciences. 2001; 189: 71-81. [ Links ]
13. HELMCHEM C, RAMBOLD H, SPRENGER A, ERDMANN C, BINKOSFSKI F. Cerebellar activation in ospsoclonus. An fMRI study Neurology. 2003; 61: 412-415. [ Links ]
14. TOORN R, RABIE H, WARWICK J. Opsoclonus-Myoclonus in an HIV-infected child on antiretroviral therapy- possible immune reconstitution inflammatory syndrome. European Journal Of Peadiatric Neurology. 2005; 9: 423-436. [ Links ]
15. DE BROUCKER T, ZUBER A. The Opsoclonus Myoclonus Syndrome. Rev Neurol2000; 156: 73-75. [ Links ]
16. PRANZATELLI MR, TATE ED, SWAN JA, TRAVELSTEAD AL, COLLIVER JA, VERHULST SJ, CROSLEY CJ, GRAF WD, JOSEPH SA, KELFER HM, RAJU GR. B cell depletion therapy for new-onset opsoclonus-myoclonus. Movement Disorders. 2008;25:238-242. [ Links ]
17. RRANZATELLI MR. The Neurobiology of the Opsoclonus-Myoclonus Síndrome. Clin. Neurophar-macol. 1992; 15: 186-228. [ Links ]
18. RALIWAL VK. Clonazepam reponsive opsoclonus myoclonus syndrome: additional evidence in favour of fastigial nucleus disinhibition hypothesis?. J Neural Transm 2010; 117:613-615. [ Links ]
19. KURIAN M. Opsoclonus-Myoclonus Syndrome in Anti N-Methyl-D-Aspartate Receptor Encephalitis. Arch Neurol. 2010;67:118-121. [ Links ]
20. KI RANG K. Dancing Eye Syndrome associated with spontaneous recovery and normal neurodevelopment. European Journal of Paediatric Neurology 2010;14: 178 -181. [ Links ]
21. KANJANASUT, N. HIV-related opsoclonus- myoclonus-ataxia syndrome: Report on two cases. Clinical Neurology and Neurosurgery 2010; 112: 572-574. [ Links ]
22. RRANZATELLI MR, TRAVELSTEAD AL, TATE ED, ALLISON TJ, MOTICKA EJ, FRANZ DN, ET AL. Band B - and T-cell markers in opsoclonus-myoclonus syndrome: immunophenotyping of CSF lymphocytes. Neurology 2004;62:1526-1532. [ Links ]
23. BURCA, G, KUTLUK, T, BUYUKRAMUKCU, M, AKYUZ, C, ET AL. Neurological complications of neuroblastic tumors: experience of a single center. Childs Nerv Syst 2010; 26:359-365. [ Links ]