Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Neurológica Colombiana
versión impresa ISSN 0120-8748
Acta Neurol Colomb. vol.27 no.4 Bogotá oct./dic. 2011
Síndromes paraneoplásicos neurológicos: para entender la respuesta inmune y los anticuerpos paraneoplásicos
The neurologies paraneoplasics syndromes to understand the immune response and paraneoplastic antibodies
Fernando González Trujillo, Neurología Clínica- Profesional observador en Neurología Oncología. Instituto Nacional de Cancerología, Hospital Simón Bolívar, Médicos Asociados Clínica Fundadores. Correo electrónico: fernando.gonzaleztrujillo@gmail.com
Yimy F Medina, Reumatología-Medicina interna, Hospital Simón Bolívar E.S.E. Pedro José Penagos González, Neurocirugía Oncología. Coordinador Unidad de Neurocirugía-Oncología. Instituto nacional de Cancerología, Organización Sanitas Clínica Reina Sofía. Camilo Zubieta Vega, Neurocirugía Oncología. Instituto Nacional de Cancerología, Clínica de Occidente. Gonzalo Melo Gómez. Neurología Oncología. Instituto Nacional de Cancerología, Clínica Navarra. Bogotá, Colombia.
Recibido: 13/06/11. Revisado: 29/08/11. Aceptado: 28/11/11.
RESUMEN
Los síndromes paraneoplásicos neurológicos (SPN) comprometen el sistema nervioso (central periférico o neu-romuscular) de forma focal o difusa y se deben a una respuesta inmune de tipo humoral o celular sin que haya metástasis o extensión directa del tumor, su incidencia es baja. El SPN hace que el sistema inmune medie su respuesta a través de las células T principalmente cuando los antígenos son de localización intracelular, pero cuando los antígenos se localizan en la membrana celular se ha observado una mediación por anticuerpos.
Los SPN pueden preceder la aparición de un tumor. Los anticuerpos onconeuronales permiten limitar su espectro diferencial y facilitan el diagnóstico y tratamiento tempranos.
Los síndromes neurológicos no paraneoplásicos y sin un tumor subyacente son entidades importantes para el diagnóstico diferencial, en ellos hay una mediación por anticuerpos contra las proteínas sinápticas y de la superficie celular y comparten características clínicas con los SPN; afectan niños y adultos jóvenes y pueden responder a inmunoterapia.
El objetivo de este artículo es explorar las características de los SPN y los mecanismos inmunológicos que los identifican, definir los anticuerpos mejor estudiados y presentar un plan de diagnóstico y tratamiento.
PALABRAS CLAVES. Síndromes paraneoplásicos, Sistema Nervioso Central, Anticuerpos (DeCS).
SUMMARY
Paraneoplastic disorders of the central nervous system (CNS) define the compromise of central nervous system diffuse or focally and it is due to an immune response of humoral type or cellular type without either metastasis or direct extension of the tumor. Its incidence is low.
The pathogenesis of paraneoplastic syndromes of the CNS result from immune responses to intracellular antigens mediated mainly by T cells and responses mainly by antibodies to antigens expressed by tumors on cell membranes.
The non paraneoplastic neurologic syndromes and syndromes without a subjacent CNS tumor are two important entities for differential diagnosis, in which there is mediation by antibodies against synaptic proteins and surface cellular proteins. These share similar clinical characteristics with paraneoplastic disorders of CNS. They affect children and young adult and are susceptible to immunotherapy depending on the immunologic mechanism involved.
Paraneoplastic disorders of the central nervous system may precede the tumor presentation. The onconeural antibodies facilitate limit a differential spectrum and lead to an early diagnosis and treatment.
The objective of this review article is sought to the Paraneoplastic disorders of the central nervous system characteristics and the immunologic mechanisms that identify them, to define the antibodies best studied and present a diagnostic and a treatment plans.
KEY WORDS. Paraneoplastic Syndromes, Central Nervous System, Antibodies (MeSH).
INTRODUCCIÓN
Los síndromes paraneoplásicos neurológicos SPN hacen referencia al compromiso focal o difuso del sistema nervioso central, periférico, de la unión neuro-muscular y del músculo asociados con neoplasias que no invaden directamente, ni dan metástasis al sistema nervioso (1). La definición en la actualidad se restringe al concepto previo, pero, es interesante presentar al lector los criterios diagnósticos aplicados anteriormente para considerar el síndrome como definido o posible (2): SPN definido
1. Cáncer y "un síndrome clásico" que se presenta dentro de los cinco años de ocurrida una lesión neurológica.
2. Cáncer y "un síndrome no clásico" que mejora con el tratamiento del cáncer, sin uso de inmuno-terapia y la certeza de que no se presentó remisión espontánea.
3. Cáncer y "un síndrome no clásico" con anticuerpos onconeuronales positivos que se manifiesta hasta 5 años después.
4. Un síndrome neurológico "clásico o no" con anticuerpos onconeuronales positivos (anti Hu, Yo, CV2, Ri, Ma 2, Amfifisina) sin cáncer.
SPN posible
1. Un "síndrome neurológico clásico" sin cáncer ni anticuerpos onconeuronales pero con alto riesgo de tumor.
2. Un síndrome neurológico "clásico o no" sin cáncer y anticuerpos onconeuronales positivos mal definidos.
3. Un "síndrome neurológico no clásico" sin anticuerpos onconeuronales y un cáncer que se presente en un período de hasta 2 años.
El síndrome paraneoplásico se establece con la demostración de un tumor o los anticuerpos positivos en suero o en líquido cefalorraquídeo (3-6). La patogénesis que se postula es una causa inflamatoria del sistema nervioso que involucra el sistema inmune y la mediación de anticuerpos específicos que reconocen los antígenos presentes en el tumor y el sistema nervioso (7). Se deben tenerse presentes, a saber: el SPN pueden preceder, o coincidir con la neoplasia, los anticuerpos onconeuronales asociados pueden facilitar la localización y reconocimiento de tumor (1,3), la evolución es impredecible, hay informes de casos con resultados malos y otros informes con mejoría o remisión espontánea como lo observado en enfermedad de Hodgkins, opsoclonos-mioclonos con neuropatía y síndrome miasténico de Lambert-Eaton (1, 5, 6). La "expresión paraneoplásica" del tumor no es siempre la misma (5, 6).
La frecuencia de presentación es baja, menos del 1% (8). La incidencia varia según los criterios aplicados: por ejemplo, Croft y Wilkinson informaron casos con debilidad muscular y neuropatía periférica en 66% de l465 pacientes con cáncer, pero cuando se aplicaron los criterios que definen el SPN el porcentaje bajó al 0,4 % (1). Henson y Urich informaron casos entre el 0,36 % y 0,31 %, Van Oosterhout y col registraron casos en el 1% de los pacientes con cáncer de pulmón (8).
El propósito de este articulo, es revisar los SPN y los mecanismos inmunológicos implicados en su patogénesis, definir la importancia de los anticuerpos onconeuronales mejor estudiados y presentar un plan de diagnóstico y tratamiento.
PATOGENESIS
Se han postulado varias hipótesis para explicar la patogénesis de los SPN, pero el mecanismo inmune es el más aceptado en el momento (1, 5, 6, 9, 10):
Se ha propuesto que el tumor y el SPN se involucran mediante la secreción ectópica de una sustancia, esto se soporta en base a los síndromes endocrinos y la producción de hormonas como la adrenocortico-trófica o paratiroidea. También en que entre el tumor y el sistema nervioso "se da una competencia" por un sustrato esencial común, este evento se ha observado en los tumores relacionados con el síndrome carci-noide y la "sustancia sustrato" el triptófano.
El sistema nervioso sometido a inmunosupresión e infección se afecta por mecanismos directos o indirectos no bien establecidos, como se apreció en los casos clínicos de leucoencefalopatía multifocal progresiva y el virus papova. Este postulado no se ha aceptado, pues cuando se realiza el diagnóstico de un síndrome paraneoplásico algunos de los pacientes no tienen evidencia de inmunosupresión.
La participación del sistema inmune en los SPN en la actualidad es la hipótesis más aceptada, postula que los antígenos en el sistema nervioso se expresan en forma aberrante y el sistema inmune los reconoce "como extraños" generando la respuesta inmuno-lógica (1, 5, 6).
El "postulado tradicional" de que las neuronas son "inmuno privilegiadas y carecen de moléculas que las hacen reconocibles por el sistema inmune" es impreciso. El sistema nervioso se considera ahora "un sitio inmunológicamente especializado" (11) al que las células T logran penetrar cuando suceden procesos infecciosos, inflamatorios y neoplásicos, además que carece de vasos linfáticos y posee una barrera hemato encefálica que limita el tránsito y las funciones de las células inmunes. Los estudios en el tema revelan que los linfocitos activados pueden atravesar la barrera hematoencefálica y que las células nerviosas especializadas (zona límbica, células de Purkinje, tallo cerebral) expresan altos niveles de antígenos del complejo mayor de histocompati-bilidad (MHC). Está por definirse si los antígenos expresados en el tumor y el sistema nervioso son idénticos o sufren una mutación cuando se originan estas noxas. Estos antígenos se pueden localizar en la membrana celular, el citoplasma (por ejemplo: proteínas asociadas con degeneración cerebelosa (CDR), Tr, Amfifisina) y en el núcleo (por ejemplo: la proteína Hu, Nova). La respuesta a los tratamientos se ha relacionado con la ubicación de los antígenos, y se han informado mejores resultados con los antígenos que se localizan en la membrana celular más que con los antígenos intracelulares (5, 6).
El sistema inmune media su respuesta por células T principalmente cuando los antígenos son de localización intracelular y cuando los antígenos son de localización en la membrana celular se ha observado la mediación por anticuerpos que tienen un papel directo en la patogénesis de los SPN.
Varios estudios han demostrado el protagonismo de los anticuerpos en la patogénesis de algunos SPN, como en los casos clínicos con encefalitis límbica donde se apreció una correlación positiva entre los niveles de anticuerpos anti CV-2, anti VGKC, anti NMDA, anti AMPA y los síntomas presentados por los pacientes; en el síndrome de opsoclonos-mioclonos relacionado con el neuroblastoma se evidenció la mediación inmune dirigida contra los antígenos presentes en el tumor y el tejido neuronal, además, se informó un incremento del factor activante de células B en el líquido cefalorraquídeo (BAFF) que pertenece a la familia de factores de necrosis tumoral que tiene un papel primordial en la proliferación y diferenciación de las células B y que también participan en la activación de células T comprometidas como mediadoras en los SPN con anticuerpos intracelulares (7).
Hay otros hallazgos que sustentan la mediación inmune por anticuerpos (5, 6, 12): la presencia en el tumor y en el sistema nervioso de altos títulos de anticuerpos anti neuronales específicos, la producción intratecal de algunos anticuerpos como se ha demostrado con los anticuerpos anti-Hu, anti-Yo, anti-Ri, en células de neuroblastoma y en las membranas celulares hay moléculas similares al antígeno Hu y los anticuerpos producidos por el tumor como en las neoplasias linfoides vinculados con SPN.
La citotoxicidad celular mediada por células T se logro documentar en autopsias de varios pacientes, encontrándose la presencia de infiltrados con células mononucleares CD4 y CD8 que no explican el daño neuronal per se, pero son áreas con gran expresión clínica que se afectan por "un mecanismo primario desconocido" mediado por citoquinas o anticuerpos (5).
La respuesta inmune afecta tanto el sistema nervioso central como el periférico y abarca el compromiso desde las neuronas motoras (esclerosis lateral amiotrófica) hasta el nervio periférico (con neuropatías sensitivo-motoras o motoras, las gama-patias monoclonales como la glicoproteína asociada a la mielina (MAG)), y la placa neuromuscular (el síndrome miasténico de Lambert-Eaton, miastenia gravis y neuromiotonía). Este compromiso puede ser focal cuando se compromete un tipo definido de célula (son ejemplos, la degeneración cerebelosa paraneoplásica y las células de Purkinje, la retinopatía asociada al cáncer y el foto receptor retinal, la sinapsis colinérgica pre-sináptica en el síndrome miasténico de Lambert-Eaton y en la neuropatía sensitiva para neoplásica que se afecta el ganglio de la raíz dorsal) o de forma difusa (como en la encefalomielitis y carcinoma, el ejemplo más conocido es el cáncer de pulmón de células pequeña con el anticuerpo anti-Hu) (8).
Se describe además las familias de antígenos onconeurales clonados con sueros de pacientes que han servido para elaborar "bancos de información", los antígenos más investigados son (6):
La familia de genes Hu: asociadas con encefa-lomielitis y neuronopatía sensitiva, las proteínas Hu se expresan temprano en el proceso de neurogénesis y se les atribuye una función en la regulación del desarrollo y diferenciación neuronal.
La familia de gen Ma: se asocia con una degeneración inflamatoria del sistema límbico, el tallo cerebral y las células de Purkinje del cerebelo. La función de estás proteínas se desconoce, se les atribuye un rol regulador en la maduración, diferenciación neuronal y en la biogénesis del RNA mensajero (mRNA).
Los antígenos Yo: relacionados con la degeneración cerebelosa que ataca las células de Purkinje. Se le otorga una función como factor de trascripción y regulador de la expresión de genes.
La familia de proteínas mediadoras de respuesta al "colapso" (CRMP):los pacientes tienen anticuerpos séricos conocidos como anti CV2, los genes que los expresan intervienen en el crecimiento axonal, la diferenciación neuronal y el desarrollo cerebral.
Los antígenos NOVA:los pacientes tienen anticuerpos llamados anti Ri. Se expresan solo en el sistema nervioso central, en el núcleo neuronal. La clínica cursa con opsoclonos, ataxia troncular y otros signos cerebelosos.
La amfifisina: es una proteína sináptica de 128 Kd localizada en la terminal presináptica, encontrada solo en el cerebro y la glándula adrenal, mas no en tejidos excitables eléctricamente como el músculo esquelético y el corazón.
Los antígenos retínales: se producen anticuerpos contra la proteína conocida como recoverin, que pertenece a la familia de las calmodulinas y tiene 23 Kd. Están presentes en los fotorreceptores de las células bipolares de los conos y en la capa de células ganglionares de la retina. La proteína regula las señales de transducción visual inhibiendo la rodopsin cinasa, como una respuesta a las altas concentraciones de calcio.
LOS ANTICUERPOS PARANEOPLASICOS
A continuación se ofrece una guía sobre la información que aportan los anticuerpos en el diagnóstico y su interpretación cuando se solicitan según el síndrome sospechado (5, 6, 12-14).
El criterio clínico debe prevalecer sobre la detección de anticuerpos cuando se estudia un SPN, pues, en el 40% de casos no se expresan y hay pacientes con anticuerpos positivos que no tienen manifestaciones clínicas.
Restringen la investigación hacia un tumor específico facilitando el diagnóstico temprano y reduciendo el espectro diferencial, hasta en el 60% de los pacientes su presencia precede la aparición de un tumor.
Los anticuerpos se miden en el suero y el líquido cefalorraquídeo con técnicas de laboratorio como inmunofluorescencia, inmunohistoquimica, western inmuno blot asociado con microscopia electrónica (7).
Un solo SPN puede manifestar varios anticuerpos y relacionarse con diferentes tumores, como la encefalitis límbica que se vincula con los anticuerpos Hu, la proteína Ma, CV2/CRMP5, anfifisina.
La encefalitis límbica tiene diferente presentación según el anticuerpo relacionado, cuando hay anticuerpo anti HU puede asociarse con encefalomie-litis o neuropatía sensitiva; cuando hay anti Ma2 se presenta con clínica de di-encefalitis o síntomas de tallo cerebral superior y se vincula con cáncer testi-cular; y cuando está presente el anti CV2/CRMP5 es aislada y se relaciona con cáncer de pulmón de célula pequeña.
Hay más anticuerpos relacionados con encefalitis límbica dirigidos contra el neurópilo como el anti receptor NMDA. Se han informado casos de encefalitis límbica no asociados con cáncer que manifiestan anticuerpos anti VGKC (canales de potasio dependientes de voltaje) y que responden bien al tratamiento inmunomodulador con glucocorticoi-des, inmunoglobulinas, plasmaferesis. Actualmente la encefalitis límbica se clasifica según el anticuerpo contra el antígeno que va dirigido ya sea intracelular o de membrana (7).
Los anticuerpos pueden ser muy específicos como se definen algunos síndromes clásicos como anti Hu, anti Yo, anti CV 2, anti Ma2; o puede ser menos específico para el tipo de síndrome o tumor relacionado (9).
Los anticuerpos siguen detectándose en el suero de pacientes por meses o años independientemente de la resección del tumor o de la inmunoterapia.
La presencia y disminución de algunos anticuerpos se relaciona con buena respuesta terapéutica y pronóstico favorable, como se reporta en los síndromes míasténico de Lambert-Eaton (LEMS), miastenia gravis y neuromiotonía luego de la terapia inmunomoduladora. Los pacientes con síndrome cerebeloso y anticuerpos anti-Ri positivos mejoraron con la resección del tumor y también pueden presentar remisión espontánea.
En LEMS asociado con cáncer de pulmón de células pequeñas se reporta un nuevo anticuerpo Sox1, como marcador para neoplásico en el 64% de pacientes (7). Hay LEMS para neoplásico y no para neoplásico clínicamente e inmunológicamente similares, su diferenciación se realiza identificando títulos altos de anticuerpos o demostrando su síntesis intratecal en el LCR.
No debe olvidarse que la detección en suero de los anticuerpos no excluye otras complicaciones neurológicas asociadas al cáncer, más cuando el SPN sospechado no es clásico (9).
Complementando la información de los anticuerpos no paraneoplásicos y síndromes neurológicos, los mas relevantes son los GAD (descarboxilasa del acido glutámico) que se presentan con el síndrome de (Stiff person) persona rígida, ataxia cerebelosa, epilepsia refractaria, temblor palatino, disfunción de tallo cerebral; los anticuerpos contra AMPA o receptor GABA y los anticuerpos AK5 (reportados en pacientes con formas de encefalitis límbica refractaria a tratamientos) (9).
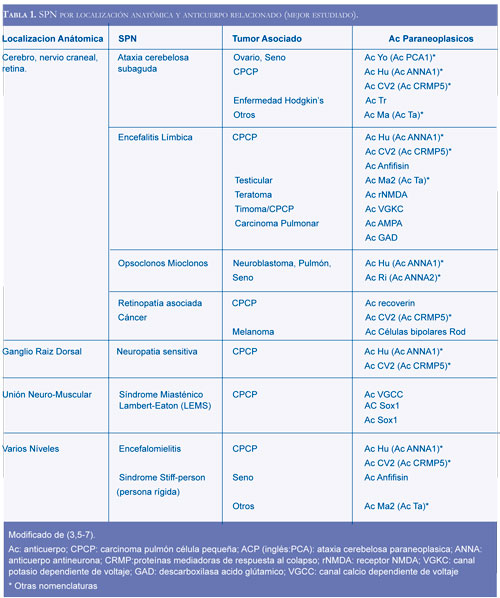
La tabla 1 presenta los anticuerpos relacionados con SPN, mejor investigados (3, 5-7).
VARIANTES CLINICAS DE LOS SPN
Hay siete síndromes clínicos bien definidos: encefalomielitis para-neoplásica, encefalitis límbica, degeneración cerebelosa sub-aguda, opsoclonos mioclonos, síndrome miasténico de Lambert-Eaton, neuropatía autonómica con seudo-obstrucción intestinal y neuropatía sensitiva sub-aguda. La presentación clínica es variable con formas sub-agudas y discapacidad severa hasta las de curso benigno con lenta progresión y recaídas (13, 15).
La historia clínica completa en apoyo con estudios de electrofisiología, de liquido cefalorraquídeo, de neuro-imágenes (Tomografía Axial, Resonancia magnética y Espectroscopia, PET con fluorodeo-xyglucosa y otros estudios neurofuncionales), y de neuropatología son necesarios para diferenciar un síndrome paraneoplásico con entidades de tipo infecciosas o enfermedades autoinmunes, o de otra etiología (5,6).
Los análisis de líquidos cefalorraquídeos revelan moderada pleocitosis con incremento de proteínas, bandas oligoclonales y elevada síntesis de IgG.
Estos síndromes tienen variantes clínicas que se deben tener presentes cuando se sospecha en un paciente en particular:
Un SPN definido puede ser la expresión clínica de diferentes tumores (Tabla 1). Se presentan algunos ejemplos: el síndrome tipo ataxia cerebelosa relacionado con cáncer de seno, ovario o linfoma de Hodking (1); la encefalitis límbica asociada con cáncer de pulmón de célula pequeña, testículo, seno, timoma y el teratoma de ovario (5,6).
Los estudios demuestran que existe una relación entre el síndrome clínico con el tipo de anticuerpo encontrado, los pacientes con anticuerpos Hu presentan una neuropatía diferente con los que tienen anticuerpos CV2, la ataxia cerebelosa es mas frecuente con anticuerpos CV2 que con Hu (7).
Los anticuerpos contribuyen a orientar la búsqueda de un tumor oculto, se indica realizar los estudios básicos de tamizaje y sí con resultados negativos persiste la sospecha alta de un síndrome para neoplásico debe procederse con la ejecución de exámenes complementarios, por ejemplo: en el paciente con los anticuerpos Hu y CV2 positivos que se relacionan con SCLC se encuentra un pequeño nódulo mediastinal debe profundizarse su estudio realizando una biopsia o extirpación para enviar a patología; el anticuerpo Yo relacionado con la ataxia cerebelosa para neoplásica es muy específico de un cáncer ginecológico, si los estudios de rutina son negativos se sugiere considerar la opción de una exploración quirúrgica; en los varones con anticuerpo positivo Ma2 y un alto riesgo de cáncer testicular con ecografía negativa para tumor se puede proponer la realización de una orquiectomia; las mujeres con anticuerpo positivo contra rNMDA (receptor NMDA) deben tener estudios para descartar un teratoma de ovario (16-18). Cuando con los estudios para-clínicos realizados no se identifica la neoplasia y se tiene una alta sospecha clínica se indica realizar estudios de tomografía de emisión de positrones con fluorodeoxiglucosa (FDG-PET) que facilita identificar lesiones de muy pequeño tamaño (7, 15, 18, 19-21).
La biopsia cerebral (9) no es primordial en el proceso de diagnóstico, solo se considera su realización en casos con alta sospecha de neoplasia y según los aportes obtenidos por examen clínico, imágenes de resonancia o PET cerebral que evidencien lesiones donde potencialmente se puedan obtener muestras que faciliten aclarar el diagnóstico. Los hallazgos de patología no son específicos, se reportan infiltrados de células mononucleares, nódulos neuronofágicos, degeneración neuronal, proliferación microglial y gliosis. Son frecuentes los hallazgos de infiltrados por células CD4 y CD8 cuando los anticuerpos atacan antígenos intracelulares, pero en los casos con antígenos localizados en la superficie celular o en el espacio sináptico se observan escasos infiltrados por células T.
Previamente se mencionaron los anticuerpos no paraneoplásicos, es importante retomar la información cada vez más numerosa respecto a los síndromes neurológicos no paraneoplásicos (9, 22-25) como diagnóstico diferencial importante de los SPN, donde hay una mediación por anticuerpos dirigidos contra proteínas sinápticas y de la superficie celular. Estos síndromes neurológicos no paraneoplásicos comparten características clínicas con los SPN, como que afectan niños y adultos jóvenes, tienen rápida evolución, incluso en días o semanas con algunas excepciones en donde hay un proceso crónico recurrente y responden a la inmunoterapia dependiendo del mecanismo inmune involucrado.
TRATAMIENTO
El tratamiento de los SPN ha avanzado poco por la baja frecuencia de presentación y la carencia de modelos animales (8). El abordaje se hace a través de dos objetivos (8, 15): la resección y esquemas adicionales de tratamiento al tumor que produce el SPN (cirugía, quimioterapia, radioterapia) y modificando la respuesta inmune con terapia inmunomoduladora. Se usan medicamentos como esteroides, ciclofos-famida, anticuerpos monoclonales, plasmaféresis, inmunoglobulina intravenosa, tacrolimus y otras sustancias.
La resección amplia del tumor facilita alcanzar mejores resultados con la terapia inmune. Sin embargo, la literatura ha reportado casos de SPN con remisión espontánea (5, 6, 8,15, 17-19).
La Federación Europea de Sociedades Neuro-lógicas público las recomendaciones para tratar los SPN y destacó que los resultados dependen del tipo de anticuerpo involucrado y que los inmunosupreso-res se deben iniciar en la fase aguda o temprana. La inmunosupresión prolongada no afectó el pronóstico y en los SPN que afectan el sistema nervioso central los resultados obtenidos son malos (7, 8, 15,18). Se
resaltó la utilidad de las inmunoglobulinas endovenosas en el síndrome miasténico de Lambert Eaton y el opsoclonos mioclonos asociado con neuroblastoma en población infantil (7).
Hay buena experiencia con alemtuzumab en la retinopatía asociada con cáncer (del inglés, CAR) (16) por la experiencia recogida en otros síndromes para neoplásicos como el pénfigo y la leucemia lin-foide crónica de célula B. En los reportes de casos se preservó la visión hasta por ocho años cuando otros tratamientos fueron fallidos. El Alemtuzumab es un anticuerpo monoclonal derivado del DNA, que actúa contra una glicoproteína CD 52 de 21-28 kD que se expresa en la superficie de los linfocitos B y T, células asesinas (natural "Killer"), monocitos, macrófagos y de las células del sistema reproductor masculino. Los autores proponen que se requieren más estudios para definir el beneficio de los anticuerpos monoclonales en los SPN.
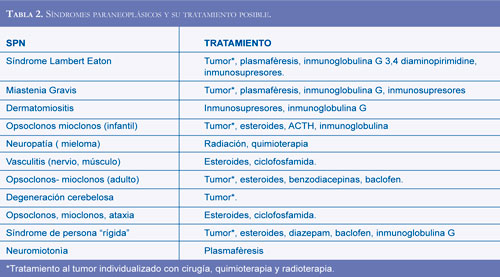
Los SPN no tienen un tratamiento definido, se describe una lista de las posibles opciones para aplicar según la entidad clínica (Tabla 2) (15,1921, 24):
CONCLUSIÓN
Los SPN explican su patogénesis en la reacción autoinmune contra un antígeno onconeural que ocasiona la formación de anticuerpos generándose la lesión en el sistema nervioso.
No hay un tratamiento definido. Los SPN con antígenos localizados intracelularmente tienen respuestas a los tratamientos inmunosupresores regulares y la neoplasia asociada con el SPN se trata con cirugía, quimioterapia, radioterapia y el síndrome paraneoplásico asociado se trata con terapia inmu-nosupresora.
Se destacan los síndromes neurológicos no paraneoplasicos (25) que comparten con los SPN la mediación por anticuerpos, presentaciones clínicas y respuestas a los tratamientos inmunomoduladores, entidades para tener presentes en el diagnóstico diferencial y que clásicamente se creía no tenían en su patogénesis un componente inmune como son la epilepsia refractaria, temblor palatino, disfunción de tallo cerebral o las encefalitis límbicas. Además, en el "mar de información de anticuerpos" reportados en estas entidades se requiere claridad en el tamizaje de los que tienen relevancia clínica para obtener datos útiles y mejorar la aplicación de las opciones terapéuticas en los pacientes, solo en la encefalitis límbica el reporte de anticuerpos es numeroso y varios no tienen una correlación para-neoplasica.
REFERENCIAS
1. SCARAVILLI F AN SF, GROVES M, THOM M. The neuropathology of paraneoplastic syndromes. Brain Pathol 1999; 9: 251-260. [ Links ]
2. GRAUS F, DELATTRE JY, ANTOINE JC, DALMAU J, GIOMETTO B, GRISOLD W, ET AL. Recommended diagnostic criteria for paraneoplastic neurological syndromes. J Neurol Neurosurg Psychiatry. 2004; 75: 1135-1140. [ Links ]
3. POSNER JB. Paraneoplastic syndromes. Curr Opin Neurol 1997; 10: 471-476. [ Links ]
4. BATALLER L, DALMAU J. Paraneoplastic neurologic syndromes. Neurol Clin 2003; 21: 221-247. [ Links ]
5. ROSENFELD MR, DALMAU J. The clinical spectrum and pathogenesis of paraneoplastic disorders of the central nervous system. Hematol Oncol Clin North Am. 2001; 15: 1109-1128. [ Links ]
6. DALMAU J, BATALLER L. Clinical and immunological diversity of limbic encephalitis: a model for paraneoplastic neurologic disorders. Hematol Oncol Clin North Am. 2006; 20: 1319-1335. [ Links ]
7. DIDELOTA A, HONNORAT J. Update on para-neoplastic neurological syndromes. Current Opinion in Oncology 2009; 21: 566-572. [ Links ]
8. DALMAU J, POSNER JB. Paraneoplastic syndromes affecting the nervous system. Semin Oncol. 1997; 24: 318-328. [ Links ]
9. ROSENFELD MR, DALMAU J. Update on para-neoplastic and autoimmune disorders of the central nervous system. Seminars in neurology 2010; 30: 320-331. [ Links ]
10. GIOMETTO B, SCARAVILLI F. Paraneoplastic syndromes. Brain Pathol 1999; 9: 247-250. [ Links ]
11. DIETRICH P Y, DUTOIT V, TRAN THANG NN, WALKER PR. T-cell immunotherapy for malignant glioma: toward a combined approach. Current Opinion in Oncology 2010; 22: 604-610. [ Links ]
12. DALMAU J, GULTEKIN HS, POSNER JB. Paraneoplastic neurologic syndromes: pathogenesis and physiopathology. Brain Pathol 1999; 9: 275-284. [ Links ]
13. AVERBUCH HL, REMLER B. Opsoclonus. Semin Neurol 1996; 16: 21-26. [ Links ]
14. GIOMETTO B, TARALOTO B, GRAUS F. Autoimmunity in paraneoplastic neurological syndromes. Brain Pathol 1999; 9: 261-273. [ Links ]
15. DARNELL RB, POSNER JB. Paraneoplastic syndromes affecting the nervous system. Semin Oncol 2006; 33: 270-298. [ Links ]
16. ESPANDAR L, O'BRIEN S, THIRKILL C, LUBECKI LA, ESMAELI B. Successful treatment of cancer-associated retinopathy with alemtuzumab. J Neurooncol 2007; 83: 295-302. [ Links ]
17. BATCHELOR TT, PLATTEN M, HOCHBERG FH. Immunoadsorption therapy for paraneoplastic syndromes. J Neurooncol 1998; 40: 131-136. [ Links ]
18. YANG YW, TSAI CH, CHANG FC, LU MK, CHIU PY. Reversible paraneoplastic limbic encephalitis caused by a benign ovarian teratoma: report of a case and review of literatures. J Neurooncol. 2006; 80: 309312. [ Links ]
19. BENKE T, WAGNER M, PALLUA AK, MUIGG A, STOCKHAMMER G. Long-term cognitive and MRI findings in a patient with paraneoplastic limbic encephalitis. J Neurooncol 2004; 66: 217-224. [ Links ]
20. DARNELL RB. Paraneoplastic neurologic disorders: windows into neuronal function and tumor immunity. Arch Neurol 2004; 61: 30-32. [ Links ]
21. DAS A, HOCHBERG FH, MCNELIS S. A review of the therapy of paraneoplastic neurologic syndromes. J Neurooncol 1999; 41: 181-194. [ Links ]
22. BORONAT A, SABATER L, SAIZ A. GABA-B receptor antibodies in limbic encephalitis and anti-GAD-associated neurologic disorders. Neurology 2011; 76: 795-800. [ Links ]
23. ADAMS C, MCKEON A, SILBER MH, KUMAR R. NARCOLEPSY, REM Sleep Behavior Disorder, and Supranuclear Gaze Palsy Associated With Ma1 and Ma2 Antibodies and Tonsillar Carcinoma. Arch Neuro. 2011; 68: 521-524. [ Links ]
24. OHTA K, KIKUCHI T, YOSHIDA N. Slowly progressive non-neoplastic autoimmune-like retinopathy. Graefes Arch Clin Exp Ophthalmol 2011; 249: 155-158. [ Links ]
25. PRUITT AA. Immune mediated encephalopathies with an emphasis on paraneoplastic encephalopa-thies. Semin Neurol2011; 31: 158-168. [ Links ]