Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.28 no.1 Bogotá Jan./Mar. 2012
Complejo esclerosis tuberosa
Tuberous sclerosis complex
Carlos Medina-Malo. Liga Central Contra la Epilepsia, Bogotá. Correo electrónico: medinamalo@epilepsia.org
Orlando Carreño. Instituto Cardio-Neuro-Vascular / CORBIC; Clínica las Américas, Medellín, Colombia, Alberto Vélez. Grupo Investigación en Neurociencias, Facultad de Medicina, Universidad Colegio Mayor de Nuestra Señora del Rosario, Bogotá. Luis Arturo Lizcano. Genética Humana E.U., Bogotá. León Darío Ortiz. Sección Neuro-Oncología, Instituto de Cancerología, Clínica las Américas, Medellín. Red Latino Americana de Neuro-Oncología - RedLANO. Henry Becerra. Grupo Oncología Clínica y Traslacional, Instituto de Oncología "Carlos Ardila Lülle", Fundación Santa Fe de Bogotá, Bogotá. Andrés Felipe Cardona. Red Latino Americana de Neuro-Oncología - RedLANO. Fundación para la Investigación Clínica y Molecular Aplicada del Cáncer - FICMAC; investigador asociado ONCOLGroup, en nombre del Consorcio Colombiano para el Estudio de las Neurodermatosis
Recibido: 19/08/11. Revisado: 24/08/11. Aceptado: 02/02/12.
RESUMEN
INTRODUCCIÓN: El complejo esclerosis tuberosa (TSC) es el prototipo de malformación relacionada con alteraciones en la diferenciación y el crecimiento celular de fenotipos variables con implicaciones sistémicas.
OBJETIVO: caracterizar y describir el TSC para facilitar el entendimiento de las neurodermatosis en la población Colombiana.
MATERIALES Y MÉTODOS: la información fue extraída a partir de búsquedas practicadas en las bases de datos MEDLINE, en BIOSIS y en EMBASE desde 1966, 1994 y 1974, respectivamente, hasta el 1 de Marzo de 2011, usando la plataforma OVID y múltiples términos clave. Se diseñaron estrategias adicionales para las bases de datos LILACS, Best Evidence y CINHAL con criterios similares. También se recopilaron datos obtenidos de sociedades científicas relacionadas con el tema en estudio.
RESULTADOS: los criterios diagnósticos han permanecido inmodificados a pesar de que el estudio molecular permite caracterizar la enfermedad. El entendimiento de la patogénesis del TSC ha favorecido el desarrollo de opciones terapéuticas contra blancos moleculares que se encuentran alterados. La vía mTOR explica la mayor parte de las alteraciones fenotípicas en pacientes con TSC.
CONCLUSIÓN: El documento del Consorcio Colombiano para el Estudio de las Neurodermatosis muestra una revisión integral del conocimiento respecto del diagnóstico y tratamiento del TSC.
PALABRAS CLAVES. Esclerosis Tuberosa, Astrocitoma Subpendimario de Células Gigantes, Terapia Biológica (DeCS).
SUMMARY
INTRODUCTION: The Tuberous Sclerosis Complex (TSC) is the mainstay of malformation related to alterations in cellular growth and differentiation, with highly variable phenotypes, and systemic impact.
OBJETIVES: To characterize and describe TSC to facilitate understanding of the neurodermatosis in the Colombian population.
MATERIALS AND METHODS: Information was obtained from searches performed in MEDLINE, BIOSIS, and EMBASE from 1966, 1994 and 1974, respectively, until March 1, 2011, using the OVID platform and multiple key terms. Additional strategies were designed for other databases like LILACS, CINAHL and Best Evidence using similar criteria. We also collected data from scientific societies related to the topic under study.
RESULTS: the diagnostic criteria have not been modified instead molecular characterizations leads to a better understanding of the disease. The characterization of pathogenesis leads to the development of target therapies against those molecular alterations. mTOR pathway explains phenotypic alterations in patients suffering of TSC.
CONCLUSION: the document of the Colombian Consensus for the Neurodermathosis, wants to show an integral review of the knowledge about the development, diagnosis and treatment of TSC.
KEY WORDS. Tuberous Sclerosis, Astrocytoma, TOR Serine-Treonine Kinasas, Biological Therapy (MeSH).
INTRODUCCIÓN
El complejo Esclerosis Tuberosa (del inglés, Tuberous Sclerosis Complex, TSC) es una enfermedad hereditaria relativamente frecuente, que afecta a niños y adultos a lo largo del mundo. Esta entidad nosológica constituye el prototipo de malformación relacionada a alteraciones en la diferenciación y el crecimiento celular, y se presenta con fenotipos variables que presentan implicaciones sistémicas asociadas a displasias en diversos tejidos, neoplasias, y otras alteraciones morfogénicas bien caracterizadas. Los criterios diagnósticos han permanecido inmodificados a pesar del progreso en el estudio molecular que permite la caracterización de la enfermedad. El entendimiento de su patogénesis ha favorecido el desarrollo de nuevas opciones terapéuticas dirigidas contra blancos moleculares específicos que se encuentran alterados. A continuación, se presenta una revisión integral del conocimiento respecto del desarrollo, evolución, diagnóstico y tratamiento de la TSC basada en la experiencia de un grupo local de expertos.
MATERIALES Y MÉTODOS
Formato utilizado para la búsqueda de información
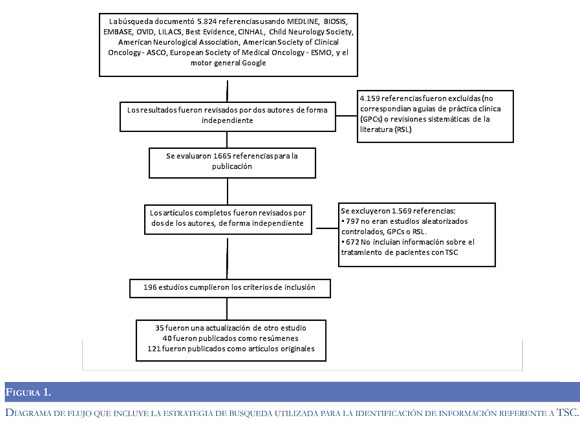
La información consignada en la presente revisión fue extraída a partir de búsquedas de guías de práctica clínica, ensayos clínicos, revisiones sistemáticas y literatura relevante respecto de la patología, en las bases de datos MEDLINE, en BIOSIS y en EMBASE desde 1966, 1994 y 1974, respectivamente, hasta el 1 de Marzo de 2011, usando la plataforma OVID y múltiples términos. Se diseñaron estrategias adicionales para las bases de datos LILACS, Best Evidence y CINHAL con criterios similares. También se recopilaron datos obtenidos de la Child Neurology Society, American Neurological Association, American Society of Clinical Oncology - ASCO, European Society of Medical Oncology - ESMO, y del motor general Google. La Figura 1 muestra la secuencia de resultados para la obtención de las referencias y el proceso implementado para su selección.
RESULTADOS
Epidemiología. El TSC es un trastorno genético que afecta la mayoría de los sistemas; sin embargo, los órganos más comprometidos suelen ser la piel, los riñones, el corazón, y el sistema nervioso. Se estima que dicha entidad presenta una incidencia que oscila entre 1 por 5.000 a 10.000 nacidos vivos (1). Su prevalencia parece ser variable, debido a las diferencias entre los criterios utilizados para el diagnóstico y por los estudios epidemiológicos publicados en las últimas dos décadas; dicha cifra se encuentra alrededor de 1 por 12.000 a 100.000 habitantes/año (2-4). Con base en estos datos se puede estimar que cerca de 2 millones de individuos están afectados por el TSC en el mundo, dado que la enfermedad compromete todos los grupos étnicos y raciales.
En América Latina hay información limitada respecto al comportamiento del TSC. Un estudio desarrollado en Brasil determinó una incidencia de 1 por 10.000 a 50.000 nacidos vivos que además permitió encontrar el diagnóstico por mutaciones de novo en el 85% de los casos (5). En el Hospital Nacional Cayetano Heredia de Perú se describieron 19 casos con una edad promedio al momento de diagnóstico de 5.3 años; de estos, el 88% debutaron con convulsiones antes de los 11 meses y las lesiones encontradas con mayor frecuencia fueron las máculas hipocrómicas (81%), los angiofibromas faciales (56%), y la piel de zapa (31%). Dentro de los hallazgos imagenológicos por tomografía del sistema nervioso se encontraron nódulos subepen-dimarios en el 92% de los casos y tuberosidades corticales en el 31%. (6). No hay datos que hagan referencia al estado actual del TSC en Colombia.
Manifestaciones clínicas. Las manifestaciones clínicas más frecuentes son las manchas hipocrómicas (presentes en el 90% de los pacientes), seguidas por los angiofibromas faciales (75% de los casos) (7). El TSC también se caracteriza por la presentación de hamartomas en múltiples órganos, predominan en el sistema nervioso, el eje cardiopulmonar y los riñones.
Las manifestaciones neurológicas comprenden diversos tipos de epilepsia, el retardo neurocognitivo y los trastornos en el espectro autista; el primero de estos síntomas está presente en el 60% a 90% de los casos, suele iniciar durante el primer año de vida y es una de las causas más frecuentes de espasmos infantiles. Con frecuencia, dicho hallazgo debuta con otro tipo de crisis como las parciales simples, las complejas y las tónico-clónicas generalizadas, que en la mayoría de los casos son refractarias al tratamiento farmacológico aún con múltiples medicamentos utilizados a altas dosis. Las manifestaciones neurocognitivas son secundarias a la presencia de tuberosidades corticales, aunque existe alguna controversia respecto de su evolución debido a que las manifestaciones persisten a pesar de haberse realizado una tuberectomía (7,8). Además, es posible encontrar nodulos subepen-dimarios distribuidos a lo largo de las paredes de los ventrículos laterales. Es frecuente que estos nódulos permanezcan sin modificación durante la vida, pero entre el 6% a 20% de los casos se transforman en astrocitomas subependimarios de células gigantes (del inglés Subependymal giant cell astrocytoma - SEGA) (8-10). Otras lesiones presentes en el cerebro de los pacientes con TSC son: agenesia del cuerpo calloso, displasia cortical, hemimegalencefalia, esquicencefalia, aneurismas intracraneales y la vasculopatía de Moya-moya (11). En lo histológico las alteraciones neurales se caracterizan por la proliferación de la glía y de los elementos neuronales con pérdida de la organización normal de las láminas corticales, con displasia celular que genera elementos gigantes. Junto a la mofología anormal, se presentan alteraciones en la migración radial de las neuronas, en la arborización dendrítica, en los transportadores y receptores de GABA (ácido gamma-aminobutírico), con disminución de la inhibición gabaérgica y disbalance en los neurotransmisores que favorecen el aumento de la excitación, lo que causa cambios secundarios en los receptores de glutamato (iGluRs) (12).
Los riñones se comprometen en el 50% a 80% de los pacientes, usualmente con angiomiolipo-mas, quistes renales, oncocitomas y carcinomas, el primero de estos representa el 80% de las lesiones renales y suelen ser causa de muerte debido a la compresión vascular y el sangrado. En el corazón se pueden encontrar rabdomiomas intracavitarios o murales en 50 - 70% de los casos. Dichas lesiones representan los tumores primarios más comunes encontrados in utero, y durante la infancia hacen sospechar el diagnóstico de TSC tras desencadenar falla cardíaca, arritmias o bloqueos. En buena cantidad de los pacientes estas lesiones pueden hacer regresión espontánea. El pulmón puede estar afectado por linfangioleiomiomatosis multifocal (30%), hiperplasia micronodular de neumocitos tipo 1 y tumores de células claras (11).
Criterios diagnósticos. El diagnóstico de TSC se basa en hallazgos clínicos y en el uso de neuroimágenes, a partir de los criterios establecidos en la Tuberous Sclerosis Complex Consensus Conference (13) (Tabla 1). Es importante considerar que no hay signos patognomónicos y que puede encontrarse hallazgos clínicos aislados sin otra evidencia física, imagenológica o genética del complejo. Por esta razón, se estableció la relevancia de encontrar lesiones en dos o más sistemas, o al menos dos lesiones típicas de TSC en el mismo órgano (14).
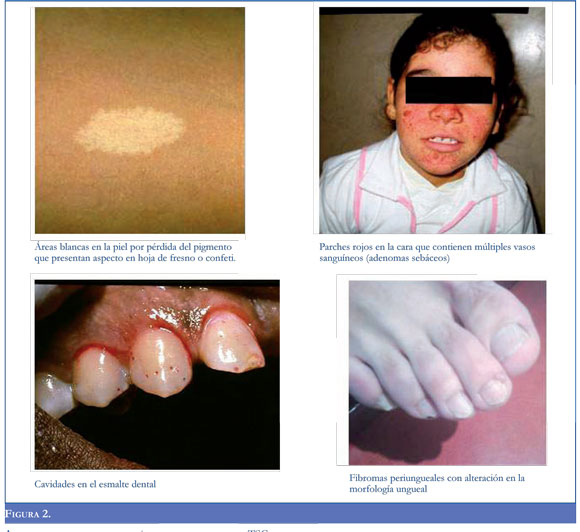
Se debe realizar una evaluación minuciosa de la piel para buscar lesiones características como los fibromas del lecho ungeal, las hendiduras o líneas dentarias, la presencia de fibromas en encías y las máculas hipocrómicas que se diagnostican con el uso de técnicas especiales con luz ultravioleta. Algunos de los hallazgos más representativos como: áreas blancas en la piel por pérdida del pigmento que presentan aspecto en hoja de fresno o confeti, parches rojos en la cara que contienen múltiples vasos sanguíneos (adenomas sebáceos), parches elevados en la piel con textura de cáscara de naranja (manchas tipo papel de lija) que se encuentran frecuentemente en el dorso y otros hallazgos como: cavidades en el esmalte dental, masas ásperas debajo o alrededor de las uñas en manos y pies y tumores benignos semejantes al caucho en la lengua o a su alrededor (Figura 2).
Genética del complejo esclerosis tuberosa. El TSC tiene un patrón de herencia auto-sómico dominante con penetrancia completa y marcada variación en su expresión incluso a nivel intrafamiliar (15). Se ha estimado que entre el 50% y el 75% de los eventos son esporádicos, con una tasa de mutaciónes por generación de 2,5x10-5 (16). Estudios realizados en individuos aparentemente sanos que han tenido dos o más hijos afectados por TSC muestran mutaciones germinales o mosaicismos somáticos en aproximadamente el 25% de los casos (17,18). Los mosaicismos somáticos determinan manifestaciones que dependen de cada tejido, siendo mínimas en buena parte de los casos por lo que pasa desapercibidas en un examen clínico rutinario. En la experiencia del grupo hay al menos dos casos de pacientes con un diagnóstico histológico de SEGA sin otras manifestaciones. Un caso semejante, confirmado con el estudio de mutaciones en diferentes tejidos, sustentó el fenómeno de un mosacismo somático en esta entidad (19).
El TSC es causado por mutaciones que inactivan los genes, TSC1 y 2 (Tuberous Sclerosis Complex Gene 1 and 2); el gen TSC1 se encuentra localizado en el cromosoma 9p34, mide 45 kb y está dividido en 23 exones que codifican un mRNA de 8.6 kb con un producto funcional denominado hamartina, una proteína de 1.164 aminoácidos. Se han descrito diversos tipos de mutaciones, desde cambios puntuales en una base, hasta deleciones. El gen TSC2 está ubicado en el segmento 16p13, mide 43 kb y está dividido en 41 exones que codifican la tuberina, una proteína de 1.807 aminoácidos com heterogeneidad mutacional (12,20).
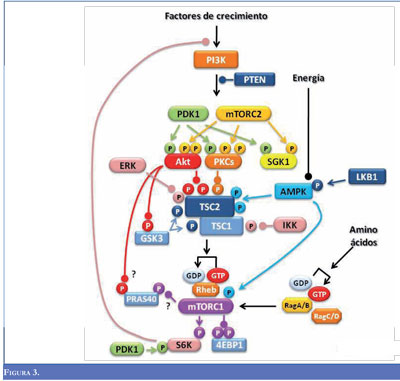
La hamartina y la tuberina interactúan al formar un complejo funcional denominado hamartina-tuberina y sus alteraciones interrumpen el proceso de señalización de la vía mTOR (Mammalian Target of Rapamycin), que es una serina/treonina cinasa de 289 kDa que tiene funciones pleiotrópicas debido a la participación en la regulación del inicio de la transcripción del mRNA y en la transducción de múltiples proteínas que intervienen en la organización del citoesqueleto, en el transporte a través de la membrana, en la degradación de proteínas, en la biogénesis de los ribosomas y en el control del ciclo celular (Figura 3) (21).
El complejo hamartina-tuberina también efectúa la inhibición de la PI3K (fosfatidil inositol-3-quinasa) y en la activación de señales dependientes de la vía de insulina, que afectan a mTOR, y a las cascadas de señalización de otras quinasas, lo que modifica el crecimiento celular y la proliferación (12). Además, activa la GTPasa de Rheb (Ras homolog enriched in brain), que a su vez regula a mTOR; al perderse este control, se generan niveles anormalmente altos de mTOR y, por ende, la activación cascada abajo de la señalización. La tuberina también se une a la p27, que está implicada en la regulación del ciclo celular. Debido a las funciones que desempeñan TSC1 y TSC2, estos genes son considerados supresores tumorales.
La pérdida de heterocigocidad es responsable de los hamartomas, de los tumores renales y cardíacos observados en el complejo (22,23); de forma global, las mutaciones pueden identificarse en el 85% de los pacientes que presentan signos clínicos de TSC, siendo más severo el compromiso fenotípico en quienes tienen alteraciones del TSC2. En casos familiares, existe igual probabilidad de encontrar mutaciones en TSC1 y 2, mientras en los esporádicos, menos del 25% tienen cambios en TSC1, y se asocian a un menor compromiso respecto de los casos esporádicos (22,23).
La severidad clínico-genética hace referencia al riesgo de retardo mental, crisis epilépticas, a la presentación de tuberosidades y de alteraciones renales. El mosaicismo es frecuente en los casos esporádicos, lo que determina que algunos pacientes no cumplan con los criterios clínicos y presenten una enfermedad de mayor severidad (24). El fenotipo variable se debe a una condición monogénica que presenta un patrón de transmisión mendeliano del tipo autosómico dominante; no obstante, en lo celular la patología se comporta como si fuese autosómica recesiva, pues requiere del fenómeno de pérdida de heterocigocidad (teoría de los dos golpes de Knudson) que ocurre aleatoriamente en los diferentes tejidos (24).
En el desarrollo del sistema nervioso central, el complejo hamartina/tuberina juega un papel fundamental en la evolución cortical, en la morfogénesis y para la adhesión celular, eventos que requieren de la interacción precisa entre éstas dos proteínas. La actividad sinérgica de ellas se ha documentado en los precursores neuronales entre las semanas 7 a 20 de gestación, donde afectan la división celular, migración y la diferenciación (12).
Diagnóstico molecular
El diagnóstico molecular tiene limitaciones ocasionadas por el tamaño de los genes, la heterogeneidad mutacional y el fenómeno de mosaicismo somático (25). Existen diferentes técnicas para la realización de éstas pruebas, las cuáles se describen a continuación.
La secuenciación del gen TSC2 permite detectar mutaciones en el 60 - 70% de los casos esporádicos y en el 50% de los familiares, mientras que en el gen TSC1 se detectan mutaciones en el 15% y 30%, de los casos esporádicos y familiares. La secuen-ciación no permite detectar deleciones grandes o rearreglos, eventos que son más frecuentes en el gen TSC2 (25-27). Siempre que se realiza esta técnica, existe la posibilidad de encontrar cambios que no representan un daño en la función de los productos protéicos, variaciones que tienen un significado clínico desconocido y demandan la realización de estudios en los padres o en familiares afectados (25-27).
Técnicas como el MLP (Multi-Layer Protocol), el FISH (Fluorescence in situ hybridization), o el Southern Blot se emplean cuando el análisis por secuenciación es negativo, lo que permite identificar mutaciones en el 0,5% al 5% de los casos. Por el fenómeno de mosaicismo, ante la ausencia de resultados positivos en los estudios moleculares, es recomendable realizar los análisis en tejidos diferentes a la sangre, incluyendo los tumores, la saliva, la piel y los folículos pilosos.
Asesoramiento genético
Los padres de un paciente con diagnóstico de TSC, que se considera como caso índice, deben ser evaluados clínicamente en busca de signos que sugieran el diagnóstico. La búsqueda de máculas hipocrómicas debe incluir en lo posible, la lámpara de Wood. Si uno de los padres está afectado, el riesgo de recurrencia del TSC en la descendencia es del 50%, sin embargo, si no hay evidencia clínica de enfermedad en los progenitores, no es posible descartar el fenómeno de mosaicismo, motivo por el que es importante realizar los análisis moleculares en sangre; en ausencia de mutaciones, en los elementos formes de la sangre, el riesgo de recurrencia es del 1% a 2%. Cuando se demuestra la existencia de alguna mutación, es posible realizar el diagnóstico genético preimplantación o prenatal (28).
Astrocitoma subependimario de células gigantes (SEGA)
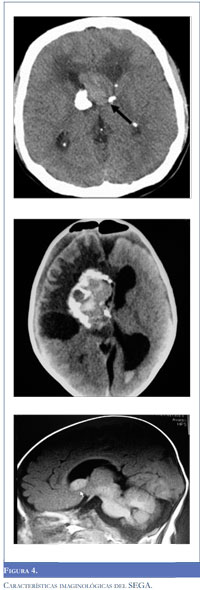
Diversos estudios de asociación genómica han encontrado que el riesgo familiar para el desarrollo de gliomas relacionados a síndromes familiares está circunscrito entre tres y cinco regiones cromosómi-cas; a partir del análisis de dos estudios de casos y controles que incluyó más de 20.300 pacientes con tumores de estirpe glial, se documentó un incremento del 70% en el riesgo de desarrollar este tipo de neoplasias entre las familias comprometidas (29). Adriaensen y colaboradores, describieron a partir de un estudio de corte transversal que incluyó 285 pacientes con TSC la evidencia tomográfica de SEGAs en el 20% de los casos, sin que hubiere diferencias significativas entre los dos sexos. Al momento del diagnóstico, el diámetro promedio de las lesiones fue de 11.4 milímetros (rango, 4-29 mm), la mediana para la edad de presentación fue de 31 años y el 21% tenía lesiones bilaterales. De igual forma, en el 14% de los casos se documentó hidrocefalia, y el acumulado para estimar el riesgo de encontrar una lesión glial de bajo grado favoreció la realización periódica (cada 3-6 meses) de resonancia magnética cerebral (RR 0.16, IC 95% 0.12-0.21) (Figura 4) (30). A partir de la revisión de los criterios diagnósticos para TSC realizada en 1998, se contempló la presencia de SEGAs aislados sin otras manifestaciones clínicas del complejo genético. Estos casos se consideran formas frustradas de TSC relacionadas con mosaicismo somático (19).
El compromiso cerebral en los pacientes con TSC consiste en la presencia de tuberomas corticales, heterotopias de la sustancia blanca, nódulos subependimarios y los SEGAs. La patogénesis común de estas alteraciones se asocia con el desarrollo cortical alterado por la migración y diferenciación anormal de las células embriónicas localizadas en la región sub-ventricular (31,32). La gran mayoría de los SEGAs se acompañan de otros nódulos subependimarios que no exhiben de forma constitutiva la pérdida de heterocigocidad ni la autofosforilación protéica de la vía mTOR (46% de los SEGAs y 14% de los tuberomas) (33). Desde la perspectiva clínica, la distinción entre los nódulos no neoplásicos y los SEGAs es importante debido a la influencia sobre las intervenciones terapéuticas relacionadas con el lento crecimiento de las lesiones tuberosas. Por el momento, los criterios imagenológicos para valorar el potencial tumoral de un nódulo subependimario son variables, en especial, debido a la mínima captación del contraste documentada en esta entidad. Son criterios relativos para definir la necesidad de cirugía o intervención con everolimus el tamaño tumoral, la localización de la lesión y su potencial para obstruir el drenaje normal del líquido cefalorraquídeo, la intensidad de señal en las secuencias T1 y la velocidad de crecimiento (Tabla 2).
En la evaluación microscópica, los SEGAs suelen estar compuestos por células tumorales disgregadas sobre un estroma vascular que incluye usualmente parénquima cerebral normal. Los elementos formes de estas lesiones tumorales son grandes, alargados y poligonales, y presentan un citoplasma hialino y rosado con núcleos excéntricos vesiculares y nucléolos prominentes. No es infrecuente encontrar el fenómeno de pseudopalizadas perivasculares ni pleomorfismo con células positivas para GFAP (Glial Fibrillary Acidic Protein; positivo en el 77% de los tuberomas y en el 50% de los SEGAs) y S100 (positivo en el 92% de los tuberomas y en el 100% de los SEGAs). En algunas ocasiones puede haber una alteración difusa para los neurofilamentos, hallazgo que sugiere una expresión híbrida de proteínas estructurales (34). La valoración patológica de las lesiones pulmonares, renales y uterinas asociadas con el TSC, presentan reactividad para HMB45, S6, SMI31, D28, sinaptofisina y MAP2. En contraposición, la gran mayoría de las lesiones cerebrales de origen astrocítico relacionadas con el TSC exhiben positividad para células gigantes que captan CD44, proteína necesaria para mantener la citoarquitectura y la capacidad de adhesión celular. También se ha postulado que la alteración en los genes TSC1/2 influencia la activación de cascadas proinflamato-rias favoreciendo ICAM-1, MAPK, NF-x[3 y TNF en los tuberomas corticales (35).
Varios estudios en modelos murinos han demostrado que las células gigantes encontradas en los astrocitromas sub-ependimarios expresan de forma aberrante marcadores de diferenciación neu-roglial, así como la displasia cortical (2,36) (Figura 5). Las células de mayor tamaño también pueden ser positivas para vimentina, NSE (88%), NCAM (63%), y nestina (100%); y negativas para cito-queratinas, desmina y EMA (epithelial membrane antigen); de forma global, el índice de proliferación cuantificado por el Ki67 suele ser inferior al 3-4%.
El diagnóstico diferencial de los SEGAs incluye los ependimomas, subependimomas, los tumores del plejo coroideo, los astrocitomas pilocíticos, los neurocitomas, tumores germinales primarios de la pineal, craneofaringiomas papilares, quistes coloides y los meningiomas. La distribución patológica diferencial de otro tipo de astrocitomas incluye las células no neoplásicas de origen neuronal y glial rodeadas por el tejido tumoral debido al patrón infiltrativo, en contraste los SEGAs tienen bordes bien definidos que con frecuencia involucran células mastocitarias y glia con pseudo-inclusiones intranucleares.
El origen de las lesiones tumorales tiene relación con la activación constitutiva de las mutaciones encontradas en los genes TSC1 y 2. Los productos originados por la transición del complejo TSC1/2 son la hamartina y tuberina, encargados de regular la función catalítica de TSC2 que promueve la hidrólisis de GTP a través de la GTPasa del Rheb. Varios estudios realizados en drosófilas han revelado que este complejo juega un papel esencial en el control del tamaño celular de la glia a través de la expresión del receptor para el factor de crecimiento similar a la insulina tipo 1 (IGFR-1). El complejo TSC inhibe las vías asociadas al efector mTOR encargado de favorecer el crecimiento tumoral; esta proteína se una a varios complejos proteicos regulados por el TORC1 y 2; la primera de estas proteínas representa un subgrupo de elementos sensibles a la rapamicina y consiste en la unión de raptor, MLST8, PRA40 y mTOR. El medicamento suprime la fosforilación de TORC1 y de varios de sus sustratos entre los cuales cabe mencionar las proteínas S6K1, S6K2, 4BMP1 y PRAS40. Por otra parte, TORC2 contiene a Rictor, MSIN1, MLST8, PRR5. Otros genes encargados de favorecer la progresión tumoral de los SEGAs son el LKB1 (Liver Kinase B1) y el PTEN, que conllevan mutaciones secundarias y la activación del factor derivado de la hipoxia tipo 1 (HIF-1), mecanismo que suprime los niveles de PIP3 y la activación de AKT. Otras de las alteraciones mecanicistas inducidas por la pérdida de función del complejo TSC1/2 tienen relación con la inducción del p53 y con el metabolismo celular de la glia que aumenta la sensibilidad a la insulina (37,38). Tyburczy y colaboradores seleccionaron 50 genes (11 aumentados y 39 disminuidos) en pacientes con SEGAs con la intención de categorizar subgrupos funcionales para explicar la biología tumoral. Los genes que demostraron alteraciones que contribuyeron con la tumorogénesis fueron el ANXA1, GPNMB, LTF, RND3, S100A11 y SFRP4. De ellos, los tres primeros se expresaron de forma diferencial en los progenitores neuroepiteliales afectos por la pérdida de TSC2 (37-39).
Clásicamente, el manejo de los SEGAs estaba circunscrito a la cirugía y a la radioterapia. La edad promedio para la realización de las intervenciones quirúrgicas es de 10 años, con una mediana entre el diagnóstico y la resección de 2 a 72 meses. En el pasado, hasta el 68% de los pacientes eran operados de urgencia con signos de hipertensión endocraneana y una morbilidad a largo plazo que superaba el 80% (40).
Recientemente, Krueger y colaboradores desarrollaron un experimento clínico fase II que incluyó 28 pacientes con TSC mayores de 3 años que tuvieran SEGAs con crecimiento progresivo candidatos a recibir everolimus 3 mg/m2 (concentraciones séricas entre 5 y 15 ng/ml). La intervención con el inhibidor mTOR se asoció con una reducción significativa en el volumen del SEGA a los 6 meses (p<0.001), con una regresión cercana al 30% en el 75% de la población y del 50% en el 32% de los pacientes. Los sujetos tratados no tuvieron nuevas lesiones, ni tampoco deterioro en el grado de hidrocefalia, incremento en la presión intracraneal o necesidad de cirugía/radioterapia para el manejo de las neoplasias. En 16 pacientes se realizó un registro encefalográfico de 24 horas que permitió encontrar una disminución en la frecuencia de las crisis epilépticas en 9 casos con un incremento medio en la puntuación para el cuestionario de calidad de vida de niños con epilepsia de 63.4+12.4 a los 3 meses y de 62.1+14.2 a los 6 meses. Globalmente, pocos pacientes tuvieron sinusitis grado III, neumonitis, estomatitis, bronquitis viral y leucopenia (41).
CONCLUSIONES
El conocimiento del TSC ha avanzado drásticamente con la aplicación de las nuevas técnicas en biología molecular; el estudio y manejo integral de ésta patología es viable en el nacional, evento que permite el diagnóstico oportuno para reducir la posibilidad de presentar complicaciones relacionadas con la cronificación de las manifestaciones genéticas del síndrome. Actualmente se cuenta con intervenciones dirigidas contra las variaciones genómicas de esta entidad nosológica que reducen el riesgo de complicaciones como los SEGAs, neoplasias de pueden afectar dramáticamente la calidad de vida.
REFERENCIAS
1. Test and teach. Explanation and diagnosis: subependymal giant cell astrocytoma. Pathology 1999; 31: 51. [ Links ]
2. ESS KC, KAMP CA, TU BP, GUTMANN DH. Developmental origin of subependymal giant cell astrocytoma in tuberous sclerosis complex. Neurology. 2005;64:1446-1449. [ Links ]
3. KRUEGER DA, FRANZ DN. Current management of tuberous sclerosis complex. Paediatr Drugs. 2008;10:299-313. [ Links ]
4. CRINO PB, ARONICA E, BALTUCH G, NATHANSON KL. Biallelic TSC gene inactiva-tion in tuberous sclerosis complex.. Neurology® 2010;74:1716-1723 [ Links ]
5. PASCUAL-CASTROVIEJO I, PASCUAL SI, VELÁZQUEZ R, VIAÑO J, CARCELLER F, HERNÁNDEZ JL, ET AL. Astrocitoma subependi-mario de células gigantes en el complejo de Esclerosis tuberosa. Presentación de ocho pacientes infantiles. Neurología. 2010;5:314-321. [ Links ]
6. HYMAN MH, WHITTEMORE VH. National Institutes of Health consensus conference: Tuberous sclerosis complex. Arch Neurol2000;57: 662-665. [ Links ]
7. TAKATA K, GASPARETTO EL, LEITE CDA C, LUCATO LT, REED UC, MATUSHITA H, ET AL. Subependymal giant cell astrocytoma in patients with tuberous sclerosis: magnetic resonance imaging findings in ten cases. ArqNeuropsiquiatr. 2007;65:313-316. [ Links ]
8. HAHN JS, BEJAR R, GLADSON CL. Neonatal subependymal giant cell astrocytoma associated with tuberous sclerosis: MRI, CT and ultrasound correlation. Neurology. 1991;41:124-128. [ Links ]
9. MEDHKOUR A, TRAUL D, HUSAIN N. Neonatal subependymal giant cell astrocytoma. Pediatr Neurosurg. 2002;36:271-4. [ Links ]
10. HUSSAIN N, CURRAN A, PILLING D, MAL-LUCI CL, LADUSANS EJ, ALFIREVIC Z, ET AL. Congenital subependymal giant cell astrocytoma diagnosed on fetal MRI. Arch Dis Child. 2006;91:520. [ Links ]
11. DIMARIO FJ JR. Brain Abnormalities in Tuberous Sclerosis Complex. J Child Neurol. 2004;19:650-657. [ Links ]
12. NAPOLIONI V, MOAVERO R, CURATOLO P. Recent advances in neurobiology of Tuberous Sclerosis Complex. Brain & Development 2009;31: 104-113. [ Links ]
13. ROACH ES, GOMEZ MR, NORTHRUP H. Tuberous sclerosis complex consensus conference: revised clinical diagnostic criteria. J Child Neurol. 1998;13:624-628. [ Links ]
14. ROACH ES, SPARAGANA SP. Diagnosis of tuberous sclerosis complex. J Child Neurol. 2004;19:643-649. [ Links ]
15. HUSON SM, KORF BR. The Phakomatoses; in: Rimoin DL, Connor JM, Pyeritz RE, Korf BR eds; Principles and practice of medical genetics, 5th Ed. Edinburgh: Churcill Livingstone 2007; 2817-2850. [ Links ]
16. OSBORNE JP, FRYER A, WEBB D. Epidemiology of tuberous sclerosis. Ann N Y Acad Sci. 1999;615:125-127. [ Links ]
17. SAMPSON JR, MAHESHWAR MM, ASPIN-WALL R, THOMPSON P, CHEADLE JP, RAVINE D, ET AL. Renal cystic disease in tuberous sclerosis: role of the polycystic kidney disease 1 gene. Am J Hum Genet. 1997;61:843-851. [ Links ]
18. VERHOEF S, BAKKER L, TEMPELAARS AM, HESSELING-JANSSEN AL, MAZURCZAK T, JOZ-WIAK S, ET AL. High rate of mosaicism in tuberous sclerosis complex. Am J Hum Genet. 999;64:1632-1637. [ Links ]
19. ICHIKAWA T, WAKISAKA A, DAIDO S, TAKAO S, TAMIYA T, DATE I, ET AL. A Case of Solitary Subependymal Giant Cell Astrocytoma Two Somatic Hits of TSC2 in the Tumor, without Evidence of Somatic Mosaicism. JMolDiagn. 2005;7:544-549. [ Links ]
20. YOUNG J, POVEY S. The genetic basis of tuberous sclerosis. Mol Med Today.1998;4:313-19. [ Links ]
21. THOMAS G, HALL MN. TOR signalling and control of cell growth. Curr Opin Cell Biol. 1997;9:782-787. [ Links ]
22. SEPP T, YATES JR, GREEN AJ. Loss of heterozygosity in tuberous sclerosis hamartomas. J Med Genet 1996;33:962-964. [ Links ]
23. NIIDA Y, STEMMER-RACHAMIMOV AO, LOGRIP M, TAPON D, PEREZ R, KWIATKOWSKI DJ, ET AL. Survery of somatic mutations in tuberous sclerosis complex (TSC) hamartomas suggests different genetic mechanisms for pathogenesis of TSC lesions. Am J Hum Genet 2001;69:493-503. [ Links ]
24. JONES AC, DANIELLS CE, SNELL RG, TACH-ATAKI M, IDZIASZCZYK SA, KRAWCZAK M, ET AL. Molecular genetic and phenotypic analysis reveals differences between TSC1 y TSC2 associated familial and sporadic tuberous sclerosis. Hum Mol Genet. 1997;6:2155-2161. [ Links ]
25. AU KS, WILLIAMS AT, ROACH ES, BATCH-ELOR L, SPARAGANA SP, DELGADO MR, ET AL. Genotype/phenotype correlation in 325 individuals referred for a diagnosis of tuberous sclerosis complex in the United States. Genet Med. 2007;9:88-100. [ Links ]
26. DABORA SL, JOZWIAK S, FRANZ DN, ROBERTS PS, NIETO A, CHUNG J, ET AL. Mutational analysis in a cohort of 224 tuberous sclerosis patients indicates increased severity of TSC2, compared with TSC1, disease in multiple organs. Am J Hum Genet. 2001;68:64-80. [ Links ]
27. JONES AC, SHYAMSUNDAR MM, THOMAS MW, MAYNARD J, IDZIASZCZYK S, TOMKINS S, ET AL. Comprehensive mutation analysis of TSC1 and TSC2-and phenotypic correlations in 150 families with tuberous sclerosis. Am J Hum Genet. 1999;64:1305-1315. [ Links ]
28. LIZCANO-GIL LA, LUCENA C, LUCENA E. Methods in preimplantation genetic diagnosis. Reprod Biomed. Online 2001;2:20-31. [ Links ]
29. KYRITSIS AP, BONDY ML, RAO JS, SIOKA C. Inherited predisposition to glioma. Neurooncol. 2010;12:104-113. [ Links ]
30. ADRIAENSEN ME, SCHAEFER-PROKOP CM, STIJNEN T, DUYNDAM DA, ZONNENBERG BA, PROKOP M. Prevalence of subependymal giant cell tumors in patients with tuberous sclerosis and a review of the literature. Eur J Neurol 2009;16:691-695. [ Links ]
31. MALDONADO M, BAYBIS M, NEWMAN D, ET AL. Expression of ICAM-1, TNF-alpha, NF kappa B, and MAP kinase in tubers of the tuberous sclerosis complex. Neurobiol Dis 2003;14:279-290. [ Links ]
32. Gómez M, Sampson J, Whittemore V, eds. The tuberous sclerosis complex. 3th Ed. Oxford, England: Oxford University Press, 1999. [ Links ]
33. CHAN JA, ZHANG H, ROBERTS PS, JOZWIAK S, WIESLAWA G, LEWIN-KOWALIK J, ET AL. Pathogenesis of tuberous sclerosis subependymal giant cell astrocytomas: biallelic inactivation of TSC1 or TSC2 leads to mTOR activation. J NeuropatholExp Neurol. 2004;63:1236-1242. [ Links ]
34. YOU H, KIM YI, IM SY, SUH-KIM H, PAEK SH, PARK SH, ET AL. Immunohistochemical study of central neurocytoma, subependymoma, and subependymal giant cell astrocytoma. J Neurooncol. 2005;74:1-8. [ Links ]
35. SHEPHERD CW, SCHEITHAUER BW, GOMEZ MR, ALTERMATT HJ, KATZMANN JA. Subependymal giant cell astrocytoma: a clinical, pathological, and flow cytometric study. Neurosurg. 1991;28:864-868. [ Links ]
36. JOZWIAK J, JOZWIAK S, SKOPINSKI P. Immunohistochemical and microscopic studies on giant cells in tuberous sclerosis. Histol Histopathol. 2005;20:1321-1326. [ Links ]
37. INOKI K, GUAN KL. Tuberous sclerosis complex, implication from a rare genetic disease to common cancer treatment. Hum Mol Genet. 2009;18(R1):R94-100. [ Links ]
38. MIEULET V, LAMB RF. Tuberous sclerosis complex: linking cancer to metabolism. Trends Mol Med. 2010;16:329-335. [ Links ]
39. TYBURCZY ME, KOTULSKA K, POKAROWSKI P, MIECZKOWSKI J, KUCHARSKA J, GRA-JKOWSKA W, ET AL. Novel proteins regulated by mTOR in subependymal giant cell astrocytomas of patients with tuberous sclerosis complex and new therapeutic implications. Am J Pathol. 2010;176:1878-1890. [ Links ]
40. CUCCIA V, ZUCCARO G, SOSA F, MONGES J, LUBIENIEKY F, TARATUTO L. Subependymal giant cell astrocytoma in children with tuberous sclerosis. Child Nerv Syst 2003;19: 232-243. [ Links ]
41. KRUEGER DA, CARE MM, HOLLAND K, AGRICOLA K, TUDOR C, MANGESHKAR P, ET AL. Everolimus for subependymal giant-cell astrocytomas in tuberous sclerosis. N Engl J Med. 2010;363:1801-1811. [ Links ]