Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Neurológica Colombiana
versão impressa ISSN 0120-8748
Acta Neurol Colomb. vol.28 no.1 Bogotá jan./mar. 2012
Linfoma primario del sistema nervioso central: serie de casos
Primary lymphoma of the central nervous system: case series
Jorge Andrés Jiménez Arango. Residente de Neurología Universidad de Antioquia. Correo electrónico: Jorge.neurologia@gmail.com
Salomé Martínez López. Médico y cirujano. Juan Pablo Gómez Escobar. Médico y cirujano. Universidad Pontificia Bolivariana. Carlos Santiago Uribe Uribe. Neurólogo, Profesor sección de posgrado. Juan Carlos Arango Viana. Neuropatólogo, Profesor sección de posgrado. Facultad de Medicina, Universidad de Antioquia. Medellín, Colombia.
Recibido: 16/01/12. Revisado: 19/01/12. Aceptado: 13/02/12.
RESUMEN
INTRODUCCIÓN: el linfoma primario del sistema nervioso central (LPSNC) corresponde a una causa de importante mortalidad dentro de los tumores primarios del sistema nervioso central, además existen pocos datos epidemiológicos actualmente, razón por la cual se decide hacer un reporte de casos en el grupo de neuropatología de la Universidad de Antioquia.
OBJETIVO: describir el comportamiento de esta patología en un grupo de pacientes.
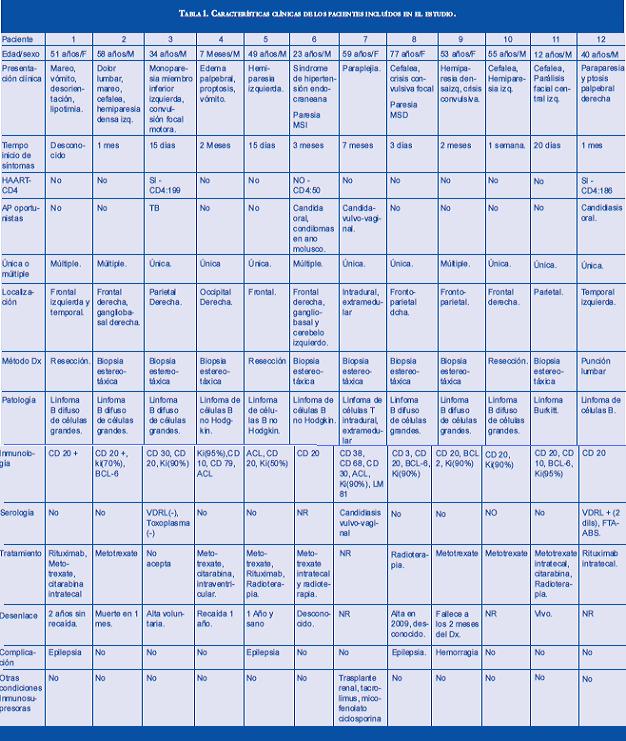
MATERIALES Y MÉTODOS: se revisaros los estudios patológicos e historias clínicas de 12 pacientes con diagnóstico de LPSNC en el servicio de neuropatología de la Universidad de Antioquia 2004 el 2011.
RESUTADOS: se encontraron 12 pacientes que cumplían el criterio de inclusión. De estos pacientes el 61.5% fueron hombres y el 38.5% mujeres. La edad promedio al momento del diagnóstico fue de 42.6 años (1- 77 años). El Linfoma B no hodking de células gigantes con patrón difuso fue el tumor más frecuente con un 83.3 %, 8.35% corresponde a linfoma de células T, 8.35% a Linfoma de Burkitt; 33.3 % corresponden a pacientes inmunode-ficientes.
CONCLUSIÓN: en esta serie de pacientes con linfoma del sistema nervioso central se encontraron características clínicas similares a las encontradas en la literatura, quizás el único hallazgo disímil fue la mayor cantidad de pacientes sin aparente alteración en el sistema inmune.
PALABRAS CLAVES. Sistema Nervioso Central, Linfoma no Hodgkin, Radioterapia, Quimioterapia (DeCS).
SUMMARY
INTRODUCTION: primary lymphoma of the central nervous system (PCNSL) is a major cause of mortality in primary tumors of the central nervous system, plus there are only a few epidemiological data today, these are the reasons why it was decided to make a report of cases in the group of neuropathology at the University of Antioquia.
OBJETIVES: to describe the behavior of this disease in group of patients.
MATERIALS AND METHODS: we reviewed the pathological studies and clinical records of 12 patients diagnosed with PCNSL in the service of neuropathology at the University of Antioquia from the years of 2004 to 2011.
RESULTS: there were 12 patients who met the inclusion criteria. Of these patients, 61.5% were male and 38.5% women. The average age at diagnosis was 42.6 years (1 - 77 years). The giant cell, diffuse pattern B non-Hodgkin lymphoma was the most frequent tumor with 83.3%,T- cell lymphoma with 8.35%, Burkitt lymphoma 8.35%; 33.3% of the patients were immunodeficient.
CONCLUSION: in this series of patients with central nervous system lymphoma similar clinical characteristics were found to those in the medical literature, perhaps the only different finding was a higher rate of patients without an apparent alteration in the immune system.
KEY WORDS. Central Nervous System, Lymphoma Non-Hodgkin, Radiotherapy, Drug Therapy (MeSH).
INTRODUCCION
El linfoma primario del sistema nervioso central (LPSNC) es una variante extra nodal poco común de los linfomas no Hodgkin que afecta exclusivamente el cerebro, las leptomeninges, ojos o con menor frecuencia la medula espinal. Debido a su baja frecuencia y principalmente a la dificultad para la obtención de tejido se ha limitado la tipificación molecular de estos tumores y la investigación con nuevas terapias. Esto es importante puesto que no se ha llegado a un consenso en cuanto a la terapia ideal. En el presente artículo informamos 12 casos vistos en el grupo de neuropatología de la Universidad de Antioquia con seguimiento clínico.
MATERIALES Y METODOS
Se revisaron los estudios patológico de los pacientes con diagnóstico de linfoma primario de sistema nervioso central (SNC) realizado en el departamento de neuropatología de la Universidad de Antioquia entre el año 2004-2011; de éstos se revisó historia clínica y estudios imagenológicos para excluir aquellos pacientes en quienes la afectación del SNC no era exclusiva.
Se elaboró un trabajo descriptivo retrospectivo donde se analizaron edad, sexo, presentación clínica, estado inmunológico, número de lesiones en estudios de neuroimagen así como su localización, método de diagnóstico, hallazgos histopatológicos, tratamiento y desenlace. El criterio de inclusión fue: pacientes a quienes se les realizó diagnóstico histopatológico de linfoma en el departamento de neuropatología de la Universidad de Antioquia en el periodo señalado; se excluyeron aquellos pacientes en quienes se encontró afectación concomitante en órganos distintos al SNC.
RESULTADOS
Se encontraron 12 pacientes que cumplían el criterio de inclusión. De estos pacientes el 66.6 % fueron hombres. La edad promedio al momento del diagnóstico fue de 42.6 años (rango 1- 77 años). El diagnóstico se hizo por medio de biopsia estereotáxica en el 66.6 %, resección 25 %, punción lumbar 8.3 %.
De los reportes histopatológicos el 83.3 % corresponde a linfoma B no Hodking de células grandes con patrón difuso, 8.35% a linfoma de células T, 8.35% a linfoma de Burkitt; en ningún reporte se observo afección ocular.
El 33.3 % (4/12) presentaban inmunodeficien-cia, 3 pacientes con SIDA de los cuales 2 recibían HAART (de la sigla en inglés Highly active antirretro-viral theraphy) en el momento del diagnóstico. Otro se negó a recibirla, otro recibía terapia inmunosupre-sora (tacrolimus, micofenolato y ciclofosfamida) por ser trasplantado renal.
Un tercio de los pacientes presentaban lesiones múltiples y los demás lesiones únicas. La localización encontrada en el 80% de los casos fue periventri-cular y con respecto a su localización hemisférica fue: frontal 53.8%, parietal 30.7%, temporal 15.3%, ganglio-basal 15.3%, occipital 7.6%, cerebelo 7.6 %, intradural extramedular 7.6%; varios de ellos tenían compromiso multilobular.
El tiempo de inicio de síntomas hasta el al diagnóstico tuvo una media de 27.4 días con una desviación estándar de 59.5 días, con un valor mínimo de 3 días y máximo de 210 días.
En cuanto al tratamiento empleado, 3 pacientes recibieron metotrexate como monoterapia, 4 pacientes quimioterapia combinada, 3 pacientes combinación de quimioterapia y radioterapia, 1 paciente radioterapia como único manejo y 1 paciente con rituximab intratecal.
DISCUSIÓN
La primera descripción sobre LPSNC fue hecha por Bailey en 1929 como sarcoma "perithelial" del cerebro (1). El LPSNC es un tumor poco común que se presenta en el cerebro, las leptomeninges, los ojos y con menor frecuencia la medula espinal, sin comprobarse enfermedad sistémica.
La incidencia ajustada por edad del LPSNC es de 4 casos por millón de personas al año y puede alcanzar el 4% de los tumores primarios del sistema nervioso central (2). El factor determinante para el desarrollo de la enfermedad es la inmunosupresión, bien sea congénita (como la ataxia telangiectasia y el síndrome de Wiskott-Aldrich) o adquirida entre estas últimas se encuentran la inmunosupresión iatro-génica (ej. post-trasplante) y la infección por VIH (3, 4). Es llamativo que en esta serie solo un tercio de los pacientes presentaban algún tipo de inmu-nodeficiencia, creemos que esto es secundario a la ausencia de un protocolo establecido de diagnóstico ya que algunos pacientes, como aquellos con SIDA en algunas ocasiones no se les realiza biopsia y en algunos otros se utilizan esteroides, los cuales, alteran dramáticamente la morfología tumoral y por ende el rendimiento diagnóstico. El riesgo de desarrollar LPSNC también aumenta en pacientes con enfermedades autoinmunes como el lupus eritematoso sistémico, la sarcoidosis, vasculitis, etc. (4).
Entre los pacientes con SIDA la incidencia del LPSNC alcanza del 2 al 6%, pero se ha informado hasta en 10% de ellos, antes del advenimiento de la terapia antiretroviral altamente efectiva (5-7). En estos pacientes el LPSNC es la segunda causa de lesiones intracraneanas luego de la toxoplasmosis y la incidencia de este linfoma es por lo menos 1000 veces más alta que la de la población general (5).
El pronóstico de estos pacientes continúa siendo pobre comparado con los otros linfomas extra nodales, con una sobrevida a 5 años del 22-40% (8).
La mayoría de los casos de LPSNC en pacientes inmunocompetentes se diagnostican entre los 40 a 70 años, con una edad media de aparición hacia los 45-50 años (9, 10). Hombres y mujeres se afectan en igual proporción. En este reporte, la edad promedio de la aparición de la lesión fue de 42.6 años.
El 90% de los LPSNC no asociados con VIH son linfomas B de células grandes con patrón difuso y en el 10% restante se encuentran linfomas de Burkitt, linfomas de células T o linfomas de bajo grado pobremente diferenciados (10), similar a lo encontrado en esta serie de casos en donde el 83.3% fueron linfoma B no hodking de células grandes con patrón difuso.
La fisiopatología del LPSNC permanece por esclarecer, se desconoce si la transformación maligna de células linfoides se da localmente luego del paso intraparenquimatoso por un proceso inflamatorio o si estas células se transforman periféricamente y desarrollan un tropismo especial por el encéfalo, meninge, globo ocular o medula espinal (11-13). Ya que la diseminación sistémica es poco común, es probable que las células originarias del LPSNC sean linfocitos malignos los cuales se erradican por el sistema inmune de la circulación periférica, pero sobreviven en el sistema inmune del SNC (9). A su vez la alta incidencia de este trastorno en condiciones inmunosupresoras sugiere un papel primordial del sistema inmune en la génesis del LPSNC.
En los pacientes con SIDA los LPSNC también son derivados de células B en su gran mayoría (14), sin embargo en los pacientes con deficiencias del sistema inmune el panorama difiere por varios motivos. El desarrollo de las neoplasias linfoides relacionadas con el SIDA, está parcialmente relacionado con el deterioro progresivo de la función de las células den-dríticas y la desorganización funcional resultante en los ganglios linfáticos que produce la infección por VIH, tanto como por el aumento en la producción de citocinas (15-17). Otro factor implicado en la diseminación del LPSNC en el SNC es la adhesión potenciada de los linfocitos neoplásicos a las células endoteliales, causada por la infección de las células linfoides por el virus del VIH (mediado principalmente por la proteína viral Tat), este endotelio a su vez produce una serie de factores de crecimiento como VCAM-1, selectina-E e ICAM-1 lo cual acelera la extravasación de las células tumorales a los tejidos (18-20). Por otro lado prácticamente en todos los pacientes con SIDA, se encuentra material genómico del virus Epstein Barr (VEB) en las células tumorales (7, 21-24). Probablemente debido a defectos en la inmunidad de células T contra el VEB (25); pues estas células adquieren una pérdida progresiva en la capacidad de producción de interferón gama en respuesta a péptidos del VEB (26). Por cada decremento en 50 células CD4 por micro litro de sangre se tiene un HR de 1.85, IC95% = 1.58 a 2.16 para desarrollo de LPSNC (27). Se ha propuesto a su vez que la inmunosupresión y la infección por VEB favorece la expansión de clones de células B, permitiendo que clones de células con mutaciones en oncogenes y genes supresores de tumores proliferen, en este caso dentro de los oncogenes más importantes se encuentra el c-MYC (28). Las secuencias del ADN del VEB pueden detectarse en el líquido cefalorraquídeo (LCR) de estos pacientes, lo cual puede ayudar en el diagnóstico. En una serie de pacientes infectados con VIH que tenían lesiones focales en el encéfalo, las secuencias fueron detectadas en 80% de quienes tuvieron LPSNC y no se hallaron en quienes no tenían tumor (29). No obstante en la mayoría de los pacientes inmunocompetentes no se encuentra el ADN del VEB en sus células tumorales lo que crea un interrogante por responder en cuanto a la patogénesis de este grupo en particular.
En el LPSNC se reconocen cinco posibles patrones de afección:
Linfoma cerebral primario: son lesiones intracraneanas únicas o múltiples, usualmente con localización periventricular, los hallazgos clínicos dependen de la localización de la lesión. En una serie de pacientes inmunocompetentes los síntomas más frecuentes fueron, déficit neurológico focal, síntomas neurosiquiátricos, signos de hipertensión intracraneana, crisis epilépticas y síntomas oculares (30). Los síntomas neurosiquiátricos más comunes son trastornos de la personalidad, depresión, sicosis y alucinaciones visuales. Las crisis epilépticas son menos comunes que en otras neoplasias del SNC debido a que el LPSNC involucra predominantemente la sustancia blanca subcortical. Muy pocos casos se presentan con síntomas B como fiebre, pérdida de peso y sudoración nocturna los cuales si son encontrados en otros linfomas no Hodgkin.
Linfoma espinal primario: se presenta en menos del 1% de los casos, generalmente en segmentos cervicales bajos o torácicos altos y el paciente se presentara con síntomas y signos de mielopatía que dependerán de la altura de la lesión. Generalmente se presenta como nódulos intramedulares definidos, distinto al compromiso secundario de un linfoma sistémico donde usualmente son extra medulares y con importante realce meníngeo (31-33), solo se han informado tres casos en la literatura de linfoma primario de células T de localización intradural extramedular, todos cervicales, ninguno reportado con afectación en el cono medular como el paciente evaluado en nuestro servicio y que se muestra en la tabla 1 (34-36).
Linfoma leptomeníngeo primario: para su diagnóstico se requiere que el compromiso meníngeo sea aislado el cual se presenta en el 7% de los pacientes, no obstante debe descartarse una meningitis linfomatosa metastásica de un linfoma sistémico pues es su sitio habitual de metástasis en el SNC, además involucra del 10 al 25% de los pacientes con afectación parenquimatosa inicial. Los síntomas más frecuentes son irritación meníngea, cefalea, compromiso de pares craneanos, hidrocefalia y radiculopatías cervicales (37-39).
Linfoma ocular primario: se define como un LPSNC con afectación ocular sin evidencia de lesión del parénquima cerebral ya que aproximadamente el 25% de los tumores parenquimatosos desarrollaron compromiso intraocular y aproximadamente el 50% de aquellos con inicio ocular desarrollaran compromiso encefálico (40). La afección puede ser uni o bilateral y generalmente involucra el segmento posterior incluyendo la retina, la coroides y el vítreo, generando desprendimiento de retina, uveítis y hemorragias (41); ocasionalmente puede haber infiltración tumoral de la arteria central de la retina con neuropatía óptica subsecuente. Los síntomas son poco específicos y hasta el 38% pueden ser asintomáticos (42). La citología del LCR con citometría de flujo es positiva en el 23% de los casos lo cual ayuda en el diagnóstico (42), también son de gran utilidad los altos niveles de interleuquina 10 en el humor vítreo o acuoso (43), pero para su diagnóstico definitivo casi siempre se requiere biopsia del lugar afectado.
Neurolinfomatosis: se conoce así a la infiltración del nervio periférico, las raíces nerviosas espinales, los nervios craneanos y plexos por las células tumorales. Puede involucrar tanto nervios sensitivos como motores y dependiendo de ello serán las manifestaciones clínicas, estas aparecen mucho tiempo antes del diagnóstico por lo cual se requiere un alto índice de sospecha, no es frecuente la afectación del parénquima cerebral ni tampoco de las meninges por lo tanto la citología del LCR no aporta en el diagnóstico. Las imágenes por RM en algunos casos muestran aumento del tamaño o realce en las raíces, troncos o nervios periféricos, sin embargo es un hallazgo inespecífico (44-47).
El diagnóstico como en cualquier lesión neoplá-sica requiere confirmación histológica, siempre que sea posible de material ocular o LCR, cuando no lo sea debe realizarse biopsia estereotáctica de la lesión intraparenquimatosa para confirmar el diagnóstico.
El grupo colaborativo internacional para LPSNC ha propuesto unas guías para la evaluación de pacientes con sospecha de este trastorno (48). En el examen físico debe enfatizar en la evaluación de los ganglios linfáticos y los testículos por la particular predilección de los linfomas testiculares de migrar al SNC. La resonancia magnética (RM) es el método de elección, cuando está contraindicada se utiliza la tomografía computarizada (TC) con contraste. También está indicada la evaluación del LCR y oftalmológica mediante la lámpara de hendidura. A su vez es necesario descartar la afectación sistémica mediante ecografía testicular, TC corporal total y biopsia de medula ósea. La química sanguínea, la deshidrogenasa láctica y las pruebas para VIH también se recomiendan. No así la tomografía corporal total por emisión de positrones para la búsqueda de un primario oculto; sin embargo un ensayo clínico (49), demostró que el 8% de los pacientes tenían un linfoma no Hodgkin sistémico oculto luego de la tomografía por emisión de positrones con 18F-fluorodesoxiglucosa, teniendo TC corporal total y biopsia de médula ósea previos negativos.
El estudio de LCR es necesario siempre que no esté contraindicado por el riesgo de herniación inherente a cualquier lesión que pueda ejercer efecto de masa. Siempre debe efectuarse antes o una semana después de la cirugía para evitar falsos positivos. Debe solicitarse conteo celular, proteínas, glucosa, citología, citometría de flujo y estudio de reordenamiento del gen de la cadena pesada de la inmunoglobulina.
La presencia de células linfoides en el estudio de LCR se observa en el 30% de los individuos con LPSNC. Se encuentra pleocitosis de predominio linfocitario con proteinorraquia aumentada, la glu-corráquia es normal o puede estar disminuida en casos de infiltración meníngea (50). En ocasiones es difícil establecer la diferencia entre células reactivas o tumorales, por lo tanto es necesario análisis inmunofenotípico para establecer el origen linfoide y la clonalidad de las células malignas, además de diferenciar entre células B o T. El estudio de reordenamiento del gen de la cadena pesada de la inmunoglobulina se hace por reacción en cadena de polimerasa (PCR) y debe reportar clonalidad, tiene una sensibilidad aproximada del 54 - 70% ya que los LPSNC pueden ser policlonales inicialmente y los "primers" usados en PCR no incluyen todos los posibles sitios de reordenamiento (51-53).
La RM es el método de elección. Las lesiones en pacientes inmunocompetentes son únicas en el 70 - 81% de los casos (54, 55) los restantes muestran un patrón multifocal, lo cual se correlaciona con lo encontrado en esta serie de casos. En los pacientes con SIDA 50% son multifocales; distintos a lo encontrado en nuestros pacientes donde se encontró predominantemente lesiones. Las lesiones son peri ventriculares hasta en 60% de los casos y los restantes son en los hemisferios frontal, parietal, temporal y occipital en orden descendente de frecuencia (30); otro informe también en pacientes inmunocom-petentes muestra que las lesiones son solitarias en 65% de los casos y se localizan en los hemisferios cerebrales (38%), el talamo/ganglios basales (16%), el cuerpo calloso (14%), la región periventricular (12%), y el cerebelo (9%) (54). Estos datos coinciden con lo encontrado en esta serie donde el 80 % fueron periventriculares en el lóbulo frontal.
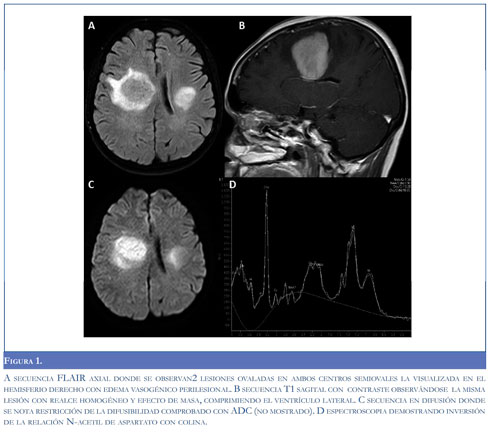
Las lesiones son isodensas o hiperdensas en la TAC (56), en la RM hipointensas en la secuencia de T2 con un patrón de realce homogéneo con la administración de gadolinio (54, 55, 57), también se han descrito hallazgos como el signo de la escotadura en pacientes inmunosuprimidos e inmunocompe-tentes y patrones de realce en anillo incompleto, estos últimos semejan lesiones desmielinizantes, no obstante el anillo en estos es delgado y uniforme, contrario al visto en LPSNC el cual es grueso y no uniforme (55, 58). El edema perilesional es menor al encontrado en otras lesiones tumorales como gliomas o metástasis. En las imágenes de difusión se observa restricción en 90% de los casos antes del tratamiento (59) (Figura 1). En la espectroscopia se observa relación aumentada de colina/creatina y disminuida de N-acetil aspartato/colina así como N-acetil aspartato/creatina (59) (Figura 1).Otros patrones menos frecuentes son calcificaciones, cambios quísticos y realce en anillo (56, 57), este último puede presentarse en pacientes inmunosuprimidos.
Los factores pronósticos en cualquier tumor ayudan al equipo médico a discutir con los pacientes acerca de su pronóstico y permite la aplicación de estrategias terapéuticas ajustadas según el riesgo.
En LPSNC hay varios sistemas de evaluación pronóstica. Uno de ellos (60) propuso dividir estos pacientes en tres grupos basado en su funcionalidad: individuos menores de 50 años, individuos mayores de 50 años y con un índice de Karnofski mayor de 70 y aquellos mayores de 50 años con Karnofski menor de 70; se observaron diferencias significativas en la supervivencia global. El grupo de estudio internacional de linfoma extra nodal propone una escala de 0 a 5 incluyendo 5 variables: edad, funcionalidad, deshidrogenasa láctica, proteinorraquia y afectación de estructuras profundas (61). Otro (62) propone una escala de tres parámetros definida por tres factores pronósticos independientes: edad, funcionalidad y extensión del compromiso cerebral.
En cuanto al tratamiento se han intentado varias estrategias como la resección quirúrgica del LPSNC no es una medida útil dada la naturaleza infiltrativa de la lesión, y la posibilidad de presentación multifocal lo cual hace difícil la resección completa, por lo tanto la cirugía solo se utiliza en caso de requerir biopsia; en vista de esto entre las posibilidades terapéuticas estan los esteroides, la quimioterapia, la radioterapia y la inmunoterapia.
Una de las características del LPSNC es su rápida respuesta a los esteroides en ocasiones tan alta como 70% (63), al parecer por linfocitolisis directa y disminución del edema cerebral (64), esto sumado a que alteran la morfología celular, hace que los esteroides no se usen antes de la biopsia cerebral requerida para el diagnóstico de LPSNC. A pesar de la buena respuesta a los esteroides los pacientes recaen con rapidez, por lo que se necesitan otras estrategias terapéuticas. Esta respuesta terapéutica también se ha propuesto como factor de buen pronóstico en pacientes sin infección VIH (64).
En los esfuerzos iniciales para tratar el LPSNC con quimioterapia se utilizó el esquema ciclofos-famida, doxorubicina, vincristina y prednisona (CHOP), con respuesta imagenológica pero con recaídas a corto plazo como las observadas con los esteroides (65). El fármaco quimioterapéutico de elección es el metotrexate en altas dosis, en un rango de 3 a 8 g/m2 debido a su poca penetración al SNC (66-70), con estrategias para mejorarla como la infusión intravenosa rápida, la infusión continua en 24 horas y la infusión intra carotidea con disrupción de la barrera hematoencefálica (65). No obstante las dosis más altas de 3 g/m2 no han sido de utilidad pues la respuesta ha sido similar y se presentan mayores efectos adversos; no es posible utilizarlas en pacientes mayores de 60 años, ni con insuficiencia renal y además requieren manejo intrahospitalario. Otro régimen utiliza altas dosis de metotrexate con altas dosis de citarabina lo cual aumenta la tasa de remisión completa de 18 a 46% (p: 0.006) y tasa de respuesta global 40% vs 69%, (p=0.009); sin embargo se informó mayor taza de toxicidad hematológica severa (grado 3/4) en 92 vs 15%, con complicaciones infecciosas en el 32% de los pacientes que reciben el régimen combinado; se recomienda el uso profiláctico de factor estimulador de granulocitos y antibióticos (71).
La terapia intratecal con metotrexate o citarabina era la terapia de primera línea en pacientes con diseminación leptomeníngea; en la actualidad esto está discutido, con los esquemas terapéuticos actuales con altas dosis de metotrexate (por lo menos 3 g/m2) se obtienen adecuados niveles de este en LCR, por lo tanto en la actualidad solo se usa metotrexate intrate-cal suplementario en pacientes con dosis menores de 3 g/m2 y evidencia de afección leptomeníngea (65). En pacientes que no toleran las dosis altas de meto-trexate o se comportan como refractarios a este, se han probado otros regímenes como temozolomida junto con rituximab (72-75).
La radioterapia cerebral total se utilizó inicial-mente como terapia de elección dado su carácter infiltrativo y multifocal, sin embargo las recaídas en pocos meses eran frecuentes, especialmente en los pacientes con diseminación meníngea (76). Hoy en día se usa como terapia de modalidad combinada (radioterapia cerebral total más quimioterapia) generalmente con metotrexate y con una respuesta radiográfica mayor del 50% y una sobrevida a dos años de 43 a 73% (77). Los efectos adversos se presentan con mayor frecuencia en pacientes mayores de 60 años y con factores de riesgo vascular, por lo tanto se reserva para pacientes con afectación de novo y menores de esta edad. Los principales efectos adversos son déficit cognitivo subcortical, incontinencia urinaria y ataxia para la marcha asociado con atrofia cerebral y leucoencefalopatía.
La terapia optima en pacientes con LPSNC y SIDA no se ha definido, más aún tomando en consideración que en el SNC el compromiso es multifocal, (incluso si no se detecta en estudios de imagen) (78), sumado a la profunda inmunosupresión en la que se encuentran los pacientes con esta comorbilidad. La terapia estándar es la radioterapia junto con esteroi-des lo que lleva a respuesta completa en el 20 a 50% de los pacientes (79-82), sin embargo con esta modalidad la sobrevida no aumenta significativamente, de 3 meses en los no tratados, hasta 3.5 meses en los que reciben esta terapia dual (80, 83). En otra serie los pacientes que recibieron radioterapia la sobrevida media solo aumento 29 días comparado con los no tratados (82). No obstante no está claro si se debe a la infección concomitante por oportunistas o al LPSNC como tal. Los factores pronósticos para respuesta completa son el estatus de funcionalidad previo y la tolerancia a dosis biológicamente efectivas de radiación (80, 84). La quimioterapia puede ofrecerse con la radiación en pacientes con niveles altos de CD4 (79, 83, 85), los esquemas probados han utilizado metotrexate, thiotepa, procarbazina y vincristina.
Estos pacientes también se benefician de terapia HAART lo cual sumado a la radioterapia y los esteroides aumentan la sobrevida comparado con aquellos que solo reciben tratamiento antitumoral (86, 87), lo cual es particularmente evidente cuando se observa disminución de la carga viral y aumento del conteo de CD4. La terapia HAART podría tener efectos radiosensibilizadores sobre las células B (88 ).
CONCLUSIONES
En esta serie de pacientes con linfoma del sistema nervioso central vistos en el grupo de neuropatología de la Universidad de Antioquia se observaron características clínicas similares a las encontradas en la literatura, quizás el único hallazgo disímil fue la mayor cantidad de pacientes supuestamente inmunocompetentes, lo cual creemos que refleja el subdiagnóstico en nuestro medio en los pacientes inmunodeficientes.
El linfoma primario del sistema nervioso central es una patología de baja prevalencia, esto hace que esta serie de pacientes, a pesar de que no refleja la realidad de este trastorno en nuestro país, sea importante pues es la serie más grande publicada y da inicio al estudio de este en nuestro medio.
REFERENCIAS
1. BAILEY P. Intracranial sarcomatous tumors of lep-tomeningeal origin. Arch Surg. 1929;18:1359-402. [ Links ]
2. HOFFMAN S, PROPP JM, MCCARTHY BJ. Temporal trends in incidence of primary brain tumors in the United States, 1985-1999. Neuro Oncol 2006;8:27-37. [ Links ]
3. SCHABET M. Epidemiology of primary CNS lymphoma. J Neurooncol. 1999;43:199-201. [ Links ]
4. BHAGAVATHI S, WILSON JD. Primary central nervous system lymphoma. Arch Pathol Lab Med. 2008;132:1830-1834. [ Links ]
5. FLINN IW, AMBINDER RF. AIDS primary central nervous system lymphoma. Curr Opin Oncol. 1996;8:373-376. [ Links ]
6. BERAL V, PETERMAN T, BERKELMAN R, JAFFE H. AIDS-associated non-Hodgkin lymphoma. Lancet. 1991;337:805-809. [ Links ]
7. MACMAHON EM, GLASS JD, HAYWARD SD, MANN RB, BECKER PS, CHARACHE P, ET AL. Epstein-Barr virus in AIDS-related primary central nervous system lymphoma. Lancet. 1991;338:969-973. [ Links ]
8. PANAGEAS KS, ELKIN EB, DEANGELIS LM, BEN-PORAT L, ABREY LE. Trends in survival from primary central nervous system lymphoma, 1975-1999: a population-based analysis. Cancer. 2005;104:2466-2472. [ Links ]
9. FINE HA, MAYER RJ. Primary central nervous system lymphoma. Ann Intern Med. 1993;119:1093- 1104. [ Links ]
10. MILLER DC, HOCHBERG FH, HARRIS NL, GRUBER ML, LOUIS DN, COHEN H. Pathology with clinical correlations of primary central nervous system non-Hodgkin's lymphoma. The Massachusetts General Hospital experience 1958-1989. Cancer. 1994;74:1383-1397. [ Links ]
11. SMITH JR, BRAZIEL RM, PAOLETTI S, LIPP M, UGUCCIONI M, ROSENBAUM JT. Expression of B-cell-attracting chemokine 1 (CXCL13) by malignant lymphocytes and vascular endothelium in primary central nervous system lymphoma. Blood. 2003;101:815-821. [ Links ]
12. KADOCH C, TRESELER P, RUBENSTEIN JL. Molecular pathogenesis of primary central nervous system lymphoma. Neurosurg Focus. 2006;21:E1. [ Links ]
13. JIANG L, MARLOW LA, COOPER SJ, ROEMEL-ING CV, MENKE DM, COPLAND JA, ET AL. Selective central nervous system tropism of primary central nervous system lymphoma. Int J Clin Exp Pathol. 2010;3:763-767. [ Links ]
14. GORMLEY RP, MADAN R, DULAU AE, XU D, TAMAS EF, BHATTACHARYYA PK, ET AL. Germinal center and activated b-cell profiles separate Burkitt lymphoma and diffuse large B-cell lymphoma in AIDS and non-AIDS cases. Am J Clin Pathol. 2005;124:790-798. [ Links ]
15. SHEARER GM. HIV-induced immunopathogen-esis. Immunity. 1998;9:587-593. [ Links ]
16. BIANCOTTO A, GRIVEL JC, IGLEHART SJ, VANPOUILLE C, LISCO A, SIEG SF, ET AL. Abnormal activation and cytokine spectra in lymph nodes of people chronically infected with HIV-1. Blood. 2007;109:4272-4279. [ Links ]
17. KHATRI VP, BAIOCCHI RA, BERNSTEIN ZP, CALIGIURI MA. Immunotherapy with low-dose interleukin-2: rationale for prevention of immune-deficiency-associated cancer. Cancer J Sci Am. 1997;3 (Suppl 1):S129-136. [ Links ]
18. MOSES AV, WILLIAMS SE, STRUSSENBERG JG, HENEVELD ML, RUHL RA, BAKKE AC, ET AL. HIV-1 induction of CD40 on endothelial cells promotes the outgrowth of AIDS-associated B-cell lymphomas. Nat Med. 1997;3:1242-1249. [ Links ]
19. CHIRIVI RG, TARABOLETTI G, BANI MR, BARRA L, PICCININI G, GIACCA M, ET AL. Human immunodeficiency virus-1 (HIV-1)-Tat protein promotes migration of acquired immunodeficiency syndrome-related lymphoma cells and enhances their adhesion to endothelial cells. Blood. 1999;94:1747-1754. [ Links ]
20. AOKI Y, TOSATO G. Targeted inhibition of angiogenic factors in AIDS-related disorders. Curr Drug Targets Infect Disord. 2003;3:115-128. [ Links ]
21. HAMILTON-DUTOIT SJ, PALLESEN G, KARKOV J, SKINHOJ P, FRANZMANN MB, PED-ERSEN C. Identification of EBV-DNA in tumour cells of AIDS-related lymphomas by in-situ hybridisation. Lancet. 1989;1:554-552. [ Links ]
22. OMETTO L, MENIN C, MASIERO S, BONALDI L, DEL MISTRO A, CATTELAN AM, ET AL. Molecular profile of Epstein-Barr virus in human immunodeficiency virus type 1-related lymphadenopathies and lymphomas. Blood. 1997;90:313-322. [ Links ]
23. MITTRA RA, PULIDO JS, HANSON GA, KAJ-DACSY-BALLA A, BRUMMITT CF. Primary ocular Epstein-Barr virus-associated non-Hodgkin's lymphoma in a patient with AIDS: a clinicopathologic report. Retina. 1999;19:45-50. [ Links ]
24. GUTERMAN KS, HAIR LS, MORGELLO S. Epstein-Barr virus and AIDS-related primary central nervous system lymphoma. Viral detection by immunohistochemistry, RNA in situ hybridization, and polymerase chain reaction. Clin Neuropathol. 1996;15:79-86. [ Links ]
25. KERSTEN MJ, KLEIN MR, HOLWERDA AM, MIEDEMA F, VAN OERS MH. Epstein-Barr virus-specific cytotoxic T cell responses in HIV-1 infection: different kinetics in patients progressing to opportunistic infection or non-Hodgkin's lymphoma. J Clin Invest. 1997;99:1525-1533. [ Links ]
26. VAN BAARLE D, HOVENKAMP E, CALLAN MF, WOLTHERS KC, KOSTENSE S, TAN LC, ET AL. Dysfunctional Epstein-Barr virus (EBV)-specific CD8(+) T lymphocytes and increased EBV load in HIV-1 infected individuals progressing to AIDS-related non-Hodgkin lymphoma. Blood. 2001;98:146-155. [ Links ]
27. BIGGAR RJ, CHATURVEDI AK, GOEDERT JJ, ENGELS EA. AIDS-related cancer and severity of immunosuppression in persons with AIDS. J Natl Cancer Inst. 2007;99:962-972. [ Links ]
28. PELICCI PG, KNOWLES DM, 2ND, ARLIN ZA, WIECZOREK R, LUCIW P, DINA D, ET AL. Multiple monoclonal B cell expansions and c-myc oncogene rearrangements in acquired immune deficiency syndrome-related lymphoproliferative disorders. Implications for lymphomagenesis. J Exp Med. 1986;164:2049-2060. [ Links ]
29. CINGOLANI A, DE LUCA A, LAROCCA LM, AMMASSARI A, SCERRATI M, ANTINORI A, ET AL. Minimally invasive diagnosis of acquired immunodeficiency syndrome-related primary central nervous system lymphoma. J Natl Cancer Inst. 1998;90:364-369. [ Links ]
30. BATAILLE B, DELWAIL V, MENET E, VAN-DERMARCQ P, INGRAND P, WAGER M, ET AL. Primary intracerebral malignant lymphoma: report of 248 cases. J Neurosurg. 2000;92:261-266. [ Links ]
31. LEE DK, CHUNG CK, KIM HJ, KIM K, CHOE G, MOON CW, ET AL. Multifocal primary CNS T cell lymphoma of the spinal cord. Clin Neuropathol. 2002;21:149-155.
32. HERRLINGER U, WELLER M, KUKER W. Primary CNS lymphoma in the spinal cord: clinical manifestations may precede MRI detectability. Neuroradiology. 2002;44:239-244. [ Links ]
33. NAKAMIZO T, INOUE H, UDAKA F, ODA M, KAWAI M, UEMURA K, ET AL. Magnetic resonance imaging of primary spinal intramedullary lymphoma. J Neuroimaging. 2002;12:183-186. [ Links ]
34. ALBANESE V, PLATANIA N. Spinal intradural extramedullary tumors. Personal experience. J Neuro-surg Sci. 2002;46:18-24. [ Links ]
35. HERAN NS, YONG RL, HERAN MS, YIP S, FAIRHOLM D. Primary intradural extraarachnoid hodgkin lymphoma of the cervical spine. Case report. J Neurosurg Spine. 2006;5:61-64. [ Links ]
36. YAMASHITA T, SAKAURA H, OSHIMA K, IWASAKI M, YOSHIKAWA H. Solitary intradural extramedullary lymphoma of the cervical spine. J Neurosurg Spine. 2010;12:436-439. [ Links ]
37. LACHANCE DH, O'NEILL BP, MACDONALD DR, JAECKLE KA, WITZIG TE, LI CY, ET AL. Primary leptomeningeal lymphoma: report of 9 cases, diagnosis with immunocytochemical analysis, and review of the literature. Neurology. 1991;41:95-100. [ Links ]
38. MATANO S, SAKASHITA Y, FURUSHO H, OHASHI M, TERAHATA S, KAKUMA K, ET AL. Primary leptomeningeal lymphoma. J Neurooncol. 2001;52:81-83. [ Links ]
39. GROVE A, VYBERG M. Primary leptomeningeal T-cell lymphoma: a case and a review of primary T-cell lymphoma of the central nervous system. Clin Neuropathol. 1993;12:7-12. [ Links ]
40. HORMIGO A, ABREY L, HEINEMANN MH, DEANGELIS LM. Ocular presentation of primary central nervous system lymphoma: diagnosis and treatment. Br J Haematol. 2004;126:202-208. [ Links ]
41. PARK S, ABAD S, TULLIEZ M, MONNET D, MERLAT A, GYAN E, ET AL. Pseudouveitis: a clue to the diagnosis of primary central nervous system lymphoma in immunocompetent patients. Medicine (Baltimore). 2004;83:223-232. [ Links ]
42. GRIMM SA, MCCANNEL CA, OMURO AM, FERRERI AJ, BLAY JY, NEUWELT EA, ET AL. Primary CNS lymphoma with intraocular involvement: International PCNSL Collaborative Group Report. Neurology. 2008;71:1355-1360. [ Links ]
43. MERLE-BERAL H, DAVI F, CASSOUX N, BAUDET S, COLIN C, GOURDET T, ET AL. Biological diagnosis of primary intraocular lymphoma. Br J Haematol. 2004;124:469-473. [ Links ]
44. BAEHRING JM, DAMEK D, MARTIN EC, BETENSKY RA, HOCHBERG FH. Neurolympho-matosis. Neuro Oncol. 2003;5:104-115. [ Links ]
45. GRISARIU S, AVNI B, BATCHELOR TT, VAN DEN BENT MJ, BOKSTEIN F, SCHIFF D, ET AL. Neurolymphomatosis: an International Primary CNS Lymphoma Collaborative Group report. Blood. 2010;115:5005-5011. [ Links ]
46. KHONG P, PITHAM T, OWLER B. Isolated neurolymphomatosis of the cauda equina and filum terminale: case report. Spine (Phila Pa 1976). 2008;33:E807-811. [ Links ]
47. LEVIN N, SOFFER D, GRISSARU S, AIZIKOV-ICH N, GOMORI JM, SIEGAL T. Primary T-cell CNS lymphoma presenting with leptomeningeal spread and neurolymphomatosis. J Neurooncol. 2008;90:77-83. [ Links ]
48. ABREY LE, BATCHELOR TT, FERRERI AJ, GOSPODAROWICZ M, PULCZYNSKI EJ, ZUCCA E, ET AL. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol. 2005;23:5034-5043. [ Links ]
49. MOHILE NA, DEANGELIS LM, ABREY LE. The utility of body FDG PET in staging primary central nervous system lymphoma. Neuro Oncol. 2008;10:223-228. [ Links ]
50. HOCHBERG FH, MILLER DC. Primary central nervous system lymphoma. J Neurosurg. 1988;68:835-853. [ Links ]
51. DIAZ-CANO S. PCR-based alternative for diagnosis of immunoglobulin heavy chain gene rearrangement: principles, practice, and polemics. Diagn Mol Pathol. 1996;5:3-9. [ Links ]
52. EKSTEIN D, BEN-YEHUDA D, SLYU-SAREVSKY E, LOSSOS A, LINETSKY E, SIEGAL T. CSF analysis of IgH gene rearrangement in CNS lymphoma: relationship to the disease course. J Neurol Sci. 2006;247:39-46. [ Links ]
53. PELS H, MONTESINOS-RONGEN M, SCHALLER C, SCHLEGEL U, SCHMIDT-WOLF IG, WIESTLER OD, ET AL. VH gene analysis of primary CNS lymphomas. J Neurol Sci. 2005;228:143-147. [ Links ]
54. KUKER W, NAGELE T, KORFEL A, HECKL S, THIEL E, BAMBERG M, ET AL. Primary central nervous system lymphomas (PCNSL): MRI features at presentation in 100 patients. J Neurooncol. 2005;72:169-177.
55. ZHANG D, HU LB, HENNING TD, RAVARANI EM, ZOU LG, FENG XY, ET AL. MRI findings of primary CNS lymphoma in 26 immunocompetent patients. Korean J Radiol. 2010;11:269-277. [ Links ]
56. JENKINS CN, COLQUHOUN IR. Characterization of primary intracranial lymphoma by computed tomography: an analysis of 36 cases and a review of the literature with particular reference to calcification haemorrhage and cyst formation. Clin Radiol.1998;53:428-434. [ Links ]
57. BUHRING U, HERRLINGER U, KRINGS T, THIEX R, WELLER M, KUKER W. MRI features of primary central nervous system lymphomas at presentation. Neurology. 2001;57:393-396. [ Links ]
58. ARORA A, KAPOOR A, SHARMA A. Correspondence re: MRI findings of primary CNS lymphoma in 26 immunocompetent patients. Korean J Radiol. 2010;11:702-703. [ Links ]
59. ZACHARIA TT, LAW M, NAIDICH TP, LEEDS NE. Central nervous system lymphoma characterization by diffusion-weighted imaging and MR spectros-copy. JNeuroimaging. 2008;18:411-417. [ Links ]
60. ABREY LE, BEN-PORAT L, PANAGEAS KS, YAHALOM J, BERKEY B, CURRAN W, ET AL. Primary central nervous system lymphoma: the Memorial Sloan-Kettering Cancer Center prognostic model. J Clin Oncol. 2006;24:5711-5715. [ Links ]
61. FERRERI AJ, BLAY JY, RENI M, PASINI F, SPINA M, AMBROSETTI A, ET AL. Prognostic scoring system for primary CNS lymphomas: the International Extranodal Lymphoma Study Group experience. J Clin Oncol. 2003;21:266-272. [ Links ]
62. BESSELL EM, GRAUS F, LOPEZ-GUILLERMO A, LEWIS SA, VILLA S, VERGER E, ET AL. Primary non-Hodgkin's lymphoma of the CNS treated with CHOD/BVAM or BVAM chemotherapy before radiotherapy: long-term survival and prognostic factors. Int J Radiat Oncol Biol Phys. 2004;59:501-508. [ Links ]
63. FERRACINI R. (Primary malignant non-Hodg-kin's lymphomas of the central nervous system in immunocompetent patients: diagnostic, prognostic and therapeutic criteria). Pathologica. 1997;89:146-154. [ Links ]
64. MATHEW BS, CARSON KA, GROSSMAN SA. Initial response to glucocorticoids. Cancer. 2006;106:383-387. [ Links ]
65. MORRIS PG, ABREY LE. Therapeutic challenges in primary CNS lymphoma. LancetNeurol. 2009;8:581-592. [ Links ]
66. BATCHELOR T, CARSON K, O'NEILL A, GROSSMAN SA, ALAVI J, NEW P, ET AL. Treatment of primary CNS lymphoma with methotrexate and deferred radiotherapy: a report of NABTT 96-07. J Clin Oncol. 2003;21:1044-1049. [ Links ]
67. HOANG-XUAN K, TAILLANDIER L, CHINOT O, SOUBEYRAN P, BOGDHAN U, HILDEBRAND J, ET AL. Chemotherapy alone as initial treatment for primary CNS lymphoma in patients older than 60 years: a multicenter phase II study (26952) of the European Organization for Research and Treat-merit of Cancer Brain Tumor Group. J Clin Oncol. 2003;21:2726-2731. [ Links ]
68. O'BRIEN P, ROOS D, PRATT G, LIEW K, BARTON M, POULSEN M, ET AL. Phase II multi-center study of brief single-agent methotrexate followed by irradiation in primary CNS lymphoma. J Clin Oncol. 2000;18:519-526. [ Links ]
69. HERRLINGER U, SCHABET M, BRUGGER W, KORTMANN RD, KUKER W, DECKERT M, ET AL. German Cancer Society Neuro-Oncol-ogy Working Group NOA-03 multicenter trial of single-agent high-dose methotrexate for primary central nervous system lymphoma. Ann Neurol. 2002;51:247-252. [ Links ]
70. PELS H, SCHMIDT-WOLF IG, GLASMACHER A, SCHULZ H, ENGERT A, DIEHL V, ET AL. Primary central nervous system lymphoma: results of a pilot and phase II study of systemic and intraven-tricular chemotherapy with deferred radiotherapy. J Clin Oncol. 2003;21:4489-4495. [ Links ]
71. FERRERI AJ, RENI M, FOPPOLI M, MARTELLI M, PANGALIS GA, FREZZATO M, ET AL. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet. 2009;374:1512-1520. [ Links ]
72. WONG ET, TISHLER R, BARRON L, WU JK. Immunochemotherapy with rituximab and temo-zolomide for central nervous system lymphomas. Cancer. 2004;101:139-145. [ Links ]
73. ENTING RH, DEMOPOULOS A, DEANGELIS LM, ABREY LE. Salvage therapy for primary CNS lymphoma with a combination of rituximab and temozolomide. Neurology. 2004;63:901-903. [ Links ]
74. Wong ET. Salvage therapy for primary CNS lymphoma with a combination of rituximab and temo-zolomide. Neurology. 2005;64:934. [ Links ]
75. SANTISTEBAN M, NIETO Y, DE LA CRUZ S, ARISTU J, ZUBIETA JL, FERNANDEZ HIDALGO O. Primary central nervous system lymphoma treated with rituximab plus temozolomide in a second line schedule. Clin Transl Oncol. 2007;9:465-467. [ Links ]
76. NELSON DF, MARTZ KL, BONNER H, NELSON JS, NEWALL J, KERMAN HD, ET AL. Non-Hodgkin's lymphoma of the brain: can high dose, large volume radiation therapy improve survival? Report on a prospective trial by the Radiation Therapy Oncology Group (RTOG): RTOG 8315. Int J Radiat Oncol Biol Phys. 1992;23:9-17. [ Links ]
77. FERRERI AJ, ABREY LE, BLAY JY, BORISCH B, HOCHMAN J, NEUWELT EA, ET AL. Summary statement on primary central nervous system lymphomas from the Eighth International Conference on Malignant Lymphoma, Lugano, Switzerland, June 12 to 15, 2002. J Clin Oncol. 2003;21:2407-2414. [ Links ]
78. JOHNSON BA, FRAM EK, JOHNSON PC, JACOBOWITZ R. The variable MR appearance of primary lymphoma of the central nervous system: comparison with histopathologic features. AJNR Am J Neuroradiol. 1997;18:563-572. [ Links ]
79. FORSYTH PA, DEANGELIS LM. Biology and management of AIDS-associated primary CNS lymphomas. Hematol Oncol Clin North Am. 1996;10:1125-1134. [ Links ]
80. RAEZ LE, PATEL P, FEUN L, RESTREPO A, RAUB WA, JR., CASSILETH PA. Natural history and prognostic factors for survival in patients with acquired immune deficiency syndrome (AIDS)-related primary central nervous system lymphoma (PCNSL). Crit Rev Oncog. 1998;9:199-208. [ Links ]
81. BAUMGARTNER JE, RACHLIN JR, BECK-STEAD JH, MEEKER TC, LEVY RM, WARA WM, ET AL. Primary central nervous system lymphomas: natural history and response to radiation therapy in 55 patients with acquired immunodeficiency syndrome. J Neurosurg. 1990;73:206-211. [ Links ]
82. SKOLASKY RL, DAL PAN GJ, OLIVI A, LENZ FA, ABRAMS RA, MCARTHUR JC. HIV-associated primary CNS lymorbidity and utility of brain biopsy. J Neurol Sci. 1999;163:32-38. [ Links ]
83. FORSYTH PA, YAHALOM J, DEANGELIS LM. Combined-modality therapy in the treatment of primary central nervous system lymphoma in AIDS. Neurology. 1994;44:1473-1479. [ Links ]
84. CORN BW, DONAHUE BR, ROSENSTOCK JG, COOPER JS, XIE Y, BRANDON AH, ET AL. Palliation of AIDS-related primary lymphoma of the brain: observations from a multi-institutional database. Int J Radiat Oncol Biol Phys. 1997;38:601-605. [ Links ]
85. DEMARIO MD, LIEBOWITZ DN. Lymphomas in the immunocompromised patient. Semin Oncol. 1998;25:492-502. [ Links ]
86. SKIEST DJ, CROSBY C. Survival is prolonged by highly active antiretroviral therapy in AIDS patients with primary central nervous system lymphoma. AIDS. 2003;17:1787-1793. [ Links ]
87. NEWELL ME, HOY JF, COOPER SG, DEGRAAFF B, GRULICH AE, BRYANT M, ET AL. Human immunodeficiency virus-related primary central nervous system lymphoma: factors influencing survival in 111 patients. Cancer. 2004;100:2627-2636. [ Links ]
88. PAJONK F, MCBRIDE WH. Survival of AIDS patients with primary central nervous system lymphoma may be improved by the radiosensitizing effects of highly active antiretroviral therapy. AIDS. 2002;16:1195-1196. [ Links ]