Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.28 no.3 Bogotá July/Sep. 2012
Aciduria glutárica tipo I
Glutaric aciduria, type I
Ángela Ortiz, MD. Pediatra-Neuropediatra, Servicio de Pediatria y Neuropediatría, Hospital Universitario Hernando Moncaleano. Neiva. Lisseth Cabarcas, MD. Eugenia Espinosa, MD. Neuropediatras, Servicio de Neuropediatría Hospital Militar Central. Bogotá. Olga Echeverri, Bact. PhD(c), Johana Guevara, Bact.(e). PhD, Instituto de Errores Innatos del Metabolismo. Pontificia Universidad Javeriana. Bogotá. Eliana Ruiz, MD, Zulma Cifuentes, MD. Residentes pediatria, Servicio de Pediatria y Neuropediatría, Hospital Universitario Hernando Moncaleano. Neiva. Luis Barrera, PhD. Instituto de Errores Innatos del Metabolismo. Pontificia Universidad Javeriana. Bogotá. Correspondencia: eugeniaespinosa@gmail.com
Recibido: 16/01/12. Revisado: 08/05/12. Aceptado: 28/07/12.
RESUMEN
La aciduria glutárica tipo I se produce por deficiencia de la enzima glutaril-CoA deshidrogenasa involucrada en el catabolismo de la L-lisina, L-hidroxilisina y L-triptófano lo que ocasiona acumulación de los ácidos glutárico y 3 hidroxiglutárico responsables del compromiso neurológico severo característico de esta enfermedad. La sospecha y diagnóstico de las enfermedades metabólicas constituyen un reto para el personal de salud dada su baja incidencia. En el caso de la aciduria glutárica tipo I se trata de una enfermedad para la cual se poseen los recursos técnicos para el diagnóstico y tratamiento nutricional, su instauración previa a la aparición de encefalopatía aguda, que ocasionan daños irreversibles en el sistema nervioso central, mejora el pronóstico y disminuye el grado de discapacidad. En esta publicación se reportan 5 casos con diagnóstico clínico y bioquímico de aciduria glutárica tipo I que ilustran el espectro clínico y el proceso diagnóstico y de tratamiento en el medio colombiano. Los pacientes se encuentran en seguimiento por los servicios de Neuropediatría.
PALABRAS CLAVES. Glutaril-CoA Deshidrogenasa, Trastornos Distónicos, Encefalopatías, Cuerpo Estriado, Ganglios Basales (DeCS).
SUMMARY
Glutaric aciduria type i is a disorder resulting trom the deficiency ot the glutaryl-CoA dehydrogenase, enzyme involved in the catabolism ot L-lysine, L-hydroxy-lysine y L-tryptophan causing the accumulation ot its derivatives glutaric acid and 3-hydroxy-glutaric acid which are responsible tor the severe neurological involvement observed in this disease. The diagnosis ot metabolic disorders represents a challenge tor health-care services given its low incidence. Glutaric aciduria type I is a disease tor which there are available technical resources tor diagnosis as well as the nutritional therapy that when set prior to acute encephalopathy, who results in irreversible damage ot central nervous system, can improve the prognosis and decrease the disability ot patients. This publication report 5 cases with clinical and biochemical diagnosis ot glutaric aciduria type i that show the clinical spectrum the diagnostic and treatment approach ot this pathology in Colombia. All the patients are being followed by neuropediatrics services.
KEY WORDS. Glutaryl-CoA Dehydrogenase, Glutaric Aciduria, Distonic Disorders, Encephalopathy, Corpus Striatum, Basal Ganglia (MeSH).
INTRODUCCIÓN
La aciduria glutárica tipo I (AG-I) es una alteración metabólica que compromete de forma aguda o crónica el sistema nervioso central (SNC) y ocasiona lesiones irreversibles. Tiene una prevalencia estimada de 1 por cada 100.000 recién nacidos (1). Es una entidad con herencia autosómica recesiva y se produce por deficiencia o ausencia en la actividad de la enzima intramitocondrial glutaril-CoA deshidrogenasa, dependiente de dinucleótidos de flavina y adenina. La enzima es codificada por el gen GCDH localizado en 19q13.2 y se encarga de la deshidrogenación del glutaril-CoA y de la descar-boxilación del glutaconil-CoA a crotonil-CoA, en la vía de degradación de la L-lisina, la L-hidroxilisina y el L-triptófano (2). Desde su primera descripción, realizada en 1975, se han descrito más de 500 pacientes y se han identificado más de 200 mutaciones causantes de la enfermedad (3).
El compromiso del SNC se caracteriza por lesiones bilaterales del estriado, (núcleo caudado y putamen), estructuras vulnerables y que resultan afectadas desde el primer evento agudo de crisis encefalopática. Las lesiones y por supuesto la clínica empeoran con los siguientes eventos generados por descompensación metabólica, precipitados en su mayoría por enfermedades febriles interrecurrentes, inmunización o procedimientos quirúrgicos. Los metabolitos acumulados como consecuencia del déficit enzimático, principalmente el ácido glutárico y el 3-hidroxi-glutárico, son neurotóxicos y explican el daño neuronal (4,5). El 90% de los pacientes desarrolla enfermedad neurológica irreversible en los primeros 6 años de edad (5).
El cuadro clínico típico es evidente luego de una crisis de encefalopatía aguda, que conlleva a la regresión de las habilidades alcanzadas en el neuro-desarrollo por el paciente, con hipotonía generalizada y movimientos distónicos erráticos de difícil control (5). En estos pacientes puede encontrarse macrocra-nea y algunos cursan con leve retraso del desarrollo psicomotor. 10 a 20% de los pacientes pueden presentar retraso en alcanzar los hitos del neurode-sarrollo y con el paso del tiempo evolucionan hacia una parálisis cerebral discinética. El compromiso neurológico puede estar presente aún sin una crisis de descompensación metabólica, puesto que el daño de los ganglios basales y de la sustancia blanca está presente. Este fenotipo clínico puede ser insidioso, crónico o de inicio tardío (6).
El diagnóstico se realiza mediante el análisis de ácidos orgánicos en orina por cromatografía de gases acoplada a espectrometría de masas (GC/MS) que revela el aumento en la excreción de ácido glutárico (AG), ácido 3-hidroxi-glutárico (3-OH-GA), ácido glutacónico y en menor proporción ácido 2 hidro-xiglutárico (7,8).
En países donde se encuentran disponibles las pruebas para tamizaje neonatal de enfermedades metabólicas, el estudio inicial se realiza mediante la detección en sangre de concentraciones elevadas de glutaril-carnitina (C5DC) según el análisis de acil-carnitinas por espectrometría de masas en tándem (MS/MS) (7,8).
A más de los fenotipos clínicos, se describen dos fenotipos bioquímicos según la excreción urinaria de metabolitos anormales. Los pacientes pueden tener alta o baja excreción de ácido glutárico, ambos sub-grupos tienen el mismo riesgo de desarrollar lesión en ganglios basales y no se asocian a una menor o mayor severidad de la enfermedad (7,8).
La confirmación de la enfermedad se hace mediante la medición de la actividad enzimática en fibroblastos o leucocitos que tiene una sensibilidad de 98-99% y se utiliza en poblaciones con alta frecuencia de una mutación conocida o para la confirmación en pacientes con fenotipo de baja excreción de ácido glutárico (9,10).
Las neuroimágenes apoyan la sospecha diagnóstica, los hallazgos muestran ampliación de la cisura silviana y aumento del espacio subaracnoideo en los lóbulos temporales de forma temprana en más del 93% de los casos; asociadas a estos o de forma independiente se observa alteración de la intensidad de la señal en las secuencias T2 en ganglios basales y sustancia blanca. Otros hallazgos son colecciones subdurales y ampliación de las cisternas mesence-fálicas (11).
El tratamiento es efectivo y mejora significativamente el pronóstico siempre y cuando se inicie antes del daño ganglio basal. El objetivo del tratamiento es disminuir la frecuencia e impacto de las crisis agudas y modificar el pronóstico neurológico (9,10).
Las recomendaciones para el tratamiento de la enfermedad incluyen un manejo nutricional libre de lisina y bajo en triptófano además de la suplemen-tación con L carnitina. Las dosis deben aumentarse durante las enfermedades febriles, la aplicación de vacunas y los procedimientos quirúrgicos (9,10).
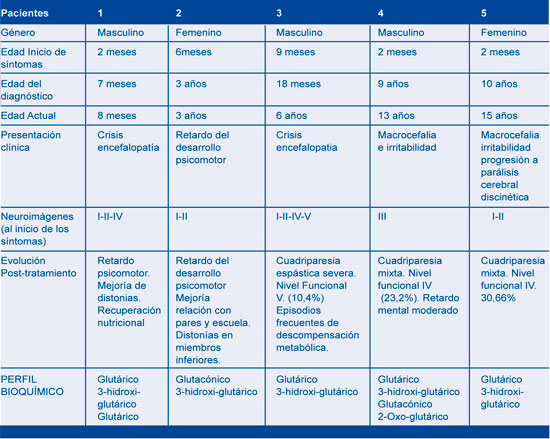
A continuación se realiza la descripción de 5 casos diagnosticados y tratados nutricional y farmacológicamente a diferentes edades. En la tabla 1 se resumen los principales hallazgos clínicos-bioquímicos de cada uno de los pacientes.
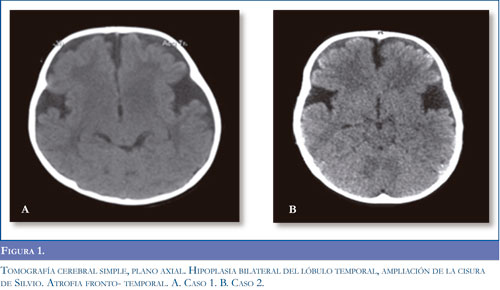
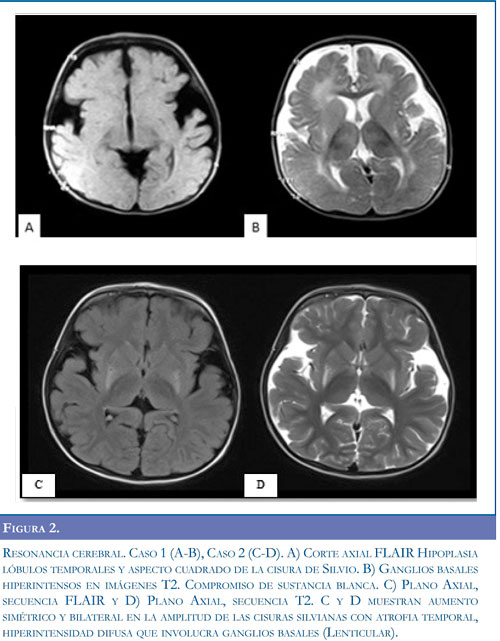
Neuroinfección, la cual se descartó por análisis de líquido cefalorraquídeo, se inició manejo anticonvulsivante con fenitoína y fenobarbital ante la sospecha de crisis epiléptica; sin obtener mejoría. Presentó síntomas respiratorios, con radiografía de tórax que mostró opacidad alveolar derecha y hemograma con aumento de leucocitos a expensas de neutrófilos, por lo cual se inició tratamiento antibiótico. Se remitió a Hospital de III nivel para manejo especializado. Al examen neurológico se encontró alerta, irritable, con sialorrea, nistagmus horizontal, hipertonía generalizada, hiperextensión de extremidades y cabeza, hiperreflexia con clonus aquiliano bilateral, respuesta plantar extensora bilateral, movimientos distónicos, y pérdida de las habilidades motoras previamente alcanzadas. Se realizó electroencefalograma sin evidencia de actividad paroxística epileptiforme, y se suspendieron los anticonvulsivantes. Las imágenes de tomografía axial computadorizada de cráneo (TC) evidenciaron atrofia bilateral de lóbulo temporal (Figura 1A). Con impresión diagnóstica de encefalopatía con disquinesia de probable origen metabólico se inició manejo con diazepam para control de crisis distónicas. Se realizó resonancia magnética (RM) cerebral evidenciando hipoplasia fronto-temporal, con aumento del tamaño de las cisuras silvianas, retardo en la mielinización y alteración de la señal en ganglios basales (Figura 2).
Con los hallazgos neuroradiológicos se sugerió como posibilidad etiológica la aciduria glutárica tipo I, se realizó cromatografía de ácidos orgánicos en orina que confirmó la excreción elevada de ácido glutárico y aumento significativo de ácido 3-hidro-xiglutárico y ácido glutacónico. Se continuó manejo con diazepam, se inició tratamiento nutricional con dieta baja en proteínas libre de lisina y baja en triptó-fano, y suplemento de L-carnitina 1000 mg VO día. Cuatro meses después el paciente presentó evidente mejoría de las distonías y recuperación nutricional.
Caso 2. Femenina 3 años de edad, hermana del paciente anterior, con antecedente de retardo global del desarrollo, sin que hubiera adquirido marcha independiente. Al examen físico, estaba alerta, con pobre relación con el medio, sialorrea persistente, lenguaje con monosílabos, aumento del tono en las 4 extremidades, hiperreflexia generalizada, marchaba con apoyo en puntas de pies, incoordinación motora y posturas distónicas asociadas. Las imágenes de TC reportaron atrofia temporal bilateral, con amplitud de la cisura de Silvio (Figura 1 B). Las imágenes de resonancia magnética cerebral mostraron hipoplasia fronto-temporal con aumento de la cisura silviana y compromiso ganglio basal (Figuras 2 C-D). La determinación de ácidos orgánicos de cadena corta y media confirmó el diagnóstico de aciduria glutárica tipo I (Tabla 1). Se inició manejo nutricional con restricción proteica libre de lisina y baja en triptófano, suplementación con L-carnitina y benzodiacepina para el manejo de las distonías. Cuatro meses después continúa manejo nutricional y farmacológico, controles ambulatorios y terapia integral, evidenciando mejor relación con el entorno, mejoría en lenguaje expresivo y asistencia al jardín infantil.
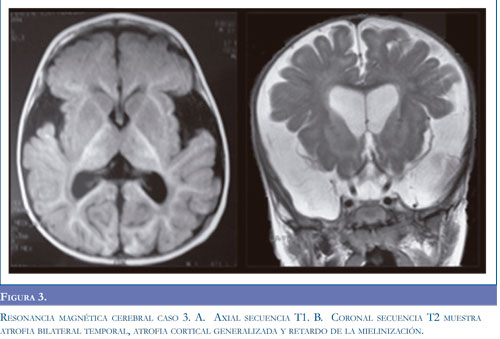
Caso 3. Escolar masculino producto de segunda gestación, controles prenatales normales, parto espontáneo, al nacer APGAR bajo y síndrome de dificultad respiratoria que requirió ventilación mecánica con evolución satisfactoria. Sostén cefálico a los 2 meses, sedente a los 6 meses; a los 9 meses presentó cuadro febril secundario a infección respiratoria alta que requirió hospitalización donde se documentó luego del cuadro viral pérdida de las habilidades adquiridas en el neurodesarrollo. Se valoró meses después en consulta de neuropediatria, se solicitó RM cerebral que mostró atrofia cortical difusa con quistes aracnoideos bilaterales temporales (Figura 3), se sospechó enfermedad metabólica y se solicitó cromatografía de aminoácidos en orina y plasma reportados normales, cromatografía de ácidos orgánicos en orina donde se documentó excreción elevada de ácido glutárico y de 3 hidroxiglutárico. La confirmación diagnóstica se realizó a los 18 meses de edad y se inició manejo nutricional con restricción proteica, multivitaminas y suplementación con L-carnitina y plan de habilitación. Presentó múltiples episodios de descompensación metabólica por manejo nutri-cional irregular, cuadros febriles, cursó con eventos de microaspiración y pérdida progresiva de peso, se realizó gastrostomía a los 2,5 años de edad. La enfermedad progresó clínica e imagenológicamente con aumento de las crisis distónicas sin respuesta a manejo farmacológico y fiebre de origen central. En la actualidad cursa con cuadriparesia discinética, retardo mental profundo. Evaluación funcional motora nivel V, 10,4%.
Caso 4. Masculino producto de primera gestación, sin consanguinidad, parto a término con peso y talla adecuados para la edad gestacional. A los 2 meses de edad se evidenció crecimiento del perímetro cefálico por lo cual se realizó una TC que reportó colecciones subdurales compatibles con higromas; fue valorado por neuropediatria y se evidenció leve alteración del tono pasivo, inconsistencia en la interacción con el medio e irritabilidad por lo cual se complementó estudio con resonancia magnética que reportó la presencia de quistes aracnoideos temporales asociados a disminución global del volumen cerebral con posible paquigiria.
A los 7 meses de edad se evidenció hipotonía, retardo del neurodesarrollo, sin sostén cefálico, arrastre, y retardo en el lenguaje se le solicitó cromatografía de aminoácidos en plasma y orina con resultados normales, cariotipo 46XY; potenciales evocados visuales y auditivos con compromiso bilateral moderado. Se inició rehabilitación integral. No volvió a controles hasta los 9 años de edad. Se encontró paciente alerta, lenguaje poco comprensible, obedecía parcialmente órdenes sencillas, con cuadriparesia espástica asociada a movimientos distónicos. Se solicitó RM que halló quistes aracnoideos temporales bilaterales y leuncoencefalopatia con aumento de la señal en cuerpo estriado; cromatografía de aminoácidos en orina con aminoaciduria generalizada con banda muy marcada de glicina y serina y patrón de aminoácidos en plasma normal. La cuantificación de ácidos orgánicos reportó elevación de ácido glutárico (985mmol/l), 3 hidroxiglutárico (335mmol/l), ácido glutacónico (22mmol/l), 2 oxo-glutárico (520mmol/l) consistentes con AG-1. Se inició manejo nutricional específico, suplementación con L-carnitina, multivitaminas, calcio y vitamina D por osteopenia secundaria y baclofen oral. No ha presentado nueva descompensación metabólica. Asiste a educación regular en 2do grado. Escala funcional motora con nivel IV (23,3%).
Caso 5. Femenina, padres consanguíneos, producto del segundo embarazo, parto a término normal. Desde los primeros meses de vida presentó irritabilidad, diaforesis, episodios de desviación de la mirada a los 2 meses de edad y a los 9 meses movimientos anormales con postura de hiperextensión en miembro superior derecho y posterior desarrollo de hipotonía progresiva, sialorrea persistente, no logró sostén cefálico. Durante valoración médica a los 9 meses se evidenció macrocefalia, se realizó una TC que mostró pérdida de sustancia cortico-subcortical que comprometió la región frontoparietal con aumento de la cisura de Silvio. Se realizó RM cerebral que mostró cambios simétricos por leucoencefalopatia bilateral con compromiso de los ganglios basales, aumento del espacio subaracnoideo y quistes aracnoideos en las fosas craneales medias. Se solicitó tamizaje metabólico de aminoácidos en orina y plasma, con resultados normales. Ingresó a rehabilitación integral con diagnóstico de parálisis cerebral discinética. A los 10 años retorna la paciente a consulta por aumento de las crisis distónicas. Al examen físico se evidenció cuadriparesia espástica y discinética de predominio en el hemicuerpo derecho. Se valoró con estudios antiguos y por los hallazgos en resonancia magnética se solicitó cromatografía de ácidos orgánicos que halló incremento del ácido glutárico y 3-hidroxiglutárico, se confirmó diagnóstico de aciduria glutárica tipo I, se inicia manejo nutricional con formula específica, suplementación con L-carnitina y manejo con benzodiacepinas. Se realizó escala funcional motora (GMFM) con nivel IV (30,66%). Se realizaron controles periódicos de ácidos orgánicos que mostraron disminución de metabolitos, no ha presentado descompensación metabólica adicional.
DISCUSIÓN
La aciduria glutárica tipo I es un error innato del metabolismo secundario a la deficiencia enzimática de glutaril-CoA deshidrogenasa que produce acumulación de ácido glutárico y 3 hidroxiglutárico, y ocasiona daño cerebral irreversible (9).
La sospecha clínica y los hallazgos en neuroi-mágenes constituyen la herramienta principal para la evaluación y confirmación diagnóstica a través del análisis de ácidos orgánicos por GC/MS. La regresión en el neurodesarrollo, la hipotonía y los movimientos distónicos luego de hospitalizaciones por enfermedades interrecurrentes, los pacientes con retraso del desarrollo psicomotor que evolucionen a parálisis cerebral discinetica de etiología no clara deben alertar a la búsqueda de esta entidad (9,10).
Los pacientes 1 y 3 representan el cuadro clínico agudo de esta enfermedad. El paciente 1 mostró retraso previo del desarrollo psicomotor, en el paciente 3 no hubo signos previos sin embargo, en ambos casos luego de un evento infeccioso febril se desencadenó una encefalopatía aguda por descompensación metabólica que evolucionó con pérdida de las habilidades en el neurodesarrollo y movimientos distónicos erráticos. Los pacientes 2, 4 y 5 cursaron con retraso del desarrollo psicomotor y evolucionaron a parálisis cerebral discinética configurando la presentación crónica e insidiosa de la enfermedad. En ambos casos al momento del diagnóstico se evidenciaron lesiones estriatales y de sustancia blanca establecidas e irreversibles.
Uno de los signos clínicos descritos en esta entidad es el crecimiento anormal del perímetro cefálico, que aunque no es patognomónico, se encuentra en más del 75% de los pacientes (11). En este reporte de casos el hallazgo de macrocefalia en dos de los pacientes asociado a otros signos neurológicos y sin la presencia de antecedentes perinatales de importancia, ocasionó el estudio para enfermedad metabólica. Otros síntomas más generales como irritabilidad, trastorno del sueño, vómitos en edades tempranas se asocian al diagnóstico de aciduria glutárica y están presentes aún en ausencia de la crisis aguda encefalopática, estos síntomas estuvieron presentes en los casos 1 y 5.
La sospecha clínica fue apoyada en todos los pacientes con imágenes típicas de atrofia frontotem-poral bilateral conocidas como "alas de murciélago" en la tomografía axial computadorizada y por alteraciones de la sustancia blanca en grados variables en la resonancia magnética cerebral como se describe en la literatura (11).
El diagnóstico se realizó por cromatografía de ácidos orgánicos en orina, con elevación anormal en la excreción de ácido glutárico y 3-hidroxi-glutárico como hallazgo predominante en todos los pacientes. Aunque la confirmación puede hacerse con la cuan-tificación de la actividad enzimática, en Colombia no se dispone de estos estudios, sin embargo, los hallazgos clínicos, imaginológicos y bioquímicos típicos a través de la GC/MS se aceptan en la literatura como suficientes para el diagnóstico definitivo (9,10).
Cuando los hallazgos bioquímicos no son típicos o en las poblaciones donde la incidencia de la enfermedad es alta y se conocen mutaciones específicas están indicados los estudios de genética molecular (10). En nuestro país no hay aún estudios pobla-cionales que muestren mutaciones específicas y los estudios de confirmación genética son, aún, de difícil acceso. Sin embargo todos los pacientes de este tipo son valorados por los servicios de genética médica, con quienes se evalúa la necesidad de confirmación molecular y se explica las posibilidades de recurrencia de la enfermedad en los nuevos nacimientos o en otros miembros de la familia.
El diagnóstico también puede realizarse presin-tomático o precoz a través de estudios de carnitinas, como tamizaje neonatal avalados por muchas poblaciones del mundo (12,13).
El pronóstico de la enfermedad es mejor si el manejo se instaura antes de la lesión neurológica; una vez iniciados los síntomas el manejo no es efectivo para prevenir el daño permanente, esto se ha comprobado en estudios realizados con pacientes diagnosticados antes del inicio de los síntomas por tamizaje neonatal al compararlos con pacientes con síntomas y daño neurológico. El tamizaje neonatal y el manejo nutricional temprano han permitido cambiar la historia natural de la enfermedad en los pacientes con aciduria glutárica tipo I (13-15). En Colombia no se dispone de tamizaje neonatal para enfermedades metabólicas diferentes al hipotiroi-dismo congénito, el diagnóstico se realiza luego de la presentación de los síntomas o en la búsqueda de la enfermedad por antecedentes familiares.
En todos los casos presentados el diagnóstico se realizó luego del daño estriatal, que se considera irreversible, sin embargo la evolución fue favorable en los pacientes 1 y 2 que mostraron adherencia al tratamiento farmacológico y al manejo nutricional efectuado. En el paciente 1 mejoraron los movimientos distónicos, se evidenció adecuada recuperación nutricional y ausencia de nuevos eventos de descompensación metabólica. Su hermana a pesar de que el diagnóstico y tratamiento se realizaron de forma tardía mostró mejoría en su relación con el medio y disminución de los movimientos anormales mejorando el bienestar y la calidad de vida. En el paciente 3 se realizó diagnóstico temprano luego de la crisis de encefalopatía aguda, similar al paciente 1, y se inició manejo nutricional y farmacológico adecuado sin embargo, la evolución fue tórpida, la escasa adherencia a las guías nutricionales ha permitido el desarrollo de crisis encefalopáticas recurrentes que ensombrecen el pronóstico tal como lo describe la literatura en la evolución de los pacientes sin tratamiento (14,15).
En los pacientes 4 y 5 se presentó retraso en el diagnóstico entre otras causas por la dificultad para acceder a las pruebas en su momento, los resultados con el tratamiento instaurado son poco alentadores, a pesar de que han estado estables metabólicamente, estos pacientes tienen muy bajos puntajes en la escala funcional motora y déficit cognitivo moderado.
Si bien todos pacientes acá reportados han recibido tratamiento posterior al daño cerebral la evolución adecuada en los pacientes 1 y 2 permite reafirmar que la aciduria glutárica es una enfermedad tratable y su manejo luego del diagnóstico, evita la recurrencia de los episodios agudos que incrementan el daño estriatal y ayuda a estabilizar las secuelas neurológicas severas (13,14).
En la actualidad es de vital importancia considerar el diagnóstico de una enfermedad neurometa-bólica en aquel paciente con diagnóstico de parálisis cerebral espástica o discinética sin un claro o confirmado evento de encefalopatía hipóxico isquémica en el periodo neonatal.
Aunque estas entidades se consideren enfermedades poco frecuentes, establecer un protocolo para el diagnóstico temprano, permite instaurar un manejo nutricional y farmacológico adecuado que evita la discapacidad motora y cognitiva severa en los pacientes, en particular en Colombia donde se cuenta con el estudio de cromatografía de ácidos orgánicos en orina que permite el diagnóstico y adicionalmente se dispone del manejo nutricional especifico de esta enfermedad.
REFERENCIAS
1. LINDNER M, KÖLKER S, SCHULZE A, CHRISTENSEN E, GREENBERG CR, HOFFMANN GF. Neonatal Screening for glutaryl-CoA dehydrogenase deficiency. J Inherited Metab Dis 2004;27:851-9. [ Links ]
2. FU Z, WANG M, PASCHKE R, RAO KS, FRERMAN FE, KIM JJ. Crystal structures of human glutaryl-CoA dehydrogenase with and without an alternate substrate: structural bases of dehydrogenation and decarboxilation reactions. Biochemistry 2004;43:9674-84. [ Links ]
3. ZSCOCKE J, QUAK E, GULDBERG P. Mutation analysis in glutaric aciduria type I. J Med Genet 2000;37:177-81. [ Links ]
4. STRAUSS KA, MORTON DH. Type I glutaric aciduria, part 2: A model of acute striatal necrosis. Am J Med Genet Semin Med Genet 2003;121c:53-70. [ Links ]
5. KÖLKER S, GARBADE SF, GREENBERG CR, LEONARD JV, SAUDUBRAY JM, RIBES A, ET AL. Natural History, outcome and treatment efficacy in children and adults with glutaryl-coa dehydrogenasa deficiency. Pediatr res 2003;59:840-47. [ Links ]
6. STRAUSS KA, MORTON DH. Type I glutaric aciduria, part 2: A model of acute striatal necrosis. Am J Med Genet Semin Med Genet 2003;121c:53-70. [ Links ]
7. LINDNER M, HO S, FANG-HOFFMANN J, HOFFMANN GF, KÖLKER S. Neonatal Screening for glutaric aciduria type I: strategies to proceed. J Inheri Metab Dis 2006;29:378-82. [ Links ]
8. BARIC I, WAGNER L, FEYH P, LIESERT M, BUCKEL W, HOFFMANN GF. Sensitivity of free and total glutaric and 3 hidroxyglutaric acid measurement by stable isotope dilution assays for the diagnosis of glutaric aciduria type I. J Inherit Metab Dis 1999;22:867-82. [ Links ]
9. KÖLKER S, CHRISTENSEN E, LEONARD JV, GREENBERG CR, BURLINA AB, BURLINA AP, ET AL. Guideline for the diagnosis and management of glutaryl -CoA dehydrogenase deficiency (Glutaric Aciduria Type I). J Inherited Metab Dis 2007;30:5-22. [ Links ]
10. KÖLKER S, CHRISTENSEN E, LEONARD JV, GREENBERG CR, BONEH A, BURLINA AB, ET AL. Diagnosis and management of glutaric type I - revised recommendations. J Inherit Metab Dis 2011;34:677-94. [ Links ]
11. TWOMEY EL, NAUGHTEN ER, DONOGHUE VB, RYAN S. Neuroimaging findings in glutaric aciduria type 1. Pediatr Radiol 2003;33:823-30. [ Links ]
12. COUCE-PICO ML, CASTIÑEIRAS-RAMOS DE, LÓPEZ-SOUSA M, FERNÁNDEZ-SEARA MJ, EIRÍS-PUÑAL J, COCHO-DE-JUAN JA. Importance of early diagnosis and treatment in the prognosis of type I Glutaric Acidaemia. An Pediatr (Bare) 2008;69:239-43. [ Links ]
13. BIJARNIA S, WILEY V, CARPENTER K, CHRISTODOULOU J, ELLAWAY CJ, WILCKEN B. Glutaric Aciduria type I. Outcome following detection by newborn screening. J InheritMetab 2008;31:503-7. [ Links ]
14. BJUGSTAD KB, GOODMAN SI, FRED CR. Age at symptom onset predicts severity of motor impairment and clinical onset of glutaric aciduria type I. J Pediatr 2000;137: 861-86. [ Links ]
15. HERINGER J, BOY SP, ENSENAUER R, ASSMANN B, ZSCHOCKE J, HARTING I, LÜCKE T, ET AL. Use of guidelines improves the neurological outcome in glutaric aciduira type I. Ann Neurol 2010;68:743-52. [ Links ]