Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Neurológica Colombiana
versión impresa ISSN 0120-8748
Acta Neurol Colomb. vol.29 no.3 Bogotá jul./sep. 2013
Ausencia de efecto cognitivo APOE en personas sanas de edad mediana
Absence of APOE cognitive effect in healthy middle-aged
Óscar Sierra-Fitzgerald, Guillermo Barreto, Francisco Lopera-Restrepo
Óscar Sierra-Fitzgerald, Grupo de Investigación Clínica en Psicología, Neuropsicología y Neuropsiquiatría, Instituto de Psicología, Universidad del Valle.
Guillermo Barreto, Laboratorio de Genética Molecular Humana, Departamento de Biología, Universidad del Valle.
Francisco Lopera-Restrepo, Grupo de Neurociencias de Antioquia, Universidad de Antioquia.
Correspondencia: osierra@univalle.edu.co
Recibido:08/07/13. Revisado: 08/08/13. Aceptado: 09/09/13.
RESUMEN
Introducción. A pesar de los conocidos cambios cerebrales estructurales y funcionales en portadores de alelos ε4 del gen de la apolipoproteína (APOE), los hallazgos sobre el funcionamiento cognitivo de estos individuos son contradictorios.
Objetivo. Evaluar el efecto cognitivo APOE (ECA) en individuos de edad mediana con pruebas neuropsicológicas tradicionales y tareas experimentales de conjunción en memoria visual de corto término y con el paradigma de tareas duales de memoria operativa.
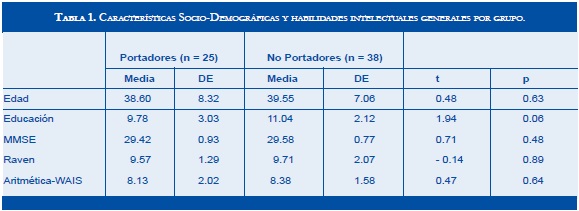
Material y Métodos. Se comparó el desempeño de 25 sujetos portadores de alelos ε4 (38.6 años de edad promedio y 9.7 años de educación promedio) con el de 38 no portadores (39.5 años de edad promedio y 11 años de educación promedio) en las pruebas referidas.
Resultados. Los resultados en ambos tipos de pruebas no fueron significativamente diferentes entre portadores y no portadores.
Conclusiones. En individuos de mediana edad portadores de alelos ε4 no se hacen evidentes déficits cognitivos. Estos resultados son de gran interés en la comprensión de la fase preclínica de la Enfermedad de Alzheimer cuando se comparan con los de un grupo de individuos de edades equiparables portadores de la mutación E280A-p1 evaluados con el mismo tipo de pruebas.
PALABRAS CLAVES. Portadores Genotipos, Apolipoproteína ε4, Enfermedad de Alzheimer, Neuropsicología. (DeCS).
SUMMARY
Introduction. Despite the known structural and functional brain changes in carriers of the apolipotrein ε4 (APOE) allele, the findings on cognitive functioning of these individuals are mixed.
Objective. Evaluate the APOE-dependent cognitive effect in middle-aged individuals with traditional neuropsychological tests and experimental tasks of binding in short-term visual memory and from the working memory by dual task paradigm.
Materials and Methods. The performance of 25 carriers of ε4 alleles was compared (mean age of 38.6 years and 9.7 mean years of schooling) with that of 38 non-carriers (mean age of 39.5 years and average education of 11 years) in both types of tests.
Results: The results in both types of tests were not significantly different between carriers and noncarriers.
conclusions: In middle-aged carriers of ε4 alleles cognitive deficits are not evident. These results are of great interest in understanding the preclinical stages of Alzheimer's Disease when compared with those of a group of individuals of similar ages who carried the mutation E280A-p1 who were evaluated with the same type of tests.
KEY WORDS: Apolipoprotein-ε4 carriers, Alzheimer's Disease, Neuropsychology (MeSH).
INTRODUCCIÓN
Cambios cerebrales asociados con el genotipo APOE
Los estudios sobre cambios cerebrales asociados con el genotipo apolipoproteína ε4 (APOE) reportan placas seniles y ovillos neurofibrilares en portadores jóvenes de los alelos ε4 (1,2). Un estudio de tromboembolismo pulmonar (TEP) con PiB -radioligando que se adhiere a los agregados fibrilares de betamiloide halló que la carga de beta-amiloide se asocia con la dosis ε4 y se localiza en las mismas áreas afectadas por la Enfermedad de Alzheimer (EA) probable (3). Otros cambios estructurales en adultos incluyen reducción de los volúmenes hipocampales (4,5) y de la sustancia gris frontotemporal (6) y, en niños y adolescentes, del espesor reducidas de corteza entorrinal (7). Los estudios del metabolismo de la glucosa han reportado tasas anormalmente bajas en las mismas regiones que los pacientes con EA probable en portadores homocigóticos de alelos ε4 de edad mediana y aún en sujetos jóvenes heterocigóticos (8).
Los estudios sobre la respuesta BOLD frente a tareas cognitivas y en estado de reposo datan de los diez últimos años y son de difícil interpretación. Una revisión reciente del efecto del genotipo APOE-ε4 en la respuesta BOLD frente a tareas cognitivas (9) halló 10 artículos que reportaban incrementos, 7 que reportaban decrementos y 5 tanto incrementos como decrementos en la actividad de diversas áreas cerebrales de portadores de los alelos ε4 y otros 5 que no reportaban diferencias entre portadores y no portadores. Incluso, un estudio con portadores heterocigóticos jóvenes que realizaron una tarea de memoria episódica, encontró activación reducida hipocámpica bilateral, frontal y temporal, acompañada de puntajes equivalentes a los de los otros grupos genotípicos en la tarea de memoria, lo cual fue interpretado como un uso económico de los recursos neurales implicados en la memoria (10). De particular interés, este resultado evoca los de un estudio de actividad eléctrica cerebral que años antes había revelado un patrón que sugirió a los autores beneficios del genotipo APOE-ε4 en redes de memoria durante el desarrollo (11). Contrariamente, otro estudio de resonancia magnética funcional (RMf), también con una tarea de memoria episódica, halló mayor y más extendida activación en sujetos mayores portadores de los alelos ε4 que en sujetos ε3-ε3 en regiones parietales, frontales y temporales derechas (hipocampales y parahipocampales) que fue interpretada como mayor "esfuerzo" para obtener el mismo nivel de ejecución que los no portadores (12).
De manera similar, los estudios de respuesta BOLD en reposo reportan efectos diversos. Un estudio encontró que el genotipo APOE-ε4 reducía la conectividad funcional de reposo, mientras que otro halló coactivación incrementada en la red de modo predeterminado (default mode network), una red íntimamente ligada con EA (13). Independientemente de la dirección, estas diferencias dan cuenta, por una parte, de la variabilidad en los diseños experimentales empleados (edades, dosis alélica, paradigma funcional de RMf, etc.) pero, por otra, muy seguramente, de cambios funcionales modulados por el genotipo APOE en interacción con otros factores.
Cambios cognitivos asociados con el genotipo APOE
Los cambios cerebrales asociados con el genotipo APOE-ε4 han dado pie a indagar por un hipotético efecto cognitivo asociado. Puntualmente se busca además determinar a partir de qué momento se reconoce, qué dominios afecta, qué magnitud tiene en cada dominio, qué tendencia despliega y cuáles son sus determinantes. Algunos estudios no han hallado diferencias cognitivas entre portadores y no portadores de alelos ε4, otros sí. Más aún, algunos han encontrado mejor ejecución cognitiva en portadores jóvenes o ausencia de compromiso en portadores de edades avanzadas. Entre los estudios que han hallado déficits relacionados con alelos ε4, la memoria episódica (14-16) y el funcionamiento ejecutivo (17-19), aisladamente o en asociación, son como los primeros y más afectados.
Los metanálisis aportan a la comprensión del efecto cognitivo APOE (ECA). Uno de ellos encontró que los grupos de portadores homocigotos de alelos ε4 tenían peores ejecuciones que los no portadores en funcionamiento cognitivo global y memoria episódica y que los heterocigotos en funcionamiento ejecutivo (15). Otro mostró que los portadores tenían ejecuciones más pobres en memoria episódica, en funcionamiento cognitivo global y ejecutivo, y en velocidad de percepción (16). La coincidencia entre ambos estudios es alta aunque el segundo reportó una diferencia adicional en velocidad de percepción. Un estudio crítico de cuarenta y cinco estudios halló que treinta y dos de ellos reportaban una asociación entre alelos ε4 y ejecución más pobre en tareas neuropsicológicas (18). Un metanálisis de estudios con adultos jóvenes, adolescentes y niños, que se preguntaba por la supuesta mejor ejecución cognitiva de portadores en ese grupo etéreo, no reveló beneficios cognitivos relacionados con el genotipo APOE-ε4 (20).
Dos décadas de estudio del ECA han mostrado que los principales factores que determinan y modulan su expresión y detección son la edad, el dominio cognitivo evaluado, los instrumentos empleados, la dosis alélica y la naturaleza (transeccional o longitudinal) de los estudios. Los estudios del ECA en individuos de edad mediana con pruebas neuropsicológicas tradicionales presentan resultados inconsistentes. Algunos estudios transeccionales han reportado hallazgos negativos (21-23) y otros positivos (24-26). Los longitudinales han producido diversos resultados: disminución de la memoria antes de los 60 años y antes de la presentación sintomática del déficit cognitivo leve (DCL) en portadores de alelos ε4 (27); disminución cognoscitiva creciente en velocidad psicomotora y recuerdo diferido por grupos genotípicos (ε2-ε2 mayor que ε2-ε3 mayor que ε3-ε3 mayor que ε3-ε4 mayor que ε4-ε4) (28); incremento de la tasa anual de reducción en recuerdo diferido en portadores de alelos ε4 (28) y decremento escalonado en la memoria de largo plazo: a los 50 años en portadores homocigóticos, a los 60 en heterocigóticos y alrededor de los 70 en no portadores (29). Los estudios de individuos portadores de alelos ε4 de mediana edad con tareas experimentales han reportado hallazgos positivos: déficits en atención espacial selectiva (30); déficit en atención espacial selectiva y MO (31); afectación del cambio atencional, de la MO visoespacial y de la modulación de la MO por la atención (32); déficits en atención dividida (18) y compromiso en varios aspectos de la capacidad y del control de la MO.
Diversos estudios han enfatizado en la necesidad de usar instrumentos con mayor sensibilidad que las pruebas tradicionales para detectar el ECA tempranamente (15,29). Entre ellos, un metanálisis, señaló que la mayoría de los estudios incluidos evaluaron la atención con el TMT-A, una prueba poco o nada sensible para evaluar el funcionamiento atencional (15). Por su parte, otro estudio (19) comentó que los resultados negativos con pruebas de CI eran esperables por no tratarse de medidas neuropsicológicas de aprendizaje y memoria y que así podrían encubrir una genuina asociación entre el genotipo APOE y un efecto cognitivo.
La distinción utilizada en este estudio entre pruebas neuropsicológicas tradicionales y tareas experimentales se planteó por diversos autores (3033). Estas últimas son tareas específicas en cuanto a las habilidades o constructos evaluados que llevaron a reconocer, en el caso particular del ECA, que el uso de operaciones componentes específicas de MO y atención, en vez de funciones cognitivas globales, permitía detectar tempranamente los cambios asociados con el genotipo APOE y distinguirlos de los propios del envejecimiento, tornándose así en pruebas de gran valor (30).
Este estudio se propuso evaluar el ECA en individuos de edad mediana con pruebas neuropsicológicas tradicionales y tareas experimentales de conjunción en memoria visual de corto término y del paradigma de tares duales de MO. Esta es la primera investigación que evalúa el ECA con tareas de conjunción de memoria visual de corto término y una de las primeras en emplear tareas duales; tareas, ambas, que ya han sido probadas como útiles en la caracterización de la fase preclínica de la EA familiar de inicio temprano (34-36). Emplear pruebas experimentales con sujetos jóvenes se justifica en tanto que se amplía la posibilidad de detectar y caracterizar tempranamente el ECA. Es necesario caracterizar el ECA ya que los marcadores radiológicos como el PiB y los estudios de RMf son más experimentales que clínicos.
MATERIAL Y MÉTODOS
Los participantes en este estudio fueron reclutados entre grupos de trabajadores de diferentes instituciones. Los potenciales participantes fueron informados, grupal o individualmente, sobre el propósito del estudio y lo que se requería de ellos para su participación. Los individuos que aceptaron participar, fueron citados para una primera evaluación de tamizaje mediante una entrevista semiestructurada para determinar la presencia o ausencia de enfermedad mental, neurológica o sistémica con implicaciones cognitivas y determinar la exclusión o inclusión en el estudio. A aquellos individuos que pasaron este primer filtro y firmaron un consentimiento de participación, se les tomó una muestra de sangre para determinar su genotipo APOE y comenzaron con las evaluaciones cognitivas que generalmente se realizaron en dos sesiones.
Los genotipos se determinaron mediante isotipificación por restricción que permite analizar el patrón de polimorfismos por restricción de longitud de fragmento. Esta técnica utilizó amplificación mediante PCR de secuencias APOE que comprendieran las posiciones de los aminoácidos 112 y 158. Los productos de la PCR fueron digeridos con HhaI y los fragmentos resultantes separados por electroforesis en geles de poliacrilamida. Los participantes fueron evaluados cognoscitivamente con pruebas neuropsicológicas tradicionales y con tareas experimentales de conjunción en memoria visual de corto término y del paradigma de tareas duales de MO. Se configuró entonces un diseño transeccional doble ciego (ni evaluadores ni evaluados conocían los genotipos). La investigación fue aprobada por el Comité de Ética de la Universidad del Valle, Cali, Colombia.
Del grupo final de 63 individuos (35 mujeres y 28 hombres), con una media de 39.2 años y 10.5 de educación, 25 fueron portadores de alelos ε4 y 38 no. Considerando que entre los portadores solo uno era homocigótico (ε4-ε4), que ε2-ε3 se considera una condición neutral y ε2-ε2 una protectora, los sujetos se agruparon en dos categorías: portadores (ε3-ε4 y ε4- ε4) y no portadores (ε3- ε3; ε2- ε3 y ε2- ε2). La proporción de portadores y no portadores no fue significativamente diferente (39.7% vs 60.3%, p = 0.99). Entre los portadores no hubo diferencias significativas por género (46% mujeres vs 34%, p = 0.98) y entre portadores y no portadores no hubo diferencias significativas ni por edad (38.60 años vs 39.55 años, p = 0.63, respectivamente) ni por años de educación (9.78 vs 11.04, p = 0.06, respectivamente). Ambos grupos genéticos fueron comparados en medidas sociodemográficas, de habilidad intelectual (MMSE, Matrices de Raven y Aritmética-wAIS) y en dos escalas funcionales (Escala de Trastornos de Memoria - Quejas del Paciente - y Escala de Depresión de yesavage). En ninguna de estas medidas se obtuvieron diferencias significativas. La tabla 1 muestra las comparaciones por edad, educación y habilidad intelectual general.
Pruebas neuropsicológicas
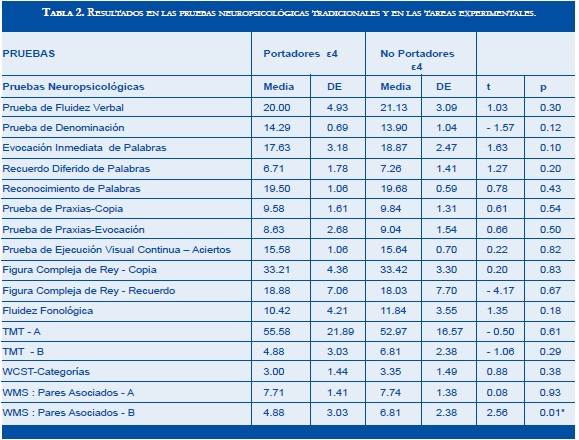
Las pruebas neuropsicológicas empleadas fueron las del Protocolo de Evaluación de Demencias del Grupo de Neurociencias de Antioquia: CERAD-Col (37), Prueba de Ejecución Visual Continua, Figura Compleja de Rey, tarea de Fluidez Fonológica, tarea de Memoria de Tres Frases, Prueba TMT, Prueba de Clasificación de Tarjetas de wisconsin, Prueba de Matrices de Raven, Escala Aritmética-wAIS, Escala de Trastornos de Memoria (Quejas del Paciente) y Escala de Depresión de yesavage. Adicionalmente se emplearon dos pruebas de aprendizaje verbal: Pares Asociados-wMS (A: Asociación Fácil, B: Asociación Difícil) y una Curva de Memoria Verbal.
Pruebas experimentales
Tareas de conjunción en memoria de corto término
En cognición la conjunción se refiere al mecanismo responsable de la representación de diferentes elementos de información tales como rostros y nombres, formas y colores en objetos unificados (38). La conjunción tiene lugar en diferentes niveles cognitivos que incluyen la percepción y el almacenamiento en memoria de corto y largo término (39). La conjunción evaluada en este estudio fue en memoria de corto término con material visual. La tarea fue similar a lo descrito en dos estudios de Parra et al. (34-35) y evaluó la memoria de arreglos de estímulos visuales presentados en una pantalla de computador. Los estímulos son objetos definidos por formas diversas, por colores o por combinaciones de formas y colores o de colores y colores. Los estímulos se seleccionaron de manera aleatoria por una presentación de E-Prime de un conjunto de formas y de un conjunto de colores para ser enseñados a los sujetos bien de manera independiente (2 formas, 3 formas, 2 colores o 3 colores) -para evaluar la memoria visual de corto término de rasgos individuales-o bien de manera combinada (2 forma-color, 3 forma-color, 2 colores en patrón, 3 colores en patrón, 2 colores no conjugados, 3 colores no conjugados, 2 colores conjugados, 3 colores conjugados) -para evaluar la memoria de conjunción visual memoria de corto término. Cada tipo de estímulo fue presentado por separado.
Tares duales de memoria operativa
La primera tarea dual experimental empleada, Seguimiento Perceptivo-Motor/Recuerdo de Dígitos [40], combina una tarea visomotora con una de dígitos en progresión. La segunda está compuesta por Recuerdo de Dígitos/Recuerdo de Patrones Visuales y Recuerdo de Patrones Visuales/Recuerdo de Dígitos (41). Estas tareas comienzan evaluando las ejecuciones en cada tarea individual, de manera inmediata y diferida, antes de evaluar las concurrentes. Al combinar dos tareas de memoria es preciso asegurar que cualquier interferencia mutua no sea la consecuencia de competencia en el ingreso o egreso de un patrón (de input o de output). Por lo tanto, el diseño adopta el procedimiento de precarga (41). Se inicia con el Recuerdo de Dígitos/Recuerdo de Patrones Visuales. Se presenta una serie de dígitos en el span verbal diferido del sujeto que este debe recuperar 15 segundos después (tarea de precarga). Durante esos 15 segundos, el sujeto realiza el recuerdo inmediato de tantos patrones visuales como pueda completar en su respectivo volumen visual inmediato (tarea interpolada). Se realizaron 6 ensayos con este diseño. Los patrones visuales están formados en matrices por cuadros negros y blancos, que definen aglomerados no verbalizables.
Se concluye con Recuerdo de Patrones Visuales/ Recuerdo de Dígito que invierte el orden de presentación. La precarga es una matriz de patrones visuales presentada durante 3 segundos, ajustada al respectivo volumen visual diferido de cada sujeto. La tarea interpolada es el recuerdo de series de dígitos ajustadas al volumen verbal inmediato de cada sujeto, tantas como pueda recuperar durante 15 segundos. Inmediatamente después se procede a la recuperación de la precarga de matrices. Se realizaron 6 ensayos con este diseño.
RESULTADOS
Las comparaciones de puntajes medios con pruebas t para muestras independientes (Tabla 2) revelaron diferencias iniciales significativas entre portadores de alelos ε4 (M= 4.88, DS = 3.03) y no portadores (M= 6.81, DS= 2.38); t (50) = 2.56, p = 0.01 en la prueba neuropsicológica Pares Asociados B. De manera similar, la comparación entre forma-color para tres objetos (M = 0.69, DS = 0.11 vs M = 0.75, DS = 0.09; t (50) = 2.24, p = 0.03) y entre dos objetos bicolores con colores conjugados (M = 0.73, DS = 0.14 vs M = 0.83, DS = 0.14; t (50) = 2.51, p = 0.01), resultaron con diferencias significativas a favor de los no portadores. Igualmente, en las tareas duales, la comparación del span individual diferido de dígitos en la tarea simple (M = 3.96, DS = 0.84 vs M = 4.48, DS = 0.89; t(50) = 2.16, p = 0.03) -en la primera tarea dual- y en la del recuerdo diferido de patrones visuales en recuerdo concurrente (M = 74.36, DS = 11.95 vs M = 65.03, DS = 18.94; t(50) = - 2.10, p = 0.04) -en la segunda tarea dual- resultaron con diferencias significativas; la primera favoreciendo a los no portadores y la segunda a los portadores. No obstante, al efectuar las correcciones del Bonferroni requeridas por las múltiples comparaciones realizadas en este estudio -surgidas de su naturaleza exploratoria- los resultados se tornaron no significativos o se hicieron marginales.
DISCUSIÓN
Pocas investigaciones han empleado tareas experimentales para estudiar el ECA. Apostarle a metodologías experimentales parte de la idea de que una evaluación sensible de operaciones cognitivas específicas, en lugar de una del funcionamiento global o de un dominio cognitivo complejo, debería ser más efectiva (30). Los estudios con tareas experimentales y pruebas tradicionales, cuyos resultados han sido positivos en las primeras y negativos en las segundas, justifican la apuesta, al tiempo que indican que la detección de un ECA también depende de los instrumentos. Este estudio fue el primero en evaluar el ECA con tareas de conjunción en memoria visual de corto término y uno de los primeros en emplear tareas duales de MO. Ambos tipos de tareas comienzan a revelar su utilidad como marcadores preclínicos de la enfermedad de Alzheimer (34-36).
Los resultados de las comparaciones de medias de las pruebas neuropsicológicas tradicionales en el presente estudio, después de las correcciones por múltiples comparaciones, indican una ausencia de compromiso cognitivo de los individuos sanos de edad mediana. De manera similar, después de las correcciones por múltiples comparaciones, las diferencias inicialmente significativas en las tareas experimentales desaparecen o se hacen marginales. La interpretación de este patrón de resultados nos lleva a considerar varias posibles explicaciones.
Si bien el ECA es más significativo y frecuente en portadores homocigóticos (16,25), también se ha documentado ampliamente en heterocigóticos (15,24,26); con todo, el efecto aditivo de la dosis alélica ε4 (32), expresado también como una disminución escalonada, parece ser operativo (29). Esto llevaría a creer que la condición de heterocigocis de los sujetos de este estudio determinó la no detección de un ECA. Por otra parte, aunque otros estudios (24-32) han documentado un efecto del genotipo APOE-ε4 en diversos dominios cognitivos en individuos de mediana edad tardía de aproximadamente 55 años de edad, los individuos de este estudio fueron significativamente más jóvenes (39.2 años de edad promedio), sugiriendo así que la ausencia de ECA dependería, al menos parcialmente, de la edad. Una limitación intrínseca de este estudio es su naturaleza transversal que carece del poder de las metodologías longitudinales para explicar la historia natural de los cambios cognitivos asociados con el genotipo APOE. Por otra parte, las interacciones entre los diferentes determinantes del ECA parecen ser complejas según lo indica la interacción de la edad y la dosis alélica (29), la interacción del genotipo y la historia familiar de EA (42) y otras interacciones entre diversos genes (43).
Evaluar diversos dominios cognitivos con diversas pruebas en vez de dominios puntuales hizo que los resultados inicialmente positivos se diluyeran o se hicieran marginales al hacer correcciones por múltiples comparaciones. Un número mayor de participantes en el estudio habría aumentado su poder estadístico y permitirá determinar si los hallazgos iniciales se mantenían o no. Con todo, es de interés notar que las diferencias entre portadores y no portadores inicialmente detectadas por las pruebas neuropsicológicas fueron en memoria episódica, algo ya reportado en diversas ocasiones en sujetos jóvenes (24,25). De manera similar, la diferencia inicialmente detectada con las tareas duales en el mecanismo coordinador del ejecutivo central, causada por mejor ejecución de los portadores que los no portadores, no carece de antecedentes en la literatura (44) y evoca la hipótesis del mecanismo de reclutamiento compensatorio (12). Es así que, si bien los resultados finales de este estudio deben ser interpretados como negativos respecto a un >ECA en sujetos jóvenes de edad mediana, igualmente sugieren una tendencia de cambios cognitivos en los portadores de alelos ε4 que requeriría un estudio longitudinal para su comprobación.
Así pues, mientras los hallazgos son contundentes respecto a los cambios cerebrales asociados con los alelos ε4 del gen APOE, aún en individuos jóvenes (7-8), los cambios cognitivos son menos predecibles y consistentes. Los resultados de este estudio, en conjunción con los resultados de un grupo de estudios relacionados llevados a cabo por diversos grupos del mismo equipo de investigadores, y dentro del marco de la caracterización de la fase preclínica de la EA (34-36), son de gran interés. En primer lugar, Parra et al. (34) encontraron que los portadores asintomáticos de la mutación E280A-p1 (que confiere un riesgo de 100% para el desarrollo de EA familiar de inicio temprano) en la tercera década de vida ya presentaban déficit en conjunción en memoria visual de corto término pero ningún déficit en memoria episódica, sugiriendo que dicho déficit específico podría ser un marcador preclínico de la EA familiar. En segundo lugar, y más puntualmente, otro estudio de 2011 (3 5)reveló un déficit específico entre los portadores asintomáticos (de 37.2 años de edad promedio) de dicha mutación en la conjunción color-color en memoria de corto término mientras que medidas neuropsicológicas tradicionales y otras de memoria de corto término no lo hicieron. Finalmente, el estudio de 2012 (36) reveló que los portadores sanos jóvenes de la mutación E280A-p1 presentaron costos significativamente mayores en la ejecución concurrente de la tarea dual Seguimiento Perceptivo-Motor/Recuerdo de Dígitos.
Conjuntamente con los datos del presente estudio, los de otros estudios con portadores de la mutación E280A-p1, sugieren que los defectos en memoria operativa y en memoria episódica (evaluados con tareas clásicas y experimentales) aparecen en poblaciones con factor genético de causalidad inequívoca (E280A-p1) pero no en poblaciones con factor genético de riego (APOE), o no al menos en edades tan tempranas. Con todo, el presente estudio presenta evidencia informativa de una tendencia de cambio en estas últimas. Desde el punto de vista de la hipótesis fenotípica del ECA (32), los resultados de este estudio indicarían que en edad media joven no hay diferencias cognitivas reconocibles entre portadores y no portadores de alelos ε4. Alternativamente, desde el punto de vista de la hipótesis prodrómica del ECA (45), los resultados de estos estudios, conjuntamente, parecerían confirmar que en el caso de un gen causal de EA las manifestaciones son tempranas y que, en el caso de un gen que determina una probabilidad, contrariamente, se confirma que las manifestaciones son tardías ya que las pruebas de alta sensibilidad y especificidad no detectan cambios fehacientes tempranamente.
REFERENCIAS
1. GHEBREMEDHIN E, SCHULTZ C, BRAAK E, BRAAK H. High frequency of apolipoprotein E ε4 allele in young individuals with very mild Alzheimer's disease-related neurofibrillary changes. Exp Neurol. 1998; 153:152-5. [ Links ]
2. KOK E, HAIKONEN S, LUOTO T, HUNTALA H, GOEBELER S, HAAPASALO H, ET AL. Apolipoprotein E-Dependent Accumulation of Alzheimer Disease-Related Lesions Begins in Middle Age. Ann Neurol. 2009; 65:650-7. [ Links ]
3. REIMAN EM, CHEN K, LIU X, BANDY D, YU M, LEE W, ET AL. Fibrillar amyloid-beta burden in cognitively normal people at 3 levels of genetic risk for Alzheimer's disease. P Natl Acad Sci USA. 2009; 106:6820-5. [ Links ]
4. JUOTTONEN K, LEHTOVIRTA M, HELISALMI S, RIEKKINEN PJ, SOININEN H. Major decrease in the volume of the entorhinal cortex in patients with Alzheimer's disease carrying the apolipoprotein E epsilon4 allele. J Neurol Neurosurg Psychiatry. 1998; 65:322-7. [ Links ]
5. PLASSMAN BL, WELSH-BOHMER KA, BIGLERED, JOHNSON SC, ANDERSON CV, HELMS MJ, ET AL. Apolipoprotein E ε4 allele and hippocampal volume in twins with normal cognition. Neurology. 1997; 48: 985-9. [ Links ]
6. WIHHART HA, SAYKIN AJ, MCALLISTER TW, RABIN LA, MCDONALD BC, FLASHMAN LA, ET AL. Regional Brain Atrophy in Cognitively Intact Adults with a Single APOE Epsilon4 Allele. Neurology. 2006; 67:1221-4. [ Links ]
7. SHAW P, LERCH JP, PRUESSNER JC, TAYLOR KN, ROSE AB, GREENSTEIN D, ET AL. Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 2007; 6:494-500. [ Links ]
8. REIMAN EM, CHEN K, ALEXANDER GE, CASELLI RJ, BANDY D, OSBORNE D, ET AL. Functional brain abnormalities in young adults at genetic risk for lateonset Alzheimer's dementia. Proc Natl Acad Sci USA. 2004; 101:284-9. [ Links ]
9. TRACHTENBERG AJ, FILIPPINI N, MACKKAY E. The effects of APOE-ε4 on the BOLD response. Neurobiol Aging. 2012; 33:323-34. [ Links ]
10. MONDADORI CR, DE QUERVAIN DJ, BUCHMANN A, MUSTOVIC H, WOLLMER MA, SCHMIDT CF, ET AL. Better memory and neural efficiency in young apolipoprotein E epsilon4 carriers. Cereb Cortex. 2007; 17:1934-47. [ Links ]
11. ALEXANDER DM, WILLIAM, LM, GATT ZM, DOBSON-STONE C, KUAN SA, TODD EG, ET AL. The contribution of apolipoprotein E alleles on cognitive performance and dynamic neural activity over six decades. Biol Psychol. 2007; 75:229-38. [ Links ]
12. BONDI MW, HOUSTON WS, EYLER LT, BROWN GG. FMRI evidence of compensatory mechanisms in older adults at genetic risk for Alzheimer disease. Neurology. 2005; 64:501-8. [ Links ]
13. BUCKNER RL, ANDREWS-HANNA JR, SCHACTER DL. The brain's default network: anatomy, function, and relevance to disease. Ann N Y Acad Sci. 2008; 1124:1-38. [ Links ]
14. WILSON RS, SChNEIDER JA, BARNES LL, BECkETT LA, AGGARWAL NT, COCHRAN EJ, ET AL. The apolipoprotein E ε4 allele and decline in different cognitive systems during a 6-year period. Arch Neurol. 2002; 59:1154-60. [ Links ]
15. SMALL BJ, ROSNICK CB, FRATIGLIONI L, BACkMAN L. Apolipoprotein E and cognitive performance: a meta-analysis. Psychol Aging. 2004; 1:592-600. [ Links ]
16. WISDOM NM, CALLAHAN JL, HAWKINS KA. The effects of apolipoprotein E on non-impaired cognitive functioning: a meta-analysis. Neurobiol Aging. 2011; 32:63-74. [ Links ]
17. GREENWOOD PM, SUNDERLAND T, FRIZ JL, PARASURAMAN R. Genetics and visual attention: selective deficits in healthy adult carriers of the ε4 allele of the apolipoprotein E gene. Proc Natl Acad Sci USA. 2000; 97: 11661-6. [ Links ]
18. ROSEN V, BERGESON J, PUTNAM K, HARWELL A, SUNDERLAND T. Working memory and apolipoprotein E: what's the connection? Neuropsychologia. 2002; 40:2226-33. [ Links ]
19. SAVITZ J, SOLMS M, RAMESAR R. Apolipoprotein E variants and cognition in healthy individuals: a critical opinion. Brain res rev. 2006; 51:125-35. [ Links ]
20. IHLE A, BUNCE D, KLIEGEL M. APOE ε4 and cognitive function in early life: a meta-analysis. Neuropsychology. 2012; 26:267-77. [ Links ]
21. SAGER MA, HERMANN B, LA RUE A. Middleaged children of persons with Alzheimer's disease: APOE genotypes and cognitive function in the wisconsin Registry for Alzheimer's Prevention. J Geriatr Psychiatry Neurol. 2005; 18:245-9. [ Links ]
22. JORM A, MATHER K, BUTTERWORTH P, ANSTEY K, CHRISTENSEN H, EASTEL S. APOE Genotype and Cognitive functioning in a large age-stratified population sample. Neuropsychology. 2007; 1:1-8. [ Links ]
23. COHEN RM, SMALL C, LALONDE F, FRIZ J, SUNDERLAND T. Effect of apolipoprotein E genotype on hippocampal volume loss in aging healthy women. Neurology. 2001; 57:2223-8. [ Links ]
24. FLORY JD, MANUCK SB, FERRELL RE, RYAN CM, MULDOON MF. Memory performance and the apolipoprotein E polymorphism in a community sample of middle-aged adults. Am J Med Genet. 2000; 96:707-11. [ Links ]
25. LEVY JA, BERGESON J, PUTNAM K, ROSEN V, COHEN R, LALONDE F, ET AL. Context-specific memory and apolipoprotein E (ApoE) epsilon 4: cognitive evidence from the NIMH prospective study of risk for Alzheimer's disease. J Int Neuropsychol Soc. 2004; 10:362-70. [ Links ]
26. SCHLTZ MR, LYONS MJ, FRANZ CE, GRANT MD, BOAKE C, JACOBSON KC, ET AL. Apolipoprotein E genotype and memory in the sixth decade of life. Neurology. 2008; 70:1771-7. [ Links ]
27. CASELLI RJ, REIMAN EM, OSBORNE D, HENTZ JG, BAXTER LC, HERNANDEZ JL, ET AL. LongitudinalU changes in cognition and behavior in asymptomatic carriers of the APOE ε4 allele. Neurology. 2004; 62:1990-5. [ Links ]
28. BLAIR CK, FOLSOM AR, KNOPMAN DS, BRAY MS, MOSLEY TH, BOERWINkLE E. APOE genotype and cognitive decline in a middle-aged cohort. Neurology. 2005; 64:268-76. [ Links ]
29. CASELLI RJ, DUECk AC, OSBORNE D, SAB-BAGH MN, CONNOR DJ, AHERN, GL, ET AL. Longitudinal Modeling of Age-Related Memory Decline and the APOE ε4 Effect. New Engl J Med. 2009; 36:255-63. [ Links ]
30. GREENWOOD PM, SUNDERLAND T, FRIZ JL, PARASURAMAN R. Genetics and visual attention: Selective deficits in healthy adult carriers of the ε4 allele of the apolipoprotein E gene. Proc Natl Acad Sci USA. 2000; 97:11661-6. [ Links ]
31. PARASURAMAN R, GREENWOOD PM, SUN-DERLAND T. The apolipoprotein E gene, attention, and brain function. Neuropsychology. 2002; 16:254-74. [ Links ]
32. GREENWOOD PM, LAMBERT C, SUNDER-LAND T, PARASURAMAN R. Effects of apolipoprotein E genotype on spatial attention, working memory, and their interaction in healthy, middle-aged adults: results from the national institute of mental health's BIOCARD study. Neuropsychology. 2005; 19:199-211. [ Links ]
33. SPAAN PE, RAAIJMAkERS J G, JONKER C. Alzheimer's Disease versus Normal Ageing: A Review of the Efficiency of Clinical and Experimental Memory Measures. J Clin Exp Neuropsy. 2003; 25:216-33. [ Links ]
34. PARRA MA, ABRAHAMS S, LOGIE RH, MÉNDEZ LG, LOPERA F. Visual short-term memory binding deficits in familial Alzheimer's disease. Brain. 2010; 133:2702-13. [ Links ]
35. PARRA MA, DELLA SALA S, ABRAHAMS S, LOGIE RH, MÉNDEZ LG, ET AL. Specific deficit of colour-colour short-term memory binding in sporadic and familial Alzheimer's disease Neuropsychologia. 2011; 49:1943-52. [ Links ]
36. MACPHERSON SE, PARRA MA, MORENO S, LOPERA F, DELLA SALA S. Dual task abilities as a possible preclinical marker of Alzheimer's disease in carriers of the E280A presenilin-1 mutation. J Int Neuropsychol Soc. 2012; 18:234-41. [ Links ]
37. AGUIRRE-ACEVEDO DC, GÓMEZ RD, MORENO S, HENAO-ARBOLEDA E, MOTTA M, MUÑOZ C, ET AL. Validez y fiabilidad de la batería neuropsicológica CERAD-Col. Rev Neurol. 2007; 45:655-60. [ Links ]
38. TREISMAN AM, GELADE G. A feature-integration theory of attention. Cognit Psychol. 1980; 12:97-136. [ Links ]
39. TULVING E. Episodic memory: from mind to brain. Annu Rev Psychol. 2002; 53:1-25. [ Links ]
40. GREENE JD, HODGES JR, BADDELEY AD. Autobiographical memory and executive function in early dementia of Alzheimer type. Neuropsychologia. 1995; 33:1647-70. [ Links ]
41. COCCHINI G, LOGIE RH, DELLA SALA S, MACPHERSON SE, BADDELEY AD. Concurrent performance of two memory tasks: Evidence for domain specific working memory systems. Mem Cognition. 2002; 30:1086-95. [ Links ]
42. BLOSS CS, DELIS DC, SALMON DP, BONDI MW. Decreased cognition in children with risk factors for Alzheimer's disease. Biol Psychiatry 2008; 64:904-6. [ Links ]
43. RUIZ JR, CASTILLO R, LABAYEN I, MORENO LA, FUENTES MG, ET AL. Individual and combined effects of ApoE and MTHFR 677C/T polymorphisms on cognitive performance in Spanish adolescents: the AVENA study. Journal Pediatrics. 2010; 156:978-84. [ Links ]
44. MARCHANT NL, KING SL, TABET N, RUSTED JM. Positive Effects of Cholinergic Stimulation Favor young APOE ε4 Carriers. Neuropsychopharmacol. 2010; 35:1090-6. [ Links ]
45. GREENWOOD PM, SUNDERLAND T, PUTNAM K, LEVY J, PARASURAMAN R. Scaling of visuospatial attention undergoes differential longitudinal change as a function of APOE genotype prior to old age: results from the NIMH BIOCARD study. Neuropsychology. 2005; 19:830-40. [ Links ]













