Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.29 no.4 Bogotá Oct./Dec. 2013
Lesión cerebral posterior a paro cardiorrespiratorio
Brain injury after cardiac arrest
Carlos Arturo Cassiani-Miranda, Eduard Pérez-Aníbal, María Camila Vargas-Hernández, Edwin Darío Castro-Reyes, Amira Fernanda Osorio
Carlos Arturo Cassiani-Miranda, Estudiante de segundo año de Especialización en Psiquiatría. Sección de Psiquiatría. Grupo de Investigación en Psiquiatría y Salud Mental.
Aníbal Eduard Pérez, Estudiante de cuarto año de medicina. Grupo de Investigación en Psiquitría y Salud Mental.
María Camila Vargas Hernández, Estudiante de cuarto año de medicina. Grupo de Investigación en Psiquitría y Salud Mental.
Edwin Darío Castro Reyes, Estudiante de tercer año de Especialización en Psiquiatría. Sección de Psiquiatría. Grupo de Investigación en Psiquiatría y Salud Mental.
Amira Fernanda Osorio. Médico Especialista en Psiquiatría. Docente Catedra. Director del Grupo de Investigación en Psiquiatría y Salud Mental.Universidad de Cartagena. Cartagena.
Correspondencia: Kassio30@hotmail.com
Recibido: 04/03/13. Revisado: 04/04/13. Aceptado: 29/08/13.
RESUMEN
La lesión cerebral postparo cardíaco es causa común de morbilidad y mortalidad, de ahí la importancia de comprender sus mecanismos fisiopatológicos, su relación con el impacto de las técnicas de resucitación y el pronóstico de los pacientes. La pérdida de la integridad celular dispara la liberación de glutamato generando excitotoxicidad asociada a la disminución de los neurotransmisores moduladores y a elevación del calcio intracelular provocando lesiones en diferentes áreas cerebrales causando síntomas cognitivos con un impacto significativo en la calidad de vida de estas personas. La Categoría de Desempeño Cerebral es el patón de oro para la evaluación de la recuperación neurológica después del paro cardiorrespiratorio (PCR) y el examen neurológico continúa siendo uno de los factores más confiables para determinar la extensión de la lesión y el pronóstico neurológico en las víctimas de PCR. La evidencia demuestra que la hipotermia leve inducida puede disminuir la lesión cerebral, mejorando la supervivencia y el resultado neurológico funcional en pacientes comatosos sobrevivientes de PCR. La lesión cerebral posterior al PCR es sin duda un área importante para la investigación clínica.
PALABRAS CLAVES: Hipoxia Encefálica, Paro Cardíaco, Reanimación Cardiopulmonar, Encefalopatía Anóxicoisquémica (DeCS).
SUMMARY
Brain injury after cardiac arrest is a common cause of morbidity and mortality, hence the importance of understanding its pathophysiological mechanisms and its relation to the impact of resuscitation and prognosis of patients. The loss of cellular integrity triggers the release of glutamate thus generating excitotoxicity associated with the decreased of modulatory neurotransmitters levels and the elevation of intracellular calcium thense causing lesions in different brain areas and generating cognitive symptoms related to significant impact on quality of life. The Cerebral Performance Category is the gold standard for the assessment of neurological recovery after cardiopulmonary arrest (CPA) and neurological examination remains one of the most reliable factors to determine the extent of the injury and neurological outcome in CPA victims. Evidence shows that mild induced hypothermia may reduce injury, improving survival and functional neurologicals outcomes in comatose survivors of CPA. Brain injury after CPA is an important area for research.
KEY WORDS: Hypoxia-ischemia, Brain, Heart Arrest, Cardiopulmonary Resuscitation, Anoxo Ischaemic encephalopathy (MeSH).
INTRODUCCIÓN
El paro cardiorrespiratorio (PCR) es un problema de salud pública (1) con baja probabilidad de supervivencia de los pacientes al alta hospitalaria (2). Los PCR producen un costo social y económico significativos para los países de ingresos económicos medios y bajos, donde el 80% de la mortalidad global se debe a la muerte cardíaca súbita (MCS) (3).El PCR produce una isquemia global en el cerebro (4) fuertemente influenciada por la duración de la interrupción del flujo sanguíneo (5), generando una cascada de eventos bioquímicos complejos que llevan a muerte neuronal y culmina en un estado comatoso postparo cardíaco (6), así como de un número considerable de alteraciones cognoscitivas y consecuencias psicológicas (7) a largo plazo que usualmente no se reconocen y se asocian con un compromiso significativo del desempeño personal y la calidad de vida (8). Por ello, esta revisión narrativa de la literatura presenta algunos aspectos del conocimiento sobre la lesión cerebral posterior a paro cardíaco, analizando los aspectos epidemiológicos, fisiopatológicos, clínicos y terapéuticos con el propósito de destacar la importancia que relaciona la ciencia de la reanimación y sus repercusiones neuropsiquiátricas.
Conceptualización del problema
Los desenlaces funcionales de los sobrevivientes de PCR son variables, pero las condiciones neurológicas post PCR y la calidad de vida son desfavorables (9) debido a que solo el 37% de ellos recuperan el nivel de funcionamiento previo (10). La existencia de coma o estado vegetativo persistente entre los sobrevivientes de PCR representa una enorme carga para los pacientes, sus familias, el personal asistencial de salud y los recursos del sistema (11). La carga económica de los sobrevivientes de lesión cerebral anóxica posterior a PCR es alta, con una duración promedio de la rehabilitación de pacientes hospitalizados de 41.5 días y un costo de 44.181 dólares por paciente (12). Esta devastadora lesión neurológica causada por el PCR se ha reconocido desde el desarrollo temprano de las técnicas en RCP (13). La persistencia de los desenlaces neurológicos desfavorables, a pesar de los avances en RCP, han llevado a la American Hearth Association (AHA) a reconocer la lesión cerebral posterior al PCR como área importante para la investigación clínica (14).
Por ello, se ha propuesto desde las guías de RCP y emergencia cardiovascular, el término "resucitación cardiopulmonar-cerebral" para enfatizar en la lesión neurológica relacionada con el PCR (15). Se han usado diferentes terminologías en la literatura científica para definir la lesión cerebral después de la RCP en un PCR (14). Los términos descriptivos utilizados para este tipo de encefalopatía han variado alrededor de los eventos fisiopatológicos relacionados con el PCR, tales como lesión anóxica, hipóxica, isquémica, hipotensiva y otros términos menos comunes (16). Considerando las amplias variaciones de esos parámetros de lesión, relacionados con el compromiso sistémico de los pacientes que presentan lesión neurológica, los términos previamente utilizados no son adecuados para dimensionar realmente la naturaleza de la encefalopatía relacionada con el PCR (15, 16). Recientemente, la AHA y el ILCOR (International Liasion Committe on Reuscitation) convocaron un panel de consenso internacional para definir formalmente el ''Síndrome Pos-Paro Cardíaco''(17, 18). En esta declaración, el síndrome postparo cardíaco (SPPC) está constituido por cuatro componentes denominados: lesión cerebral postparo cardíaco; disfunción miocárdica postparo cardíaco; síndrome sistémico de isquemia y reperfusión; y patología persistente precipitada por el paro. Aunque lo interesante es evaluar la lesión cerebral, es bien conocido que esos cuatro componentes tejen una compleja interacción llevando a una presentación sobrepuesta, un curso clínico y un pronóstico que incluye las manifestaciones neurológicas agudas de los sobrevivientes al PCR (19). Dadas todas estas consideraciones, en esta revisión se utiliza el término "lesión cerebral postparo cardíaco" o "encefalopatía postparo cardíaco", término que es más consistente con el SPPC.
Prevalencia de la lesión neurológica postPCR
La lesión cerebral postparo cardíaco (LCPC) es una causa común de morbilidad y mortalidad (14). En un estudio de pacientes que sobrevivieron al ingresar a la UCI, pero que posteriormente murieron en otras áreas del hospital, la LCPPC fue la causa de muerte en 68% de los paros cardíacos extrahospitalarios (PCREH) y en 23% de los paros cardíacos intrahospitalarios (PCRIH) (20). Este panorama epidemiológico muestra la necesidad de comprender los mecanismos fisiopatológicos de la lesión neurológica posterior al paro cardíaco y su relación con el impacto de las técnicas de resucitación y el pronóstico de los pacientes.
Mecanismos fisiopatológicos de la lesión neurológica postPCR
Durante el paro circulatorio total, la falta de oxigenación cerebral desencadena una pérdida las bombas Na+-K+ dependientes de ATP (21, 22). La subsecuente pérdida de la integridad celular dispara la liberación de glutamato, el cual causa lesión excitotóxica (23) que es mediada a través de los receptores N-metil-D-aspartato (NMDA) (24).otros neurotransmisores que modulan la excitoxicidad por glutamato, tales como glicina y GABA, se reducen concomitantemente (25). La activación de los receptores NMDA por el glutamato lleva a un influjo de calcio al espacio intracelular (26). La elevación de los niveles de calcio intracelular activa una serie de segundos mensajeros, los cuales amplifican la lesión mediante el incremento de la permeabilidad al calcio y la liberación de glutamato (27). La elevación del calcio intracelular también incrementa los niveles de radicales libres de oxígeno por la interferencia de la cadena respiratoria mitocondrial (28). Durante la fase de reperfusión, la excitoxicidad puede exacerbarse a través de la provisión de oxígeno como substrato para diversas reacciones enzimáticas que producen radicales libres en la mitocondria (29). Se sabe que estas formas reactivas de oxigeno causan lesión celular por medio de la peroxidación lipídica, oxidación proteínica y la fragmentación del ADN; todo lo cual conduce a la muerte celular (Figura 1) (30). La complejidad de la cascada inflamatoria no se limita a los procesos previamente descritos. Existen revisiones más extensas de la literatura que describen detalladamente los mecanismo bioquímicos de lesión neuronal relacionada con la isquemia global que no son motivo de esta revisión (31, 32). Esta cascada de eventos bioquímicos comienza con hipoxia global, reperfusión, un periodo transitorio de hiperemia cerebral, es seguido de vasoespasmo y un estado de hipoperfusión global y multifocal prolongado (33) que puede continuar por horas o días después del PCR (13).
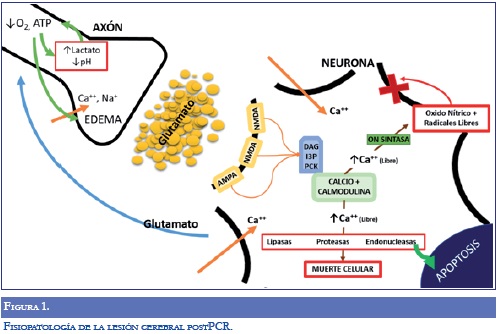
La disminución de oxígeno y energía en las neuronas aumenta los niveles de lactato y pH, además de la permeabilidad celular que facilitan el ingreso de Ca++ y Na+, produciendo edema celular; y liberación de glutamato, que al unirse con los receptores NMDA y AMPA de la neurona postsináptica, activan segundos mensajeros que aumentan el Calcio libre intracelular, el cual a través de diferentes vías favorece la muerte celular.
Manifestaciones clínicas de la lesión neurológica
La isquemia cerebral global durante el PCR produce una lesión heterogénea importante en el cerebro (14). Las extensas proyecciones de la corteza cerebral, las células de Purkinge del cerebelo y el área CA-1 del hipocampo son las zonas más vulnerables (34). Las áreas subcorticales, tales como el tronco encefálico, el tálamo y el hipotálamo, son más resistentes a la lesión que la corteza cerebral (35). Si el complejo tálamocortical o las extensas regiones corticales bilaterales se lesionan, se produce una alteración en el nivel de alertamiento y de la conciencia (36). La alteración del alerta continúa siendo el problema neurológico predominante durante el período temprano post resucitación (37). otras aéreas proclives a sufrir lesión isquémica incluyen los ganglios basales y el cerebelo, los cuales dan cuenta de los trastornos del movimiento y la ataxia incoordinación que se observan frecuentemente después del PCR (38). El tallo cerebral puede tolerar un alto grado de isquemia global, lo cual se traduce en la preservación de los reflejos sensoriomotores y de los pares craneales. Este patrón de alteración significativa de la corteza cerebral y del tálamo con una relativa preservación del tallo cerebral produce estados vegetativos y comatosos posteriores al PCR (39).
Otros de los problemas prevalentes en los sobrevivientes de PCR con LCPPC son las disfunciones cognoscitivas crónicas tales como alteraciones de conciencia, atención, proceso del lenguaje y funciones ejecutivas que pueden tener un impacto significativo en la calidad de vida de las personas (40). otros estudios informan que los sobrevivientes de PCR pueden sufrir consecuencias psiquiátricas como Trastorno por Stress Postraumático (41).
Forma de evaluar la lesión neurológica
La determinación del estado neurológico y de la discapacidad de los sobrevivientes de PCR es importante para la evaluar los desenlaces de los esfuerzos de resucitación (42). ya se mencionó que el período posterior a la recuperación del ritmo de perfusión se asocia a un nivel significativo de lesión neurológica (20). Más aún, se ha reportado deterioro del estado neurológico después de la RCP en diversos estudios (43), lo que determina la necesidad de evaluar adecuadamente el estado neurológico y el nivel de discapacidad de los sobrevivientes al PCR. La Categoría de Desempeño Cerebral (CPC, por sus siglas en Inglés) es el patón de oro para la evaluación de la recuperación neurológica después del PCR (44). Sin embargo, la CPC ha sido criticada por su pobre definición, la subjetividad de sus criterios, la falta de información sobre sus propiedades psicométricas y su débil correlación con las mediciones a largo plazo de discapacidad y calidad de vida (QOL) (45).
Más recientemente Stiell et al, condujeron un estudio encaminado a comparar la utilidad de la CPC con medidas ampliamente validadas como Health Utilities Index (HUI)(46). este trabajo es un subcomponente del gran estudio prospectivo de Soporte Cardíaco Avanzado de Vida Prehospitalario de ontario (oPALS) que incluyó sobrevivientes de PCREH de 20 ciudades entre 1995 y el 2002, los cuales fueron evaluados a los 12 meses del evento con CPC y HUI. Los autores concluyeron que la CPC permitió una buena clasificación de los pacientes de acuerdo a su calidad de vida, con aceptable sensibilidad y especificidad, lo que confirma que la CPC sea considerada como una herramienta importante que define una amplia gama de categorías funcionales pronósticas útiles para un número de aplicaciones clínicas y de investigación claves pero que no debería ser considerada un substituto de HUI.
Otras formas de evaluar la LCPP
Otra estrategia usada para clasificar los desenlaces en la investigación de los eventos cerebrovasculares es formular dos preguntas simples que han mostrado una bien establecida confiabilidad y validez (47, 48), sin embargo existen pocos estudios que determinen si esto es aplicable a la evaluación neurológica y a la discapacidad luego de un PCR. En este sentido, Longstreth Jr et al (49), entrevistaron, vía telefónica, a los sobrevivientes de PCREH 3 meses después del egreso hospitalario con dos simples preguntas: en los últimos dos meses, usted ha requerido ayuda de otra persona para sus actividades diarias?, ha sentido usted que ha conseguido una recuperación completa de su estado mental después de su paro cardíaco?; después de estas dos preguntas los autores aplicaron a los pacientes pruebas como el Mini-Mental (MMSE), la entrevista del estilo de vida y función (ALFI) y el Índice de Utilidades en Salud-3 (HUI3). Los autores encontraron que la clasificación basada en las dos preguntas simples se correlacionó significativamente con ALFI-MMSE (p=0.002) y con HUI3 (p=0.001) concluyendo que los desenlaces neurológicos después de PCR basados en dos preguntas simples pueden obtenerse de manera sencilla, con una buena sensibilidad y fácil interpretación, lo que justifica su uso en tal contexto, aunque se requieren estudios posteriores para generalizar su uso en la evaluación neurológica después de PCR.
Otra estrategia que puede utilizarse con el fin de evaluar la LCPP son los potenciales evocados neurosensoriales (SSEP), estos son un tipo de potenciales evocados (PE) generados por la estimulación con impulsos eléctricos de fibras nerviosas periféricas aferentes, táctiles u otras (50). Estos analizan la integridad y función de los circuitos tálamocorticales, ya que estas señales se conducen a través del núcleo talámico ventral posterolateral (VPL) hacia la corteza sensorial primaria (51).
La medición de la respuesta N20 (evaluada 20 ms después de la estimulación eléctrica en la muñeca del nervio mediano) ha emergido como el predictor más exacto de un pobre descenlace en los pacientes con encefalopatía anoxisquémica (52). Los SSEP son menos susceptibles que el electroencefalograma (EEG) al efecto de los fármacos sedantes, los factores metábolicos y la sepsis (53).
La ausencia bilateral de la respuesta cortical N20 sin lesión cortical preexistente conocida se interpreta como una lesión cortical extensa después del paro cardíaco con alta especificidad para pobre desenlace (16). No obstante, un N20 normal tiene poca precisión para determinar buen pronóstico (16).
Factores asociados con la lesión neurológica
Las circunstancias que rodean el PCR tienen implicaciones en la sobrevida y el pronóstico neurológico de los pacientes (14). Por ejemplo, el área hospitalaria en donde ocurra el PCR tiene un impacto significativo sobre el pronóstico neurológico de los pacientes.(54-56); en este sentido la mayoría de los estudios (57-59) informan mejores resultados para el PCRIH que ocurre en áreas críticas (UCI) que los que ocurren en la sala general. Las posibles explicaciones para esta observación incluyen: la posibilidad de PCR presenciado y monitorizado de la mayoría de los pacientes en UCI, disponibilidad inmediata de soporte vital avanzado (SVA), las menores edades y la mejor selección de los pacientes candidatos a reanimación y, el uso adecuado de políticas sobre no iniciar reanimación (NIR) (59). Otros factores asociados a peor pronóstico neurológico incluyen inicio tardío de la RCP, duración de la misma, y encontrar como ritmo inicial asistolia o AESP (60, 61). Sin embargo ninguna de estas asociaciones son suficientemente fuertes para ser usadas como marcadores pronósticos confiables de pobre pronóstico (14).
El examen neurológico continúa siendo uno de los factores más utilizados y confiables para determinar la extensión de la LCPP y el pronóstico neurológico en las víctimas de PCR (62). Algunos elementos específicos del examen neurológico pueden usarse en el pronóstico, tales como reacción pupilar a la luz, reflejo corneal y respuesta motora a los estímulos dolorosos (61, 63). Algunos estudios han demostrado que la reacción pupilar puede ser un marcador confiable de pronóstico neurológico entre las 24 y 72 horas después del PCR (62). La ausencia del reflejo corneal también indica mal pronóstico neurológico; así múltiples estudios han mostrado que la ausencia de este reflejo después de 72 horas del PCR predice un pobre pronóstico sin falsos positivos (63). Cuando se evalúa la respuesta motora ante estímulos dolorosos, 72 horas o más tras el PCR, la ausencia de respuesta motora normal o de postura extensora son predictores de pronóstico neurológico desfavorable casi sin falsos positivos (61,64). Sin embargo, cuando se emplean los hallazgos del examen físico como marcadores pronóstico del estado neurológico, se debe tener en cuenta si se está usando hipotermia terapéutica (65). De hecho, la implementación de estrategias >en el manejo postreanimación como la hipotermia terapéutica y la intervención coronaria percutánea tienen el potencial de influir significativamente en el resultado neurológico final (66).
Estrategias terapéuticas
Numerosos estudios clínicos han evaluado terapias dirigidas hacia etapas específicas de la cascada isquémica y han fallado en demostrar cualquier beneficio en los desenlaces (67). Recíprocamente, algunos estudios aleatorizados recientes demostraron que la hipotermia terapéutica está asociada con mejor supervivencia y mejores resultados funcionales después del PCR, aunque los mecanismos subyacentes de los efectos neuroprotectores de la hipotermia no se han comprendido totalmente, hay numerosas hipótesis sobre su utilidad potencial (68). La capacidad de la hipotermia leve (HTL) para afectar puntos múltiples de la cascada isquémica podría contribuir significativamente a su éxito como intervención terapéutica (69-73). Estos efectos incluyen el retardo en la tasa de la depleción inicial de ATP, la reducción de la liberación de neurotransmisores excitotóxicos (69), la modificación de la actividad de mensajeros intracelulares (70), la limitación de la disrupción de la barrera hematoencefálica (71), la reducción de la respuesta inflamatoria, la alteración de la expresión genética y la síntesis de proteínas (72), la reducción del calcio intracelular y cambios en la regulación del receptor de glutamato (73). Después de más de 2 décadas de ensayos clínicos fracasados con diversas estrategias neuroprotectoras, dos ensayos clínicos publicados en el 2002 mostraron que la hipotermia leve inducida puede disminuir la lesión cerebral, mejorando la supervivencia y el resultado neurológico funcional en pacientes comatosos sobrevivientes de PCREH (67); un estudio prospectivo que incluyó una cohorte de 2.973 adultos con PCREH dentro del registro alemán de Resucitación entre 2004 y 2010 encontró que la hipotermia terapéutica leve se asoció a un incremento de la supervivencia a las 24 horas (8.24 IC95% 4.24 a 16.00), p < 0.001) y con mejor desenlace neurológico dado por una mayor proporción de pacientes con CFC al egreso hospitalario (CPC 1 o CPC) (2.13 IC95% 1.17 a 3.90), p < 0.05) (74). Sin embargo el análisis de regresión logística subsecuente de este trabajo no mostró una significancia estadística para la HTL como predictor independiente de un buen desenlace neurológico.
Otra modalidad terapéutica con efecto potencial sobre los desenlaces neurológicos de los sobrevivientes de PCR es la intervención coronaria percutánea (ICP) (75). Numerosos informes sugieren que la coronariografía temprana y la Intervención Coronaria Percutánea (Angioplastia percutánea-ICP) mejoran los desenlaces de los pacientes reanimados cuyo electrocardiograma portresucitación mostró evidencia de infarto agudo del miocardio con elevación del segmento ST (IAMCEST) (76-79). En un estudio prospectivo realizado entre 1995 y 2005, 186 >pacientes fueron sometidos a ICP temprana después de una reanimación exitosa tras un PCR complicado con IAM (79) encontrándose una tasa de supervivencia a los 6 meses de 54% y una proporción de pacientes libres de secuelas neurológicas de 46%. Adicionalemente, un análisis de regresión logística realizado por Gräsner et al en el 2001 (80), reveló que en pacientes normotérmicos, la ICP estuvo independientemente asociada a un incremento en la supervivencia a las 24 horas (4.46 IC95% 2.26 a 8.81, p < 0.001 y un CPC 1 ó 2 (10.8 IC95% 5.86 a 19.93, p < 0.001).
Sin embargo, al parecer dentro del abordaje actual postresucitación, la estrategia que parece más promisoria es la combinación de HTL y coronariografía temprana con ICP, pues se ha documentado que su uso produce tasas de supervivencia de 70% con más de 80% de todos los sobrevivientes intactos neurológicamente (75). Inclusive los pacientes sin elevación del segmento ST en su periodo postresucitación podrían obtener un beneficio significativo con esta estrategia combinada (81).
Otra de las modalidades terapéuticas que ha mostrado beneficios potenciales en los sobrevivientes de PCR es la rehabilitación neurológica (82) que consiste en el reentrenamiento basado en la repetición de actividades, que facilita los procesos de plasticidad celular, reforzando de manera positiva una o más tareas, mientras que otras se inhiben, en individuos con algún grado de compromiso neurológico (83). Fertl et al (84) describieron un modelo de neurorehabilitación implementado en 20 pacientes que habían sufrido LCPP extrahospitalario a través de 15 sesiones por semana durante 12 semanas, de terapia física, ocupacional y terapia de lenguaje. Las metas terapéuticas fueron la orientación, la comunicación con propósito, la movilidad independiente, el auto cuidado y la mejoría en la funcionalidad evaluada mediante el índice de Barthel (IB). Durante la rehabilitación, se observó una mejoría media semanal de 1,88 puntos en IB. Al final del ciclo, se observó un aumento significativo en la capacidad de autocuidado con un puntaje medio en el IB de 60 (Z de wilcoxon = - 3,32; P<0.001).
Pusswald et al en 2000 (85), en un grupo pequeño de sobrevivientes de PCR con pobre pronóstico neurológico, atendidos en el Hospital Universitario de Viena durante los años 1998-1999 observaron que el 66,7% de los pacientes recuperaron la capacidad para deambular de manera independiente; y que el 58,3% tuvieron mejoría significativa en la capacidad de comunicación verbal. Recientemente Howell et al en el 2013 (86), en un estudio retrospectivo evaluó la rehabilitación en 113 pacientes con encefalopatía anoxoisquémica con desórdenes prolongados de la conciencia, observaron que el 20% de los sujetos del estudio recuperaron la conciencia con la implementación de las estrategias de neurorehabilitación.
A pesar de la poca evidencia en este tipo de pacientes, la amplia experiencia de la neurorehabilitación en pacientes con ACV isquémico (87) brinda mayor seguridad de los resultados benéficos de esta estrategia terapéutica debido a la similitud en la cascada de eventos fisiopatológicos entre las dos entidades (88).
Si bien es un hecho cierto que la rehabilitación reduce la carga de la atención a las familias y la sociedad, la falta de ensayos clínicos controlados con buen control de sesgos limita su recomendación en la práctica clínica, por lo que se recomienda la realización de estudios multicéntricos con altos niveles de evidencia para evaluar el potencial real de la rehabilitación en pacientes sobrevivientes de PCR con alteraciones de conciencia, deterioro cognitivo y perturbación en su calidad de vida (89, 90).
Conclusiones
La LCPP continúa representando una enorme carga para los pacientes, sus familias, el personal asistencial de salud y los recursos del sistema y parece estar asociada con variables de las víctimas del PCR, la localización de presentación del PCR y el ritmo durante el identificado paro. La evaluación neurológica y neurocognitiva debe ser un área que incluyan los clínicos en el abordaje de sus pacientes postPCR ya que estas variables son predictoras de pobre desenlace neurológico.
La evidencia acerca de los aspectos de la neurorehabilitación en personas con alteraciones cognitivas posteriores a PCR es limitada por ello se requieren trabajos de investigación que relacionen la patofisiología de la LCPP y sus secuelas cognitivas, identificando neurotransmisores específicos y blancos neuroanatómicos de tratamiento, que a su vez orienten el diseño de más ensayos clínicos sobre intervenciones farmacológicas y no farmacológicas que tengan impacto en las estrategias de neurorehabilitación en esta población.
Debido a la ausencia de evidencia contundente sobre el efecto neuroprotector de diversas estrategias farmacológicas, la combinación de la hipotermia terapéutica con la intervención coronaria percutánea en sobrevivientes de PCR por FV o TVSP, en estado comatoso parece prometedora en el manejo de la LCPP por su capacidad de actuar en múltiples puntos de la cascada isquémica y en los desenlaces neurológicos.
REFERENCIAS
1. ADABAG AS, LUEPKER RV, ROGER VL, GERSH BJ. Sudden cardiac death: epidemiology and risk factors. Nat Rev Cardiol. 2010; 7:216-25. [ Links ]
2. BRADY WJ, GURKA KK, MEHRING B, PEBERDY MA. In-hospital cardiac arrest: impact of monitoring and witnessed event on patient survival and neurologic status at hospital discharge. Resuscitation. 2011; 82:845-52. [ Links ]
3. DEATON C, FROELICHER ES, WU LH, HO C, SHISHANI K, JAARSMA T. The global burden of cardiovascular disease. Eur J Cardiovasc Nurs. 2011; 10(Suppl 2):5-14. [ Links ]
4. INAMASU J, MIYATAKE S, NAKATSUKASA M, KOH H, YAGAMI T. Loss of gray-white matter discrimination as an early CT sign of brain ischemia/ hypoxia in victims of asphyxial cardiac arrest. Emerg Radiol. 2011; 18:295-8. [ Links ]
5. INAMASU J, MIYATAKE S, SUZUKI M, NAKATSUKASA M, TOMIOKA H, HONDA M, ET AL. Early CT signs in out-of-hospital cardiac arrest survivors: Temporal profile and prognostic significance. Resuscitation. 2010; 81:534-8. [ Links ]
6. PAARMANN H, HERINGLAKE M, SIER H, SCHÖN J. The association of non-invasive cerebral and mixed venous oxygen saturation during cardiopulmonary resuscitation. Interact Cardiovasc Thorac Surg. 2010; 11:371-3. [ Links ]
7. MOULAERT VR, VERBUNT JA, VAN HEUGTEN CM, WADE DT. Cognitive impairments in survivors of out-of-hospital cardiac arrest: a systematic review. Resuscitation. 2009; 80:297-305. [ Links ]
8. MOULAERT VR, WACHELDER EM, VERBUNT JA, WADE DT, VAN HEUGTEN CM. Determinants of quality of life in survivors of cardiac arrest. J Rehabil Med. 2010; 42:553-8. [ Links ]
9. NICHOL G, STIELL IG, HEBERT P, WELLS GA, VANDEMHEEN K, LAUPACIS A. What is the quality of life for survivors of cardiac arrest? A prospective study. Acad Emerg Med. 1999; 6:95-102. [ Links ]
10. EDGREN E, KELSEY S, SUTTON K, SAFAR P. The preenting ECG pattern in survivors of cardiac arrest and its relation to the subsequent long-term survival. Acta Anaesthesiol Scand. 1989; 33:265-71. [ Links ]
11. HAMEL MB, PHILLIPS R, TENO J, DAVIS RB, GOLDMAN L, LYNN J, ET AL. Cost effectiveness of aggressive care for patients with nontraumatic coma. Crit Care Med. 2002; 30:1191-6. [ Links ]
12. BURKE DT, SHAH MK, DORVLO AS, ALADAWI S. Rehabilitation outcomes of cardiac and noncardiac anoxic brain injury: a single institution experience. Brain Inj. 2005; 19:675-80. [ Links ]
13. GEOCADIN RG, KOENIG MA, JIA X, STEVENS RD, PEBERDY MA. Management of brain injury after resuscitation from cardiac arrest. Neurol Clin. 2008; 26:487-506. [ Links ]
14. XIONG W, HOESCH RE, GEOCADIN RG. Postcardiac arrest encephalopathy. Semin Neurol. 2011; 31:216-25. [ Links ]
15. KARANJIA N, GEOCADIN RG. Post-cardiac arrest syndrome: update on brain injury management and prognostication. Curr Treat Options Neurol. 2011;13:191-203. [ Links ]
16. HOWARD RS, HOLMES PA, KOUTROUMANIDIS MA. Hypoxic-ischaemic brain injury. Practical neurology. 2011; 11:4-18. [ Links ]
17. NOLAN JP, NEUMAR RW, ADRIE C, AIBIKI M, BERG RA, BBTTIGER BW, ET AL. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication: a scientific statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; the Council on Stroke (Part II). Int Emerg Nurs. 2010; 18:8-28. [ Links ]
18. NOLAN JP, NEUMAR RW, ADRIE C, AIBIKI M, BERG RA, BBTTIGER BW, ET AL. Post-cardiac arrest syndrome: Epidemiology, pathophysiology, treatment, and prognostication: A scientific statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; the Council on Stroke (Part 1). Int Emerg Nurs. 2009; 17:203-25. [ Links ]
19. STUB D, BERNARD S, DUFFY SJ, KAYE DM. Post cardiac arrest syndrome: a review of therapeutic strategies. Circulation. 2011; 123:1428-35. [ Links ]
20. LAVER S, FARROW C, TURNER D, NOLAN J. Mode of death after admission to an intensive care unit following cardiac arrest. Intensive Care Med. 2004; 30:2126-8. [ Links ]
21. BUSL KM, GREER DM. Hypoxic-ischemic brain injury: pathophysiology, neuropathology and mechanisms. NeuroRehabilitation. 2010; 26:5-13. [ Links ]
22. SHARMA HS, MICLESCU A, WIkLUND L. Cardiac arrest-induced regional blood-brain barrier breakdown, edema formation and brain pathology: a light and electron microscopic study on a new model for neurodegeneration and neuroprotection in por-cine brain. J Neural Transm. 2011; 118:87-114. [ Links ]
23. VAAGENES P, GINSBERG M, EBMEYER U, ERNSTER L, FISCHER M, GISVOLD SE, ET AL. Cerebral resuscitation from cardiac arrest: pathophysiologic mechanisms. Crit Care Med. 1996; 24:57-68. [ Links ]
24. LIPTOT SA. NMDA receptor activity regulates transcription of antioxidant pathways. Nat Neurosci. 2008; 11:381-2. [ Links ]
25. FERNÁNDEZ-GÓMEZ FJ, HERNÁNDEZ F, ARGANDOÑA L, GALINDO MF, SEGURA TT, JORDÁN. Pharmacology of neuroprotection in acute ischemic stroke. J Rev Neurol. 2008; 47:253-60. [ Links ]
26. Dolga AM, Terpolilli N, Kepura F, Nijholt IM, Knaus HG, D'Orsi B, et al. KCa2 channels activation prevents [Ca2+] i deregulation and reduces neuronal death following glutamate toxicity and cerebral ischemia. Cell Death Dis. 2011;2:e147. [ Links ]
27. ARUNDINE M, TYMIANSKI M. Molecular mechanisms of calcium-dependent neurodegeneration in excitotoxicity. Cell Calcium. 2003; 34:325-37. [ Links ]
28. LAU A, TYMIANSKI M. Glutamate receptors, neurotoxicity and neurodegeneration. Pflugers Arch. 2010; 460:525-42. [ Links ]
29. ONO T, TSURUTA R, FUJITA M, AKI HS, KUTSUNA S, KAWAMURA Y, ET AL. Xanthine oxidase is one of the major sources of superoxide anion radicals in blood after reperfusion in rats with forebrain ischemia/reperfusion. Brain Res. 2009; 1305:158-67. [ Links ]
30. CHEN H, YOSHIOKA H, KIM GS, JUNG JE, OKAMI N, SAKATA H. Oxidative stress in ischemic brain damage: mechanisms of cell death and potential molecular targets for neuroprotection. Antioxid Redox Signal. 2011; 14:1505-17. [ Links ]
31. GREER DM. Mechanisms of injury in hypoxicischemic encephalopathy: implications to therapy. Semin Neurol. 2006; 26:373-9. [ Links ]
32. HARUKUNI I, BHARDWAJ A. Mechanisms of brain injury after global cerebral ischemia. Neurol Clin. 2006; 24:1-21. [ Links ]
33. XU K, PUCHOWICZ MA, SUN X, LAMANNA JC. Decreased brainstem function following cardiac arrest and resuscitation in aged rat. Brain Res. 2010; 1328:181-9. [ Links ]
34. WIJDICKS EF, CAMPEAU NG, MILLER GM. MR imaging in comatose survivors of cardiac resuscitation. AJNR Am J Neuroradiol. 2001; 22:1561-5. [ Links ]
35. WIJDICKS EF. The diagnosis of brain death. N Engl J Med. 2001; 344:1215-21. [ Links ]
36. STERIADE M. Corticothalamic resonance, states of vigilance and mentation. Neuroscience. 2000; 101:243-76. [ Links ]
37. HOESCH RE, KOENIG MA, GEOCADIN RG. Coma after global ischemic brain injury: patho-physiology and emerging therapies. Crit Care Clin. 2008; 24:25-44.
38. LU-EMERSON C, KHOT S. Neurological sequelae of hypoxic-ischemic brain injury. NeuroRehabilitation. 2010; 26:35-45. [ Links ]
39. BUSSIÈRE M, YOUNG GB. Anoxic-Ischemic Encephalopathy and Strokes Causing Impaired Consciousness. Neurol Clin. 2011; 29:825-36. [ Links ]
40. ANDERSON CA, ARCINIEGAS DB. Cognitive sequelae of hypoxic-ischemic brain injury: a review. NeuroRehabilitation. 2010; 26:47-63. [ Links ]
41. SAUVE MJ, DOOLITTLE N, WALKER JA, PAUL SM, SCHEINMAN MM. Factors associated with cognitive recovery after cardiopulmonary resuscitation. Am J Crit Care. 1996; 5:127-39. [ Links ]
42. RAINA KD, CALLAWAY C, RITTENBERGER JC, HOLM MB. Neurological and functional status following cardiac arrest: method and tool utility. Resuscitation. 2008; 79:249-56. [ Links ]
43. VAN ALEM AP, DE VOS R, SCHMAND B, KOSTER RW. Cognitive impairments in survivors of out-of-hospital cardiac arrest. Am Heart J. 2004;148:416-21. [ Links ]
44. JENNETT B, BOND M. Assessment of outcome after severe brain damage. Lancet. 1975; 7905:480-4. [ Links ]
45. HSU JWY, MADSEN CD, CALLAHAM ML. Quality-of-life and formal functional testing of survivors of out-of-hospital cardiac arrest correlates poorly with traditional neurologic outcomes scales. Ann Emerg Med. 1996; 28:597-605. [ Links ]
46. StIELL IG, NESBITT LP, NICHOL G, MALONEY J, DREYER J, BEAUDOIN T, ET AL. OPALS Study Group. Comparison of the Cerebral Performance Category score and the Health Utilities Index for survivors of cardiac arrest. Ann Emerg Med. 2009; 53:241-8. [ Links ]
47. BERGE E, FJAERTOFT H, INDREDAVIK B, SANDSET PM. Validity and reliability of simple questions in assessing short- and long-term outcome in Norwegian stroke patients. Cerebrovasc Dis. 2001; 11:305-10. [ Links ]
48. MCKEVITT C, DUDNAS R, WOLFE C. Two simple questions to assess outcome after stroke: a European study. Stroke. 2001; 32:681-6. [ Links ]
49. LONGSTRETH WT JR, NICHOL G, VAN OTTINGHAM L, HALLSTROM AP. Two simple questions to assess neurologic outcomes at 3 months after out-of-hospital cardiac arrest: experience from the public access defibrillation trial. Resuscitation. 2010; 81:530-3. [ Links ]
50. LOGI F, FISCHER C, MURRI L, MAUGUIERE F. The prognostic value of evoked responses from primary somatosensory and auditory cortex in comatose patients. Clinical neurophysiology: official journal of the International Federation of Clinical Neurophysiology. 2003; 114:1615-27. [ Links ]
51. BOUWES A, BINNEKADE JM, ZANDSTRA DF, KOELMAN JH, VAN SCHAIK IN, HIJDRA A, ET AL. Somatosensory evoked potentials during mild hypothermia after cardiopulmonary resuscitation. Neurology. 2009; 73:1457-61. [ Links ]
52. YOUNG GB. Clinical practice. Neurologic prognosis after cardiac arrest. N Engl J Med. 2009; 361:605-11. [ Links ]
53. LEE YC, PHAN TG, JOLLEY DJ, CASTLEY HC, INGRAM DA, REUTENS DC. Accuracy of clinical signs, SEP, and EEG in predicting outcome of hypoxic coma: a meta-analysis. Neurology. 2010; 74:572-80. [ Links ]
54. DI BARI M, CHIARLONE M, FUMAGALLI S, BONCINELLI L, TARANTINI F, UNGAR A, ET AL. Cardiopulmonary resuscitation of older, inhospital patients: immediate efficacy and long-term outcome. Crit Care Med. 2000; 28:2320-5. [ Links ]
55. LUNDBYE JB, RAI M, RAMU B, HOSSEINIKHALILI A, LI D, SLIM HB, ET AL. Therapeutic hypothermia is associated with improved neurologic outcome and survival in cardiac arrest survivors of non-shockable rhythms. Resuscitation. 2012; 83:202-7. [ Links ]
56. SAKLAYEN M, LISS H, MARKERT R. In-hospital cardiopulmonary resuscitation. Survival in 1 hospital and literature review. Medicine (Baltimore). 1995; 74:163-75. [ Links ]
57. DE VOS R, KOSTER RW, DE HAAN RJ, OOST-ING H, VAN DER WOUW PA, LAMPE-SCHOEN-MAECKERS AJ. In-hospital cardiopulmonary resuscitation: prearrest morbidity and outcome. Archives of internal medicine. 1999; 159:845-50. [ Links ]
58. DUMOT JA, BURVAL DJ, SPRUNG J, WATERS JH, MRAOVIC B, KARAFA MT, ET AL. Outcome of adult cardiopulmonary resuscitations at a tertiary referral center including results of "limited" resuscitations. Archives of internal medicine. 2001; 161:1751-8. [ Links ]
59. HERLITZ J, BÅNGA, AUNE S, EKSTRÖM L, LUNDSTRÖM G, HOLMBERG S. Characteristics and outcome among patients suffering in-hospital cardiac arrest in monitored and non-monitored areas. Resuscitation. 2001; 48:125-35. [ Links ]
60. SAYRE MR, TRAVERS AH, DAYA M, GREENE HL, SALIVE ME, VIJAYARAGHAVAN K, ET AL. Measuring survival rates from sudden cardiac arrest: the elusive definition. Resuscitation. 2004; 62:25-34. [ Links ]
61. WIJDICKS EF, HIJDRA A, YOUNG GB, BASSETTI CL, WIEBE S. Practice parameter: prediction of outcome in comatose survivors after cardiopulmonary resuscitation (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2006; 67:203-10. [ Links ]
62. RITTENBERGER JC, SANGL J, WHEELER M, GUYETTE FX, CALLAWAY CW. Association between clinical examination and outcome after cardiac arrest. Resuscitation. 2010; 81:1128-32. [ Links ]
63. ZHENG ZJ, CROFT JB, GILES WH, MENSAH GA. Sudden cardiac death in the United States, 1989 to 1998. Circulation. 2001; 104:2158-63. [ Links ]
64. ZANDBERGEN EG, HIJDRA A, KOELMAN JH, ET AL. PROPAC Study Group. Prediction of poor outcome within the first 3 days of postanoxic coma. Neurology. 2006; 66:62-8. [ Links ]
65. AL THENAYAN E, SAVARD M, SHARPE M, NORTON L, YOUNG B. Predictors of poor neurologic outcome after induced mild hypothermia following cardiac arrest. Neurology. 2008; 71:1535-7. [ Links ]
66. TACCONE FS, DONADELLO K, BEUMIER M, SCOLLETTA S. When, where and how to initiate hypothermia after adult cardiac arrest. Minerva Anestesiol. 2011; 77:927-33. [ Links ]
67. GEOCADIN RG, editors. Hypoxic-ischemic encephalopathy. Semin Neurol. 2006. [ Links ]
68. GINSBERG M, BELAYEV L. The effects of hypothermia and hyperthermia in global cerebral ischemia. In: Maier, C; Steinberg, G; editors. Hypothermia and cerebral ischemia. Totowa (NJ): Humana Press. 2004:17-38. [ Links ]
69. BUSTO R, GLOBUS MY, DIETRICH WD, ET AL. Effect of mild hypothermia on ischemia-induced release of neurotransmitters and free fatty acids in rat brain. Stroke. 1989; 20:904-10. [ Links ]
70. CARDELL M, BORIS-MOLLER F, WIELOCH T. Hypothermia prevents the ischemia-induced translocation and inhibition of protein kinase C in the rat striatum. J Neurochem. 1991; 57:1814-7. [ Links ]
71. DEMPSEY RJ, COMBS DJ, MALEY ME, ET AL. Moderate hypothermia reduces postischemic edema development and leukotriene production. Neurosurgery. 1987; 21:177-81. [ Links ]
72. KUMAR K, WU X, EVANS AT, ET AL. The effect of hypothermia on induction of heat shock protein (HSP]72 in ischemic brain. Metab Brain Dis. 1995; 10:283-91. [ Links ]
73. COLBOURNE F, GROOMS SY, ZUKIN RS, ET AL. Hypothermia rescues hippocampal CA1 neurons and attenuates down-regulation of the AMPAreceptor GluR2 subunit after fore-brain ischemia. Proc Natl Acad Sci USA. 2003; 100:2906-10. [ Links ]
74. CALLAWAY CW. Refining the use of therapeutic hypothermia after cardiac arrest. Crit Care Med. 2011; 39:201-2. [ Links ]
75. KERN KB, RAHMAN O. Emergent percutaneous coronary intervention for resuscitated victims of out-of-hospital cardiac arrest. Catheterization and cardiovascular interventions: official journal of the Society for Cardiac Angiography & Interventions. 2010; 75:616-24. [ Links ]
76. WOLFRUM S, PIERAU C, RADKE PW, SCHUNKERT H, KUROWSKI V. Mild therapeutic hypothermia in patients after out-of-hospital cardiac arrest due to acute ST-segment elevation myocardial infarction undergoing immediate percutaneous coronary intervention. Crit Care Med. 2008;36:1780-6. [ Links ]
77. MAGER A, KORNOWSKI R, MURNINKAS D, VAKNIN-ASSA H, UKABI S, BROSH D, ET AL. Out-come of emergency percutaneous coronary intervention for acute ST-elevation myocardial infarction complicated by cardiac arrest. Coronary artery disease. 2008; 19:615-8. [ Links ]
78. LETTIERI C, SAVONITTO S, DE SERVI S, GUAGLIUMI G, BELLI G, REPETTO A, ET AL. Emergency percutaneous coronary intervention in patients with ST-elevation myocardial infarction complicated by out-of-hospital cardiac arrest: early and mediumterm outcome. Am Heart J. 2009; 157:569-75. [ Links ]
79. GAROT P, LEFEVRE T, ELTCHANINOFF H, MORICE MC, TAMION F, ABRY B, ET AL. Sixmonth outcome of emergency percutaneous coronary intervention in resuscitated patients after cardiac arrest complicating ST-elevation myocardial infarction. Circulation. 2007; 115:1354-62. [ Links ]
80. GRASNER JT, MEYBOHM P, CALIEBE A, BOTTIGER BW, WNENT J, MESSELKEN M, ET AL. Postresuscitation care with mild therapeutic hypothermia and coronary intervention after out-of-hospital cardiopulmonary resuscitation: a prospective registry analysis. Critical Care. 2011;15:R61. [ Links ]
81. MOtTTILLO S, SHARMA K, EISENBERG MJ. Therapeutic hypothermia in acute myocardial infarction: a systematic review. The Canadian journal of cardiology. 2011; 27:555-61. [ Links ]
82. KURIHARA M, OGASAWARA S, KADOWAKI A, ONIZUKA S, SAMEJIMA M. [Consideration of early rehabilitation in the treatment of post-cardiac arrest syndrome]. Nihon rinsho Japanese journal of clinical medicine. 2011; 69:653-7. [ Links ]
83. DIMYAN MA, DOBKKIN BH, COHEN LG. Emerging subspecialties: neurorehabilitation: training neurologists to retrain the brain. Neurology. 2008; 70:e52-4. [ Links ]
84. FERTL E, VASS K, STERZ F, GABRIEL H, AUFF E. Neurological rehabilitation of severely disabled cardiac arrest survivors. Part I. Course of post-acute inpatient treatment. Resuscitation. 2000; 47:231-9. [ Links ]
85. PUSSWALD G, FERTL E, FALTL M, AUFF E. Neurological rehabilitation of severely disabled cardiac arrest survivors. Part II. Life situation of patients and families after treatment. Resuscitation. 2000; 47:241-8. [ Links ]
86. HOWELL K, GRILL E, KLEIN AM, STRAUBE A, BENDER A. Rehabilitation outcome of anoxicischaemic encephalopathy survivors with prolonged disorders of consciousness. Resuscitation. 2013; 84:1409-15. [ Links ]
87. OTTENBACHER KJ. The post-stroke rehabilitation outcomes project. Archives of physical medicine and rehabilitation. 2005; 86:S121-3. [ Links ]
88. STEULTJENS EM, DEKKER J, BOUTER LM, VAN DE NES JC, CUP EH, VAN DEN ENDE CH. Occupational therapy for stroke patients: a systematic review. Stroke. 2003; 34:676-87. [ Links ]
89. CHARD SE. Community neurorehabilitation: a synthesis of current evidence and future research directions. NeuroRx: the journal of the American Society for Experimental NeuroTherapeutics. 2006; 3:525-34. [ Links ]
90. LEÓN-SARMIENTO FE, BAYONA-PRIETO J, CADENA Y. Plasticidad neuronal, neurorehabilitación y trastornos del movimiento: el cambio es ahora. Acta Neurol Colomb. 2008; 24:40-2. [ Links ]













