Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.29 no.4 Bogotá Oct./Dec. 2013
ACV lacunar talámico y piramidal bulbar en adulto joven diabético: reporte de caso
Lacunar stroke in thalamic and bulbar pyramid in a young diabetic adult: case report
Andersson L Rozo A, Germán Cantillo Mackenzie, Juan Camilo Suárez-Escudero
Andersson L Rozo A, Médico fisiatra, Hospital Militar Central.
Germán Cantillo Mackenzie, Psicólogo, estudiante de especialización en rehabilitación neuropsicológica Universidad CES.
Juan Camilo Suarez-Escudero, Médico, especialista en neurorehabilitación - rehabilitación neuropsicológica. Coordinador Unidad de Neurorehabilitación Instituto Neurológico de Colombia. Docente e investigador facultad de Medicina yPsicología Universidad Pontificia Bolivariana y Universidad CES. Bogotá.
Correspondencia: camilo.suarez@neurologico.org.co
Recibido: 02/07/13. Revisado: 10/08/13. Aceptado: 02/10/13.
RESUMEN
Reportamos el caso de un paciente con enfermedad diabética tipo 1 que sufrió un ACV isquémico lacunar talámico derecho y simultáneamente otro en la pirámide bulbar derecha, con manifestaciones sensitivas y motoras. Este cuadro clínico se consideró asociado a microangiopatía vascular por el antecedente personal de diabetes tipo 1 y debido a que los demás estudios realizados durante la atención médica no mostraron otra causa aparente.
PALABRAS CLAVES. Palabras clave: Accidente cerebrovascular, Accidente Vascular Cerebral Lacunar, Tálamo, Diabetes Mellitus (DeCS).
SUMMARY
We report a patient with Diabetes mellitus who suffers simultaneus ischemic stroke at the rigth talamus and the ipsilateral bulbar pyramid. This vascular phenomenom was attributed to vascular microangiopathy as part of type 1 diabetes mellitus. Remaining work up ruled out other causes for acute ischemic stroke.
KEY WORDS: Stroke, Stroke, Lacunar, Thalamus, Diabetes Mellitus (MeSH).
INTRODUCCIÓN
La organización Mundial de la Salud define la enfermedad cerebrovascular (ECV) como "el rápido desarrollo de signos focales (o globales) de compromiso de la función cerebral, con síntomas de 24 horas o más, o que lleven a la muerte sin otra causa que el origen vascular" (1). Esta definición permanece vigente a pesar de los avances en imágenes diagnósticas que han permitido identificar de manera más temprana los cambios por isquemia cerebral (2). La severidad del compromiso varía desde la discapacidad leve a severa y muerte hasta la recuperación parcial o casi completa.
El término Ataque (o accidente) Cerebrovascular (ACV) se refiere al evento neurológico agudo o ictus, causado por una oclusión súbita de un vaso, de origen trombótico, embolico o por hemorragia intraparenquimatosa, subaracnoidea o intraventricular por aneurisma, hipertensión o secundario a un tumor o malformación arteriovenosa (2).
La incidencia de ACV es variable, cambia desde 76.1/100.000 en Shangai, 158/100.000 en Nueva Zelanda, hasta de 940/100.000 en Rotterdam en personas mayores de 55 años (3-5). En Colombia es la principal causa de discapacidad de origen neurológico, con una mayor incidencia en hombres (118.7 hombres vs. 61.8 mujeres/100.000) (1). Se resalta su importancia por ser una causa importante de muerte, discapacidad, dependencia y estancia hospitalaria en el país (1).
Alrededor del 8% de la población adulta en Estados Unidos presenta enfermedad diabética (ED) (6), y entre los pacientes que han sufrido un ECV se presenta entre el 15% y el 33% (4). Se ha descrito que las personas con diabetes morirán entre 5 y 10 años antes que las personas sin ED; la ECV produce un 50% de las muertes entre las personas con ED (7). Los pacientes con ED tienen el doble de posibilidad de padecer un evento coronario o un ACV en comparación a aquellos que no la padecen (7). El 84% de las muertes producidas por ECV relacionadas con la diabetes se dan en países con niveles bajos o medios de ingresos (7). En los pacientes con ED tipo 1 la incidencia de ACV aumenta con la edad, principalmente en mayores de 40 años; el 76% son isquémicos y el 24% hemorrágicos, con una supervivencia posACV del 80.6%, 45.2 y 9.6% a 1, 5 y 10 años respectivamente (8).
La diabetes es un factor de riesgo para sufrir ataque cerebrovascular y es predictor de severidad de la enfermedad. Los niveles de glicemia superiores a 126 mg/dl están relacionados con un primer evento y los niveles de hemoglobina glicosilada A1c superiores a 7% se relacionan con cuadros recidivantes (2). La ECV causada por enfermedad de pequeños vasos se observa en pacientes con ED (8). En Colombia cerca del 42% de los pacientes que han presentado un ACV tienen ED (9). Un cuarto de los ataques cerebrovasculares isquémicos son infartos lacunares resultantes de la oclusión de las pequeñas arterias perforantes (10). El infarto cerebral de tipo lacunar (IL) producido por oclusión de las arteriolas cerebrales perforantes se presenta en pacientes diabéticos (11,12).
Presentación del caso
Hombre de 29 años; natural de Medellín, reside en Cisneros/Antioquia. Desempleado. El 8 de septiembre de 2009 consultó por cuadro clínico de 5 días de evolución de déficit motor con hemiplejia izquierda de inicio súbito, primer episodio. Refirió que (3/09/2009) inició con parestesias en 2 y 3 dedos del miembro superior izquierdo, que en el curso de 10 minutos se extendió a toda la extremidad hasta cuello. En las 24 horas de inicio del cuadro, presentó hemiparesia con consecuente incapacidad para la marcha. Negó otros síntomas. Sus antecedentes patológicos eran: Diabetes Mellitus tipo 1 diagnosticada a los 8 años de edad en tratamiento con insulina NPH 30 unidades en la mañana y 10 unidades en la noche.
El examen físico (08/09/2009) lo mostró: orientado, presión arterial: 109/70 mm Hg, frecuencia cardíaca: 74/min; frecuencia respiratoria: 20/min; saturación de oxígeno: 94%. Sin disartria, ni compromiso de pares craneanos, isocórico normoreactivo a la luz de 3 mm, sin compromiso facial. Arreflexia generalizada, Babinski presente en pie izquierdo, sin signos meníngeos. Hemicuerpo derecho normal. Plejía braquial 0/5 y paresia crural izquierdas 2/5.
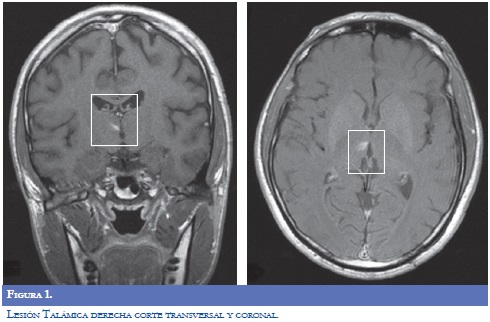
Paraclínicos de ingreso: glucometría 272 mg/ dl, Hb Glicosilada 15,8%. La RM del encéfalo (9/09/2009): evidenció lesión que restringía la difusión, visible en FLAIR y T2, infarto subagudo en región superior y anterior derecha del bulbo raquídeo. Imagen hiperintensa en T1, que no realzaba, en el tálamo derecho. Angioresonancia: fenestración de la arteria vertebral derecha distal, hallazgo incidental Neuroradiología reportó que la lesión hiperintensa talámica derecha pudiera obedecer a alteración metabólica por hiperglicemia, pero fue asumido por neurología clínica como infarto lacunar (Figuras 1-2).

Ecocardiograma transesofágico (12/09/2009): fracción de eyección 60%, función diastólica normal, aurícula izquierda normal. Septo inter auricular integro. Shunt significativo a través de la vena pulmonar superior derecha vs. drenaje venoso anómalo. Eco renal y urinario: hiperecogenecidad de riñón izquierdo. Eco de MMII: negativo para TVP. EKG de superficie: sin alteración. Doppler de vasos carotideos: normal. Ionograma: Mg: 1.8; Na:141; K: 3.92; Cl:105.1. Uroanálisis: glucosuria de 1000 mg/ dl. Creatinina de 0,8 con nitrógeno uréico normal.
Depuración de creatinina: 143,5. Proteinuria 24 horas: 0,21. TP: 11,7 TPT: 25,8 ANAS: negativos. Serología RPR: no reactiva. HIV: negativo. Cardiología (13/09/2009): paciente asintomático cardiovascular, ruidos cardiacos rítmicos sin soplos, murmullo vesicular conservado sin agregados. Sin alteraciones hemodinámicas. TAC multicorte de tórax con énfasis en corazón normal.
Se inició terapia física basada en estiramientos pasivos sostenidos, movilizaciones pasivas por medio de patrones unilaterales, posicionamiento, fortalecimiento muscular, entrenamiento de agarre fino y grueso y entrenamiento del patrón de marcha sin caminador, equilibrio y propiocepción. Mejoró a paresia braquial izquierda 3/5 y 4/5 crural ipsilateral, hipotónico, con Babinski izquierdo. Parestesias de hemicuerpo izquierdo. Logró marcha parética, muy limitada. Valoración de egreso (18/09/2009): lesión talámica derecha que sugiere infarto lacunar con transformación hemorrágica. Se descartó cardioembolismo, estenosis intracraneana o extracraneana, trombofilia o autoinmunidad. Por ser diabético mal controlado, se atribuyó la causa del ACV a microangiopatía.
Los diagnósticos de egreso (18/09/2009) fueron: ACV bulbar superior y anterior derecho en paciente joven; infarto lacunar talámico derecho con transformación hemorrágica; Diabetes insulino requiriente descompensada.
En el control ambulatorio por Neurología (5/10/2009) se halló mejoría clínica, recuperación de marcha y función de la mano, paciente funcional e independiente en AVD, con mejoría de cifras glucométricas. Persistencia de parestesias en hemicuerpo izquierdo. En su más reciente control se apreció (19/10/2012): disminución de fuerza del hemicuerpo izquierdo pero logra desempeñarse como conductor de vehículo. Control parcial de diabetes por cifras ocasionales elevadas. Sin alteración del tono muscular.
DISCUSIÓN
La causa atribuida al cuadro neurológico que presentó el paciente correspondió a infartos lacunares secundarios a microangiopatia diabética en el talámo y la pirámide bulbar derechos. El infarto de la pirámide bulbar derecha explica una lesión parcial de la vía córtico espinal previa a la decusación. De esta forma dicho déficit explica la hemiplejia izquierda inicial. La ubicación de esta lesión no explica la sintomatología sensitiva. La lesión talámica derecha, en la zona medial, explica la sintomatología sensitiva. La arteria cerebral posterior, mediante su rama geniculotalámica, perfunde el territorio talámico posterolateral. La arteria comunicante posterior, a través de la rama tuberotalámica, riega el territorio talámico anterolateral. La arteria carótida interna, por su rama coroidea anterior, se distribuye en el territorio talámico lateral (13).
Los requisitos diagnósticos para considerar infarto lacunar son: pequeño tamaño (menor de 1,5 cm de diámetro) en territorio de arteria perforante cerebral, un síndrome lacunar (hemiparesia motora pura, síndrome sensitivo puro, síndrome sensitivo motriz, hemiparesia atáxica y disartria, mano torpe) en paciente con antecedente de HTA, ED u otros factores de riesgo vascular cerebral, en ausencia de otra etiología. El paciente cumplió con esos requisitos diagnósticos (12).
Las ramas arteriales más comprometidas en el infarto lacunar son: la arteria cerebral media en sus arterias lentículo estriadas, la arteria cerebral anterior en la arteria recurrente de Heubner, la arteria cerebral posterior en las arterias tálamogeniculadas y la arteria basilar (12,13).
El deterioro motor después del ACV se ha relacionado con el sitio y el tamaño de la lesión, lesiones previas y otros factores como la edad o las comorbilidades existentes (14, 15). A su vez el metabolismo anormal de la glucosa se relaciona con infartos lacunares de la sustancia blanca, igual que el tabaquismo y el alcohol se relacionan con microangiopatía. Aunque cerca del 50% de los pacientes que sufren un ataque lacunar no presentan alteraciones microangiopáticas (12).
Los niveles de Hb A1c se encuentran aumentados en los pacientes con microangiopatia y a su vez son factor predisponente para nuevos eventos, al igual que la edad mayor de 60 años, la hiperlipidemia y la hipertesion arterial. Por lo tanto se recomienda el control de las cifras para prevenir eventos lacunares y sus respectivas secuelas (16).
En el contexto de un paciente diabético que desarrolla microangiopatia suele presentarse un síndrome sensitivomotriz. Corresponde al síndrome lacunar que más habitualmente está ocasionado con etiologías diferentes a los infartos lacunares (infartos extensos, pequeñas hemorragias cerebrales o incluso procesos expansivos). Consiste en la presencia de un síndrome piramidal completo (faciobraquiocrural) o incompleto, proporcionado o no, asociado a un déficit sensitivo global o parcial del mismo hemicuerpo (16). Estas fueron las características clínicas del paciente, lo que indica que los hallazgos clínicos se correlacionaron con los hallazgos imaginológicos, encontrándose un déficit motor con inicio sensitivo que llevó a alteraciones de la marcha.
La clínica del infarto talámico es variable, dependiendo de la lateralidad de la lesión y del territorio vascular afectado. Durante la fase aguda los síntomas más frecuentes son: hipersomnia, parálisis oculomotora, ataxia moderada de la marcha y déficits de atención, aprendizaje y memoria (17, 18). Llama la atención que el paciente presentado no expresó déficit cognitivo alguno. otros reportes de caso han mostrado la relación del infarto talámico con déficit cognitivo agudo y demencia posterior (19).
Dentro del marco de evaluación y manejo de rehabilitación se ha encontrado que los hallazgos más comunes en los pacientes con ACV son: dificultad para movilizar y realizar actividades con la extremidad superior (87,5%), dificultad motora en hemicuerpo (87,5%), dificultad para hablar o entender el lenguaje (50%), dificultad en la capacidad de recordar (41,1%), dificultad visual (30,4%) y dificultad auditiva (19,6%) (15). Entre el 75 - 85% de las personas con ACV, recuperan la capacidad de caminar con ayudas externas o sin ellas, y 48 - 58% logran adquirir independencia en el auto cuidado. En la recuperación motora se evidencia mayor mejoría en los movimientos de la extremidad inferior que de la extremidad superior (fenómeno relacionado con la complejidad funcional y bioestructural que posee la extremidad superior, específicamente la mano) (20). Igualmente la hemiparesia mejora un 73% en etapas tempranas posteriores al ACV, y puede llegar a mejorar un 37% en el transcurso de 12 meses. El 70% de los pacientes que muestran algún grado de recuperación en la función manual, en el primer mes posterior al evento, logran una buena recuperación motora (14).
El ACV es una causa importante de discapacidad. De acuerdo al sitio afectado el cuadro clínico va a variar en cada paciente. En las personas con ED tipo 1 es común encontrar infartos lacunares secundarios a enfermedad microvascular que se pueden ubicar de manera estratégica y generar déficits específicos individuales. La recuperación funcional del paciente estará orientada a obtener la mayor mejoría posible para que retorne a sus actividades cotidianas.
REFERENCIAS
1. Guía de manejo. Rehabilitación de las secuelas de enfermedad cerebro vascular, Bogotá: Servicio Medicina Física y Rehabilitación, Hospital Militar Central, 2010. [ Links ]
2. Scottish Intercollegiate Guidelines Network. Management of patients with stroke: Rehabilitation,prevention and management of complications, and discharge planning. A national clinical guideline, June 2010. [ Links ]
3. LINDENBERG R, RENGA V, ZHU LL, BEZLER F, ALSOP D, SCHLAUG G. Structural integrity of corticospinal motor fibers predicts motor impairment in chronic stroke. Neurology. 2010; 74:280-7. [ Links ]
4. KOZERA GM, WOLNIK B, KUNICKA KB, SZCZYRBA S, WOJCZAL J, SCHMINKE U, NYKA WM, BIENIASZEWSKI L. Cerebrovascular reactivity, intima-media thickness, and nephropathy presence in patients with type 1 diabetes. Diabetes Care. 2009; 32:878-82. [ Links ]
5. CUI R, ISO H, YAMAGISHI K, SAITO I, KOKUBO Y, INOUE M, TSUGANE S. Diabetes mellitus and risk of stroke and its subtypes among Japanese: the Japan public health center study. Stroke. 2011; 42:2611-4. [ Links ]
6. International Diabetes Federation. Diabetes Atlas, Fourth Edition, 2009. Morbidity and Mortality. Last accessed at: http://www.diabetesatlas.org/content/diabetes-mortality, 25 January 2011. [ Links ]
7. DANAEI G, LAWES CM, VANDER HOORN S, MURRAY CJ, EZZATI M. Global and regional mortality from ischaemic heart disease and stroke attributable to higher-than-optimum blood glucose concentration: comparative risk assessment. Lancet. 2006; 368:1651-9. [ Links ]
8. JOHNSTON KC, CONNORS AF JR, WAGNER DP, HALEY EC JR. Predicting outcome in ischemic stroke: external validation of predictive risk models. Stroke. 2003; 34:200-2. [ Links ]
9. ROZO A, MENDOZA AM. Impacto funcional del evento cerebro vascular en los pacientes del Hospital Militar Central entre octubre de 2010 y mayo de 2011. Rev Col Med Fis Rehab 2012; 22:49-57. [ Links ]
10. PÉREZ GE. Ed. Guía Neurológica 8 Enfermedad Cerebrovascular. Asociación Colombiana de Neurología; Bogotá 2008. [ Links ]
11. JACKSON CA, HUTCHISON A, DENNIS MS, WARDLAW JM, LINGDREN A, NORRVING B, ET AL. Differing risk factor profiles of ischemic stroke subtypes: evidence for a distinct lacunar arteriopathy? Stroke. 2010; 41:624-9. [ Links ]
12. PARK JH, RYOO S, KIM SJ, KIM GM, CHUNG CS, LEE KH, BANG OY. Differential risk factors for lacunar stroke depending on the MRI (white and red) subtypes of microangiopathy. PLoS One. 2012; 7:e44865. [ Links ]
13. SCHMAHMANN JD. Vascular syndromes of the thalamus. Stroke. 2003; 34:2264-78. [ Links ]
14. CUADRADO A. Rehabilitación del ACV: evaluación, pronóstico y tratamiento. Galicia Clin 2009; 70:25-40. [ Links ]
15. SUÁREZ-ESCUDERO JC, RESTREPO SC, RAMÍREZ EP, BEDOYA CL, JIMÉNEZ I. Descripción clínica, social, laboral y de la percepción funcional individual en pacientes con ataque cerebrovascular. Acta Neurol Colomb. 2011; 27:97-105. [ Links ]
16. SECREST AM, PRINCE CT, COSTACOU T, MILLER RG, ORCHARD TJ. Predictors of and survival after incident stroke in type 1 diabetes. Diab Vasc Dis Res. 2013; 10:3-10. [ Links ]
17. ENGELBORGHS S, MARIEN P, PICKUT BA, VERSTRAETEN S, DE DEYN PP. Loss of psychic self-activation after paramedian bithalamic infarction. Stroke. 2000; 31:1762-5. [ Links ]
18. HERMANN DM, SICCOLI M, BRUGGER P, WACHTER K, MATHIS J, ACHERMANN P, BASSETTI CL. Evolution of neurological, neuropsychological and sleep-wake disturbances after paramedian thalamic stroke. Stroke. 2008; 39:62-8. [ Links ]
19, BRAVO F, BELLO C, GONZÁLEZ-HERNÁNDEZ J. Infarto talámico bilateral y deterioro cognitivo progresivo: discusión de un caso. Revista Memoriza. com. 2009; 3: 41-48. [ Links ]
20. DIEZ-TEJEDOR E. Ed. Guía para el diagnostico y tratamiento del ictus. Sociedad Española de Medicina Física y Rehabilitación, 2006. Disponible: http://www.ictussen.org/files3/23145_GuiaSen_32.pdf [ Links ]













