Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.30 no.1 Bogotá Jan./Mar. 2014
Artículo original
Puntuaciones del MoCA y el MMSE en pacientes con deterioro cognitivo leve y demencia en una clínica de memoria en Bogotá
MoCA and MMSE scores in patients with mild cognitive impairment and dementia in a memory clinic in Bogotá
Olga Lucia Pedraza L., Erick Sánchez, Sandra J. Plata, Camila Montalvo, Paula Galvis, Andrés Chiquillo, Ingrid Arévalo-Rodríguez
Olga Lucia Pedraza L, MD, MSc., Neuróloga, Profesora Titular, FUCS. Erick Sánchez P. MD, Neurólogo, Profesor Titular FUCS. Sandra Juliana Plata, Psicóloga, Esp. Educación, Profesora Asociada FUCS. María Camila Montalvo, MD, Psiquíatra, Instructora Asociada FUCS. Paula Galvis, Psicóloga, Esp. Neuropsicología, U. San Buenaventura. Andrés Chiquillo, Psicólogo Universidad del Bosque. Ingrid Arévalo-Rodríguez, Psicóloga Epidemióloga, Instructora Asociada FUCS.
Correspondencia: opedraza@hospitalinfantildesanjose.org.co
(Olga Lucia Pedraza L. Erick Sánchez, Sandra. J. Plata, Camila Montalvo, Paula Galvis, Andrés Chiquillo, Ingrid Arévalo-Rodríguez. Puntuaciones del MoCA y el MMSE en pacientes con deterioro cognitivo leve y demencia en una clínica de memoria en Bogotá. Acta neurol Colomb 2014;30:22-31).
(Olga Lucia Pedraza L. Erick Sánchez, Sandra. J. Plata, Camila Montalvo, Paula Galvis, Andrés Chiquillo, Ingrid Arévalo-Rodríguez. MoCA and MMSE scores in patients with mild cognitive impairment and dementia in a memory clinic in Bogotá. Acta neurol Colomb 2014;30:22-30).
Recibido: 20/09/13. Revisado: 30/09/13. Aceptado: 12/01/14.
Resumen
Introducción. Diferentes pruebas neuropsicológicas permiten explorar las funciones cognitivas del adulto mayor, en un tiempo corto. En Colombia se dispone de pocos estudios sobre puntuaciones y puntos de corte para el MMSE y para el MoCA en relación al diagnóstico de deterioro cognitivo.
Objetivo. Describir la distribución de las puntuaciones del MMSE y el MoCA y los puntos de corte con mejor discriminación, para el diagnóstico de deterioro cognitivo leve y demencia, en una muestra de pacientes de Bogotá.
Material y métodos. Se evaluaron 248 pacientes por un equipo multidisciplinario, que consultaron a la Clínica de Memoria del HIUSJ entre 2009-2012, siguiendo un protocolo establecido. Se identificaron las puntuaciones del MoCA y MMSE, que permitieron obtener el mayor porcentaje de pacientes correctamente clasificados.
Resultados. En el 70% de los pacientes con DCL y en el 69 % de los sujetos normales, se encontraron puntuaciones del MMSE inferiores o iguales a 28. En 91% de pacientes con DCL y 84% de los sujetos normales, se presentaron puntuaciones del MoCA inferiores o iguales a 25. Los pacientes con cualquier tipo de demencia, presentaron puntuaciones del MMSE inferiores o iguales a 27 e inferiores o iguales a 24 en el MoCA.
Conclusión. Según el presente estudio, el tamizaje de funciones cognitivas, utilizando el MoCA, clasifica de manera más acertada que el MMSE, a los sujetos con deterioro cognitivo. Creemos que en atención primaria, estos puntos de corte del MoCA, pueden ser considerados por ahora, cuando se trate especialmente de sujetos con alta escolaridad.
Palabras clave. Deterioro Congnitivo Leve DCL, Demencia, Trastorno de la Memoria, Pruebas Neuropsicológicas (DeCS).
Summary
Introduction. Some cognitive tests allow the evaluation of cognitive functions on the elderly in a short period of time. There are few studies in Colombia about cut-off point for the MMSE and the MoCA test.
Objectives. To describe the distribution on scores on MMSE and MoCA test and the cut-off point with a better discrimination criteria for the diagnosis of mild cognitive impairment and dementia, in a sample of patients from Bogotá.
Materials and methods. Two hundred forty eight patients were included in this study, being evaluated by a multidisciplinary team that followed an established protocol, on patients who attended to the Memory Clinic of HIUSJ between 2009-2012. MoCA test and MMSE scores that allow higher percentages of correctly classified patients were identified.
Results. Seventy percent of patients with mild cognitive impairment and 69% of normal individuals had scores on MMSE below or equal to 28. Ninety-one percent of patients with MCI and 89% of normal patients, had scores below or equal to 25. Patients with any type of dementia had scores on MMSE below or equal to 27 and below or equal to 24 in MoCA test.
Conclusion. According to the study, the screening of cognitive functions, using MoCA test, is more accurate than MMSE in patients with cognitive decline. The cut-off points, identified in our study, can be considered useful until now in primary attention, in patients with a high level of education.
Key words: Mild Cognitive Impairment MCI, Memory Disorders, Neuropsychology Test. (MeSH).
Introducción
El aumento de la expectativa de vida en el mundo, ha resultado en el incremento del deterioro cognitivo, con alto costo para los sistemas de salud a nivel mundial (1). Según las proyecciones realizadas por Ferri et al., el número de sujetos con demencia en Latinoamérica podría incrementarse hasta en un 120% y 393% en el 2020 y el 2040, respectivamente (2). En Colombia, la prevalencia de demencia durante la década del noventa, se estimó en 13 sujetos por 1000 habitantes mayores de 55 años, esta cifra podría ser aún mayor, de acuerdo con estas proyecciones, lo que hace necesario identificar y tratar temprana y oportunamente esta patología (3,4).
La detección temprana de los cambios cognitivos, se realiza por medio de pruebas neuropsicológicas breves. Estas pruebas son útiles, si se cuenta con puntos de corte validados, en diferentes regiones y culturas, de acuerdo a la edad y la escolaridad.
En la actualidad, existen numerosas pruebas breves que permiten la exploración general de las funciones cognitivas en corto tiempo. El Mini-Mental State Examination (MMSE) es el cuestionario que más se ha utilizado para la identificación del deterioro cognitivo asociado a demencia (5-9). En el MMSE se valoran funciones de orientación temporo espacial, memoria de trabajo y de corto plazo, habilidades de cálculo, lenguaje y praxis. La influencia de variables como la edad y el nivel educativo del paciente en la puntuación total de la prueba, ha llevado a que se propongan diferentes puntos de corte para éste instrumento, mejorando su capacidad diagnóstica según diferentes estudios (10, 11). Tombaugh y McIntyre sugieren que el punto de corte del MMSE adecuado para la detección de alteraciones cognitivas es 23/24 puntos en personas con 8 o más años de educación, estimando una sensibilidad y especificidad superiores al 80%, mientras que puntuaciones menores a 18/19 indicarían un deterioro cognitivo más severo (12). Por otra parte, Mitchel propone un punto de corte de 26/27 para la identificación del deterioro en pacientes de clínicas de memoria, con una sensibilidad y especificidad de 79.8% y 81.3%, respectivamente (13). otros estudios locales sugieren puntos de corte variados, para identificar diferentes niveles del deterioro cognitivo (9,14,15).
Dada la baja capacidad diagnóstica del MMSE en la detección de cambios cognitivos, especialmente en poblaciones con alta escolaridad, se han diseñado otros instrumentos de evaluación breve para detectar cambios en funciones intelectuales. Uno de ellos es el Montréal Cognitive Test Assessment (MoCA), diseñado para detectar deterioro cognitivo leve y demencia Tipo Alzheimer (DTA) en estadios tempranos, con numerosas validaciones y adaptaciones (16-20).
El MoCA incluye la evaluación de 8 dominios cognitivos: atención, concentración, memoria de trabajo y de corto plazo, habilidades visoespaciales, fluidez verbal, lenguaje y funciones ejecutivas, con una puntuación máxima de 30 y un punto de corte propuesto de 25/26 (sensibilidad de 90% y especi ficidad de 87%) (18).
En Colombia existen pocas investigaciones que presenten información sobre los puntos de corte del MMSE y su discriminación en sujetos con deterioro cognitivo. Como parte de un estudio poblacional, Roselli et al, encuentran que la sensibilidad y la especificidad del MMSE fue 92.3% y 53.7%, respectivamente, describiendo puntos de corte por escolaridad: 21 para sujetos con más de 6 años de estudio, 24 para sujetos con 7-12 años de estudio y 27 para sujetos con menos de 12 años (21). Recientemente, un estudio de casos y controles en la ciudad de Medellín mostró la validez concurrente del MMSE con las demás pruebas de la batería del CERAD, sin analizar puntos de corte por edad o nivel educativo (22). El MoCA aplicado en una muestra de población mayor colombiana, con baja escolaridad, demostró tener una alta confiabilidad, pero requiere una adaptación cultural (23).
El objetivo es presentar la distribución de las puntuaciones del MMSE y el MoCA obtenidos de una muestra de pacientes consecutivos, que consultaron por queja de memoria, a la Clínica de Memoria del Hospital Infantil Universitario de San José de Bogotá (HIUSJ), considerando variables como la edad, la escolaridad y el diagnóstico final dado por consenso.
Materiales y métodos
Previa firma de consentimiento informado, se realizó un estudio observacional de corte transversal, incluyendo los pacientes referidos a la Clínica de la Memoria del HIUSJ en Bogotá, durante el periodo comprendido entre Enero-2009 a Julio-2012. A esta clínica asisten pacientes de Bogotá y de ciudades del centro del país, para ser evaluados por presentar quejas de memoria, sospecha de deterioro cognitivo leve o demencia. En este estudio se incluyeron sujetos evaluados por primera vez y se excluyeron pacientes que ya tuviesen diagnóstico previo de DCL o demencia.
La evaluación de cada paciente fue realizada por un equipo experto multidisciplinario, conformado por profesores de neurología, neuropsicología y psiquiatría, de acuerdo con un protocolo previamente establecido, que aplicó instrumentos adaptados, el cual incluyó la historia clínica neurológica y psiquiátrica, examen clínico y neurológico completo, exámenes de laboratorio y neuroimágenes. La evaluación neuropsicológica incluyó pruebas de memoria (24), lenguaje (denominación y fluidez verbal), funciones ejecutivas y procesos viso espaciales. La evaluación psiquiátrica incluyó: funcionalidad valorando las actividades básicas de la vida diaria e instrumental, depresión, comportamiento y sobrecarga del cuidador (25). Tanto al paciente como el acompañante respondieron el cuestionario de quejas subjetivas de memoria (26). Se utilizaron las versiones en español del MMSE y del MoCA con los puntos de corte sugeridos por los autores (24 y 26, respectivamente) aplicadas de manera independiente por neurología y neuropsicología sin conocer el diagnóstico.
Terminada la evaluación, el equipo de especialistas se reunió para analizar los resultados de las pruebas y definir por consenso el diagnóstico, considerando las historias de neurología, psiquiatría y neuropsicología, y los resultados obtenidos con los diferentes instrumentos aplicados, sin considerar el MMSE ni el MoCA. El resultado del consenso clínico fue el patrón de referencia para este estudio. Los criterios diagnósticos utilizados, además de la historia clínica, fueron: DSM-IV para demencia y depresión, NINCDS-ARDRA para demencia tipo Alzheimer (27), NINDS-AIREN para demencia Vascular y DTA con componente vascular, junto con la escala de Haschinski (28); criterios de Lund-Manchester para demencia frontotemporal (DFT) (29), criterios de McKeith para demencia de cuerpos de Lewy (30) y los criterios de Petersen para deterioro cognitivo leve (31). Se graduó la severidad de la DTA por medio de la escala Global de deterioro de Reisberg(GDS) (32).
Se registraron los datos de cada paciente en una base de datos, salvaguardando la confidencialidad de la información. Las variables como la edad, la escola ridad y el diagnóstico final fueron categorizadas para facilitar su análisis. Se estimó la media, la mediana y el rango para variables cuantitativas, así como las frecuencias absolutas y relativas en variables categóricas. Se evaluó si existían diferencias estadísticas entre los diferentes grupos, por medio de la prueba no paramétrica de Kruskall-wallis, con un nivel de significancia de 0.05. Finalmente, se evaluaron las diferentes puntuaciones del MoCA y el MMSE, para identificar aquellas en las cuales se obtenía el mayor porcentaje de pacientes correctamente clasificados con y sin deterioro, durante el consenso. Todos los análisis se realizaron en el programa estadístico STATA 10.0.
Resultados
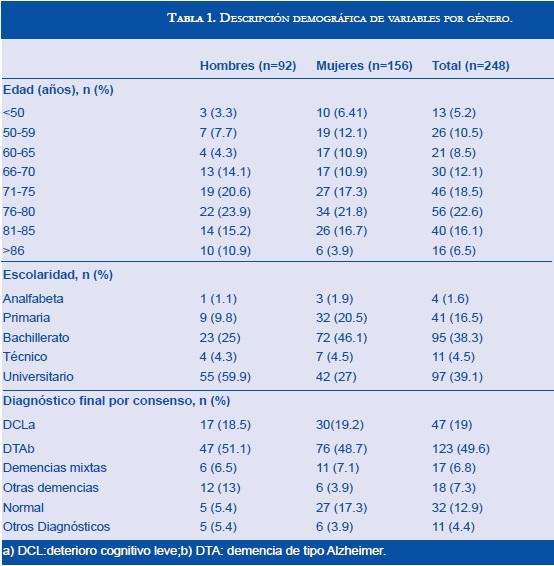
Se incluyeron 248 sujetos con edad promedio de 71 años (Rango: 19-95), el grupo de edad más frecuente fue el de 76 a 80 años (22.6%). Un 62% pertenecieron al género femenino, 39% fueron universitarios y 1.6% anαbetas letrados (Tabla 1). Ciento cincuenta y ocho (64%) pacientes fueron diagnosticados con demencia. La prevalencia estimada de DCL fue de 19% y de 50% para DTA; un 26.6% de estos últimos estaban en GDS-5. La demencia frontotemporal (DFT) se diagnosticó en 3 pacientes (1.2%) y la demencia mixta (DTA con componente vascular) en un 6.8%, la demencias de otros tipos (como enfermedad de cuerpos de Lewy, demencia en Parkinson y postencefalitis) se presentaron en 7.3% de la muestra y otros diagnósticos (como depresión, retardo mental leve y Síndrome de Asperger) en 4.4%.Se encontraron 13% de sujetos sin deterioro cognitivo ni otras patologías neurológicas, los cuales fueron catalogados como normales para este estudio.
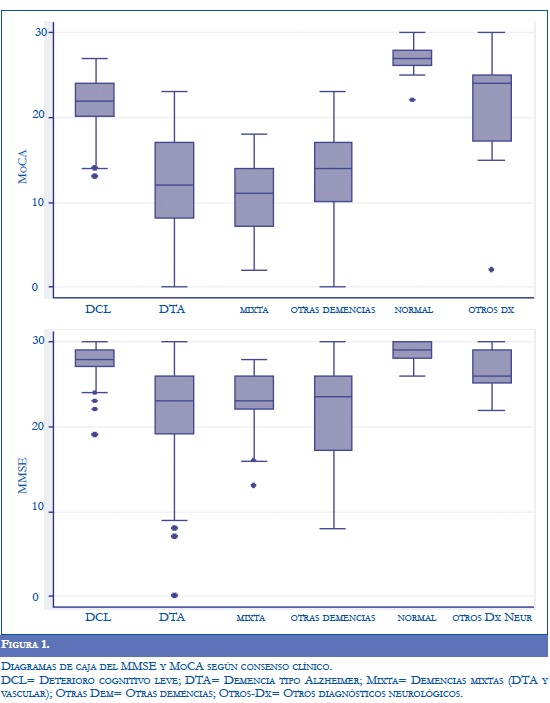
Los siguientes fueron los puntajes promedio del MMSE acorde con los diferentes diagnósticos: 27 para DCL; 22 para DTA; 23 para demencia mixta; 22 para otras demencias y 29 para sujetos normales. Por otra parte, los puntajes promedio del MoCA según los diferentes diagnósticos fueron: 21 para DCL; 12 para DTA; 11 para demencia mixta; 14 para otras demencias y 27 para sujetos normales. La figura 1 muestra las puntuaciones del MMSE y el MoCA de acuerdo con el diagnóstico clínico.
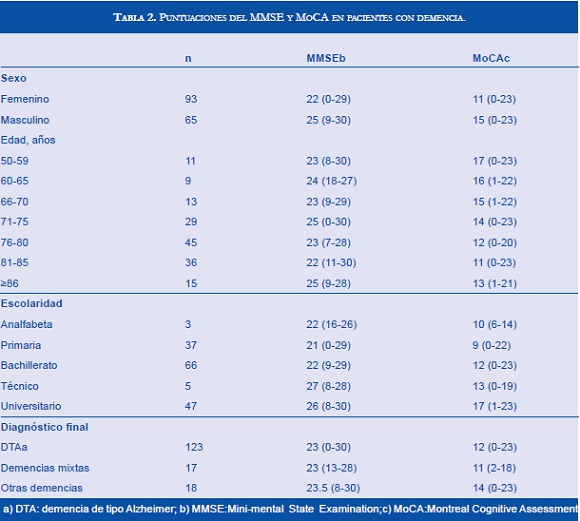
En los pacientes con diagnóstico de demencia, las puntuaciones más bajas para ambas pruebas se encontraron en el grupo de 81 a 85 años (Tabla 2); sin embargo, no se encontraron diferencias estadísticamente significativas de estas puntuaciones entre los diferentes rangos de edad (Kruskall-wallis: MMSE= χ2: 4.8, 6 g.l; p: 0.562. MoCA= χ2: 4.4, 6 g.l; p: 0.619). Las puntuaciones más altas del MMSE y del MoCA en pacientes con demencia, se presentaron en sujetos con niveles educativos superiores (Kruskall-Wallis: MMSE= χ2: 9.9; 4g.l; p: 0.04. MoCA= χ2: 18.6; 4 g.l; p: 0.001). En relación con el género, las mujeres con demencia presentaron puntajes más bajos, con diferencias estadísticamente significativas al compararlas con los hombres con demencia (Kruskall-Wallis: MMSE= χ2: 5.1, 1 g.l; p: 0.02. MoCA= χ2: 6.4; 1g.l; p: 0.01).
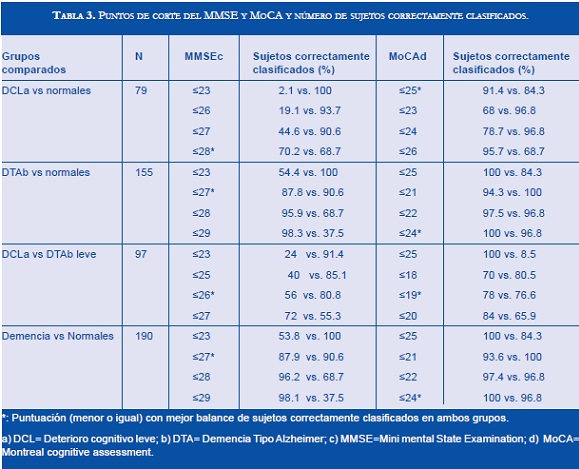
Las puntuaciones de las dos diferentes pruebas, que presentaron un mayor número de sujetos correctamente clasificados (según el consenso clínico final), fueron igual o menores de 28 en el MMSE en 70% de los pacientes con DCL y 69% de los normales; mientras que sólo 2.1% de los pacientes con DCL tuvieron puntuaciones igual o menores de 23 (Tabla 3). Por otra parte, 91.4% de los pacientes con DCL y 84.3% de los normales, tuvieron puntuaciones igual o menores de 25 en el MoCA. Cuando se evaluó la capacidad de discriminación para los pacientes con DTA u otras demencias frente a los sujetos normales, se halló que las puntuaciones del MMSE ≤27 y del MoCA ≤24 fueron las que mejor clasificaron a este grupo de pacientes (Tabla 3). No se encontró una puntuación óptima que discriminase a los sujetos con DCL frente a aquellos con DTA leve.
Discusión
En este grupo de pacientes, se encontró una alta frecuencia del diagnóstico de demencia, lo cual demuestra que aún se consulta tardíamente. Sin embargo con más de 15 años de experiencia, hemos observado que aunque la mayoría de los pacientes que consultan corresponden a DTA, se ha incrementado la consulta de sujetos normales, de pacientes con DCL y de pacientes con otros tipos de demencias; lo que sugiere una mayor percepción por parte del cuerpo médico y de la población general sobre el tema, dando la posibilidad de ofrecer una intervención oportuna.
La escolaridad y el género, son dos variables que se han relacionado con demencia. La escolaridad ha sido una variable ampliamente documentada en relación con los resultados del MMSE, también se relaciona con las puntuaciones encontradas en el MoCA. En este estudio no se sumó un punto adicional al puntaje final del MoCA en sujetos con menos de 12 años de escolaridad, como sugieren los autores, dado que las puntuaciones de los pacientes con menos de esa escolaridad, y que generaron duda diagnóstica, no alcanzaron aun así el punto de corte propuesto (Tabla 2). Esta propuesta debería evaluarse, en una muestra de sujetos con una distribución más homogénea de la escolaridad que el grupo aquí analizado.
En relación a la influencia de la baja escolaridad (menos de 4 años) en mujeres con puntuaciones bajas en el MMSE, descrita por Roselli et al, este estudio no permite realizar un análisis similar, por la alta escolaridad (21).
Los resultados sugieren, en relación con el MMSE, que las puntuaciones menores o iguales a 23, como las propuestas por Folstein, para discriminar entre sujetos con o sin deterioro cognitivo, no parecen ser ideales para discriminar entre los grupos aquí presentados. En el caso de la identificación del DCL observó que estos valores del MMSE, sólo se presentan en 2,1% de dichos pacientes; asimismo, la prueba no permite identificar a cerca del 46% de los pacientes con DTA. Para la identificación de los pacientes con demencia frente a sujetos normales con el MMSE, las puntuaciones con mayor porcentaje de sujetos correctamente clasificados en este estudio dejan un margen de error cercano al 10%. Esta situación es más crítica cuando se desea discriminar a personas con DCL y DTA en estadios tempranos. Si se deseara mantener el uso del MMSE para el tamizaje de demencia, sería necesario tener aún más información sobre las poblaciones, ajustándolas por edad y nivel educativo como proponen Rosselli et al. (21), o combinar el MMSE con otras pruebas breves para incrementar su poder discriminativo de acuerdo a lo sugerido en otros estudios (33,34).
En cuanto al MoCA se encontró que los sujetos con DCL obtuvieron con frecuencia puntuaciones iguales o menores a 26 (91.4%), esto estaría de acuerdo a lo propuesto en el artículo original de Nasreddine. Los pacientes con cualquier tipo de demencia presentaron puntuaciones en el MoCA de 24 o menos en todos los casos (100%) encontrándose una muy buena clasificación de los sujetos normales (96.8%).
La versión de la prueba del MoCA utilizada en este estudio corresponde a la traducción del original al español, la cual presenta términos que pueden ser extraños a nuestra cultura, especialmente para sujetos mayores con baja escolaridad, por lo que se requeriría una adaptación cultural como sugieren Gómez et al (23).
El presente estudio tiene varias limitaciones: en primer lugar puede existir un sesgo en el diagnóstico de consenso del grupo experto, que aunque soportado en el análisis de la historia clínica, los criterios diagnósticos, los paraclínicos, y los instrumentos utilizados por neurología, psiquiatría y neuropsicología no disponía de estudios histopatológicos (35).
En segundo lugar, esta fue una muestra de adultos mayores con alta escolaridad y alta prevalencia de demencia, que no representan la población general de adultos mayores de Colombia, por lo cual no se puede aún, extrapolar estos resultados a escenarios de atención primaria o tamizaje poblacional. Las puntuaciones aquí presentadas pueden ser una ayuda para el estudio de casos con alta escolaridad sin que se requieran adaptaciones del MoCA. Sin embargo, para la aplicación del MoCA, en sujetos con menos de 6 y 12 años de escolaridad, no sólo se requiere una adaptación cultural (23), sino determinar puntos de corte más bajos y diferentes en cada uno de estos dos grupos de escolaridad, con adaptaciones para la evaluación del lenguaje y el desempeño de las funciones ejecutivas, y no agregar un punto al puntaje total obtenido como han sugerido diferentes autores (18,36). La mayor utilidad del MoCA en relación al MMSE como prueba de tamizaje para detectar deterioro cognitivo, una vez adaptado para la población de adultos mayores de baja escolaridad, puede serlo también para orientar al médico de atención primaria, en su tarea de evaluar, identificar y clasificar a los adultos mayores que requieren una evaluación especializada.
Referencias
1. Wimo A, Winblad B, Jonsson L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimers Dement. 2010; 6:98-103. [ Links ]
2. Ferri CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguli M, ET AL. Global prevalence of dementia: a Delphi consensus study. Lancet. 2005; 366:2112-7. [ Links ]
3. PRADILLA G, VESGA BE, LEÓN-SARMIENTO FE. Estudio neuroepidemiológico nacional (EPI-NEURO) colombiano. Revista Panamericana de Salud Pública. 2003; 14:104-11. [ Links ]
4. MCKHANN GM, KNOPMAN DS, CHERTKOW H, HYMAN BT, JACK CR JR, kawas CH, ET AL. The diagnosis of dementia due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011; 7:263-9. [ Links ]
5. Folstein MF, Folstein SE, Mchugh PR. Mini-mental state. A practical method for grading the cognitive state of patients for the clinician. Journal of psychiatric research. 1975; 12:189-98. [ Links ]
6. XU G, MEYER JS, HUANG Y, DU F, CHOWD-HURY M, QUACH M. Adapting mini-mental state examination for dementia screening among illiterate or minimally educated elderly Chinese. International journal of geriatric psychiatry. 2003; 18:609-16. [ Links ]
7. CULLEN B, FAHY S, CUNNINGHAM CJ, COEN RF, BRUCE I, GREENE E, ET AL. Screening for dementia in an Irish community sample using MMSE: a comparison of norm-adjusted versus fixed cut-points. International journal of geriatric psychiatry. 2005; 20:371-6. [ Links ]
8. DE SILVA HA, GUNATILAKE SB. Mini Mental State Examination in Sinhalese: a sensitive test to screen for dementia in Sri Lanka. International journal of geriatric psychiatry. 2002; 17:134-9. [ Links ]
9. KULISEVSKY J, PAGONABARRAGA J. Cognitive impairment in Parkinson's disease: tools for diagnosis and assessment. Movement disorders : official journal of the Movement Disorder Society. 2009; 24:1103 [ Links ]
10. CRUM RM, ANTHONY JC, BASSETT SS, FOL-STEIN MF. Population-based norms for the minimental state examination by age and educational level. JAMA: The Journal of the American Medical Association. 1993; 269:2386-91. [ Links ]
11. BRAYNA C, CALLOWAY P. The Association of Education and Socioeconomic Status with the Mini Mental State Examination and the Clinical Diagnosis of Dementia in Elderly People. Age and Ageing. 1990; 19:91-6. [ Links ]
12. TOMBAUGH TN, MCINTYRE NJ. The minimental state examination: a comprehensive review. J Am Geriatr Soc. 1992; 40:922-35. [ Links ]
13. MITCHELL AJ. A meta-analysis of the accuracy of the mini-mental state examination in the detection of dementia and mild cognitive impairment. Journal of psychiatric research. 2009; 43:411-31. [ Links ]
14. TRENKLE DL, SHANKLE WR, AZEN SP. Detecting cognitive impairment in primary care: performance assessment of three screening instruments. Journal of Alzheimer's disease: JAD. 2007; 11:323-35. [ Links ]
15. SHIROKY JS, SCHIPPER HM, BERGMAN H, CHERTKOW H. Can You Have Dementia With an MMSE Score of 30? American journal of Alzheimer's disease and other dementias. 2007; 22:406-15. [ Links ]
16. MEMORIA CM, YASSUDA MS, NAKANO EY, FORLENZA OV. Brief screening for mild cognitive impairment: validation of the Brazilian version of the Montreal cognitive assessment. Int J Geriatr Psychiatry. 2012; 28:34-40. [ Links ]
17. FUJIWARA Y, SUZUKI H, YASUNAGA M, SUGI-YAMA M, IJUIN M, SAKUMA N, ET AL. Brief screening tool for mild cognitive impairment in older Japanese: validation of the Japanese version of the Montreal Cognitive Assessment. Geriatr Gerontol Iint. 2010; 10:225-32. [ Links ]
18. NASREDDINE ZS, PHILLIPS NA, BEDIRIAN V, CHARBONNEAU S, WHITEHEAD V, COLLIN I, ET AL. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005; 53:695-9. [ Links ]
19. GILL DJ, FRESHMAN A, BLENDER JA, RAVINA B. The Montreal cognitive assessment as a screening tool for cognitive impairment in Parkinson's disease. Movement disorders: official journal of the Movement Disorder Society. 2008; 23:1043-6. [ Links ]
20. MCLENNAN SN, MATHIAS JL, BRENNAN LC, STEWART S. Validity of the montreal cognitive assessment (MoCA) as a screening test for mild cognitive impairment (MCI) in a cardiovascular population. Journal of geriatric psychiatry and neurology. 2011; 24:33-8. [ Links ]
21. ROSSELLI D, ARDILA A, PRADILLA-ARDILA G, MORILLO L, BAUTISTA L, REY O, ET AL. El examen mental abreviado (Mini-Mental State Examination) como prueba de tamizaje para el diagnóstico de demencia: estudio poblacional colombiano. Rev Neurol. 2000; 30:428-32. [ Links ]
22. AGUIRRE-ACEVEDO DC, GÓMEZ RD, MORENO S, HENAO-ARBOLEDA E, MOTTA M, MUÑOZ C, ET AL. Validez y fiabilidad de la batería neurop sicológica CERAD-Col. Rev Neurol. 2007; 45:655-60. [ Links ]
23. GOMÉZ F, ZUNZUNEGUI MV, LORD C, ALVARADO B, GARCÍA A. Applicability of the MoCA-S test in populations with little education in Colombia. Int J Geriatr Psychiatry. 2013; 28:813-20. [ Links ]
24. GROBER E, BUSCHKE H, CRYSTAL H, BANG S, DRESNER R. Screening for dementia by memory testing. Neurology. 1988; 38:900-3. [ Links ]
25. Zarit SH, Reever KE, Bach-Peterson J. Relatives of the impaired elderly: correlates of feelings of burden. The Gerontologist. 1980; 20:649-55. [ Links ]
26. FLICKER C, FERRIS SH, REISBERG B. A longitudinal study of cognitive function in elderly persons with subjective memory complaints. J Am Geriatr Soc. 1993; 41:1029-32. [ Links ]
27. MCKHANN G, DRACHMAN D, FOLSTEIN M, KATZMAN R, PRICE D, STADLAN EM. Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 1984; 34:939-44. [ Links ]
28. ROMAN GC, TATEMICHI TK, ERKINJUNTTI T, CUMMINGS JL, MASDEU JC, GARCIA JH, ET AL. Vascular dementia: diagnostic criteria for research studies. Report of the NINDS-AIREN International Workshop. Neurology. 1993; 43:250-60. [ Links ]
29. Clinical and neuropathological criteria for frontotemporal dementia. The Lund and Manchester Groups. J Neurol Neurosurg Psychiatry. 1994; 57:416-8. [ Links ]
30. MCKEITH IG, GALASKO D, KOSAKA K, PERRY EK, DICKSON DW, HANSEN LA, ET AL. Consensus guidelines for the clinical and pathologic diagnosis of dementia with Lewy bodies (DLB): report of the consortium on DLB international workshop. Neurology. 1996;47:1113-24. [ Links ]
31. PETERSEN RC. Mild cognitive impairment as a diagnostic entity. Journal of internal medicine. 2004; 256:183-94. [ Links ]
32. REISBERG B, FERRIS SH, DE LEON MJ, CROOK T. The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry. 1982;139:1136-9. [ Links ]
33. CACHO J, BENITO-LEON J, GARCIA-GARCIA R, FERNANDEZ-CALVO B, VICENTE-VILLAR-DON JL, MITCHELL AJ. Does the combination of the MMSE and clock drawing test (mini-clock) improve the detection of mild Alzheimer's disease and mild cognitive impairment? Journal of Alzheimer's disease: JAD. 2010; 22:889-96. [ Links ]
34. POZUETA A, RODRIGUEZ-RODRIGUEZ E, VAZQUEZ-HIGUERA JL, MATEO I, SANCHEZ-JUAN P, GONZALEZ-PEREZ S, ET AL. Detection of early Alzheimer's disease in MCI patients by the combination of MMSE and an episodic memory test. BMC neurology. 2011;11:78. [ Links ]
35. WHITING PF, RUTJES AW, WESTWOOD ME, MALLETT S, DEEKS JJ, REITSMA JB, ET AL. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Annals of internal medicine. 2011;155:529-36. [ Links ]
36. LOZANO M, HERNÀNDEZ M, TURRO O, PERICOT I, LÓPEZ-POUSA S, VILALTA J. Validación del Montréal Cognitive Assessment (MoCA): test de cribado para el deterioro cognitivo leve. Datos preliminares. Alzheimer. Real Invest Demenc. 2009;43:4. [ Links ]