Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Acta Neurológica Colombiana
versión impresa ISSN 0120-8748
Acta Neurol Colomb. vol.30 no.1 Bogotá ene./mar. 2014
Revisión
Controversias en Neurología: Esclerosis Múltiple
Controversies in Neurology: Multiple Sclerosis
Jaime Toro1, Saúl Reyes2, Adrián Zamora3
1 Departamento de Neurología, Hospital Universitario-Fundación Santa Fe de Bogotá. Facultad de Medicina, Universidad de Los Andes. Posgrado en Neurología, Universidad El Bosque. Bogotá, Colombia.
2 Departamento de Neurología, Hospital Universitario-Fundación Santa Fe de Bogotá. Bogotá, Colombia.
3 Departamento de Neurología, Hospital Universitario-Fundación Santa Fe de Bogotá. Posgrado en Neurología, Universidad El Bosque. Bogotá, Colombia.
Correspondencia: jtoro@uniandes.edu.co
(Jaime Toro, Saúl Reyes, Adrián Zamora. Controversias en Neurología: Esclerosis Múltiple. Acta Neurol Colomb 2014;30:32-48).
(Jaime Toro, Saúl Reyes, Adrián Zamora. Controversies in Neurology: Multiple Sclerosis. Acta Neurol Colomb 2014;30:32-48).
Recibido: 15/11/13. Revisado: 18/11/13. Aceptado: 10/12/13.
Resumen
La esclerosis múltiple es la condición desmielinizante que afecta con mayor frecuencia el sistema nervioso central (SNC). Se considera una enfermedad de alto costo y una de las principales causas de discapacidad neurológica en adultos jóvenes. A pesar de los avances logrados en su diagnóstico y tratamiento, algunos aspectos continúan siendo controversiales. En este manuscrito se discuten 15 puntos polémicos, reconocidos en la práctica clínica diaria y la investigación de sujetos con EM. Para analizar el contexto de cada controversia con la mejor evidencia disponible, se realizó una revisión sistemática de la literatura disponible en MEDLINE, Embase, Cochrane y LILACS. Los temas incluyen la interrupción del tratamiento inmunomodulador, la utilidad de las bandas oligoclonales, el cambio a fármacos de segunda línea, las indicaciones de seguimiento con resonancia magnética, la plasmaféresis, el síndrome radiológico aislado, el manejo ambulatorio de las recaídas, la duración óptima de los ciclos de corticoides intravenosos, el beneficios de la tomografía de coherencia óptica, la deficiencia de vitamina D, el manejo de la EM secundariamente progresiva, los nuevos medicamentos orales y la seguridad del uso de interferón durante el embarazo. En el marco de cada controversia, se plantean recomendaciones específicas y conclusiones que pueden ser de utilidad para futuras investigaciones.
Palabras clave. Esclerosis múltiple, Esclerosis múltiple progresivo primaria, Bandas oligoclonales, Interferones, Imagen por Resonancia magnética (DeCS).
Summary
Multiple sclerosis (MS) is the most common demyelinating disorder of the central nervous system, and contributes greatly to health care costs and disability in young adults. Despite advances in diagnostic techniques and treatment, several important issues remain controversial. We addressed fifteen specific controversies that arise at the bedside and affect clinical practice, education and research in MS. We reviewed these issues followed by some opinions as to how use the best available evidence in a way that support clinical decisions. Topics discussed include utility of oligoclonal IgG bands in the diagnosis and prognosis of multiple sclerosis, cost-effectiveness of disease-modifying therapies, change from first- to second-line treatment, indications for follow-up MR imaging, plasma exchange, radiologically isolated syndrome, discontinuation of immunomodulatory therapies, home administration of intravenous methylprednisolone, duration of corticosteroids treatment, role of optical coherence tomography, vitamin D deficiency and supplementation, management of secondary progressive multiple sclerosis, emerging therapies and interferon during pregnancy. A systematic review of the literature was conducted using MEDLINE, Embase, Cochrane and the Literatura Latino-Americana y del Caribe en Ciencias de la Salud (LILACS) databases. Answers to the targeted questions were formulated and specific recommendations were made with the hope to stimulate future research.
Key words: Multiple sclerosis, Multiple sclerosis chronic progresive, oligoclonal bands, Interferons, magnetic resonance Imaging (MeSH).
Introducción
La esclerosis múltiple (EM) es una enfermedad inflamatoria desmielinizante del sistema nervioso central (SNC), que resulta de la interacción entre diversos factores inmunológicos, genéticos y ambientales (1). Se estima que afecta más de 1 millón de personas en el mundo (2). Colombia se considera una región de baja prevalencia con una cifra menor a 5/100.000 habitantes (3).
Esta condición se presenta con mayor frecuencia en adultos jóvenes entre los 20 y 50 años, con una proporción de 2-3 mujeres por cada hombre (4). El 85% de las personas con EM tienen un curso inicial de tipo recaída-remisión (RR), caracterizado por episodios de exacerbación con déficit neurológico nuevo o recurrente y posterior recuperación parcial o completa (5). El 25-40% de estos pacientes continúa acumulando discapacidad y progresa hacia una variante secundariamente progresiva (SP) luego de hasta 20 años de seguimiento (6). Sólo un 10-15% de los casos cursan con una forma progresiva desde el inicio de la enfermedad, conocida como esclerosis múltiple primaria progresiva (7).
Aunque décadas de exhaustiva investigación han suscitado avances importantes en el manejo de la EM, diversos aspectos relacionados con el ejercicio diagnóstico y terapéutico de estos pacientes continúan siendo motivo de debate. Con esta revisión se realiza una aproximación detallada a las controversias en la EM. De acuerdo con los resultados de una revisión sistemática de la literatura, se formularon recomendaciones basadas en la evidencia, y finalmente, se propusieron directrices para futuras investigaciones que pretendan resolver estos interrogantes.
¿Es posible suspender el tratamiento inmunomodulador?
En la actualidad, no se dispone de un tratamiento definitivo para la EM. Considerando que el mecanismo inmunológico es un componente cardinal en la fisiopatología de esta enfermedad, se han empleado diferentes medicamentos inmunomoduladores para controlar su evolución a largo plazo.
No existen recomendaciones precisas sobre la posibilidad de interrumpir el tratamiento en pacientes que han alcanzado un control satisfactorio de su EM. La tasa de adherencia a los diferentes medicamentos disponibles es variable y desciende significativamente luego de 2 años (8). No obstante, es escaza la literatura científica disponible con respecto a las consecuencias de suspender la medicación.
El interferón (IFN) no ha demostrado inducir remisión prolongada de la EM. Su interrupción se ha asociado con un mayor riesgo de recaídas y acumulación de discapacidad (9). Asimismo, descontinuar la medicación resulta en la reaparición de la actividad radiológica de la enfermedad (10) y podría suscitar un efecto de rebote con aumento en el volumen de las lesiones desmielinizantes (11).
Un fenómeno similar acontece a los pacientes que interrumpen el tratamiento crónico con natalizumab o fingolimod. La actividad basal de la enfermedad reaparece e incluso se manifiesta clínica y radiológicamente con mayor severidad. Este efecto es más evidente en pacientes con EM muy activa (12-14).
La literatura médica disponible sobre los efectos de interrumpir el tratamiento inmunomodulador, evaluó una población pequeña que no es precisamente representativa, sin embargo, confiere información primordial sobre la importancia de continuar activamente el tratamiento de la EM. Los pacientes que interrumpen su proceso terapéutico con IFN, natalizumab o fingolimod, están en mayor riesgo de cursar con progresión de la enfermedad.
La "desescalar el tratamiento" representaría un escenario menos radical que la suspensión completa de los fármacos modificadores de la enfermedad. Consiste en regresar a un medicamento de primera línea luego de haber instaurado manejo con uno de segunda línea (15). Pocos estudios reportan empeoramiento del cuadro al reemplazar natalizumab por IFN (16) o acetato de glatiramer (AG) (17). otros resultados fueron inconclusos para la desescalar la mitoxantrona (18). En general, la actividad de la enfermedad posterior al cambio depende de la severidad basal de la misma (15). Esta conducta tan controversial demanda con rigor nuevos estudios aleatorizados y controlados.
¿Es seguro y costo efectivo tratar lasrecaídas de forma ambulatoria?
El manejo de las recaídas de EM habitualmente se instaura en el ámbito hospitalario. Sin embargo, estudios recientes indican que trasladar su tratamiento al hogar puede ser una medida costo-efectiva y segura (19,20). Introducir modelos de cuidado ambulatorio como el manejo domiciliario representa un reto para los sistemas de salud. Esta disposición puede constituir una estrategia favorable ya que en Colombia la EM es una enfermedad de alto costo (21).
Si el cuidado domiciliario está indicado para la administración endovenosa de agentes quimioterapéuticos y el tratamiento de otras enfermedades crónicas ¿Por qué no manejar las recaídas de EM en casa o centros especializados diferentes al hospital?
Chataway et al., demostraron que la administración de corticosteroides era igualmente segura y efectiva en cualquiera de las dos locaciones, además, los costos fueron significativamente más bajos para la terapia en el domicilio (20). La tasa de efectos adversos fue baja y su tratamiento no representó costos adicionales significativos. Asimismo, existe evidencia de que el manejo ambulatorio de las recaídas, mejora la calidad de vida de estos pacientes (19). Los costos de la terapia establecida en el domicilio, son significativamente más bajos respecto al tratamiento intrahospitalario (20,22). Un estudio multicéntrico en Francia, que involucró cerca de 800 pacientes con EM, reportó una reducción del 70% en costos cuando la administración de metilprednisolona se realizó en el lugar de residencia y no en el hospital (23). El cuidado domiciliario de las recaídas de EM es seguro, costo-efectivo y ampliamente aceptado por los pacientes. En Colombia, es apremiante realizar estudios que reafirmen estas observaciones.
¿Se justifica la resonancia magnética de control?
Las técnicas de resonancia magnética (RM) convencional en la EM variante RR, permiten evaluar la actividad inflamatoria subclínica y monitorizar la respuesta al tratamiento inmunomodulador (24,25). Con relativa frecuencia, se solicitan estudios de neuroimágenes en pacientes que cursan con una recaída de la enfermedad. Sin embargo, no existe consenso respecto a la necesidad de ordenar una RM con esta indicación. En Colombia, su uso rutinario representa un incremento en la carga financiera al sistema de salud (26), entonces, ¿Cuándo se justifica solicitar una RM de control para la EM?
Un panel de expertos en Latinoamérica analizó la utilidad de realizar una RM durante las recaídas de EM y consideró que la neuroimágen no modifica la decisión terapéutica durante los episodios de exacerbación, recomendaron juzgar su indicación a la luz de variables como la severidad del cuadro y la respuesta a los corticosteroides (26). Asimismo, concluyeron que la RM de control se justifica en pacientes que reciben tratamiento con natalizumab, en particular si presentan un cuadro sugestivo de efectos adversos a la medicación, como la leucoencefalopatía multifocal progresiva (LMP) (26).
Las guías disponibles no recomiendan el uso rutinario de la RM sin la debida justificación (27,28). Las indicaciones propuestas para solicitar una imágen de control incluyen la aparición de deterioro clínico inesperado para el curso natural de la enfermedad, la intención de revaluar la actividad de la enfermedad antes de instaurar un manejo farmacológico y la sospecha de un diagnóstico diferente (27). Sin embargo, la actualización de este protocolo fue menos conservadora y sugiere realizar una RM con contraste para vigilar la actividad subclínica de la enfermedad cada 1 o 2 años (29). Esta nueva aproximación es importante para establecer un pronóstico, ya que los pacientes con mayor actividad radiológica de la enfermedad mostraron un riesgo mayor de presentar recaídas y acumular discapacidad (30). otros autores también recomiendan obtener una neuroimágen entre 6 y 12 meses luego de iniciar un nuevo medicamento inmunomodulador (31) y al documentar evidencia clínica de pobre respuesta al tratamiento (26).
Tras una extensa revisión de la literatura sobre el seguimiento con RM en pacientes con diagnóstico establecido de EM, se recomienda solicitar estudios imagenológicos de forma exclusiva bajo las indicaciones discutidas anteriormente. De las guías actualizadas, se destaca el valor pronóstico de realizar una RM contrastada anualmente. De cualquier forma, se necesitan estudios adicionales para determinar la costoefectividad de estas directrices en Colombia. Se advierte que el criterio médico para individualizar cada paciente con EM define su plan de seguimiento radiológico.
¿Cómo cambiar a natalizumab?
En determinadas circunstancias es preciso sustituir el tratamiento inmunomodulador en pacientes con EM por un fármaco de segunda línea. El cambio es pertinente cuando existe evidencia de intolerancia o pobre respuesta a los medicamentos de primera línea como los IFNs y el AG (15).
El natalizumab es un anticuerpo monoclonal antagonista de la α4-integrina. En pacientes con EM variante RR se indica como un fármaco de segunda línea que ha mostrado reducir de forma significativa la tasa anual de recaídas (TAR), la carga lesional en la RM, la acumulación de discapacidad y la atrofia cerebral (32). Sin embargo, se ha asociado a complicaciones serias como la LMP (33). Los pacientes con exposición previa a agentes inmunosupresores como mitoxantrona, ciclofosfamida, micofelonato y metotrexate, tienen mayor riesgo de desarrollar LMP (34). Por lo tanto, se recomienda un periodo libre de fármaco inmunosupresor de 3 a 6 meses antes de iniciar el natalizumab (32).
Considerando su efecto inmunomodulador ¿Este riesgo también aplica para el interferón y otros medicamentos modificadores de la enfermedad? ¿Existe alguna precaución al momento de realizar el cambio por natalizumab?
Los medicamentos para la EM no necesitan un periodo libre de fármaco o de lavado ("wash-out") (35). Los estudios de seguridad poscomercialización sugieren que los pacientes tratados con IFN o AG pueden cambiar directamente a natalizumab. Su sustitución inmediata no incrementa el riesgo de complicaciones como la LMP (32,35).
Existe una particularidad en pacientes con leucopenia severa asociada al uso de fingolimod. Aunque no se considera que este agente inmunosupresor incremente el riesgo de LMP y no se ha establecido un período libre de fármaco, algunos autores recomiendan retrasar el inicio de natalizumab hasta que el conteo de leucocitos aumente (15). En general, los pacientes que requieren tratamiento con un medicamento de segunda línea como el natalizumab, cursan con una EM muy activa (35). Como ya se discutió, prolongar el tiempo sin medicación durante el cambio de fármaco podría aumentar el riesgo de recaídas y acumulación de discapacidad (15,9).
El natalizumab es muy efectivo en pacientes con EM variante RR (32), de acuerdo con la evidencia disponible, este anticuerpo monoclonal se puede iniciar de forma inmediata luego de suspender fármacos de primera línea como IFN y AG. Su prescripción demanda evaluar la dinámica riesgo-beneficio para cada paciente.
¿Es importante solicitar bandasoligoclonales para el diagnóstico de EM?
El diagnóstico de la EM depende de la aplicación de criterios clínicos y paraclínicos cuyos principios destacan la importancia de ratificar la diseminación de las lesiones en tiempo y espacio, además de excluir otras entidades que puedan explicar la sintomatología (36). Cada actualización de los criterios de McDonald tiende a resaltar la utilidad diagnóstica de la RM y a restarle valor al estudio del líquido cefalorraquídeo (LCR) (37). Considerando la discrepancia que existe respecto a la relevancia de este examen paraclínico ¿En qué situación es particularmente útil?
El análisis del LCR para bandas oligoclonales (BoC) es una herramienta valiosa que soporta el diagnóstico de EM. De acuerdo con la más extensa revisión sistemática de la literatura que evaluó la prevalencia de BoC en pacientes con EM, el estudio de LCR es positivo en cerca del 90% de los casos (38). Asimismo, la presencia de BoC ayuda a descartar condiciones que clínica o radiológicamente pueden simular EM. Los pacientes con otras enfermedades como neuromielitis óptica, encefalomielitis aguda diseminada y cambios inespecíficos de sustancia blanca asociados a migraña y enfermedad isquémica de pequeños vasos, usualmente resultan negativos para el estudio de BoC (38-40).
Su valor pronóstico también se ha documentado en numerosos estudios. En pacientes con diagnóstico de síndrome clínico aislado (SCA), la presencia de BoC en el LCR incrementa el riesgo de desarrollar EM definitiva (41,42); aproximadamente el 62% de los pacientes con SCA y BoC en el LCR progresan a EM, comparado con un porcentaje de conversión menor al 19% cuando el estudio de LCR es negativo (38).
El isoelectroenfoque es el patrón de oro para detectar la síntesis intratecal de BoC, con una sensibilidad superior al 95% y un alto valor predictivo negativo (43). Aunque ha demostrado un rendimiento superior respecto a la electroforesis de proteínas de alta resolución (44,45), no siempre está disponible en Colombia, por consiguiente, algunos centros emplean procesos con un rendimiento inferior al recomendado internacionalmente (46).
En conclusión, el estudio de BoC en el LCR es útil para orientar el diagnóstico diferencial de la EM y evaluar el riesgo de un segundo evento clínico en pacientes con SCA. Juzgando por el estado del arte, su estudio debe realizarse especialmente en pacientes con síntomas atípicos y hallazgos en la RM explicables por otra patología (47). En toda situación se debe evitar el error diagnóstico de una enfermedad crónica y de alto costo como la EM. Además, es apremiante adoptar la técnica de isoelectroenfoque como método estándar para el estudio de BoC en LCR en Colombia.
¿Cómo manejar los pacientes con síndrome radiológico aislado?
Los avances en el campo de las neuroimágenes han incrementado la solicitud de estudios de RM, y es cada vez más frecuente el reporte de hallazgos incidentales sugestivos de lesiones desmielinizantes en pacientes con síntomas atípicos de EM (48). Desde el 2009, esta entidad se conoce como síndrome radio-lógico aislado (SRA) (49). De acuerdo con la revisión más reciente de los criterios de McDonald, estos hallazgos pueden corresponder a una fase presintomática de la EM, sin embargo, es difícil establecer un diagnóstico certero de la enfermedad justificado en este fenómeno radiológico (36). Aunque el SRA parece conferir un mayor riesgo de EM definitiva (36,50,51), el tratamiento y el pronóstico de estos pacientes precisa una mejor caracterización.
Una revisión sistemática de la literatura estableció que luego de hasta 5 años de seguimiento, dos tercios de los pacientes con SRA presentan progresión radiológica con nuevas lesiones o realce de las placas desmielinizantes previamente conocidas. Además, un tercio de los casos evoluciona clínicamente hacia SCA o EM (52). La presencia de lesiones en la médula espinal cervical, constituye un factor predictor de progresión clínica que ha demostrado alta sensibilidad y especificidad y un notable valor predictivo positivo (51,52).
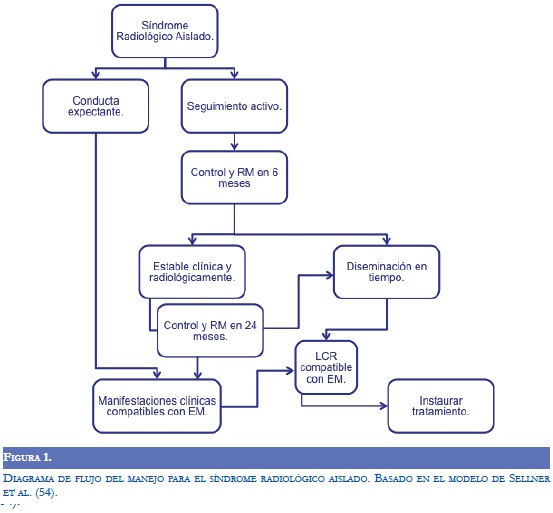
Apoyado en la evidencia disponible, el trabajo de Sellner et al. propone un algoritmo para el enfoque del SRA (54). Esta aproximación tiene 2 vertientes, como se muestra en la figura 1. La primera consiste en una "conducta expectante" hasta el momento en que el paciente presente manifestaciones clínicas compatibles con EM, requiriere entonces estudios adicionales y se advirte la posibilidad de iniciar tratamiento inmunomodulador. Como alternativa, existe una conducta de "seguimiento activo", que propone la realización de un control a los 6 meses después de establecido el diagnóstico de SRA. Un paciente estable desde el punto de vista clínico y radiológico, debe tener su control en 24 meses, cuando esta evaluación determina diseminación en el tiempo, se justifica la realización de un estudio de LCR. En este caso, el resultados positivo para BoC pueden derivar en la instauración de manejo farmacológico (53). El enfoque diagnóstico de estos pacientes demanda pericia clínica y comunicación efectiva. Discutir el pronóstico de esta condición, que potencialmente representa la fase preclínica de una enfermedad crónica con alto impacto en la calidad de vida, exige gran cautela.
El tratamiento inmunomodulador en el SRA no se ha estudiado ampliamente. Por consiguiente, no es apropiado instaurar manejo farmacológico en los pacientes con SRA que no desarrollen manifestaciones clínicas compatibles con EM.
¿Cuál es la indicación de plasmaféresis en la EM?
La plasmaféresis es una técnica que permite filtrar la sangre para obtener plasma. Su posterior procesamiento resulta en la eliminación selectiva de algunos componentes como anticuerpos, complejos inmunes, citoquinas y otros mediadores inflamatorios (54).
Este procedimiento está indicado en el tratamiento de determinadas enfermedades neurológicas cuya etiología incluye un proceso autoinmune (55). Su beneficio como monoterapia y manejo inicial de exacerbaciones en la EM tipo RR no se ha estudiado (54). Además, los altos costos y potenciales efectos adversos de la plasmaféresis, hacen de su indicación un tema controversial.
Un estudio multicéntrico, aleatorizado y doble ciego, investigó el uso coadyuvante de plasmaféresis para tratar recaídas en la EM y demostró que el recambio de plasma aceleraba el proceso de recuperación (56). Considerando el estado del arte, la Academia Americana de Neurología (AAN) recomienda la plasmaféresis como terapia adyuvante en pacientes con exacerbaciones de la EM tipo RR (Nivel de evidencia B) (57). Asimismo, la guía recomienda el recambio de plasma para pacientes refractarios al tratamiento inicial con corticosteroides (Nivel de Evidencia C) (57). Según la literatura científica disponible, en estos casos la tasa de respuesta terapéutica varía entre un 40% y 63% (58,59). Algunos estudios sugieren que su instauración precoz constituye un factor predictor de buena respuesta al tratamiento; sin embargo, otras publicaciones han demostrado beneficio hasta 90 días después del inicio de los síntomas (59).
La plasmaféresis no es una alternativa protectora en las formas progresivas de la EM (60-62). Dada su futilidad para estabilizar la enfermedad a largo plazo, las guías no recomiendan practicar el recambio de plasma para el tratamiento de las variantes progresivas de EM (Nivel de Evidencia A) (57).
En resumen, la plasmaféresis se considera un tratamiento coadyuvante para el manejo de las recaídas en la EM tipo RR, especialmente en pacientes con sintomatología severa y refractaria al manejo primario con corticosteroides (57).
¿Cuáles son las consecuencias de utilizar interferón durante el embarazo?
La EM afecta a mujeres en edad reproductiva. En esta población, es frecuente la interrupción del tratamiento inmunomodulador antes de la concepción, con el fin de minimizar su potencial efecto deletéreo sobre el feto (63). Sin embargo, la exposición fetal ocurre con relativa frecuencia debido a que un gran porcentaje de los embarazos no son planeados (64).
La literatura científica reporta de forma consistente que la exposición a IFN durante el embarazo se asocia con bajo peso al nacer (65-67), menor edad gestacional (68) y parto pretérmino (67). De acuerdo con el estado del arte, la administración de IFN en pacientes embarazadas no incrementa de forma significativa el riesgo de aborto espontáneo o malformaciones congénitas (63,67).
La clasificación de la Food and Drug Administration (FDA) sobre el riesgo del uso de medicamentos durante el embarazo, adjudica al IFN una categoría C, es decir, existen estudios sobre reproducción animal que han documentado efectos adversos, aunque no hay investigaciones controladas y metodológicamente adecuadas para evaluar su efecto en seres humanos (69).
La mejor evidencia disponible sugiere que el IFN ejerce un efecto negativo sobre el feto, sin embargo, no se justifica interrumpir un embarazo viable aunque haya estado expuesto a este fármaco (68). El beneficio de utilizar IFN en pacientes embarazadas debe ser aceptable respecto a sus potenciales riesgos.
¿Cuál es la duración óptima de los ciclosde corticoides intravenosos?
Los corticoides intravenosos (IV) son el tratamiento de elección en las recaídas de EM (70,71). Los estudios iniciales evaluaron la administración de ciclos de metilprednisolona (MTP) por periodos de hasta 15 días (72). Desde entonces y considerando su potencial toxicidad, la tendencia ha sido la de ahorrar corticoides. En la actualidad, los ciclos más utilizados tienen una duración de 3 a 5 días. Sin embargo, en términos de eficacia y tolerabilidad, ¿existe alguna diferencia significativa respecto a la duración del tratamiento?
Un metanálisis (73) que incluyó los estudios cardinales sobre el uso de MTP IV para el manejo de las exacerbaciones de EM (74,75), no detectó diferencia entre los desenlaces al discriminar los resultados por la duración del tratamiento. Aunque estos resultados sugieren que no existen diferencias significativas en términos de eficacia y tolerabilidad, es pertinente aclarar que estos protocolos fueron diseñados con el fin de establecer la eficacia del corticoide, su ruta de administración y la dosis de elección. Sin realizar mayor consideración sobre la duración de los ciclos, el periodo de administración fue definido a discreción del grupo de investigación y de acuerdo con protocolos locales.
No existen estudios que comparen los beneficios y desventajas de administrar corticoides por 3 días con periodos de tratamiento más extensos. De acuerdo a la guía del National Institute for Clinical Excellence (NICE), los individuos que cursen con una recaída de la enfermedad deben recibir tratamiento con altas dosis de MTP tan pronto como sea posible. La dosis recomendada es de 500 mg a 1 gr diario por un periodo de 3 a 5 días (76). Esta conducta acelera el proceso de recuperación, disminuye la actividad de la enfermedad y restaura la función neurológica (71).
¿Cuál es el rol de la vitamina D en la EM?
La teoría sobre los niveles de vitamina D como un factor determinante de la prevalencia de EM, fue descrita por primera vez hace aproximadamente 3 décadas (77). Con el paso de los años y la acumulación de evidencia científica, se estableció el efecto inmunmodulador de la vitamina D y se identificó de forma consistente su deficiencia como factor de riesgo para desarrollar EM (77,78). Sin embargo, aún se desconoce el mecanismo específico por el cual esta vitamina ejerce su efecto protector y no se tiene certeza sobre su papel como modificador del curso de la enfermedad. Se ha propuesto que el efecto protector de la vitamina D estaría mediado por su actividad regulatoria sobre el sistema inmunológico, incluyendo mecanismos como la reducción de las poblaciones linfocitarias Th1 y natural killer, el control sobre los niveles circulantes de factor de necrosis tumoral y la disminución de interleucinas pro-inflamatorias 1 y 8 (79,80).
La evidencia disponible no es conclusiva respecto al beneficio de administrar suplementos de vitamina D como tratamiento para la EM (79,81,82). Esta paradoja podría explicarse por los mecanismos fisiopatológicos "no inmunes" de la enfermedad, los cuales se encontrarían fuera del área de influencia de la vitamina D. Es importante señalar que existen factores genéticos que podrían condicionar los resultados de estas investigaciones. Por ejemplo, el efecto protector de la vitamina D podría atenuarse o abolirse en individuos portadores del HLA-DR15 (83). De cualquier forma, los estudios publicados incluyen poblaciones pequeñas y son heterogéneos respecto a la dosificación de la vitamina D y los desenlaces evaluados.
Se han desarrollado protocolos de investigación que pretenden evaluar la eficacia de la vitamina D a altas dosis. Uno de ellos demostró que el suplemento con 6.000 UI/día de Vitamina D comparado con su administración a 1.000 UI/día no condicionó mejores desenlaces respecto a los hallazgos en la RM cerebral (Evidencia Clase I) (84). El estudio EVIDIMS evalúa la eficacia de la vitamina D a dosis promedio de UI/día, sus resultados ayudarán a esclarecer el rol terapéutico de altas dosis de vitamina D en la EM (85).
Los pacientes con EM tienen mayor riesgo de osteoporosis, caídas y fracturas (86). Considerando que la deficiencia de vitamina D puede contribuir al deterioro óseo, algunos autores justifican su identificación temprana y tratamiento oportuno (81).
La evidencia sobre el tratamiento con vitamina D para la EM no legitima un beneficio clínico sobre el curso de la enfermedad. No existe entonces otra indicación para administrar vitamina D en la EM, más que la corrección de su deficiencia cuando está claramente establecida (77).
¿Cómo se interpreta la tomografía de coherencia óptica retiniana?
La tomografía de coherencia óptica (TCo) es una técnica que permite la obtención de imágenes de alta resolución de la retina y otras estructuras oculares (87). Ha adquirido especial relevancia porque cuantifica de forma segura, reproducible y no invasiva, el grosor de la capa de fibras nerviosas retinianas (CFNR). Este parámetro constituye una medida indirecta del daño axonal en la vía visual anterior (87,88). Por esta razón, se considera una herramienta útil en la evaluación de la neuritis óptica (No) desmielinizante (89). Sin embargo, existen algunas consideraciones para su adecuada interpretación en los pacientes con EM. Al analizar los resultados de la TCo es imprescindible determinar el tiempo de evolución de los síntomas visuales. Frente a una noxa desmielinizante, el nervio óptico se edematiza causando un aumento en el grosor de la CFNR durante los primeros 2 meses. Sólo a partir de la octava semana es posible apreciar el compromiso real de la CFNR por disminución en su espesor (87).
El estudio con TCo orienta el diagnóstico diferencial de la No desmielinizante. Algunas características clínicas como el compromiso bilateral, la presentación recurrente y la pobre recuperación de la visión, son sugestivas de NMo. Asimismo, el adelgazamiento severo de la CFNR ocurre con mayor frecuencia en la enfermedad de Devic (90). Al comparar el ojo sano con el ojo afectado, se ha reportado una diferencia de grosor de la CFNR superior a 15-μm en el 75% de los pacientes con NMo. Este grado de adelgazamiento sólo se documenta en el 24% de los sujetos con EM tipo RR (91). La literatura científica disponible sugiere que existe una correlación entre los parámetros evaluados por la TCo y el tipo de EM. En las formas progresivas de la enfermedad, se ha demostrado un mayor adelgazamiento de la CFNR, especialmente al evaluar el ojo sin antecedente de No (92).
La TCo es una técnica promisoria como biomarcador de actividad de la enfermedad y de respuesta al tratamiento inmunomodulador (87,93,94). Aunque su uso en la práctica clínica diaria es limitado, en un futuro cercano podría considerarse un estudio de rutina en el seguimiento de los pacientes con EM.
Medicamentos orales para la EM, ¿Cuál elegir?
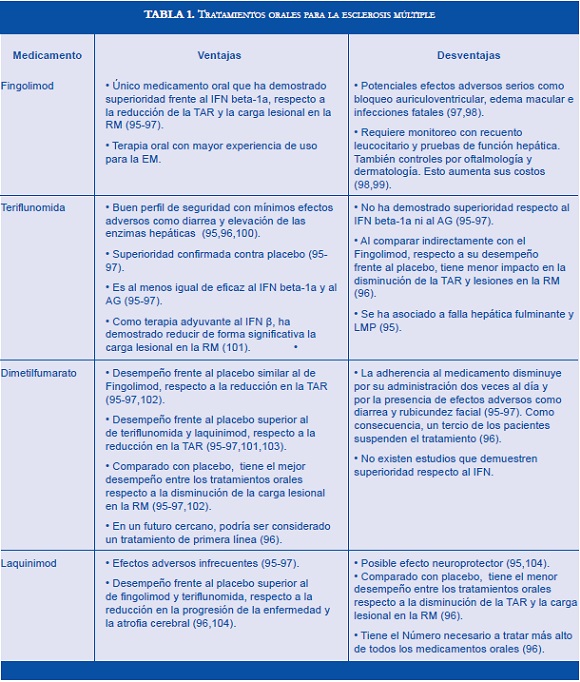
En la actualidad se dispone de diferentes tratamientos modificadores de la enfermedad para administración oral. En términos de eficacia y seguridad, no se han realizado estudios comparativos entre las nuevas terapias orales. Además, no existen biomarcadores que pronostiquen con certeza la respuesta individual de los pacientes a cada fármaco inmunomodulador. Por esta razón, la elección del tratamiento se fundamenta en la ejecución de un análisis de riesgo-beneficio. Se recomienda individualizar los casos considerando las principales ventajas y desventajas de cada medicamento (Tabla 1).
¿Interferón o fingolimod?
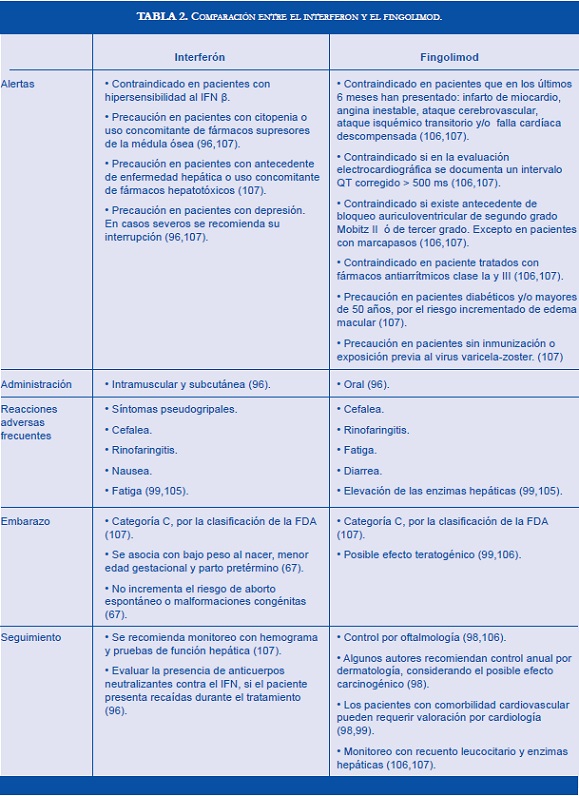
Durante años, el interferón ha sido el paradigma terapéutico para la EM tipo RR, sin embargo, su aplicación parenteral puede ser incómoda y frecuentemente causa síntomas pseudogripales (99,105). En el año 2010, fue aprobado el fingolimod como tratamiento de primera línea para la EM variante RR (106). Este medicamento ha demostrado superioridad frente al IFN beta-1α y ofrece la comodidad de su administración oral (105). Aunque el fingolimod ha surgido como una alternativa atractiva para el manejo de estos pacientes, resulta imprescindible comparar sus potenciales riesgos y beneficios respecto al interferón (Tabla 2). La evaluación de su perfil farmacológico permite una adecuada elección del tratamiento para cada paciente.
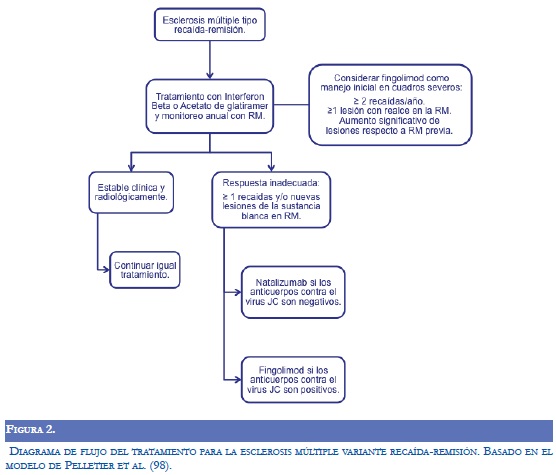
El trabajo de Pelletier et al. propone un algoritmo de manejo para la EM tipo RR, bajo el supuesto de que la mayoría de pacientes responden adecuadamente al tratamiento inicial con IFN o AG (98). Sin embargo, la Agencia Europea de Medicamentos (AEM) también considera el uso de fingolimod como tratamiento de primera línea en pacientes que cursan con cuadros agresivos de la enfermedad: dos o más recaídas en un año, una o más lesiones con realce en la RM o un aumento significativo en la carga lesional respecto a una RM reciente (99,106). Las principales recomendaciones se incluyen en la figura 2.
¿Cuáles son las opciones de tratamiento en la EM secundariamente progresiva?
La EM tipo SP se diagnostica cuando los pacientes con una variante inicial RR, cursan con progresión de la enfermedad que es independiente de las recaídas. Se caracteriza clínicamente por alteración de la marcha, espasticidad y disfunción de esfínteres (4,6).
El efecto de los fármacos modificadores de la enfermedad en la EM variante SP ha sido modesto (108). En Estados Unidos, la mitoxantrona es el único medicamento aprobado por la FDA bajo esta indicación. En Europa, la AEM también aprobó el IFN beta-1β y beta-1α (108). Aunque no están certificados por las entidades regulatorias, algunos tratamientos como la azatioprina y la ciclofosfamida se utilizan con frecuencia en este escenario clínico.
El interferón ha demostrado beneficio por disminución en la TAR y la carga lesional en la RM, particularmente en pacientes jóvenes con EM activa y recaídas frecuentes (108-110). Sin embargo, su efecto sobre la progresión de la enfermedad y el grado de discapacidad es mínimo e inconsistente (108). De acuerdo con las guías de la AAN el uso de IFN es apropiado en pacientes con EM tipo SP que continúan presentando exacerbaciones de la enfermedad (Recomendación tipo A). No existe suficiente evidencia que soporte su administración en ausencia de recaídas (Recomendación tipo U) (109).
Los estudios aleatorizados con un número reducido de pacientes, han demostraron la eficacia de la mitoxantrona en el tratamiento de pacientes con EM variante SP (111,112). Sin embargo, ha caído en desuso por su potencial efecto cardiotóxico y el riesgo de desarrollar leucemia. Las Guías de la AAN (112) recomiendan limitar su uso a pacientes con cuadros rápidamente progresivos y refractarios al manejo con otros tratamientos (Recomendación tipo B). Además, advierten sobre la necesidad de monitorizar periódicamente la función cardíaca, hepática y renal (Recomendación tipo A) (112).
Los protocolos de investigación que evaluaron el tratamiento con azatioprina han obtenido resultados conflictivos, pues se evidenció una disminución en la frecuencia de recaídas, con un aumento paradójico en la escala de discapacidad (108). Sin embargo, estas conclusiones son producto de estudios no controlados en poblaciones pequeñas (113). Con respecto a la seguridad del fármaco, la evidencia sugiere un posible efecto carcinogénico. También se han documentado eventos adversos serios como aplasia medular (108).
Los pulsos bimensuales de corticoide IV se han evaluado como tratamiento de la EM tipo SP (108), se administran esquemas de 500 mg IV de MTP por 3 días y se continua con corticoide oral en dosis decrecientes cada 2 meses por 2 años. El estado del arte sugiere que existe un beneficio modesto durante la fase inflamatoria de la enfermedad, aunque no ejercería un efecto en la fase degenerativa tardía (108,114). De cualquier forma no ha demostrado ser eficaz en el tratamiento de estos pacientes (108). Los estudios con ciclofosfamida han demostrado un efecto favorable sobre la escala de discapacidad, principalmente en pacientes con EM de corta evolución (109,115). Sin embargo no existen estudios controlados aleatorizados que soporten su indicación para el manejo de la EM variante SP (109). Por el potencial riesgo de toxicidad y su posible efecto carcinogénico, su administración debería restringirse a los casos refractarios a otros medicamentos (108).
Aunque no existe un tratamiento eficaz para los pacientes en la fase tardía de la EM variante SP, en la actualidad se están ejecutando estudios con el fin de establecer el efecto y optimizar las indicaciones de otros fármacos como el natalizumab (108).
Agradecimientos
Los autores agradecen de forma especial la ayuda prestada por Jenny M. Macheta (Bibliotecóloga, Facultad de Medicina, Universidad de Los Andes, Bogotá, Colombia) en la búsqueda de literatura científica relevante.
Referencias
1. RAMAGOPALAN SV, DOBSON R, MEIER uC, GIOVANNONI G. Multiple sclerosis: risk factors, prodromes, and potential causal pathways. Lancet Neurol. 2010; 9:727-39. [ Links ]
2. COURTNEY AM, TREADAWAY K, REMINGTON G, FROHMAN E. Multiple sclerosis. Med Clin North Am. 2009; 93:451-76. [ Links ]
3. TORO J, CARDENAS S, MARTINEZ CF, URRU- TIA J, DIAZ C. Multiple sclerosis in Colombia and other Latin American Countries. Mult Scler Relat Disord. 2013; 2;80-9. [ Links ]
4. KATZ SAND IB, LUBLIN FD. Diagnosis and differential diagnosis of multiple sclerosis. Continuum. 2013; 19:922-43. [ Links ]
5. COMPSTON A, COLES A. Multiple sclerosis. Lancet. 2008; 372:1502-17. [ Links ]
6. ROVARIS M, CONFAVREUX C, FURLAN R, KAPPOS L, COMI G, FILIPPI M. Secondary progressive multiple sclerosis: current knowledge and future challenges. Lancet Neurol. 2006; 5:343-54. [ Links ]
7. MILLER DH, LEARY SM. Primary-progressive multiple sclerosis. Lancet Neurol. 2007; 6:903-12. [ Links ]
8. BISCHOFF C, SCHREIBER H, BERGMANN A. Background information on multiple sclerosis patients stopping ongoing immunomodulatory therapy: a multicenter study in a community-based environment. J Neurol. 2012; 259:2347-53. [ Links ]
9. SIGER M, DURKO A, NICPAN A, KONARSKA M, GRUDZIECKA M, SELMAJ K. Discontinuation of interferon beta therapy in multiple sclerosis patients with high pre-treatment disease activity leads to prompt return to previous disease activity. J Neurol Sci. 2011; 303:50-2. [ Links ]
10. RICHERT DN, ZIERAK MC, BASH CN, LEWIS BK, MCFARLAND HF, FRANK JA. MRI and clinical activity in MS patients after terminating treatment with interferon beta 1b. Mult Scler. 2000; 6:86-90. [ Links ]
11. WU X, DASTIDAR P, KUUSISTO P, UKKONEN M, HUHTALA H, ELOVAARA I. Increased disability and MRI lesions after discontinuation of IFN-beta- 1a in secondary progressive MS. Acta Neurol Scand. 2005; 112:242-7. [ Links ]
12. O'CONNOR PW, GOODMAN A, KAPPOS L, LUBLIN FD, MILLER DH, POLMAN C, ET AL. Disease activity return during natalizumab treatment interruption in patients with multiple sclerosis. Neurology. 2011; 76:1858-65. [ Links ]
13. MIRAVALLE A, JENSEN R, KINKEL RP. Immune reconstitution inflammatory syndrome in patients with multiple sclerosis following cessation of natalizumab therapy. Arch Neurol. 2011; 68:186-91. [ Links ]
14. HAKIKI B, PORTACCIO E, GIANNINI M, RAZZOLINI L, PASTO L, AMATO MP. Withdrawal of fingolimod treatment for relapsing-remitting multiple sclerosis: report of six cases. Mult Scler. 2012; 18:1636-9. [ Links ]
15. COYLE PK. Switching therapies in multiple sclerosis. CNS Drugs. 2013; 27:239-47. [ Links ]
16. GOBBI C, MEIER DS, COTTON F, SINTZEL M, LEPPERT D, GUTTMANN CR, ET AL. Interferon beta 1b following natalizumab discontinuation: one year, randomized, prospective, pilot trial. BMC Neurol. 2013; 13:101. [ Links ]
17. HAVLA J, GERDES LA, MEINL I, KRUMBHOLZ M, FABER H, WEBER F, ET AL. De-escalation from natalizumab in multiple sclerosis: recurrence of disease activity despite switching to glatiramer acetate. J Neurol. 2011; 258:1665-9. [ Links ]
18. RIECKMANN P, HEIDENREICH F, SAILER M, ZETTL UK, ZESSACK N, HARTUNG HP, ET AL. Treatment de-escalation after mitoxantrone therapy: results of a phase IV, multicentre, open-label, randomized study of subcutaneous interferon beta-1a in patients with relapsing multiple sclerosis. Ther Adv Neurol Disord. 2012; 5:3-12. [ Links ]
19. POZZILLI C, BRUNETTI M, AMICOSANTE AM, GASPERINI C, RISTORI G, PALMISANO L, ET AL. Home based management in multiple sclerosis: results of a randomised controlled trial. J Neurol Neurosurg Psychiatry. 2002; 73:250-5. [ Links ]
20. CHATAWAY J, PORTER B, RIAZI A, HEANEY D, WATT H, HOBART J, ET AL. Home versus outpatient administration of intravenous steroids for multiple-sclerosis relapses: a randomised controlled trial. Lancet Neurol. 2006;5:565-71. [ Links ]
21. ROMERO M, ARANGO C. ALVIS N, SUÁREZ JC, DUQUE. A. Costos de la Esclerosis Multiple en Colombia. Value Health. 2011;14 (5 suppl1):548-50. [ Links ]
22. ROBSON LS, BAIN C, BECK S, GUTHRIE S, COYTE PC, O'CONNOR P Cost analysis of methyl- prednisolone treatment of multiple sclerosis patients. Can J Neurol Sci. 1998; 25:222-9. [ Links ]
23. CRÉANGE A, DEBOUVERIE M, JAILLON- RIVIÈRE V, TAITHE F, LIBAN D, MOUTEREAU A, ET AL. Home administration of intravenous methylprednisolone for multiple sclerosis relapses: the experience of French multiple sclerosis networks. Mult Scler. 2009; 15:1085-91. [ Links ]
24. ROVIRA A, AUGER C, ALONSO J. Magnetic resonance monitoring of lesion evolution in multiple sclerosis. Ther Adv Neurol Disord. 2013;6:298-310. [ Links ]
25. FILIPPI M, ROCCA MA. MR imaging of multiple sclerosis. Radiology. 2011; 259:659-81. [ Links ]
26. CARRÂ A, MACÎAS-ISLAS MÂ, GABBAI AA, CORREALE J, BOLANA C, SOTELO ED, ET AL. Optimizing outcomes in multiple sclerosis: consensus guidelines for the diagnosis and treatment of multiple sclerosis in Latin America. Ther Adv Neurol Disord. 2011; 4:349-60. [ Links ]
27. SIMON JH, LI D, TRABOULSEE A, COYLE PK, ARNOLD DL, BARKHOF F, ET AL. Standardized MR imaging protocol for multiple sclerosis: Consortium of MS Centers consensus guidelines. AJNR Am J Neuroradiol. 2006; 27:455-61. [ Links ]
28. ROVIRA A, TINTORÉ M, ALVAREZ-CERMENO JC, IZQUIERDO G, PRIETO JM. Recommendations for using and interpreting magnetic resonance imaging in multiple sclerosis. Neurologia. 2010; 25:248-65. [ Links ]
29. THE CONSORTIUM OF MULTIPLE SCLEROSIS CENTERS. Consortium of MS Centres MRI Protocol for the Diagnosis and Follow-Up of MS. 2009 revised guidelines. 2009 [Actualizado 2012 Nov 10; Citado 2013 Sep 20]. Disponible en: http://cymcdn.com/sites/www.mscare.org/resource/collection/9C5F19B9-3489-48B0-A54B-623A1ECEE07B/mriprotocol2009.pdf. [ Links ]
30. PROSPERINI L, MANCINELLI CR, DE GIGLIO L, DE ANGELIS F, BARLETTA V, POZZILLI C. Interferon beta failure predicted by EMA criteria or isolated MRI activity in multiple sclerosis. Mult Scler. 2013 Sep 3. Artículo en prensa. [ Links ]
31. KLAWITER EC. Current and new directions in MRI in multiple sclerosis. Continuum. 2013;19:1058-73. [ Links ]
32. KAPPOS L, BATES D, EDAN G, ERAKSOY M, GARCIA-MERINO A, GRIGORIADIS N, ET AL. Natalizumab treatment for multiple sclerosis: updated recommendations for patient selection and monitoring. Lancet Neurol. 2011; 10:745-58. [ Links ]
33. AKSAMIT AJ. Review of progressive multifocal leukoencephalopathy and natalizumab. Neurologist. 2006; 12:293-8. [ Links ]
34. BLOOMGREN G, RICHMAN S, HOTERMANS C, SUBRAMANYAM M, GOELZ S, NATARAJAN A, ET AL. Risk of natalizumab-associated progressive multifocal leukoencephalopathy. N Eng. J Med. 2012; 366:1870-80. [ Links ]
35. PUCCI E, GIULIANI G, SOLARI A, SIMI S, MINOZZI S, DI PIETRANTONJ C, ET AL. Natali- zumab for relapsing remitting multiple sclerosis. Cochrane Database Syst Rev. 2011;(10):CD007621. [ Links ]
36. POLMAN CH, REINGOLD SC, BANWELL B, CLANET M, COHEN JA, FILIPPI M, ET AL. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol. 2011; 69:292-302. [ Links ]
37. SANDBERG-WOLLHEIM M, OLSSON T. Cerebrospinal fluid oligoclonal bands are important in the diagnosis of multiple sclerosis, unreasonably downplayed by the McDonald criteria 2010: Yes. Mult Scler. 2013; 19:714-6. [ Links ]
38. DOBSON R, RAMAGOPALAN S, DAVIS A, GIOVANNONI G. Cerebrospinal fluid oligoclonal bands in multiple sclerosis and clinically isolated syndromes: a meta-analysis of prevalence, prognosis and effect of latitude. J Neurol Neurosurg Psychiatry. 2013; 84:909-14. [ Links ]
39. JARIUS S, PAUL F, FRANCIOTTA D, RUPRECHT K, RINGELSTEIN M, BERGAMASCHI R, ET AL. Cerebrospinal fluid findings in aquaporin-4 antibody positive neuromyelitis optica: results from 211 lumbar punctures. J NeurolSci. 2011; 306:82-90. [ Links ]
40. DALE RC, SOUSA C, CHONG WK, COX TC, HARDING B, NEVILLE BG. Acute disseminated encephalomyelitis, multiphasic disseminated encephalomyelitis and multiple sclerosis in children. Brain. 2000; 123:2407-22. [ Links ]
41. TINTORÉ M, ROVIRA A, RÍO J, TUR C, PELAYO R, NOS C, ET AL. Do oligoclonal bands add information to MRI in first attacks of multiple sclerosis? Neurology. 2008; 70:1079-83. [ Links ]
42. FERRARO D, SIMONE AM, BEDIN R, GALLI V, VITETTA F, FEDERZONI L. Cerebrospinal fluid oligoclonal IgM bands predict early conversion to clinically definite multiple sclerosis in patients with Clinically Isolated Syndrome. J Neuroimmunol. 2013; 257:76-81. [ Links ]
43. FREEDMAN MS, THOMPSON EJ, DEISEN- HAMMER F, GIOVANNONI G, GRIMSLEY G, KEIR G, ET AL. Recommended standard of cerebrospinal fluid analysis in the diagnosis of multiple sclerosis: a consensus statement. Arch Neurol. 2005; 62:865-70. [ Links ]
44. FORTINI AS, SANDERS EL, WEINSHENKER BG, KATZMANN JA. Cerebrospinal fluid oligoclonal bands in the diagnosis of multiple sclerosis. Isoelectric focusing with IgG immunoblotting compared with high-resolution agarose gel electrophoresis and cerebrospinal fluid IgG index. Am J Clin Pathol. 2003; 120:672-5. [ Links ]
45. LUNDING J,MIDGARD R, VEDELER CA. Oligoclonal bands in cerebrospinal Fluid: a comparative study of isoelectric focusing, agarose gel electrophoresis and IgG index. Acta Neurol Scand. 2000: 102:322-5. [ Links ]
46. CABRERA-LIMPIAS S, GONZÁLEZ JC, ROMERO-SÁNCHEZ C, CENTANARO G, VERGARA JP. Bandas oligoclonales en líquido cefalorraquídeo de pacientes con esclerosis múltiple del Hospital Militar Central, Bogotá DC. Acta Neurol Colomb. 2011; 28:80-4. [ Links ]
47. HUTCHINSON M. Cerebrospinal fluid oligoclonal bands are important in the diagnosis of multiple sclerosis, unreasonably downplayed by the McDonald criteria 2010: Commentary. Mult Scler. 2013; 19:717-8. [ Links ]
48. CHATAWAY J. When confronted by a patient with the radiologically isolated syndrome. Pract Neurol. 2010; 10:271-7. [ Links ]
49. OKUDA DT, MOWRY EM, BEHESHTIAN A, WAUBANT E, BARANZINI SE, GOODIN DS, ET AL. Incidental MRI anomalies suggestive of multiple sclerosis: the radiologically isolated syndrome. Neurology. 2009; 72:800-5. [ Links ]
50. OKUDA DT, MOWRY EM, CREE BA, CRABTREE EC, GOODIN DS, WAUBANT E, ET AL. Asymptomatic spinal cord lesions predict disease progression in radiologically isolated syndrome. Neurology. 2011; 76:686-92. [ Links ]
51. LEBRUN C, BENSA C, DEBOUVERIE M, WIERTLEVSKI S, BRASSAT D, DE SEZE J, ET AL. Association between clinical conversion to multiple sclerosis in radiologically isolated syndrome and magnetic resonance imaging, cerebrospinal fluid, and visual evoked potential: Follow-up of 70 patients. Arch Neurol. 2009; 66: 841-6. [ Links ]
52. GRANBERG T, MARTOLA J, KRISTOFFER- SEN-WIBERG M, ASPELIN P, FREDRIKSON S. Radiologically isolated syndrome--incidental magnetic resonance imaging findings suggestive of multiple sclerosis, a systematic review. Mult Scler. 2013; 19:271-80. [ Links ]
53. SELLNER J, SCHIRMER L, HEMMER B, MÜHLAU M. The radiologically isolated syndrome: take action when the unexpected is uncovered? J Neurol. 2010;257:1602-11. [ Links ]
54. SCHWARTZ J, WINTERS JL, PADMANABHAN A, BALOGUN RA, DELANEY M, LINENBERGER ML, ET AL. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing Committee of the American Society for Apheresis: the sixth special issue. J Clin Apher. 2013; 28:145-284. [ Links ]
55. LEHMANN HC, HARTUNG HP, HETZEL GR, STÜVE O, KIESEIER BC. Plasma exchange in neuroimmunological disorders: Part 1: Rationale and treatment of inflammatory central nervous system disorders. Arch Neurol. 2006;63:930-5. [ Links ]
56. WEINER HL, DAU PC, KHATRI BO, PETAJAN JH, BIRNBAUM G, MCQUILLEN MP, ET AL. Double-blind study of true vs. sham plasma exchange in patients treated with immunosuppression for acute attacks of multiple sclerosis. Neurology. 1989; 39:11439. [ Links ]
57. CORTESE I, CHAUDHRY V, SO YT, CANTOR F, CORNBLATH DR, RAE-GRANT A. Evidence-based guideline update: Plasmapheresis in neurologic disorders: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 2011; 76:294-300. [ Links ]
58. WEINSHENKER BG, O'BRIEN PC, PETTER- SON TM, NOSEWORTHY JH, LUCCHINETTI CF, DODICK DW, ET AL. A randomized trial of plasma exchange in acute central nervous system inflammatory demyelinating disease. Ann Neurol. 1999; 46:878-86. [ Links ]
59. MAGAÑA SM, KEEGAN BM, WEINSHENKER BG, ERICKSON BJ, PITTOCK SJ, LENNON VA, ET AL. Beneficial plasma exchange response in central nervous system inflammatory demyelination. Arch Neurol. 2011; 68:870-8. [ Links ]
60. THE CANADIAN COOPERATIVE MULTIPLE SCLEROSIS STUDY GROUP. The Canadian cooperative trial of cyclophosphamide and plasma exchange in progressive multiple sclerosis. Lancet. 1991; 337:441-6. [ Links ]
61. GORDON PA, CARROLL DJ, ETCHES WS, JEFFREY V, MARSH L, MORRICE BL, ET AL. A double-blind controlled pilot study of plasma exchange versus sham apheresis in chronic progressive multiple sclerosis. Can J Neurol Sci. 1985; 12:39-44. [ Links ]
62. SORENSEN PS, WANSCHER B, SZPIRT W, JENSEN CV, RAVNBORG M, CHRISTIANSEN P, ET AL. Plasma exchange combined with azathioprine in multiple sclerosis using serial gadolinium-enhanced MRI to monitor disease activity: a randomized single-masked cross-over pilot study. Neurology 1996; 46:1620-5. [ Links ]
63. HELLWIG K, BRUNE N, HAGHIKIA A, MÜLLER T, SCHIMRIGKS, SCHWODIAUER V, ET AL. Reproductive counselling, treatment and course of pregnancy in 73 German MS patients. Acta Neurol Scand. 2008; 118:24-8. [ Links ]
64. HENSHAW SK. Unintended pregnancy in the United States. Fam Plann Perspect. 1998; 30:24-9. [ Links ]
65. WEBER-SCHOENDORFER C, SCHAEFER C. Multiple sclerosis, immunomodulators, and pregnancy outcome: a prospective observational study. Mult Scler. 2009; 15:1037-42. [ Links ]
66. BOSKOVIC R, WIDE R, WOLPIN J, BAUER DJ, KOREN G. The reproductive effects of beta interferon therapy in pregnancy: a longitudinal cohort. Neurology. 2005; 65:807-11. [ Links ]
67. LU E, WANG BW, GUIMOND C, SYNNES A, SANDOVNICK D, TREMLETT H. Disease-modifying drugs for multiple sclerosis in pregnancy: a systematic review. Neurology. 2012; 79:1130-5. [ Links ]
68. PATTI F, CAVALLARO T, LO FERMO S, NICO-LETTI A, CIMINO V, VECCHIO R, ET AL. Is in utero early-exposure to interferon beta a risk factor for pregnancy outcomes in multiple sclerosis? J Neurol. 2008; 255:1250-3. [ Links ]
69. BOOTHBY LA, DOERING PL. FDA labeling system for drugs in pregnancy. Ann Pharmacother. 2001; 35:1485-9. [ Links ]
70. KUPERSMITH MJ, KAUFMAN D, PATY DW, EBERS G, MCFARLAND H, JOHNSON K, ET AL. Megadose corticosteroids in multiple sclerosis. Neurology. 1994; 44:1-4. [ Links ]
71. MURRAY TJ. Diagnosis and treatment of multiple sclerosis. BMJ. 2006; 332:525-7. [ Links ]
72. DURELLI L, COCITO D, RICCIO A, BARILE C, BERGAMASCO B, BAGGIO GF, ET AL. High-dose intravenous methylprednisolone in the treatment of multiple sclerosis: clinical-immunologic correlations. Neurology. 1986; 36:238-43. [ Links ]
73. FILIPPINI G, BRUSAFERRI F, SIBLEY WA, CITTERIO A, CIUCCI G, MIDGARD R, ET AL. Corticosteroids or ACTH for acute exacerbations in multiple sclerosis. Cochrane Database Syst Rev. 2000; (4):CD001331. [ Links ]
74. MILLIGAN NM, NEWCOMBE R, COMPSTON DA. A double-blind controlled trial of high dose methylprednisolone in patients with multiple sclerosis: 1. Clinical effects. J Neurol Neurosurg Psychiatry. 1987; 50:511-6. [ Links ]
75. BARNES D, HUGHES RA, MORRIS RW, WADE-JONES O, BROWN P, BRITTON T, ET AL. Randomised trial of oral and intravenous methyl- prednisolone in acute relapses of multiple sclerosis. Lancet. 1997; 349:902-6. [ Links ]
76. NATIONAL INSTITUTE FOR CLINICAL EXCELLENCE. Management of multiple sclerosis in primary and secondary care. NICE Clinical Guidelines, No. 8. 2003 [Actualizado 2010 Mar 30; Citado 2013 Sep 20]. Disponible en: http://www.nice.org.uk/nicemedia/live/10930/29199/29199.pdf. [ Links ]
77. ASCHERIO A, MUNGER KL, SIMON KC. Vitamin D and multiple sclerosis. Lancet Neurol. 2010; 9:599-612. [ Links ]
78. CARLSON NG, ROSE JW. Vitamin D as a clinical biomarker in multiple sclerosis. Expert Opin Med Diagn. 2013; 7:231-42. [ Links ]
79. POZUELO-MOYANO B, BENITO-LEÖN J. Vitamin D and multiple sclerosis. Rev Neurol. 2013; 56:243-51. [ Links ]
80. PIERROT-DESEILLIGNY C. Clinical implications of a possible role of vitamin D in multiple sclerosis. J Neurol. 2009; 256:1468-79. [ Links ]
81. HOLM0Y T, KAMPMAN MT, SMOLDERS J. Vitamin D in multiple sclerosis: implications for assessment and treatment. Expert Rev Neurother. 2012; 12:1101-12. [ Links ]
82. POZUELO-MOYANO B, BENITO-LEON J, MITCHELL AJ, HERNANDEZ- GALLEGO J. A systematic review of randomized, double-blind, placebo-controlled trials examining the clinical efficacy of vitamin D in multiple sclerosis. Neuroepidemiology. 2012; 40:147-53. [ Links ]
83. SIMON KC, MUNGER KL, KRAFT P, HUNTER DJ, DE JAGER PL, ASCHERIO A. Genetic predictors of 25-hydroxyvitamin D levels and risk of multiple sclerosis. J Neurol. 2011; 258:1676-82. [ Links ]
84. STEIN MS, LIU Y, GRAY OM, BAKER JE, KOLBE SC, DITCHFIELD MR, ET AL. A randomized trial of high-dose vitamin D2 in relapsing-remitting multiple sclerosis. Neurology. 2011; 77:1611-8. [ Links ]
85. DÖRR J, OHLRAUN S, SKARABIS H, PAUL F. Efficacy of vitamin D supplementation in multiple sclerosis (EVIDIMS Trial): study protocol for a randomized controlled trial. Trials. 2012; 13:15. [ Links ]
86. GIBSON JC, SUMMERS GD. Bone health in multiple sclerosis. Osteoporos Int. 2011;22: 2935-49. [ Links ]
87. LAMIREL C, NEWMAN NJ, BIOUSSE V. Optical Coherence Tomography (OCT) in Optic Neuritis and Multiple Sclerosis. Rev Neurol (Paris). 2010; 166:97886. [ Links ]
88. COSTELLO F. Evaluating the Use of Optical Coherence Tomography in Optic Neuritis. Mult Scler Int. 2011; 2011:148394. [ Links ]
89. PETZOLD A, DE BOER JF, SCHIPPLING S, VERMERSCH P, KARDON R, GREEN A, ET AL. Optical coherence tomography in multiple sclerosis: a systematic review and meta-analysis. Lancet Neurol. 2010; 9:921-32. [ Links ]
90. NAISMITH RT, TUTLAM NT, XU J, KLAWITER EC, SHEPHERD J, TRINKAUS K, ET AL. Optical coherence tomography differs in neuromyelitis optica compared with multiple sclerosis. Neurology 2009; 72:1077-82. [ Links ]
91. RATCHFORD JN, QUIGG ME, CONGER A, FROHMAN T, FROHMAN E, BALCER LJ, ET AL. Optical coherence tomography helps differentiate neuromyelitis optica and MS optic neuropathies. Neurology. 2009; 73:302-8. [ Links ]
92. VIDAL-JORDANA A, SASTRE-GARRIGA J, MONTALBAN X. Optical coherence tomography in multiple sclerosis. Rev Neurol. 2012; 54:556-63. [ Links ]
93. SEPULCRE J, MURIE-FERNANDEZ M, SALI- NAS-ALAMAN A, GARCIA-LAYANA A, BEJARANO B, VILLOSLADA P. Diagnostic accuracy of retinal abnormalities in predicting disease activity in MS. Neurology. 2007; 68:1488-94. [ Links ]
94. COSTELLO F, HODGE W, PAN YI, EGGENBERGER E, COUPLAND S, KARDON RH. Tracking retinal nerve fiber layer loss after optic neuritis: a prospective study using optical coherence tomography. Mult Scler. 2008; 14:893-905. [ Links ]
95. KILLESTEIN J, RUDICK RA, POLMAN CH. Oral treatment for multiple sclerosis. Lancet Neurol. 2011; 10:1026-34. [ Links ]
96. FREEDMAN MS. Present and emerging therapies for multiple sclerosis. Continuum. 2013; 19:968-91. [ Links ]
97. FOX EJ, RHOADES RW. New treatments and treatment goals for patients with relapsing-remitting multiple sclerosis. Curr Opin Neurol. 2012;25:S11-9. [ Links ]
98. PELLETIER D, HAFLER DA. Fingolimod for multiple sclerosis. NEngl J Med. 2012; 366:339-47. [ Links ]
99. FAZEKAS F, BERGER T, FABJAN TH, LEDINEK AH, JAKAB G, KOMOLY S, ET AL. Fingolimod in the treatment algorithm of relapsing remitting multiple sclerosis: a statement of the Central and East European (CEE) MS Expert Group. Wien Med Wochenschr. 2012; 162:354-66. [ Links ]
100. HE D, XU Z, DONG S, ZHANG H, ZHOU H, WANG L, ET AL. Teriflunomide for multiple sclerosis. Cochrane Database Syst Rev. 2012;12:CD009882. [ Links ]
101. FREEDMAN MS, WOLINSKY JS, WAMIL B, CONFAVREUX C, COMI G, KAPPOS L, ET AL. Teriflunomide added to interferon-ß in relapsing multiple sclerosis: a randomized phase II trial. Neurology. 2012; 78:1877-85. [ Links ]
102. GOLD R, KAPPOS L, ARNOLD DL, BAR-OR A, GIOVANNONI G, SELMAJ K, ET AL. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med. 2012; 367:1098-107. [ Links ]
103. FOX RJ, MILLER DH, PHILLIPS JT, HUTCHINSON M, HAVRDOVA E, KITA M, ET AL. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med. 2012; 367:1087-97. [ Links ]
104. COMI G, JEFFERY D, KAPPOS L, MONTALBAN X, BOYKO A, ROCCA MA, ET AL. Placebocontrolled trial of oral laquinimod for multiple sclerosis. N Engl J Med. 2012; 366:1000-9. [ Links ]
105. COHEN JA, BARKHOF F, COMI G, HARTUNG HP, KHATRI BO, MONTALBAN X, ET AL. oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N EnglJ Med. 2010; 362:402-15. [ Links ]
106. SINGER BA. Initiating oral fingolimod treatment in patients with multiple sclerosis. Ther Adv Neurol Disord. 2013; 6:269-75. [ Links ]
107. ONTANEDA D, FOX RJ. Multiple sclerosis treatment: risk mitigation. Continuum. 2013; 19:1092-9. [ Links ]
108. ROMMER PS, STÜVE O. Management of secondary progressive multiple sclerosis: prophylactic treatment-past, present, and future aspects. Curr Treat Options Neurol. 2013; 15:241-58. [ Links ]
109. GOODIN DS, FROHMAN EM, GARMANY GP JR, HALPER J, LIKOSKY WH, LUBLIN FD, ET AL. Disease modifying therapies in multiple sclerosis: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and the MS Council for Clinical Practice Guidelines. Neurology. 2002; 58:169-78. [ Links ]
110. KAPPOS L, WEINSHENKER B, POZZILLI C, THOMPSON AJ, DAHLKE F, BECKMANN K, ET AL. Interferon beta-1b in secondary progressive MS: a combined analysis of the two trials. Neurology. 2004;63:1779-87. [ Links ]
111. HARTUNG HP, GONSETTE R, KÖNIG N, KWIECINSKI H, GUSEO A, MORRISSEY, ET AL. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multicentre trial. Lancet. 2002; 360:2018-25. [ Links ]
112. GOODIN DS, ARNASON BG, COYLE PK, FROHMAN EM, PATY DW. The use of mitoxantrone (Novantrone) for the treatment of multiple sclerosis: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 2003; 61:1332-8. [ Links ]
113. FERNÁNDEZ O, GUERRERO M, MAYORGA C, MUÑOZ L, LEÁN A, LUQUE G, ET AL. Combination therapy with interferon ß-1b and azathioprine in secondary progressive Multiple Sclerosis. A two- year pilot study. J Neurol. 2002; 249:1058-62. [ Links ]
114. GOODKIN DE, KINKEL RP, WEINSTOCK- GUTTMAN B, VANDERBRUG-MEDENDORP S, SECIC M, GOGOL D, ET AL. A phase II study of i.v. methylprednisolone in secondary-progressive multiple sclerosis. Neurology. 1998; 51:239-45. [ Links ]
115. HAUSER SL, DAWSON DM, LEHRICH JR, BEAL MF, KEVY SV, PROPPER RD, ET AL. Intensive Immunosuppression in Progressive Multiple Sclerosis A Randomized, Three-Arm Study of High-Dose Intravenous Cyclophosphamide, Plasma Exchange, and ACTH. N Engl J Med. 1983; 308:173-80. [ Links ]