Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Neurológica Colombiana
versão impressa ISSN 0120-8748
Acta Neurol Colomb. vol.30 no.3 Bogotá jul./set. 2014
Caso Clínico
Leucoencefalopatía multifocal progresiva asociada al uso de Natalizumab en un paciente con esclerosis múltiple. Primer caso en Latinoamérica. Hospital de San José - Bogotá 2013
Progressive Multifocal Leukoencephalopathy associated with the use of Natalizumab in Patient with Multiple Sclerosis. First Case Report in Latin America Hospital de San Jose - Bogota, 2013
Javier Darío Triana (1), Marco Reyes (1), Leonardo Hernández (1), Oscar Mendoza (2), Sergio A. Salgado (3), Gina Paola Becerra (3)
(1) Neurólogos clínicos, instructores Fundación Universitaria Ciencias de la Salud, Hospital de San José. Bogotá, Colombia
(2) Médico patólogo - neuropatología. Fundación Universitaria Ciencias de la Salud, Hospital San José. Bogotá, Colombia
(3) Residentes de neurología, Fundación Universitaria Ciencias de la Salud, Hospital de San José. Bogotá, Colombia
Recibido: 26/02/14. Aceptado: 03/07/14.
Correspondencia: Javier Darío Triana: javtriana@gmail.com
RESUMEN
La Leucoencefalopatía Multifocal Progresiva (LMP) es una condición grave secundaria a la infección por virus John Cunningham (VJC) derivada de la deficiencia de inmunidad celular innata o adquirida. Se presenta el primer caso reportado en Latinoamérica de (LMP) asociada a Natalizumab (NZB) en un paciente con diagnóstico de esclerosis múltiple recaída-remisión, quien ingresa a urgencias con cuadro clínico de deterioro cognoscitivo, comportamental, motor y de lenguaje de curso progresivo. Se realizaron neuroimágenes con resonancia magnética cerebral sugestivas de LMP, estudios de reacción en cadena de polimerasa en líquido cefalorraquídeo para virus JC, que resultaron negativos en dos oportunidades; el diagnóstico se confirmó mediante la técnica de hibridación in situ en biopsia cerebral. Se realiza este reporte con el fin de resaltar la importancia de la vigilancia clínica y paraclínica en los pacientes con esclerosis múltiple que reciben NZB.
PALABRAS CLAVE: Leucoencefalopatía multifocal progresiva, virus JC, natalizumab, esclerosis múltiple (DECS).
SUMMARY
Progressive Multifocal Leukoencephalopathy (PML) is a serious condition secondary to John Cunningham virus (JCV) infection derived from an innate or acquired cellular immunity deficiency. We present the first reported case in Latin America of PML associated with Natalizumab (NZB) in a patient with a diagnostic of relapsing - remitting multiple sclerosis, who entered the emergency room with progressive cognitive, behavioral, motor and language impairment. Neuroimaging performed with magnetic resonance imaging was suggestive of PML. Polymerase chain reactions in cerebrospinal fluid for JC virus were conducted twice with negative results. Finally the diagnosis was confirmed by in situ hybridization technique on brain biopsy. This report is made in order to highlight the importance of clinical and paraclinical monitoring in patients with multiple sclerosis receiving NZB.
KEY WORDS: Progressive multifocal leukoencephalopathy, JC virus, natalizumab, multiple sclerosis (MeSH).
INTRODUCCIÓN
La leucoencefalopatía multifocal progresiva (LMP) es una manifestación grave de la infección causada por el virus Jhon Cunningham (VJC) (1), que invade los oligodendrocitos presentes en la sustancia blanca, produciendo una desmielinización multifocal e inflamación difusa (2). En pacientes con Esclerosis Múltiple (EM) se ha asociado a la infusión con natalizumab (NZB), y una incidencia de 3,3 casos por cada 1000 usuarios (95% IC: 2,82-3,46) (3, 4). Hasta el momento, en Latinoamérica no se han reportado casos de LMP asociada a NZB.
PRESENTACIÓN DEL CASO
Paciente masculino de 32 años con antecedente de EM recaída-remisión. En 2011 debutó con cuadro de hemiparesia derecha y neuritis óptica con imágenes compatibles con un diagnóstico de EM. Debido a la alta carga lesional y a factores de mal pronóstico, se iniciaron infusiones de NZB. Al momento del diagnóstico, su escala EDSS (Expanded Disability Status Scale) puntuó 6,5 según historia clínica. En Julio de 2012 el paciente presenta una nueva recaída a pesar de llevar 10 infusiones de NZB; esta consistió en hemiparesia derecha. El paciente fue hospitalizado y se realizó una resonancia cerebral (RM) simple y con contraste, que evidenció una nueva lesión captante de contraste sin imágenes sugestivas de LMP. No se encontró en la historia clínica del paciente ningún estudio de anticuerpos contra VJC previo al inicio del tratamiento.
El paciente acude al servicio de urgencias y es valorado por neurología el primero de Junio de 2013. Se informa que cuenta con un cuadro de un mes de desorientación, cambios conductuales, no reconocimiento de familiares, lenguaje incoherente y posterior emisión de monosílabos hasta llegar al mutismo, deterioro motor (empeoramiento de hemiparesia derecha secuelar) y hemianopsia parcial homónima derecha. Al momento del examen neurológico, el paciente se encuentra alerta, hipoproséxico, presenta afasia global, cuadriparesia de predominio en hemicuerpo derecho y Babinski bilateral. Se calculó en ese momento un EDSS de 9 puntos. Hasta ese momento se habían registrado 20 infusiones de NZB, con falla en la administración del medicamento entre la dosis 19 y 20 debido a un distanciamiento de 55 días entre las dos últimas dosis. Así mismo, se registró la última infusión 2 días antes de la consulta.
Se consideró como diagnóstico más probable una LMP y como diagnóstico diferencial un probable síndrome inflamatorio de reconstitución inmune (SIRI) debido al distanciamiento de sus dos últimas dosis. Se realizó RM cerebral simple y contrastada que mostró lesiones hiperintensas de la sustancia blanca en las secuencias en T2 y FLAIR de localización frontal y temporales bilaterales sin efecto de masa ni realce posterior a la administración del medio de contraste (Figura 1), y se consideró en ese momento como principal diagnostico una probable LMP. Se realizó una primera punción lumbar obteniendo líquido cefalorraquídeo (LCR) con hiperproteinorraquia (61mg/dl) y escasa pleocitosis linfocitaria (8 linfocitos), sin encontrar otras alteraciones.
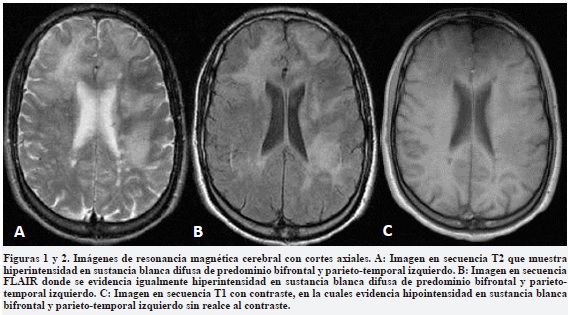
El paciente fue trasladado a la unidad de cuidado intensivo y se decidió iniciar plasmaféresis (5 sesiones), mirtazapina 30mg día y risperidona 1,5mg día. La reacción en cadena de polimerasa (PCR) para VJC en LCR fue negativa en dos oportunidades, con un punto de corte de 500 copias, mientras que los anticuerpos séricos IgG contra VJC fueron positivos.
Se realizó una nueva RM cerebral simple y contrastada a los 15 días del ingreso, y un nuevo examen de líquido cefalorraquídeo de control a los 12 días; ninguno de estos exámenes mostró diferencias con los estudios iniciales. Durante la hospitalización, el paciente presentó una neumonía asociada al cuidado médico que recibió manejo con meropenem; se presentó la resolución satisfactoria de este cuadro.
Ante la alta sospecha clínica y la no disponibilidad de PCR de alta sensibilidad, se decidió llevar a cabo una biopsia cerebral de la región frontal derecha, en la que se encontró infiltrado inflamatorio con población heterogénea de linfocitos que resaltaron con el marcador CD45, compuesto por linfocitos T CD3 y linfocitos B CD20. Este se encuentra asociado a polimorfonucleares con marcado predominio perivascular, además de focos de desmielinización, compatible con proceso inflamatorio agudo y crónico; no obstante no fue posible descartar proceso infeccioso.
Debido a que las imágenes y la clínica del paciente eran compatibles con LMP y ante la ausencia de certeza diagnóstica, se decidió remitir algunas muestras de tejido cerebral a la Clínica Mayo donde reportaron un resultado positivo para la presencia de virus JC en el tejido cerebral, mediante la técnica de hibridación in situ. Esto confirmó el diagnóstico (Figura 2).
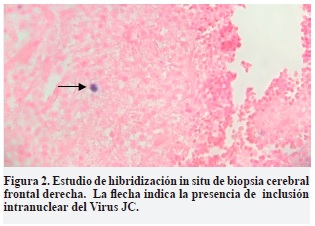
Durante la estancia hospitalaria, el paciente tuvo una leve mejoría de la función motora, persistiendo, sin embargo, las alteraciones en el lenguaje y en el comportamiento con signos de frontalización. Se tomaron nuevas imágenes de RM de control a los 23 días, que mostraron cambios posquirúrgicos y algunos focos escasos de captación de contraste. 52 días después de su ingreso inicial, el paciente es dado de alta con plan de hospitalización domiciliaria. Al egreso se calculó una EDSS de 8.
DISCUSIÓN
La LMP es una manifestación de la infección causada por el VJC, un poliomavirus de doble cadena de DNA, que presenta dos proteínas reguladoras tempranas (proteína t y proteína T), encargadas de la replicación e iniciación de la codificación de proteínas estructurales VP1, VP2 y VP3, las cuales forman la cápside para la adhesión y penetración del virus (5). El virus permanece latente en el tejido renal, cerebral y linforeticular luego de la primo infección (6). Si el huésped presenta una disminución de la inmunidad celular mediada por linfocitos T, el virus se reactiva e invade preferentemente los oligodendrocitos, generando lisis celular (7, 8). Se ha calculado una seroprevalencia del 50-60% para VJC en adultos (5).
EL NZB es un anticuerpo monoclonal recombinante dirigido contra la integrina alfa 4; fue aprobado inicialmente en el 2004 por la FDA (Food and Drug Administration) y posteriormente retirado por la presencia de casos de LMP asociados al medicamento (9). Es nuevamente aprobado por la FDA en 2006, una vez se demostró su eficacia como monoterapia en pacientes con EM recaída-remisión, al lograr una reducción en la progresión de la discapacidad en un 42-54% y de la tasa anual de recaídas en un 68%, según conclusiones del estudio AFFIRM (10). Su aplicación clínica se realiza bajo un estricto programa de farmacovigilancia.
La LMP es una infección oportunista asociada a una deficiencia en la inmunidad celular de cualquier origen, pero encontrada con mayor frecuencia en pacientes con infección por VIH (85% de los casos) sin tener una clara relación con el grado de inmunosupresión (1). En los pacientes con EM tratados con NZB, la LMP es una complicación poco frecuente pero grave, con una mortalidad reportada del 20% (11). Los sobrevivientes presentan secuelas neurológicas moderadas en el 70% y severas en un 30% (12). Se han reportado casos de LPM con uso de otros medicamentos inmunosupresores (13, 14).
El riesgo de LMP ha sido calculado a partir de la presencia de anticuerpos VJC, el uso de inmunosupresor previo y más de 24 infusiones de NZB. Si ninguno de los tres factores de riesgo está presente, el riesgo es de 0,09 por 1000 usuarios, mientras que si todos están presentes, el riesgo asciende hasta un 11,1 por 1000 usuarios (3).
Las manifestaciones clínicas pueden ser heterogéneas e incluso similares a las de una recaída de EM; sin embargo, la presentación típica está descrita como síntomas de progresión subaguda con cambios neuropsiquiátricos, motores, visuales y de lenguaje y, con menor frecuencia, la presencia de convulsiones, síntomas sensitivos y ataxia (12).
Según reportes del laboratorio comercializador actualizados a Junio de 2013, existen 372 casos confirmados de LMP asociado a NZB, con un balance de incidencia post-marketing de 3,13 x 1000 usuarios (95% IC: 2,82 - 3,46). La mayoría de estos pacientes fueron diagnosticados en Europa (218) y Estados Unidos (127). En Latinoamérica aún no se han confirmado casos hasta el presente reporte. En los casos reportados se encontró una mortalidad absoluta del 23% (85 pacientes), mientras que los 287 sobrevivientes (77%), presentaron secuelas neurológicas que oscilan entre moderadas y severas (4) aunque sin progresión de la enfermedad incluso tras 14 meses de seguimiento (12). Del total de pacientes con LMP (372), solo en 158 se conoce el estado previo de anticuerpos contra virus JC (98,7% positivos y 1,3% negativos)(4).
Los factores asociados a mayor sobrevida son: el diagnóstico temprano, un tratamiento agresivo, que la PML sea localizada, que el paciente sea joven y que presente un EDSS bajo previo a la infección (15).
Dentro de los tratamientos sugeridos por series de casos se encuentra la plasmaféresis 3-5 sesiones con un volumen plasmático promedio de 1,5 litros; con esto se logra, en el 95% de los pacientes, una concentración plasmática del NZB menor a 1 microgramo/mililitro (16, 17). Otros tratamientos estudiados han sido el uso de la mirtazapina y risperidona por su efecto inhibidor de los receptores 5HT2A, el cual se ha postulado como básico para la entrada del virus a las células astro-gliales (18). Además, se ha intentado el uso de antivirales como el cidofovir y el topotecán sin encontrar beneficio clínico pero sí efectos asociados a su toxicidad (1).
Presentamos el primer caso descrito en Latinoamérica de LMP en un paciente con diagnóstico de EM, en el cual no se logró determinar el riesgo pre-tratamiento por la ausencia de información del estado serológico previo. A pesar de tener 2 PCR negativas en LCR, debe tenerse en cuenta que en Colombia la PCR utilizada es de baja sensibilidad (mayor de 500 copias). Estudios han reportado que hasta en el 58% de los casos el conteo es menor a 500 copias (11), por lo que ante la alta sospecha clínica la biopsia cerebral es el estándar de oro para el diagnóstico. Existen muchos métodos de rastreo como inmunohistoquímica, PCR in situ, PCR en tiempo real, PCR seguida de pirosecuenciación y la hibridación in situ; esta última cuenta con una gran sensibilidad y hay amplia experiencia con ella en centros internacionales especializados (19, 20).
Desde nuestra experiencia, consideramos que el inicio del tratamiento no debe retrasarse por esperar los resultados de pruebas serológicas, y que a pesar de que estos puedan ser negativos, la sospecha clínica e imagenológica constituyen los factores más importantes a tener en cuenta para el inicio de tratamiento. Se realiza este reporte con el fin de resaltar la importancia de la vigilancia clínica y paraclínica en los pacientes con esclerosis múltiple que reciben NZB tanto como para recomendar una adecuada adherencia a las guías y protocolos de administración del medicamento.
Agradecimientos
Agradecemos al laboratorio Sthendal y a su división de farmacovigilancia por facilitar el envío de las muestras a laboratorios de referencia.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
REFERENCIAS
1. BAG AK, CURÉ JK, CHAPMAN PR, ROBERSON GH, SHAH R. JC Virus Infection of the Brain. AJNR Am J Neuroradiol. 2010;31(9):1564-76. [ Links ]
2. JR AJA. Progressive Multifocal Leukoencephalopathy. Continuum Lifelong Learning Neurol. 2012;18(6):1374-1391. [ Links ]
3. BLOOMGREN G, RICHMAN S, HOTERMANS C, SUBRAMANYAM M, GOELZ S, NATARAJAN A, ET AL. Risk of natalizumab-associated progressive multifocal leukoencephalopathy. N Engl J Med. 2012;366(20):1870-80. [ Links ]
4. GIOVANNONI G. TYSABRI (natalizumab) Benefit/Risk Update & PML Risk Stratification. Biogen indec medical affairs and TYSABRI symmary of product characteristics 2013. [ Links ]
5. SAFAK M, KHALILI K. An overview: Human polyomavirus JC virus and its associated disorders. J Neurovirol. 2003;9 Suppl 1:3-9. [ Links ]
6. BOZIC C RS, PLAVINA T. Anti-John Cunningham virus antibody prevalence in multiple sclerosis patients: baseline results of STRATIFY-1. Ann Neurol. 2011;70(5):742Y750. [ Links ]
7. WEBER T, WEBER F, PETRY H, LÜKE W. Immune response in progressive multifocal leukoencephalopathy: an overview. J Neurovirol. 2001;7(4):311-7. [ Links ]
8. AKSAMIT AJ. Progressive multifocal leukoencephalopathy: a review of the pathology and pathogenesis. Microsc Res Tech. 1995;32(4):302-11. [ Links ]
9. KLEINSCHMIDT-DEMASTERS BK, TYLER KL. Progressive multifocal leukoencephalopathy complicating treatment with natalizumab and interferon beta-1a for multiple sclerosis. N Engl J Med. 2005;353(4):369-74. [ Links ]
10. POLMAN CH, O'CONNOR PW, HAVRDOVA E, HUTCHINSON M, KAPPOS L, MILLER DH, ET AL. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med. 2006;354(9):899-910. [ Links ]
11. BALDWIN KJ, HOGG JP. Progressive multifocal leukoencephalopathy in patients with multiple sclerosis. Curr Opin Neurol. 2013;26(3):318-23. [ Links ]
12. DONG-SI T RS, GANGADHARAN A, RICHERT N, DATTA S, MCININCH J, PHILIP J, BOZIC C, BLOOMGREN G BIOGEN IDEC INC. Disability after natalizumab-associated PML in a large cohort of survivors. 28th Congress of the European Committee for Treatment and Research in Multiple Sclerosi, Lyon FranceOctober 10-13 2012. [ Links ]
13. BERGER JR, HOUFF SA, MAJOR EO. Monoclonal antibodies and progressive multifocal leukoencephalopathy. MAbs. 2009;1(6):583-9. [ Links ]
14. CARSON KR, EVENS AM, RICHEY EA, HABERMANN TM, FOCOSI D, SEYMOUR JF, ET AL. Progressive multifocal leukoencephalopathy after rituximab therapy in HIV-negative patients: a report of 57 cases from the Research on Adverse Drug Events and Reports project. Blood. 2009;113(20):4834-40. [ Links ]
15. VERMERSCH P, KAPPOS L, GOLD R, FOLEY JF, OLSSON T, CADAVID D, ET AL. Clinical outcomes of natalizumab-associated progressive multifocal leukoencephalopathy. Neurology. 2011;76(20):1697-704. [ Links ]
16. KHATRI BO, MAN S, GIOVANNONI G, KOO AP, LEE JC, TUCKY B, ET AL. Effect of plasma exchange in accelerating natalizumab clearance and restoring leukocyte function. Neurology. 2009;72(5):402-9. [ Links ]
17. FOX R. Advances in the management of PML: focus on natalizumab. Cleve Clin J Med. 2011;78 Suppl 2:S33-7. [ Links ]
18. O'HARA BA, ATWOOD WJ. Interferon beta1-a and selective anti-5HT(2a) receptor antagonists inhibit infection of human glial cells by JC virus. Virus Res. 2008;132(1-2):97-103. [ Links ]
19. PROCOP GW, BECK RC, PETTAY JD, KOHN DJ, TUOHY MJ, YEN-LIEBERMAN B, ET AL. JC virus chromogenic in situ hybridization in brain biopsies from patients with and without PML. Diagn Mol Pathol. 2006;15(2):70-3. [ Links ]
20. SAMOREI IW, SCHMID M, PAWLITA M, VINTERS HV, DIEBOLD K, MUNDT C, ET AL. High sensitivity detection of JC-virus DNA in postmortem brain tissue by in situ PCR. J Neurovirol. 2000;6(1):61-74. [ Links ]













