Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.31 no.2 Bogotá Apr./June 2015
https://doi.org/10.22379/2422402226
Caso clínico
Queratopatía neurotrófica severa en paciente con compromiso bilateral del reflejo palpebral con diferente sustrato neurológico pos-TEC: reporte de un caso
Severe Neurotrophic keratopathy in patients with bilateral involvement of blink reflex with different neurological lesion post TBI: a case report
María Isabel Zuluaga Rodas (1), Juan Camilo Suárez-Escudero (2)
(1) Médica, especialista en Neurología Clínica, Universidad CES - Instituto Neurológico de Colombia. Medellín (Antioquia), Colombia.
(2) Médico, especialista en Neurorrehabilitación-Rehabilitación Neuropsicológica. Unidad de Neurorrehabilitación, Instituto Neurológico de Colombia. Docente e investigador, Facultad de Medicina y Psicología, Universidad Pontificia Bolivariana y Universidad CES. Medellín (Antioquia), Colombia.
Recibido: 1/07/14. Aceptado: 19/03/15.
Correspondencia: María Isabel Zuluaga Rodas: maria_zulu@me.com
Resumen
Se presenta el caso de un paciente que experimentó un TEC severo, asociado a fracturas de huesos craneales y lesión de pares craneales: II par izquierdo, ramas sensitivas corneales y oculares de la primera rama del trigémino derecho, y VII par izquierdo. Secundario a lo anterior, en el paciente se alteró el reflejo palpebral de manera bilateral, pero con un sustrato neurológico diferente. Con el paso del tiempo, ya en fase crónica pos-TEC, el paciente desarrolló una queratopatía neurotrófica severa. Es un caso llamativo por la correlación neuroanatómica que exige y el papel trófico epitelial que representa el nervio trigémino a nivel corneal y porque otorga información al personal médico en neurociencias clínicas para predecir la aparición de una complicación compleja de tratar como lo es la queratopatía neurotrófica. Son escasos los reportes en la literatura de esta temática, asociada a TEC y lesión de diferentes pares craneanos.
Palabras clave: Úlcera de la córnea, úlcera corneal neurotrófica, queratopatía neurotrófica, nervio trigémino, traumatismos craneoencefálicos (DECS).
Summary
A case report of a patient with severe TBI associated with fractures of the skull base and cranial nerve involvement: II left cranial nerve, sensitive fibers from de V right cranial nerve and VII left cranial nerve. Because of complex lesions in cranial nerves, the patient had bilateral altered blink reflex. During the follow-up the patient developed severe neurotrophic keratopathy because. This is a rare cause of corneal lesion secondary to the damage to the trigeminal fibers which has a protective effect in the corneal epithelium. It is also important because could be a complications that could be avoidable en patients with severe TBI with an early diagnosis and treatment. There are few cases reported in the literature.
Key words. Corneal ulcer, neurotrophic corneal ulcer, neurotrophic keratopathy, trigeminal nerve, craneocerebral trauma (MeSH).
Introducción
El trauma encefalocraneano (TEC) es una condición crítica de salud púbica y un reto socioeconómico mundial por los costos derivados de su atención, las deficiencias permanentes y la discapacidad asociada a largo plazo en los pacientes. Reportes epidemiológicos recientes han demostrado cambios en los patrones de presentación, con aumento en la edad de presentación y TEC secundarios a accidentes de tránsito (1).
Con respecto al compromiso visual en los pacientes con TEC se sabe que por la gran complejidad de la vía visual esta es susceptible de ser lesionada incluso con traumas leves (2). Se estima que 56,7% de los pacientes pueden tener déficits visuales luego de un TEC, secundarios a trauma directo sobre el ojo, lesión de la corteza occipital o daño indirecto sobre el tallo cerebral y los pares craneanos (3). Las manifestaciones más frecuentes de lesión visual pos-TEC son: visión borrosa 46% (4), diplopía 30%, defectos en campos visuales 35%, alteraciones de pares craneales 25,7% y 12,2% ceguera por neuropatía óptica traumática debida a trauma directo o por lesión secundaria a nivel del nervio óptico (edema, compresión, isquemia) (3).
Es escasa la literatura frente a la asociación y explicación de complicaciones severas corneales (tipo queratopatía neurotrófica) secundarias a lesión de pares craneales posterior a un TEC.
Presentación de caso
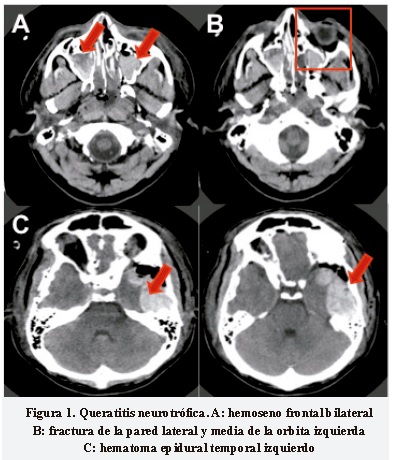
Paciente masculino de 30 años, que en abril de 2011 sufrió accidente de tránsito en calidad de conductor de motocicleta, con golpe contuso en el rostro. Ingresó al servicio de urgencias con Glasgow inicial 11/15 por traumatismo encefalocraneano (TEC) severo. Se realizó tomografía axial computada (TAC) de cráneo y rostro en la cual se evidenció: hematoma epidural temporal izquierdo con efecto de masa y edema cerebral generalizado. Además, múltiples fracturas de huesos craneales (temporo-parietal bilateral y fractura transversa de mastoides bilaterales, fractura de piso de órbita, pared lateral y media) (Figura 1), hemoseno frontal, esfenoidal y maxilar bilateral. Por los hallazgos anteriores y deterioro de su estado neurológico con disminución del Glasgow a 7/15, se llevó a cirugía para drenaje quirúrgico del hematoma epidural y mastoidectomía más liberación de VII par izquierdo. Permaneció en unidad de cuidado intensivo durante 11 días con soporte ventilatorio y sedación. Sale de alta luego de 14 días con amnesia de 1 semana periepisodio, no percepción de la luz (NPL) en ojo izquierdo (OI) por neuropatía óptica traumática, úlcera corneal en ojo derecho (OD) por alteración sensitiva córneo-conjuntival del V1, úlcera corneal por exposición en OI y parálisis facial ipsilateral secundaria a lesión de VII par izquierdo, tinitus bilateral y pérdida de audición en oído derecho.
El paciente refiere que lo primero que recuperó al alta fue la coordinación en el movimiento de las extremidades y mejoría de la disartria. Sin cambios en la visión (NPL) en OI y estabilidad de la agudeza visual (AV) en el OD.
Ingresó al servicio de neurorrehabilitación luego de 15 meses del TEC con los siguientes diagnósticos:
- - OI ciego (amaurosis) por neuropatía óptica traumática izquierda.
- Queratitis derecha por lesión de la primera rama del trigémino (V1) e izquierda por exposición, secundaria a lesión periférica del VII par.
- Lagoftalmos OD secundarios a TEC severo.
- Parálisis facial periférica izquierda con compromiso del gusto.
Al examen físico se encontró AV OD sin corrección cercana 20/60, con corrección 20/40. OI sin percepción de luz ni visión de bultos. Motilidad conservada. Hipoestesia en territorio de V1 derecho. Parálisis facial periférica izquierda, con compromiso de la protracción palpebral izquierda que no ocluye al 100% el globo ocular. No hay lagoftalmo izquierdo. Alteración bilateral del reflejo palpebral. Hipogeusia. Leve incoordinación ojo-nariz y adiadococinesia del miembro superior izquierdo. Resto del examen neurológico normal.
Se inició proceso de rehabilitación visual preventiva para evitar complicaciones secundarias al compromiso corneal por exposición.
Luego de 33 sesiones de rehabilitación realizadas en el trascurso de 13 meses, el paciente se ha podido reincorporar a su rol de padre de familia y colabora en el almacén de un amigo. Tiene mejoría en deglución, en la asimetría facial, y capacidad de olfacción/gusto.
Última revisión (1 año después de iniciar proceso de rehabilitación), en el paciente prima el malestar visual (irritación) al exponerse al frío y al ambiente, resequedad ocular y episodios de dolor en la órbita derecha. Persiste hipoestesia corneal y conjuntival en ojo derecho. Parálisis facial periférica izquierda, con lagoftalmos. Motilidad ocular conservada. No hay otro déficit de pares. AV cercana en ojo único derecho 20/20, con visión cromática normal. Defecto pupilar aferente izquierdo. Atrofia óptica bilateral. Oftalmología esp. en córnea, refiere como diagnóstico queratopatía neurotrófica severa y ojo único derecho.
Discusión
El reflejo palpebral está alterado de manera bilateral y con diferente sustrato en el paciente: a la derecha hay compromiso aferente por lesión de ramas corneales y oftálmicas del V1, y en el lado izquierdo hay compromiso eferente por lesión periférica del VII par craneano.
El reflejo palpebral es un mecanismo de defensa ocular, en el que están involucradas fibras sensitivas del trigémino en la vía aferente y fibras motoras del nervio facial en la vía eferente. A nivel neurofisiológico, una vez se realiza un estímulo nociceptivo de los tramos bulbares, conjuntivales y/o corneales de la rama 1 del trigémino (V1 o nervio oftálmico), se produce una respuesta ipsilateral o R1 y una bilateral o R2 que provoca en últimas la contracción bilateral para el cierre palpebral. Tras la estimulación eléctrica alterna de la rama V1 y el registro simultáneo de ambos músculos orbiculares de los ojos, la respuesta R1 se da a los 12-13 meses y la respuesta R2 ipsilateral cerca de los 38-40 meses. La diferencia entre la R2 ipsilateral y bilateral es de 5-6 meses (5-6).
Compromiso de la vía aferente del reflejo palpebral
El trigémino es un nervio craneal mixto que se origina en la protuberancia. Las raíces motoras inervan la mayoría de los músculos masticatorios (masetero, temporal, pterigoideos, milohioideo) y tienen su origen en el núcleo motor del trigémino.
La rama sensitiva es de gran tamaño y se encarga de la inervación sensitiva de la piel y mucosas ubicadas en el rostro. Se origina en la porción lateral de la protuberancia hasta la médula oblonga y en los primeros segmentos cervicales. En el ganglio de Gasser se divide en sus tres ramas principales: oftálmica, maxilar y mandibular. La rama oftálmica (o V1) pasa por el agujero orbitario superior para inervar el cuero cabelludo y frente, párpado superior, la córnea, la nariz, la mucosa nasal, los senos frontales y parte de las meninges (7).
Además de la sensibilidad corneal, el nervio trigémino provee factores tróficos a la córnea que desempeñan un papel fundamental en el mantenimiento de la integridad anatómica y funcional (8).
Compromiso de la vía eferente del reflejo de parpadeo
La parálisis facial periférica, que corresponde a una lesión de motoneurona inferior, produce pérdida del movimiento voluntario y emocional de los músculos del rostro del lado afectado, rostro asimétrico en reposo y con el movimiento voluntario, disminución o pérdida de pliegues cutáneos en la región de la frente y surco nasogeniano, hendidura palpebral amplia, caída de la comisura labial; alteración para sonreír, silbar, soplar; disartria, disfagia oral, el platisma del cuello no se contrae cuando se abre la boca contra oposición (signo cutáneo de Babinski), contracción sinérgica del recto superior del lado afectado que provoca giro hacia arriba del globo ocular al intentar cerrar los párpados (signo de Bell), epifora y lagoftalmos. La sensibilidad corneal, bulbar, conjuntival y periocular están conservadas. En paresias ligeras al cerrar la hendidura palpebral con fuerza las pestañas del lado afectado se aprecian mejor —signo de Souques— (9). De esta manera las lesiones periféricas del nervio facial alteran la vía eferente del reflejo palpebral, trastornando la protracción palpebral para cerrar la hendidura y así proteger al globo ocular (principalmente la córnea).
El trayecto intrapetroso del VII par se divide en laberíntico (proximal), timpánico (horizontal) y mastoideo (distal o vertical) (10). Emerge por el agujero estilomastoideo del hueso temporal y a nivel de la parótida, un vez dio sus primeras ramas (nervio auricular posterior, rama para el músculo digástrico y rama para el músculo estilohiodeo), se divide según algunos autores en dos ramas (la rama superior o temporofacial del facial, y la rama inferior o cervicofacial del facial), y para autores el nervio facial en este punto se divide en 5 tramos nerviosos, a saber: rama temporal, zigomática, bucal, mandibular y cervical (10). Independiente de la forma de división, el nervio facial a este nivel inerva los músculos faciales del cuadrante superior del rostro, incluyendo el músculo orbicular de los ojos (orbicularis oculi), este último encargado de la protracción palpebral u oclusión de la hendidura palpebral para la protección del globo ocular, principalmente la córnea, desplazamiento mecánico de la película lagrimal, regulación de la entrada de luz al globo ocular y reflejo del parpadeo.
Algunos autores clásicos reportan que la parálisis facial periférica es la neuropatía craneal de comienzo agudo más frecuente, la cual posee dos formas clínicas: idiopática y sintomática; a su vez, la forma sintomática secundaria a procesos lesionales orgánicos es poco frecuente (11-13). La parálisis facial idiopática tiene una incidencia de 14 a 25/100.000/año (9). El 16% de los pacientes presentan secuelas moderadas o graves tras una parálisis facial periférica (14).
La disminución del tono del musculo orbicular de los ojos lleva a un aumento de la apertura ocular, disminuye el parpadeo e impide en cierre palpebral completo (lagoftalmos). Algunos pacientes toleran el lagoftalmos sin tener síntomas ni alteraciones oculares, otros pueden desarrollar queratopatía por exposición, úlceras corneales y deterioro de la visión. Esto depende de diferentes factores (15):
- Edad: a mayor edad hay pérdida del tono muscular y disminución en la producción de lágrimas que contribuye a la lesión corneal.
- Sensibilidad corneal: la hipoestesia corneal por lesión de la primera rama del trigémino aumenta el riesgo de queratopatía por exposición, pues están comprometidas tanto la vía aferente como eferente del reflejo de parpadeo (ver en discusión).
- Motilidad ocular: el compromiso de otros pares craneales que impidan la motilidad ocular evitan el adecuado mantenimiento de la película lacrimal mediado por el fenómeno de Bell.
- Producción de lágrimas: la lesión de la inervación parasimpática de la glándula lacrimal puede alterar la producción de lágrimas y aumentar el riesgo de lesión corneal.
El manejo de los pacientes con parálisis facial periférica debe incluir la lubricación tópica de la córnea y la oclusión ocular durante la noche para mantener la integridad corneal y evitar la queratopatía por exposición. Algunos pacientes con parálisis facial crónica pueden requerir procedimientos quirúrgicos para mejorar la oclusión palpebral y lograr la protección de la córnea (15).
Queratopatía neurotrófica
La queratopatía neurotrófica es una patología degenerativa del epitelio de la córnea, huérfana, secundaria a una alteración de la sensibilidad corneal e inadecuado proceso de cicatrización de la superficie corneal (16). Se reporta que la alteración o abolición del estímulo trigeminal sobre las células límbicas altera el metabolismo corneal epitelial (17). En estudios animales se ha demostrado que la proliferación e integridad del epitelio de la córnea están reguladas de manera bidireccional por los estímulos nerviosos mediados por la inervación sensitiva y simpática. Cualquier alteración en esta inervación afecta la viabilidad de las células madres que se encuentran en el limbo esclerocorneal (18), esto lleva a una desvitalización epitelial (disminución metabólica y mitótica de las células epiteliales), alteración de la película lagrimal por reducción del reflejo de lagrimación y parpadeo, y alteración de las microvellosidades epiteliales (19). Todo lo anterior favorece la formación de un defecto epitelial crónico que es susceptible de ulceraciones y que si no es tratado de manera adecuada puede finalmente llegar a una perforación. La porción generalmente más afectada es la porción central de la córnea, pues este epitelio se regenera de manera centrípeta de la periferia hacia el centro.
Es una de las enfermedades oculares de más difícil manejo por falta de tratamiento específico y estandarizado (20).
Se proyecta una prevalencia menor a 5 por cada 10.000 personas, según la prevalencia de las condiciones asociadas donde prima la queratitis herpética. Alrededor del 6% de las personas con queratitis herpética desarrolla una queratopatía neurotrófica (21), 12,8% secundaria a queratitis por herpes zoster (22) y 2,8% secundaria a procedimientos quirúrgicos para manejo de neuralgia trigeminal (23).
Las causas más frecuentes de esta condición son las infecciones por virus herpes simple y zoster, traumatismos físicos, químicos (quemaduras, uso crónico de medicación tópica oftálmica) o quirúrgicos a nivel de la córnea —cirugías del segmento anterior del ojo— (24), causticaciones, radiaciones, tumores que afecten el ganglio y recorrido del V par, diabetes mellitus, síndrome de Riley-Day (17).
Otras causas posibles de una queratopatía neurotrófica son los accidentes cerebrovasculares, aneurismas y esclerosis múltiple (25), lesiones ocupantes de espacio intracraneal, procedimientos neuroquirúrgicos, lepra (26). Además, algunas patologías que se han asociado son: disautonomía familiar, síndrome de Goldenhar-Gorlin, síndrome de Moebius, hipoestesia corneal familiar e insensibilidad congénita al dolor con anhidrosis (26).
Son factores de riesgo de pérdida de sensibilidad corneal para tener en cuenta en neurología la esclerosis múltiple y tratamiento con neurolépticos y antipsicóticos (26).
El diagnóstico de esta patología se basa en historia clínica que indique daño o compromiso del nervio trigeminal, presencia de defecto epitelial persistente o úlceras corneales y disminución de la sensibilidad corneal (10, 26).
Los pacientes con queratopatía neurotrófica rara vez son sintomáticos debido a la pérdida de sensibilidad de la córnea. Si hay alguna sintomatología esta consiste en visión borrosa secundaria al defecto epitelial persistente, cicatrización del estroma corneal (opacidad corneal) y presencia de edema (26). Indirectamente se puede observar disminución en la frecuencia del parpadeo y del reflejo lacrimal.
Diagnósticos diferenciales: síndrome de ojo seco, blefaritis crónica, queratopatía por exposición, toxicidad por medicamentos tópicos, lesión química, alteraciones por uso de lentes de contacto, deficiencia de células madres del limbo corneal, queratitis inmune. La presencia de la úlcera corneal debe hacer descartar siempre causas infecciosas o inmunes (26, 27).
Al examen neurológico se debe evaluar con cuidado la presencia de compromiso de otros pares craneales para ayudar a localizar el sitio anatómico de lesión, como lo es: compromiso de VII y VIII par pueden indicar lesiones en el ángulo pontocerebeloso (neurinoma del acústico), y el compromiso de oculomotores (III, IV y VI) puede indicar lesión en la región selar, el seno cavernoso o el ápex de la cavidad orbitaria (26). La presencia de lagoftalmos señala compromiso de VII par, que lleva a queratitis por exposición y empeora la queratitis neurotrófica, como es el caso del paciente aquí presentado.
Se debe realizar un examen oftalmológico completo, con énfasis en la sensibilidad corneal. La sensibilidad se puede evaluar de manera cualitativa estimulando la córnea con mota de algodón o solución salina hipertónica al 3% para desencadenar el reflejo de parpadeo, o de manera cuantitativa con un estesiómetro con y sin contacto (tipo Cochet-Bonnet), evaluación de la película lacrimal (test de Schirmer, test de osmolaridad). Examen microbiológico ante la presencia de úlcera corneal (con el fin de descartar diagnósticos diferenciales). Evaluación de la estructura corneal con microscopia confocal in vivo, la cual permite ver la disminución de la capa de fibras nerviosas subbasales que se relacionan con la disminución de la sensibilidad corneal. La queratopatía neurotrófica se presenta usualmente en forma redonda u oval, y su cronicidad lleva a compromiso estromal (úlcera neurotrófica) (28).
Según la etiología detectada, requiere manejo multidisciplinario (neurología, oftalmología, otorrinolaringología), y solicitud de otros exámenes complementarios (RMN, paraclínicos sanguíneos, electrofisiología, entre otros) (20).
El pronóstico de estos pacientes depende de un diagnóstico y tratamiento temprano que evite la pérdida completa del epitelio y posterior perforación de la córnea que puede llevar a daños visuales irreparables.
En la literatura se reporta el caso de un paciente con queratopatía neurotrófica bilateral secundaria a una metástasis por cáncer pulmonar en tallo cerebral —carcinomatosis meníngea con metástasis de los trayectos cisternales de ambos nervios trigéminos— (29). Pero el caso aquí reportado es el primero en presentar una queratopatía neurotrófica en un paciente con lesión de varios nervios craneales pos-TEC y con alteración bilateral del reflejo palpebral.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Referencias
1. ROOZENBEEK B, MAAS AI, MENON DK. Changing patterns in the epidemiology of traumatic brain injury. Nature Reviews Neurology 9, 231-6. [ Links ]
2. KELTS EA. Traumatic brain injury and visual dysfunction: a limited overview. Neuro Rehabilitation 2010;27(3):223-9. [ Links ]
3. STAVERN G. VAN, BIOUSSE V., LYNN M., ET AL. Neuro Ophthalmic Manifestations of Head Trauma. Journal of Neuroophthalmology 2001;21, 112-7. [ Links ]
4. PADULA W.V., ET AL. Evaluating and Treating Visual Dysfunction. In Zasler, ND, et al. Brain Injury Medicine: Principles and Practice. New York: Demos, 207:511. [ Links ]
5. ESTEBAN A. A neurophysiological approach to brainstem reflexes. Blink reflex. Neurophysiol Clin. 1999;29:7-38. [ Links ]
6. RUSHWORTH G. Clinical neurophysiology of various reflexes in the facial nerve region. Electromyogr. 1968;8:349-66. [ Links ]
7. WAXMAN SG. Clinical Neuroanatomy, 27 ed. (Chapter 8). Cranial Nerves and Pathways. 2013. [ Links ]
8. MÜLLER LJ, MARFURT CF, KRUSE F, TERVO TM. Corneal nerves: structure, contents and function. Exp Eye Res. 2003;76:521-42. [ Links ]
9. SANTOS S, PASCUAL LF, TEJERO C, MORALES F. Peripheral facial paralysis: etiology, diagnosis and treatment. Rev Neurol. 2000, Jun 1-15;30(11):1048-53. [ Links ]
10. PARDAL JM, GARCÍA G, JEREZ P, MARCO J, ALMODÓVAR C. Peripheral facial paralysis. The value of clinical neurophysiology. Rev Neurol. 2003, May 16-31;36(10):991-6. [ Links ]
11. KIMURA J. Electrodiagnosis in diseases of nerve and muscle: principles and practice 2. Philadelphia: F.A. Davis Co; 1989. p. 496-8. [ Links ]
12. DUMITRU MD. Electrodiagnostic medicine. Philadelphia: Hanley & Belfus INC; 1994. p. 709-17. [ Links ]
13. BRACKMAN DE. Bell's palsy: incidence, etiology, and results of medical treatment. Otolaryngol Clin North Am. 1974; 7:357-68. [ Links ]
14. PEITERSEN E. The natural history of Bell's palsy. Am J Otol. 1982, Oct; 4(2):107-11. [ Links ]
15. CUSTER PL. Ophthalmic management of the facial palsy patient. Semin Plast Surg. 2004, Feb; 18(1):31-8. [ Links ]
16. DÍAZ-VALLE D, BENÍTEZ JM, DÍAZ E, TOLEDANO N, ARTEAGA A, SAYAGUÉS O. Manejo de la queratopatía neurotrófica mediante tarsorrafia con cianocrilato y suero autólogo. Arch Soc Esp Oftalmol. [revista en Internet] 2003, Feb [citado en 2014, Jun 12]; 78(2):119-22. [ Links ]
17. BONINI S, LAMBIASE A, RAMA P, CAPRIOGLIO G, ALOE L. Topical treatment with nerve growth factor for neurotrophic keratitis. Ophthalmology 2000;107:1347-52. [ Links ]
18. CHANG BH, GROOS ER. Neurotropic Keratitis in Cornea. Madrid: Elsevier; 2011. [ Links ]
19. HEIGLE TJ, PFLUGFELDER SC. Aqueous tear production in patients with neurotrophic keratopathy. Cornea 1996;15:135-38. [ Links ]
20. SACCHETTI M, LAMBIASE A. Diagnosis and management of neurotrophic keratitis. Clin Ophthalmol. 2014, Mar 19;8:571-9. [ Links ]
21. LABETOULLE M, AUQUIER P, CONRAD H, CROCHARD A, DANILOSKI M, BOUÉE S, ET AL. Incidence of herpes simplex virus keratitis in France. Ophthalmology 2005, May; 112(5):888-95. [ Links ]
22. DWORKIN RH, JOHNSON RW, BREUER J, ET AL. Recommendations for the management of herpes zoster. Clin Infect Dis. 2007, Jan 1;44(suppl. 1):S1-26. [ Links ]
23. BHATTI MT, PATEL R. Neuro-ophthalmic considerations in trigeminal neuralgia and its surgical treatment. Curr Opin Ophthalmol. 2005, Dec; 16(6):334-40. [ Links ]
24. GROSS EB JR. Neurotrophic keratitis. In: Krachmer JH, Mannis MJ, Holand EJ. Cornea: Fundamentals of Corneal and External Disease. St. Louis: Mosby; 1997, p. 1339-62. [ Links ]
25. GUEL L, GRIS O. Tratamiento de las úlceras corneanas. En Garg, Sheppard, Donnenfeld, Friedlaender. Tratamiento antibiótico y antiinflamatorio en oftalmología. Madrid: Ed. Médica Panamericana; 2007. p. 173-74. [ Links ]
26. BONINI S, RAMA P, OLZI D, LAMBIASE A. Neurotrophic keratitis. Eye (Lond) 2003;17:989-95. [ Links ]
27. SACCHETTI M, LAMBIASE A, COASSIN M, BONINI S, BONINI S. Toxic corneal ulcer: a frequent and sight-threatening disease. Eur J Ophthalmol. 2009, Nov-Dec;19(6):916-22. [ Links ]
28. MARTÍNEZ AM, SANTACRUZ C, CLIMENT A. Queratitis herpética: revisión. Revista Sociedad Colombiana de Oftalmología 2008, Abril-Junio; 41(2):580-92. [ Links ]
29. IBÁÑEZ N, SANZ S. Queratopatía neurotrófica bilateral secundaria a metástasis en tronco del encéfalo. Arch Soc Esp Oftalmol. 2002 (Scielo). [ Links ]













