Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Neurológica Colombiana
versão impressa ISSN 0120-8748
Acta Neurol Colomb. vol.32 no.2 Bogotá abr./jun. 2016
Trabajo original
Deterioro cognitivo y factores de riesgo cardiovascular y metabólico en una muestra de adultos de Bogotá
Cardiovascular and metabolic risk factors, for cognitive impairment in adults from Bogotá
Olga Lucía Pedraza (1), Helen Johana Perilla (2), Alberto Cruz (2), Juan Antonio Botero (2), María Camila Montalvo (1), Ana María Salazar (3), Yolanda Muñoz (4), José Miguel Díaz (4), Sandra Juliana Plata (1)
(1) Grupo de Neurociencias, Grupo Interdisciplinario de la Memoria, Hospital Infantil Universitario de San José, Facultad de Medicina, Fundación Universitaria de Ciencias de la Salud), Bogotá, Colombia
(2) Residentes de Medicina Familiar, Facultad de Medicina, Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia
(3) Grupo de Procesos Cognoscitivos y Educación, Psicología Universidad El Bosque, Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia
(4) Grupo Perspectivas del Cuidado, Facultad de Enfermería, Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia
Recibido: 27/11/15. Aceptado: 15/3/16.
Correspondencia: Olga Lucía Pedraza: opedraza@hospitalinfantildesanjose.org.co
Resumen
Introducción: la relación entre los factores de riesgo cardiovascular (FRCV) y los factores metabólicos con deterioro cognitivo (DC), definido como deterioro cognitivo leve (DCL) o demencia, es controversial.
Objetivo: describir los FRCV y metabólicos relacionados con DC, en una muestra de adultos de Bogotá.
Material y métodos: se diseñó un estudio de corte transversal y se evaluó el estado cognitivo en dos fases, en adultos mayores de 50 años, autónomos, no institucionalizados, aplicando pruebas neuropsicológicas y un protocolo de evaluación neuropsiquiátrica. Los FRCV y metabólicos fueron documentados por autoreporte, y se tomaron medidas antropométricas.
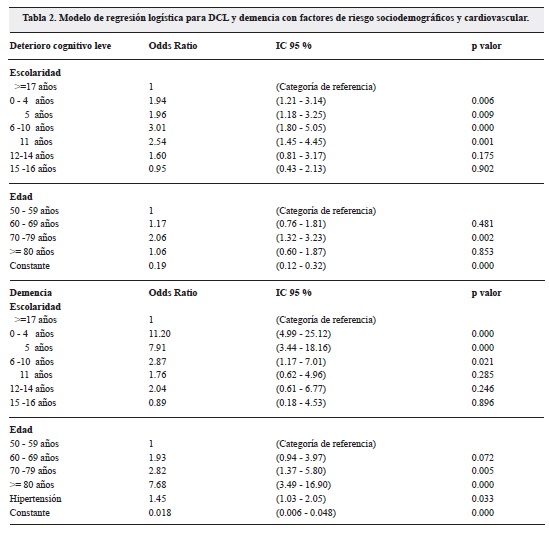
Resultados: en 1.045 adultos estudiados, el promedio de edad fue de 68 años (DS 8.6), y de educación 8 años (DS 6.0), 76 % fueron mujeres, 56 % presentaba hipertensión arterial (HTA), 40 % dislipidemia, 37 % fueron fumadores, 37 % tenían sobrepeso, 28 % hipotiroidismo, 25 % obesidad, 17 % consumían alcohol y 16 % eran diabéticos. El DCL se asoció con escolaridad de primaria-incompleta OR:1.94 (95 % IC: 1.21- 3.14), primaria-completa OR:1.96 (95 % IC: 1.18- 3.25), bachillerato- incompleto OR:3.01 (95 % IC: 1.80-5.05), bachillerato-completo OR: 2.54 (95 % IC: 1.45- 4.45) y con edad entre 70 y 79 años OR:2.06 (95% IC: 1.32-3.23). La demencia se asoció con escolaridades de primaria-incompleta OR: 11.20 (95 % IC: 4.99- 25.12), primaria-completa OR: 7.91 (95 % IC: 3.44-18.16), bachillerato- incompleto OR: 2.87 (95 % IC: 1.17- 7.01) y con edades entre 70 -79 años OR: 2.82. (95 % IC: 1.37-5.80), o mayores de 80 años OR: 7.68 (95 % IC: 3.49- 16.90) y con sufrir HTA OR: 1.45 (95 % IC: 1.03-2.05).
Conclusión: la baja escolaridad, una edad avanzada y sufrir HTA son en su orden los factores más importantes para el desarrollo de la demencia. Los adultos entre 70 y 79 años con bachillerato incompleto, tienen mayor riesgo de DCL.
Palabras clave: Factores de riesgo cardiovascular y metabólico, deterioro cognitivo leve, demencia, estilos de vida, adultos (DeCS).
Summary
Introduction: The relationship between some metabolic and cardiovascular risk factors (CVRF) and cognitive impairment (CI) defined as mild cognitive impairment (MCI) and dementia, is controversial.
Objective: Describe the cardiovascular and metabolic risk factors that are associated with cognitive impairment in adults from Bogotá.
Materials and methods: A cross-sectional study, where the state of cognitive functions (normal, MCI or dementia) was evaluated in two phases, in adults older than 50 years, autonomous, non-institutionalized, using neuropsychological tests and neuropsychiatric protocol. Its cardiovascular and metabolic risk by self-reported history and standardized anthropometric measurements were documented.
Results: Of 1045 adults surveyed, the mean age of the group was 68 years(SD 8.6), and the mean education level was 8 years(SD 6.0), 76% were women, 56% had hypertension(HT), 40% dyslipidemia, 37% were smokers, 36% were overweight, 28% presented hypothyroidism, 25% were obese, 17% drank alcohol and 16% were diabetic. MCI was associated with incomplete high school education OR:3.01(95% CI 1.80-5.05) and aged between 70 and 79 years OR:2.06(95%CI 1.32-3.23). Dementia was associated with lower scholarity, incomplete-primary OR:11.20(95%CI 4.99-25.12), complete-primary OR 7.91(95% CI.3.44-18.16), incomplete-high school OR: 2.87(95% CI 1.17-7.01), age over 80 years OR:7.68(95%CI 3.49-16.90); and suffer hypertension OR:1.45(95%CI 1.03- 2.05)
Conclusion: Low education, older age and hypertension are in order, the most important risk factors for the development of dementia in our population. Adults between 70 and 79 with incomplete high school have higher risk of MCI.
Key words: cardiovascular and metabolic risk factors, mild cognitive impairment, dementia, lifestyles, adults (MeSH).
Introducción
Los perfiles de envejecimiento poblacional de los países industrializados muestran marcadas diferencias en relación con los de bajos y medianos ingresos. Según las proyecciones de la OMS hacia el 2050, el incremento será exponencial en los países de menores ingresos económicos1.
La población que envejece presenta una mayor prevalencia de enfermedades cardiovasculares, particularmente hipertensión arterial (HTA), y deterioro cognitivo (DC)2,3. Estas enfermedades conllevan a un incremento sensible de los costos de atención para los sistemas de salud y serán además una causa importante de discapacidad. En el 2050, el 70% de los sujetos con demencia vivirán en países en vías de desarrollo, lo que representa un reto económico y social para asegurar coberturas efectivas de atención en estas naciones4.
Diferentes estudios han revisado la relación entre los factores de riesgo cardiovascular (FRCV) y metabólico con DC, especialmente HTA, diabetes mellitus (DM), dislipidemia, tabaquismo, consumo de alcohol, sedentarismo, sobrepeso, obesidad y disfunción tiroidea; Sin embargo los mecanismos vasculares y metabólicos implicados no han sido bien identificados5-11. La enfermedad cardiovascular mayor, dada por HTA, DM, enfermedad cerebrovascular (ECV), enfermedad coronaria y enfermedad arterial periférica, hace parte de los criterios diagnósticos del síndrome metabólico, que implica grados variables de resistencia a la insulina y junto a la dislipidemia, consecuencias vasculares sistémicas, en forma de arterioesclerosis, convirtiéndola en un importante factor de riesgo para el DC12,13.
La presencia de sobrepeso y obesidad, han sido también relacionados con el aumento del riesgo de enfermedad cardiovascular, por lo tanto, los estilos de vida no saludables de la población, son factores potencialmente modificables, si se realizan las correspondientes acciones de detección precoz, educación y prevención14,15.
El mecanismo clave del efecto de la enfermedad cardiovascular sobre la unidad neurovascular no es conocido. Parece deberse a lesión directa de los mecanismos que mantienen la presión de perfusión cerebral estable, o al compromiso indirecto por efecto de la disminución del gasto cardiaco en la enfermedad coronaria y/o en arritmias cardiacas; estos mecanismos parecerían ser el nexo entre estas patologías y el riesgo de desarrollar DCL o demencia16. Los mecanismos fisiopatológicos pueden actuar de manera individual o en conjunto sobre la unidad neurovascular y sobre la protección cerebral en las oscilaciones de la presión de perfusión3,17.
El DCL se considera un estadio intermedio entre los cambios cognitivos normales del adulto mayor y la demencia, con la posibilidad de permanecer en esta condición como parte de un envejecimiento normal; progresar a demencia o revertir a la normalidad18. Las intervenciones que puedan favorecer el retorno a un estado cognitivo normal o retarden la progresión a un DC, se constituyen en la base racional de las actividades de promoción y prevención para la protección de las funciones cognitivas del adulto13,19.
En Colombia el estudio EPINEURO, fue el primer estudio epidemiológico de demencia disponible y mostró una muy baja prevalencia de la misma, 13.1 por mil en mayores de 70 años20. No disponemos de estudios en nuestra población que demuestren la relación entre los factores de riesgo sociodemográficos, cardiovascular o metabólico con el DCL y la demencia.
El objetivo del presente estudio es describir la asociación entre FRCV y metabólicos, con la presencia de DCL y demencia, en una muestra de adultos mayores de 50 años, no institucionalizados, de la ciudad de Bogotá, evaluados entre 2012 y 2014.
Materiales y Métodos
Población: el presente estudio, observacional de corte transversal, es parte del proyecto “Prevalencia y caracterización del DCL y demencia en una muestra de adultos mayores de 50 años de Bogotá 2012- 2014” realizado por el grupo de neurociencias de la FUCS. Se convocó a la población mayor de 50 años, de diferentes localidades de Bogotá, a participar en el estudio, mediante invitación por carta, a través de las juntas de acción local; las parroquias y las asociaciones de pensionados. Las personas que acudían a la invitación recibieron explicación del estudio y se citaron en grupos de 20 adultos con un familiar o acompañante.
Los criterios de inclusión fueron tener edad igual o mayor de 50 años, ser residentes en alguna localidad del distrito capital y ser autónomos. Se excluyeron sujetos con antecedentes de enfermedad neuro-psiquiátrica previa, víctimas de desplazamiento, indígenas y personas institucionalizadas.
Procedimiento de evaluación: previa firma de consentimiento informado, se procedió a realizar una primera evaluación (fase I), por parte de estudiantes de enfermería, medicina y psicología, previamente entrenados, junto con profesores investigadores de medicina y enfermería de la FUCS, y psicología de la Universidad El Bosque. La evaluación consistía en la aplicación de un cuestionario sociodemográfico y de salud, preguntando sobre los riesgos cardiovasculares; los sujetos participantes fueron además pesados y tallados, para calcular el índice de masa corporal (IMC). En esta fase, se aplicaron los test breves MoCA y Mini mental state examination (MMSE) por parte de los estudiantes y profesores de psicología. Los adultos que presentaron un puntaje del MoCA test menor de 26 o menor de 24 en el MMSE, fueron citados a una segunda evaluación (fase II) realizada por residentes de medicina familiar y especialistas de neurología, psiquiatría y neuropsicología. En esta fase se realizó una nueva historia clínica, un examen neurológico, psiquiátrico y neuropsicológico aplicando un amplio protocolo, con diferentes baterías y test que evaluaban riesgo vascular, depresión, funcionalidad, cambios comportamentales, memoria, fluidez de lenguaje denominación, funciones viso-constructivas y ejecutivas, queja subjetiva de memoria, razonamiento y abstracción, así como inhibición. Se determinó en cada caso, una vez analizadas todas las pruebas y por consenso, si el sujeto presentaba un estado cognitivo normal, un DCL o una demencia21,22.
Se definió demencia, de acuerdo a los criterios del DSM-IV, como una pérdida de la memoria con una o más funciones cognitivas alteradas de forma tal que afectaran la funcionalidad del sujeto con relación a su funcionamiento previo. El DCL se definió según los criterios de Petersen como una queja de memoria, corroborada por un familiar o conocido, evidenciada en las pruebas neuropsicológicas, con una funcionalidad conservada y sin evidencia de demencia23,24.
Análisis estadístico
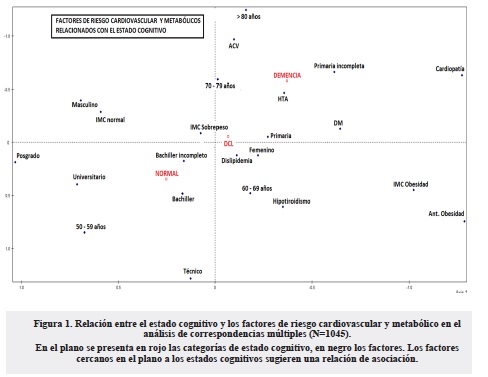
Las características sociodemográficas y los factores de riesgo cardiovascular y metabólico se resumieron con frecuencias absolutas y relativas. Para explorar la relación entre los factores de riesgo y el estado cognitivo, se realizó un análisis en correspondencias múltiples, tomando como variable ilustrativa la función cognitiva y como variables activas factores de riesgo cardiovascular y metabólico. Se ajustó un modelo de regresión logística para demencia y DCL considerando como variables independientes los factores de riesgo considerados. El análisis estadístico de la información se realizó en el programa STATA 12.
El estudio fue aprobado por el Comité de Ética de Investigación en seres humanos de la FUCS y cumple con los requisitos de la declaración de Helsinki 2013 y la Resolución 8430 de 1993 sobre investigación con seres humanos en Colombia.
Resultados
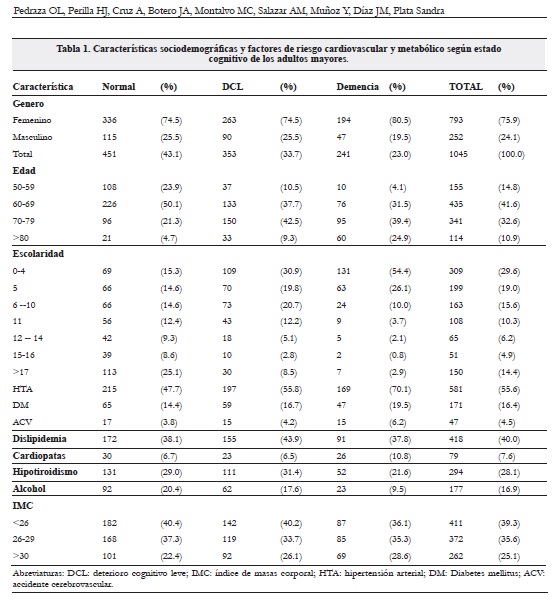
Participaron 1.263 sujetos adultos, autónomos de 19 localidades de Bogotá. Se identificaron datos completos sobre los FRCV y metabólicos en 1.045 sujetos. Las características sociodemográficas y los factores de riesgo cardiovascular y metabólico se describen según el estado de la función cognitiva encontrada (tabla 1).
Un 76 % de los participantes fueron mujeres, el promedio de edad del grupo fue de 68 años (DS 8,6) y el promedio de escolaridad de 8 años (DS 6,0), 56 % tenían antecedentes de HTA, 49 % tenían escolaridad de primaria o primaria incompleta y 14 % tenían estudios de postgrado o doctorado. La frecuencia de DCL y demencia en esta muestra fue de 34 % y 23 % respectivamente.
La figura 1 de correspondencias múltiples muestra la relación entre el estado de la función cognitiva normal, DCL y demencia con los FRCV y metabólicos. La presencia de DCL más frecuente en el género femenino se relacionó con edades entre 70 y 79 años y escolaridad inferior a 11 años. La demencia se observó en personas mayores de 70 años, con escolaridades de primaria o menos y con la presencia de hipertensión arterial.
Se ajustaron dos modelos de regresión logística. En el primero se tomó como variable dependiente el DCL y en el segundo demencia, realizando el análisis por edad en relación al grupo 50 a 59 años y por escolaridad con el grupo de mayor escolaridad (>17 años). Encontramos que el DCL presentaba un mayor riesgo entre sujetos con escolaridades de primaria incompleta (OR: 1.94. 95 % IC 1.21- 3.14), primaria completa (OR: 1.96. 95 % IC 1.18- 3.25), bachillerato incompleto (OR: 3.01. 95 % IC: 1.80- 5.05), bachillerato completo (OR: 2.54, 95 % IC: 1.45- 4.45) y con edades entre 70 y 79 años (OR: 2.06. 95 % IC: 1.32-3.23). Un mayor riesgo de demencia se encontró entre individuos con escolaridades de primaria incompleta (OR: 11.20. 95 % IC: 4.99- 25.12), primaria completa (OR: 7.91. 95 % IC: 3.44-18.16), bachillerato incompleto (OR: 2.87. 95% IC: 1.17- 7.01) y con edades entre 70 -79 años (OR: 2.82. 95% IC: 1.37-5.80), mayores de 80 años (OR: 7.68. 95 % IC: 3.49- 16.90), o con antecedentes de HTA (OR: 1.45. 95 % IC: 1.03- 2.05) (tabla 2).
No se encontraron asociaciones estadísticamente significativas entre el DC y tener antecedentes de DM, enfermedad cardiaca, ataque cerebral vascular (ACV), consumo de alcohol, tabaquismo, hipotiroidismo, estado del IMC y dislipidemia. Igualmente no hubo diferencias de género con respecto a la probabilidad de presentar DC.
Discusión
La relación entre HTA y demencia encontrada en nuestro estudio concuerda con el trabajo de Goldstein et al., quienes encontraron evidencia de una relación significativa entre HTA y DC, particularmente en sujetos con hipertensión arterial sistólica25.
Esta relación entre HTA y demencia tiene importantes implicaciones para considerar en nuestros procesos de atención primaria y secundaria, relacionados con el manejo de pacientes hipertensos y su tratamiento. Sachdev et al., encuentran que los sujetos hipertensos que reciben medicación antihipertensiva, tendrían una mayor posibilidad de revertir un DCL con un buen control de TA y propone que el desarrollo de demencia en los adultos mayores es consecuencia del efecto combinado de la enfermedad cardiovascular y la presencia de varios factores de riesgo como el gen APO E4, el estado nutricional, los estilos de vida y género26. Por otro lado, Seo, SW et al., sugieren que la enfermedad vascular correlaciona con disfunción cognitiva frontal, compromiso de la atención, ejecución y procesamiento de la información y que obedece a atrofia neuronal por lesión axonal de causa microvascular16.
El tiempo de exposición al factor de riesgo cardiovascular, en edad media de la vida, en particular con la HTA, es determinante en el desarrollo del DC; por otra parte hay diferencias significativas entre pacientes hipertensos con tratamiento y aquellos sin tratamiento en el riesgo para desarrollar demencia tipo Alzheimer27. El tipo de tratamiento, como el uso de inhibidores de enzima convertidora de angiotensina disminuiría el riesgo de DC en pacientes con HTA28. Este aspecto será importante a tener en cuenta dentro de las estrategias de tratamiento de nuestros adultos hipertensos.
Aunque nuestro estudio no demostró relaciones significativas entre tener el antecedente de otros FRCV mayores, diferentes a la HTA con el DC, están descritas las asociaciones de diferentes patologías cardiacas y vasculares arteriales que alteran indirectamente la perfusión cerebral y favorecen el DC, particularmente en sujetos de edad avanzada. Se ha documentado diferencias de género con respecto a los FRCV y subtipos de DC; Haring et al., encuentran relación entre DCL e infarto agudo de miocardio (IAM) en mujeres mayores pos menopaúsicas con enfermedad cardiovascular y otros riesgos vasculares29.
El estudio de Ikram et al., encontró una mayor incidencia de demencia entre hombres con historia de IAM subclínico; esto se atribuyó a los cambios de enfermedad ateroesclerótica de pequeño vaso que parece ser más prevalente entre hombres que en mujeres30.
Tener historia de DM no mostró una relación con DC en nuestros adultos, sin embargo, se debe tener en cuenta que la DM al ser causa de micro-angiopatía y arterioesclerosis, se convierte en un factor indirecto causal de DC. Rhee et al., resaltan la importancia de la relación de los FRCV con la arteriosclerosis y sus complicaciones, y sugieren que la DM es más frecuente entre sujetos con síndrome metabólico, lo que aumenta el riesgo para el desarrollo de enfermedad cardiovascular mayor; estos autores destacan el efecto sinérgico entre la hiperglicemia y los demás factores de riesgo cardiovascular en la morbilidad y mortalidad de los sujetos31.
No se encontró tampoco relación significativa entre obesidad o sobrepeso y DC, lo que coincide con los resultados del estudio Women's Health Initiative (WHI); en donde no se encontraron diferencias significativas entre el rendimiento cognitivo y los cambios de IMC a través del tiempo; sin embargo, un peor rendimiento cognitivo sí parece asociarse con la pérdida de peso, que fue común en etapas pre-demenciales; llegándose incluso a sugerir que el sobrepeso y la obesidad podrían tener un efecto protector contra el deterioro cognitivo y la demencia en mujeres mayores32,33.
Vidoni et al., sugieren que el sobrepeso puede ser un factor de riesgo para DC entre adultos jóvenes y maduros (edad media), mientras que en adultos mayores existiría una relación entre DCL y un índice de masa corporal bajo34.
No encontramos tampoco correlaciones significativas entre dislipidemia y DC, lo que está en desacuerdo con lo descrito en varios estudios como el estudio CAIDE que encontró que los sujetos con colesterol plasmático > 251 mg/dl y presión sistólica > 160mm/Hg tienen mayor riesgo de DC y según Kivipelto et al., los sujetos con HTA y dislipidemia tienen mayor riesgo de desarrollar demencia35,36.
La mitad de nuestra población estudiada presentaba una baja escolaridad, y esto se relacionó con un claro aumento del riesgo y frecuencia de demencia en este grupo de la muestra. Esta relación de DC y baja escolaridad ha sido descrita por Mez et al., quienes describen que los sujetos sanos de edad avanzada y baja escolaridad obtienen bajos puntajes en pruebas ejecutivas; mientras que pacientes con DCL amnésico y baja escolaridad presentaban además compromiso del lenguaje37. En el estudio de Tokuchi et al., los sujetos con baja escolaridad tendían a progresar de DCL a demencia, mientras que los sujetos con educación superior y una alta reserva cognitiva, tenían una mayor posibilidad de reversión de su DCL hacia un estado cognitivo normal para la edad19.
La frecuencia de demencia encontrada en esta muestra es tres veces más alta de lo que se ha propuesto para América Latina (8,5 %) y que la propuesta para Colombia (13,1 %) por Pradilla et al20,38; y aunque el DCL también tiene una frecuencia mayor que el descrito en Medellín (9.5 %), es menor que el de otros estudios de adultos de la comunidad39,40.
Los resultados de nuestro estudio muestran relación entre baja escolaridad, edad avanzada e hipertensión arterial con DC, particularmente con demencia. Aunque no hubo relación entre otros FRCV y DC creemos que esta asociación podría demostrarse en un estudio de seguimiento de una cohorte de esta población.
La principal fortaleza del presente estudio fue el número de adultos participantes de las diferentes localidades de Bogotá, con diferentes niveles de educación, principalmente de 5 años o menos, lo cual coincide con el promedio de escolaridad de los mayores de 60 años en Colombia. Otra fortaleza fue la amplia evaluación cognitiva interdisciplinaria y el diagnóstico por consenso del estado de la función cognitiva, realizada por un grupo experto. Las principales debilidades del estudio son: el que la muestra no sea probabilística, que la identificación de los factores de riesgo fuese por auto-reporte, y eventualmente en el tipo de muestra, dado que podrían haber participado especialmente sujetos con preocupación por su memoria, lo que representaría sin duda un sesgo.
Estos resultados deberían llevarnos a revisar nuestros programas de atención primaria de detección y tratamiento adecuado de factores de riesgo, con un mayor énfasis en el control de la HTA de los adultos. La búsqueda del DC en adultos se debe volver sistemática. Plantear estrategias de educación en salud de la población adulta se volverá prioridad.
Conclusiones
La baja escolaridad, edad avanzada e hipertensión arterial, fueron en su orden, los principales factores de riesgo encontrados para desarrollar demencia en la población adulta estudiada. Desarrollar un programa de prevención clínica del DC y de educación al adulto, es una urgencia en la Secretaria de Salud de Bogotá.
Agradecimientos
A nuestra población de adultos mayores y sus familias, a los líderes comunitarios que nos apoyaron. Al Dr. Erick Sánchez quien participó en el desarrollo del trabajo de campo. A los estudiantes de enfermería de la FUCS y de psicología de la Universidad El Bosque por su trabajo en la fase I.
Conflicto de intereses
Los autores manifiestan no tener conflictos de intereses en este estudio.
Referencias
1. HALVARI OT. Envejecimiento y ciclo de vida.: Organización Mundial de la Salud.; 2012. Availablefrom:http://www.who.int/features/factfiles/ageing/ageing_facts/es/. [ Links ]
2. PRADILLA G. Demencia: La epidemia silenciosa del III Milenio. Salud UIS,36. 2004; 36:138-145 [ Links ]
3. CHEN RH, JIANG XZ, ZHAO XH, QIN YL, GU Z, GU PL, ET AL. Risk factors of mild cognitive impairment in middle aged patients with type 2 diabetes: a cross-section study. Ann Endocrinol (Paris). 2012;73(3):208-12. [ Links ]
4. WIMO A, WINBLAD B, JÖNSSON L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimers Dement. 2010;6(2):98-103. [ Links ]
5. GOMBOJAV B, YI SW, SULL JW, NAM CM, OHRR H. Combined effects of cognitive impairment and hypertension on total mortality in elderly people: the Kangwha Cohort study. Gerontology. 2011;57(6):490-6. [ Links ]
6. HARWOOD DG, KALECHSTEIN A, BARKER WW, STRAUMAN S, ST GEORGE-HYSLOP P, IGLESIAS C, ET AL. The effect of alcohol and tobacco consumption, and apolipoprotein E genotype, on the age of onset in Alzheimer's disease. Int J Geriatr Psychiatry. 2010;25(5):511-8. [ Links ]
7. ANNERBO S, LÖKK J. A clinical review of the association of thyroid stimulating hormone and cognitive impairment. ISRN Endocrinol. 2013;2013:856017. [ Links ]
8. LUCK T, LUPPA M, BRIEL S, RIEDEL-HELLER SG. Incidence of mild cognitive impairment: a systematic review. Dement Geriatr Cogn Disord. 2010;29(2):164-75. [ Links ]
9. MOON SY, NA DL, SEO SW, LEE JY, KU BD, KIM SY, ET AL. Impact of white matter changes on activities of daily living in mild to moderate dementia. Eur Neurol. 2011;65(4):223-30. [ Links ]
10. SOLFRIZZI V, D'INTRONO A, COLACICCO AM, CAPURSO C, DEL PARIGI A, BALDASSARRE G, ET AL. Alcohol consumption, mild cognitive impairment, and progression to dementia. Neurology. 2007;68(21):1790-9. [ Links ]
11. SIERRA C, DOMÉNECH M, CAMAFORT M, COCA A. Hypertension and mild cognitive impairment. Curr Hypertens Rep. 2012;14(6):548-55. [ Links ]
12. MULÈ G, CALCATERRA I, NARDI E, CERASOLA G, COTTONE S. Metabolic syndrome in hypertensive patients: An unholy alliance. World J Cardiol. 2014;6(9):890-907. [ Links ]
13. RINCON F WC. Vascular cognitive impairment. [Curr Opin Neurol. 2013] - PubMed - NCBI: Department of Neurology, Thomas Jefferson University, Philadelphia, Pennsylvania, USA.; 2013. 2013 Feb;26(1):29-36.:[Available from: http://catalogo.fucsalud.edu.co:2080/pubmed/23254555. [ Links ]
14. CRAFT S. The role of metabolic disorders in Alzheimer disease and vascular dementia: two roads converged. Arch Neurol. 2009;66(3):300-5. [ Links ]
15. GANGULI M, FU B, SNITZ BE, HUGHES TF, CHANG CC. Mild cognitive impairment: Incidence and vascular risk factors in a population-based cohort. Neurology. 2013. [ Links ]
16. SEO SW, LEE JM, IM K, PARK JS, KIM SH, KIM ST, ET AL. Cardiovascular risk factors cause cortical thinning in cognitively impaired patients: relationships among cardiovascular risk factors, white matter hyperintensities, and cortical atrophy. Alzheimer Dis Assoc Disord. 2012;26(2):106-12. [ Links ]
17. DHIKAV V, ANAND K. Potential predictors of hippocampal atrophy in Alzheimer's disease. Drugs Aging. 2011;28(1):1-11. [ Links ]
18. KOEPSELL TD, MONSELL SE. Reversion from mild cognitive impairment to normal or near-normal cognition: risk factors and prognosis. Neurology. 2012;79(15):1591-8. [ Links ]
19. TOKUCHI R, HISHIKAWA N, KURATA T, SATO K, KONO S, YAMASHITA T, ET AL. Clinical and demographic predictors of mild cognitive impairment for converting to Alzheimer's disease and reverting to normal cognition. J Neurol Sci. 2014. [ Links ]
20. PRADILLA GA, BORIS E. VESGA A. FIDIAS E. LEÓN-SARMIENTO Y GRUPO GENECO4. Estudio neuroepidemiológico nacional (EPINEURO) colombiano. Rev Panam Salud Publica/Pan Am J Public Health. Rev Panam Salud Pública. 2003 Aug; 14 (2):104-111. [ Links ]
21. PEDRAZA OL, SANCHÉZ E, PLATA SJ, MONTALVO C, GALVIS P, CHIQUILLO A, ET AL. Puntuaciones del MoCA y el MMSE en pacientes con deterioro cognitivo leve y demencia en una clínica de memoria en Bogotá. Acta Neurol Colomb 2014: 22-30 ISSN 0120-8748 [ Links ]
22. CANO C, RUIZ A, PLATA S, MATALLANA D, MONTAÑES P, BENITO M, ET AL. Capacidad operativa de una prueba de tamizado en el diagnóstico temprano de la Enfermedad de Alzheimer [Operational capacity of a screening test in early diagnosis of Alzheimer's disease]. Revista de la Asociación Colombiana de Gerontología y Geriatría 2002 16[3], 428-430. [ Links ]
23. PETERSEN RC, SMITH GE, WARING SC, IVNIK RJ, TANGALOS EG, KOKMEN E. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol. 1999;56(3):303-8. [ Links ]
24. Association: AP. Diagnostic and statistical manual of mental disorders DSM IV. 1994. [ Links ]
25. GOLDSTEIN FC, LEVEY AI, STEENLAND NK. High blood pressure and cognitive decline in mild cognitive impairment. J Am Geriatr Soc. 2013;61(1):67-73. [ Links ]
26. SACHDEV PS, LIPNICKI DM, CRAWFORD J, REPPERMUND S, KOCHAN NA, TROLLOR JN, ET AL. Factors Predicting Reversion from Mild Cognitive Impairment to Normal Cognitive Functioning: A Population-Based Study. PLoS One. 2013;8 (3):e59649. doi: 10.1371/journal.pone.0059649. [ Links ]
27. HAYDEN KM, ZANDI PP, LYKETSOS CG, KHACHATURIAN AS, BASTIAN LA, CHAROONRUK G, ET AL. Vascular risk factors for incident Alzheimer disease and vascular dementia: the Cache County study. Alzheimer Dis Assoc Disord. 2006;20(2):93-100. [ Links ]
28. HAJJAR I, HART M, CHEN YL, MACK W, NOVAK V, C CHUI H, ET AL. Antihypertensive therapy and cerebral hemodynamics in executive mild cognitive impairment: results of a pilot randomized clinical trial. J Am Geriatr Soc. 2013;61(2):194-201. [ Links ]
29. HARING B, LENG X, ROBINSON J, JOHNSON KC, JACKSON RD, BEYTH R, ET AL. Cardiovascular disease and cognitive decline in postmenopausal women: results from the Women's Health Initiative Memory Study. J Am Heart Assoc. 2013;Dec 18 2(6):e000369. doi: 10.1161/JAHA.113.000369. [ Links ]
30. IKRAM MA, VAN OIJEN M, DE JONG FJ, KORS JA, KOUDSTAAL PJ, HOFMAN A, ET AL. Unrecognized myocardial infarction in relation to risk of dementia and cerebral small vessel disease. Stroke. 2008;39(5):1421-6. [ Links ]
31. RHEE SY, PARK SY, HWANG JK, SON JI, CHIN SO, KIM YS, ET AL. Metabolic syndrome as an indicator of high cardiovascular risk in patients with diabetes: Analyses based on Korea National Health and Nutrition Examination Survey (KNHANES) 2008. Diabetol Metab Syndr. 2014;6(1):98. [ Links ]
32. DRISCOLL I, ESPELAND MA, WASSERTHEIL-SMOLLER S, GAUSSOIN SA, DING J, GRANEK IA, ET AL. Weight change and cognitive function: findings from the Women's Health Initiative Study of Cognitive Aging. Obesity (Silver Spring). 2011;19(8):1595-600. [ Links ]
33. ANSTEY KJ, CHERBUIN N, BUDGE M, YOUNG J. Body mass index in midlife and late-life as a risk factor for dementia: a meta-analysis of prospective studies. Obes Rev. 2011;12(5):e426-37. [ Links ]
34. VIDONI ED, TOWNLEY RA, HONEA RA, BURNS JM, INITIATIVE ASDN. Alzheimer disease biomarkers are associated with body mass index. Neurology. 2011;77(21):1913-20. [ Links ]
35. REITZ C. Dyslipidemia and dementia: current epidemiology, genetic evidence, and mechanisms behind the associations. J Alzheimers Dis. 2012;30 Suppl 2:S127-45. [ Links ]
36. KIVIPELTO M, HELKALA EL, LAAKSO MP, HÄNNINEN T, HALLIKAINEN M, ALHAINEN K, ET AL. Midlife vascular risk factors and Alzheimer's disease in later life: longitudinal, population based study. BMJ. 2001;322(7300):1447-51. [ Links ]
37. MEZ J, COSENTINO S, BRICKMAN AM, HUEY ED, MANLY JJ, MAYEUX R. Dysexecutive versus amnestic Alzheimer disease subgroups: analysis of demographic, genetic, and vascular factors. Alzheimer Dis Assoc Disord. 2013;27(3):218-25. [ Links ]
38. PRINCE M, BRYCE R, ALBANESE E, WIMO A, RIBEIRO W, FERRIA CP. The global prevalence of dementia: A systematic review and meta-analysis. Alzheimer and Dementia 2013 (9):63-75 e2. doi: 10.1016/j. [ Links ]
39. HENAO-ARBOLEDA E, AGUIRRE-ACEVEDO DC, MUÑOZ C, PINEDA DA, LOPERA F. Prevalencia de deterioro cognitivo leve de tipo amnésico en una población colombiana [Prevalence of amnestic type mild cognitive impairment in a Colombian population]. Rev. Neurol. 2010; 46, 709-713. [ Links ]
40. ARTERO S, ANCELIN L, PORTET F, DUPUY A, BERR C, DARTIGUES JF ET AL. Risk profiles for mild cognitive impairment and progression to dementia are gender specific. J Neurol Neurosurg Psychiatry 2008;79 :979-984 doi: 10.1136/jnnp.2007.136903. [ Links ]