Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Acta Neurológica Colombiana
versão impressa ISSN 0120-8748
Acta Neurol Colomb. vol.32 no.2 Bogotá abr./jun. 2016
Caso clínico
Angiopatía amiloide cerebral con inflamación relacionada y demencia rápidamente progresiva: primer reporte de caso en Colombia
Cerebral amyloid angiopathy-related inflammation and rapidly progressive dementia: first case report in Colombia
Carlos Hugo Zapata Zapata (1), Edwing Franco Dáger (1), Juan Carlos Arango Viana (2)
(1) Residente de Neurología, Universidad de Antioquia, Medellín, Colombia.
(2) Neuropatólogo, profesor titular de la Universidad de Antioquia, Medellín, Colombia.
Recibido: 31/8/16. Aceptado: 6/6/16.
Correspondencia: Carlos Hugo Zapata: zcarloshz@yahoo.es
Resumen
La angiopatía amiloide cerebral (AAC) consiste en el depósito de amiloide en la pared de los vasos sanguíneos intracraneales, y conlleva a la aparición de hemorragia, isquemia o leucoencefalopatía. Las manifestaciones clínicas de la AAC son muy variables, tales como alteraciones cognitivas, alteraciones comportamentales, déficit neurológico focal, cefalea o crisis epilépticas. Un subtipo de angiopatía amiloide cerebral con inflamación relacionada (AAC-IR), se ha reportado recientemente en la literatura mundial. Presentamos el caso de una paciente de 74 años de edad, con un cuadro de demencia rápidamente progresiva de aproximadamente tres meses de evolución, asociada a cefalea, meningismo, disminución de la fuerza en hemicuerpo derecho, múltiples lesiones hemorrágicas parenquimatosas, hemosiderosis difusa, edema cerebral focal y estudio histológico con evidencia de amiloide intracerebral.
El diagnóstico de la AAC se basa en una historia clínica compatible; neuroimagenes que demuestren hemosiderosis o múltiples hemorragias de predominio en fosa posterior, y en algunos casos estudio histológico que confirme la presencia de amiloide en la microcirculación intracraneal. Los criterios de Boston modificados unifican los hallazgos para el diagnóstico de AAC con diferentes grados de certeza. En algunas ocasiones, como en el caso presentado, la AAC se asocia a un componente inflamatorio, y se manifiesta con una demencia rápidamente progresiva, constituyéndose en un verdadero reto diagnóstico.
Palabras clave: angiopatía amiloide cerebral, amiloide, demencia, hemorragia cerebral, hemorragia subaracnoidea, hemosiderosis (DeCS).
Summary
Cerebral amyloid angiopathy (CAA) is the deposition of amyloid in the wall of intracranial blood vessels, and leads to the appearance of hemorrhage, ischemia or leukoencephalopathy. The clinical manifestations of the CAA are highly variable, such as cognitive impairment, behavioral abnormalities, focal neurological deficits, headache or seizures. A subtype, Cerebral amyloid angiopathy-related inflammation (CAA-RI) has recently been reported in the world literature. We report the case of a 74-year-old with a rapidly progressive dementia about three months duration, associated with headache, meningismus, decreased strength in right hemisphere, multiple parenchymal hemorrhagic lesions, diffuse hemosiderosis, cerebral edema focal and histological study with evidence of intracerebral amyloid.
The diagnosis of CAA is based on a clinical history compatible, neuroimaging showing hemosiderosis or multiple bleeding, predominantly in posterior fossa, and in some cases histological examination to confirm the presence of amyloid in intracranial microcirculation. Modified Boston criteria, unify the findings for the diagnosis of CAA, with varying degrees of certainty. Sometimes, as in the case presented, the CAA is associated with an inflammatory component, and is manifested by a rapidly progressive dementia, becoming a true diagnostic challenge.
Key words: Amyloid, cerebral amyloid angiopathy, cerebral hemorrhage, dementia, hemosiderosis, subarachnoid hemorrhage (MeSH)..
Introducción
La angiopatía amiloide cerebral (AAC) se origina por depósito de amiloide en la capa media y adventicia de la microcirculación intracerebral, específicamente de las arteriolas, capilares y menos común de las vénulas1,2. La AAC puede ser esporádica o familiar y se clasifica según el tipo de proteína acumulada3,4.
La AAC tipo beta-amiloide (βA) esporádica es común entre personas ancianas mayores de 60 años y en pacientes con enfermedad de Alzheimer4. El espectro clínico varía entre déficit neurológico focal, cefalea, crisis epilépticas, alteración del estado de conciencia y demencia5. Las diferentes manifestaciones clínicas se encuentran relacionadas con la alteración microvascular presente en la AAC6.
Un subtipo de AAC se relaciona con inflamación vascular o perivascular alrededor de los depósitos de βA; para lograr el diagnóstico son requeridas las ayudas imaginológicas o histopatológicas, además de descartar previamente otras posibles causas7. Presentamos el caso de una paciente atendida en un hospital de alta complejidad en la ciudad de Medellín-Colombia, quien sufrió déficit motor agudo con demencia rápidamente progresiva y sólo por estudios imaginológicos y hallazgos histológicos se llegó al diagnosticó de una AAC con inflamación relacionada (AAC-IR), descrita recientemente en la literatura8.
Presentación del caso
Paciente femenina de 74 años de edad, religiosa, independiente en sus actividades de la vida diaria, sin deterioro cognitivo previo. Como antecedente personal de importancia se encontró hipertensión arterial crónica controlada.
Inició con cuadro clínico de aproximadamente un mes de evolución consistente en deterioro cognitivo leve rápidamente progresivo, asociado a cefalea holocraneana pulsátil, fluctuante y moderada intensidad. Dos semanas después desarrolló alteración del ciclo sueño vigilia, desorientación, inatención y actitud indiferente con incontinencia de esfínteres. El cuadro clínico progresó en tres semanas a logopenia, marcha inestable y culminó con postración en cama, por lo que fue hospitalizada para estudio etiológico. En la revisión por sistemas no se encontró síntomas constitucionales.
Al ingreso hospitalario tenía una presión arterial de 140/80 mmHg, una frecuencia cardiaca de 81 por minuto y estaba afebril. El examen cardiopulmonar y de abdomen eran normales. En el examen neurológico se encontró alerta, hipoproséxica, no obedecía órdenes y su lenguaje era hipofónico. Presentó rigidez de nuca sin otros signos meníngeos. Las pupilas eran reactivas a la luz, sin déficit de oculomotores ni asimetrías faciales. Había disminución de la fuerza muscular en el miembro superior derecho, hiperreflexia generalizada y respuesta plantar extensora derecha. La sensibilidad nociceptiva era simétrica. No fue posible evaluar coordinación ni marcha.
Se realizaron exámenes de hemograma, ionograma, glucemia, niveles de vitamina B12, función renal, perfil hepático y perfil tiroideo que reportaron normalidad, sin elevación de la proteína C reactiva, ni de la velocidad de sedimentación globular, serología para sífilis y Elisa para VIH fueron negativas.
Se efectuó una punción lumbar con presión de apertura de 33 cm de agua y el citoquímico de líquido cefalorraquídeo (LCR) mostró: leucocitos: 0 células; eritrocitos: 270/mm3, glucosa: 49 mg/dl, proteínas: 7.2 g/L, en la tinción Gram no se observaron bacterias, ni reacción leucocitaria. La serología para sífilis en LCR fue negativa, al igual que el látex para criptococo, el cultivo para anaeróbios y la reacción en cadena de polimerasa (PCR) para micobacterias y para herpes. La adenosin deaminasa (ADA) no reportó elevación. El estudio citológico del LCR mostró polimorfonucleares eosinófilos, linfocitos y macrófagos.
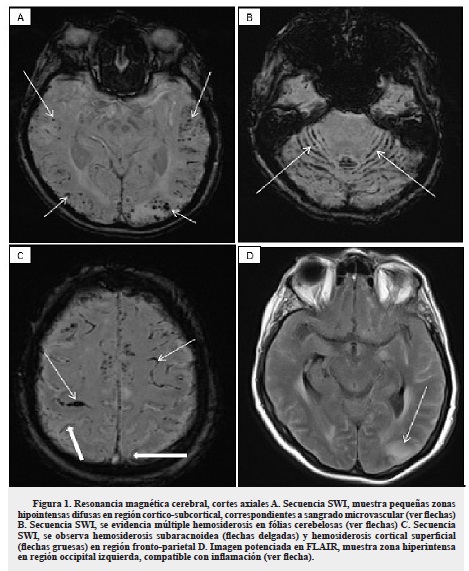
Se realizó electroencefalograma que registró lentificación difusa del trazado por encefalopatía moderada y alteración de la función eléctrica cortical fronto parietal izquierda, sin actividad epileptiforme. La resonancia magnética (RM) de cráneo simple y contrastada mostró múltiples hemorragias puntiformes córtico-subcorticales en hemisferios cerebelosos y región parieto-occipital izquierda con edema vasogénico (figura 1).
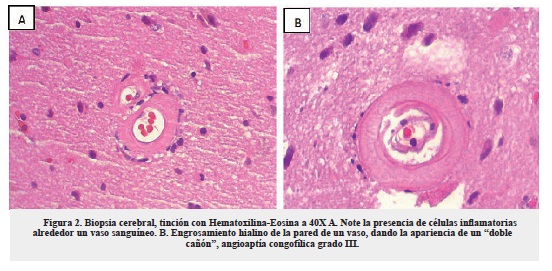
En vista del deterioro cognitivo progresivo y la presencia de múltiples lesiones hemorrágicas de predominio en la fosa posterior, se sospechó como causa probable angiopatía amiloide con cambios inflamatorios y menos probable, vasculitis primaria del sistema nervioso central. Se solicitó arteriografía cerebral de cuatro vasos, la cual reveló un pequeño aneurisma de la bifurcación de M2 derecha de 4 mm de diámetro sin signos de sangrado. Se realizó biopsia de una de las lesiones cerebrales y el informe histopatológico concluyó que se trataba de una AAC-IR (figuras 2 y 3). Se decidió iniciar pulsos de esteroides con metilprednisolona durante cinco días, con evidencia de mejoría clínica, por lo que se continuó con prednisona oral 50 mg día, sin embargo, esta última se suspendió al cuarto día por elevación de las cifras tensionales.
Se le realizó gastrostomía y tratamiento ambulatorio de cifras tensionales sin uso de antiagregantes plaquetarios. Dos meses después de su egreso, la paciente se encontraba alerta, sin cefalea, toleraba ocasionalmente la vía oral y sin nuevos déficits neurológicos.
Discusión
La AAC tipo βA es una vasculopatía que puede dar origen a lesiones hemorrágicas, isquémicas o leucoencefalopáticas1. Cuando hay una reacción inflamatoria perivascular significativa, la AAC se asocia con un cuadro clínico caracterizado por alteraciones de la función cognitiva y de la conciencia, cambios de personalidad y comportamiento, cefalea y signos de focalización neurológica5,7-10.
La AAC-IR, se ha reportado en casos clínicos o serie de casos. En una revisión sistemática de la literatura mundial realizada por Castro y colaboradores11, sólo se encontraron 67 publicaciones, en las cuales se incluyeron 155 pacientes, con una edad promedio 67 años y predominio en el sexo masculino (53 %). Las manifestaciones clínicas más frecuentemente halladas fueron: disfunción cognitiva, cefalea, crisis epilépticas y signos piramidales. En la misma revisión la mayor parte de los pacientes respondieron favorablemente al tratamiento con corticosteroides.
Realizamos una revisión en las principales bases de datos (Pubmed, Embase, Lilacs y Scielo) y sólo encontramos cinco casos reportados en Latinoamérica con AAC o AAC-IR, uno en México12, uno en Uruguay13 y dos en Brasil14,15 no relacionados con inflamación y el quinto caso en Argentina asociado a inflamación16. En Colombia no encontramos ningún caso reportado de AAC con o sin inflamación.
En el caso presentado, la paciente desarrolló un cuadro clínico compatible con demencia rápidamente progresiva de 3 meses de evolución, similar al caso reportado en Uruguay por Blanco y colaboradores13, manifestada por cambios en la conducta, disminución de la atención, alteración del ciclo sueño-vigilia, incontinencia de esfínteres y dependencia en todas sus funciones básicas vitales. Asociada a cefalea y déficit neurológico focal, como en los casos reportados por Chung y colaboradores pero sin crisis epilépticas17.
La vasculopatía por AAC se relaciona con ACV hemorrágico cortico-subcortical, en contraste con la vasculopatía hipertensiva que se asocia a sangrado cerebral profundo18,19. En el caso reportado, a pesar de que la paciente tenía antecedente de hipertensión arterial, no se registraron cifras tensionales elevadas durante el inicio de las manifestaciones clínicas, ni sangrados cerebrales profundos.
Los hallazgos de la AAC en RM de cráneo son inespecíficos, generalmente se observan hiperintensidades cortico-subcorticales en T2 y FLAIR, lesiones lacunares con ausencia de señal en secuencia de gradiente eco, que corresponde a zonas de microsangrados de predominio en las regiones temporal, occipital y cerebelosa. También se han descrito desde hemorragias mayores, hemorragia subaracnoidea (HSA) y edema cerebral focal en relación con la AAC10,20-22, hasta la falta de evidencia de microsangrado en la RM cerebral tal como lo reporta Sakaguchi y colaboradores en su reporte de caso y en la revisión sistemática de la literatura23. La paciente descrita presentaba microsangrados cortico-subcorticales de predominio posterior e infratentorial, hemosiderosis cortical superficial, HSA a nivel de surcos y edema vasogénico local asimétrico, tal como lo mencionan Chung y colaboradores en una propuesta unificada de criterios diagnósticos para AAC-IR, en la categoría posible, sin ayuda histopatológica17.
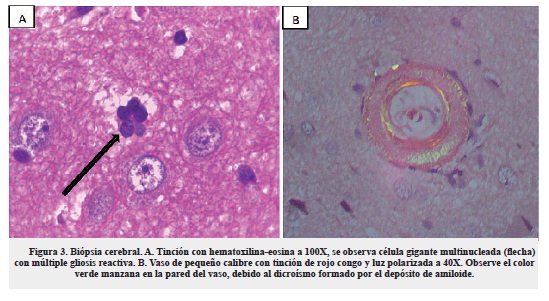
En la histopatología de la AAC existen diferencias de acuerdo con los grados de severidad de la enfermedad. En 1997, una escala modificada para describir los hallazgos histológicos según el grado de severidad, fue propuesta por Greenberg y colaboradores24. De acuerdo a dicha escala, la biopsia del caso reportó una angiopatía congofílica grado III (figura 2B). Adicionalmente, en la AAC-IR se han identificado células gigantes multinucleadas perivasculares en la circulación microvascular del parénquima cerebral y de la meninges8,17. En el caso presentado, el estudio histológico mostró engrosamiento vascular con algunas células gigantes multinucleadas en parénquima cerebral, acorde con el diagnóstico de AAC-IR, similar a lo reportado en los casos de Castro11, Verón16 y Chung17 (figura 3A).
Los criterios de Boston se han utilizado para determinar el grado de certeza diagnóstica en casos de AAC, estos hallazgos se basan en datos clínicos, histopatológicos e imaginológicos25. En el año 2010, Linn y colaboradores modificaron dichos criterios, adicionándole hemosiderosis cortical superficial a los hallazgos observados en la RM de cráneo, lo que aumenta la sensibilidad diagnóstica de 90 a 95 % sin modificar la especificidad del 81 %20.
De acuerdo con los criterios de Boston modificados (2010), la paciente descrita se clasifica en la categoría de “Diagnóstico probable de AAC apoyado por patología” debido a que tenía hemorragia cortico-subcortical y hemosiderosis cortical superficial, con algún grado de AAC (grado III) y ausencia de otras posibles causas, pero no se clasificó como definitiva porque esta categoría sólo se realiza post-mortem20; y de acuerdo a los criterios de Chung para AAC-IR, la paciente se clasifica en la categoría “Diagnóstico definitivo de AAC-IR” por el inicio agudo, la edad, las manifestaciones clínicas, los hallazgos en la RM cerebral y las características histopatológicas, además de haber descartado otras posibles causas17.
En la paciente reportada, es llamativa la elevada hiperproteinorraquia (7.2 g/L), sin embargo presentó HSA y hemosiderosis cortical superficial difusa que pueden explicar dicho hallazgo. Scolding y colaboradores26 reportaron niveles hasta de 4,46 g/L de proteínas en LCR y Salvarani y colaboradores27 reportaron hasta 5,73 g/L de proteinorraquia en pacientes con AAC y vasculitis asociada. Birch y colaboradores28 reportaron 132 pacientes con hiperproteinorraquia, de los cuales 51 tenían HSA confirmada y un rango de concentración de proteínas totales en LCR de 0,4 a 3 g/L. Lo anterior puede ser explicado por lisis de los eritrocitos que liberan oxihemoglobina y esta se transforma por acción de los macrófagos en bilirrubina, aumentando la concentración total de proteínas en el LCR.
No existe un tratamiento específico para la AAC, el manejo debe ser de soporte, un adecuado control de la presión arterial y evitar el uso de antiagregantes plaquetarios, lo que ha demostrado reducción del riesgo de aparición de hemorragia cerebral29-31. Se ha planteado usar esteroides en AAC-IR con diversos grados de mejoría sin conocer el tiempo exacto de tratamiento27,32,33 . En el caso que reportamos se utilizaron esteroides por vía intravenosa y luego por vía oral con mejoría clínica, tal como lo reportó Crosta y colaboradores en un caso en Italia34, García y colaboradores en tres casos en España35, De la Riva y colaboradores en un caso en España33 o Sakaguchi y colaboradores con otro caso en Japón23 en el que demuestra mejoría neu-imaginológica y en pruebas neusicológicas durante el seguimiento. En nuestro reporte no se mantuvo el tratamiento ambulatorio con esteroides orales debido a la presencia de efectos secundarios asociados al esteroide oral, sin embargo al cabo de dos meses la paciente persistía con una moderada mejoría clínica y sin nuevas descompensaciones.
Conclusiones
La AAC, tiene un amplio espectro de manifestaciones clínicas inespecíficas, y requiere ser descartada especialmente en las personas mayores de 60 años con ACV hemorrágico o con hemosiderosis cortical superficial. Si adicionalmente se encuentra un deterioro cognitivo rápidamente progresivo, el diagnóstico probable podría ser AAC-IR, apoyado por el hallazgo de inflamación focal asimétrica en la RM cerebral y por la respuesta clínica favorable al uso esteroides, dejando sólo la histopatología para los casos que no mejoren o para realizar el diagnóstico definitivo, como en el caso que reportamos.
Agradecimientos
A Sergio Alberto Vargas, MD Neurorradiológo y profesor titular de la Universidad de Antioquia, por su contribución en la sección de las neuroimágenes.
A Luis Fernando Arias, MD Patólogo y profesor titular de la Universidad de Antioquia, por su contribución en la obtención de las imágenes histológicas.
Conflicto de intereses
Los autores declaran no presentar conflicto de intereses.
Referencias
1. YAMADA M. Cerebral Amyloid Angiopathy: Emerging Concepts. J Stroke.2015;17:17-30. [ Links ]
2. DODEN T, SATO H, SASAHARA E, MURATA T, YAKO T, KITAZAWA K, ET AL. Clinico-Radiological Characteristics and Pathological Diagnosis of Cerebral Amyloid Angiopathy-Related Intracerebral Hemorrhage. J Stroke Cerebrovasc Dis. 2016(16):194-204. [ Links ]
3. RENSINK AA, DE WAAL RM, KREMER B, VERBEEK MM. Pathogenesis of cerebral amyloid angiopathy. Brain Res Brain Res Rev. 2003;43:207-23. [ Links ]
4. YAMADA M, NAIKI H. Cerebral amyloid angiopathy. Prog Mol Biol Transl Sci. 2012;107(número):41-78. [ Links ]
5. MAIA LF, MACKENZIE IR A, FELDMAN HH. Clinical phenotypes of Cerebral Amyloid Angiopathy. J Neurol Sci. 2007;257(número):23-30. [ Links ]
6. YAMADA M. Cerebral amyloid angiopathy: an overview. Neuropathology. 2000;20(número):8-22. [ Links ]
7. ENG JA, FROSCH MP, CHOI K, REBECK GW, GREENBERG SM. Clinical Manifestations of Cerebral Amyloid Angiopathy-Related Inflammation. Ann Neurol. 2004;55(número):250-6. [ Links ]
8. AURIEL E, CHARIDIMOU A, GUROL ME, NI J, VAN ETTEN ES, MARTINEZ-RAMIREZ S, ET AL. Validation of Clinicoradiological Criteria for the Diagnosis of Cerebral Amyloid Angiopathy-Related Inflammation. JAMA Neurol. 2016;73(2):197-202. [ Links ]
9. CENINA AR, DE LEON J, TAY KY, WONG CF KN. Cerebral Amyloid Angiopathy - related Inflammation Presenting With Rapidly Progressive Dementia , Responsive to IVIg. Alzheimer Dis Assoc Disord. 2015;29(4):347-9. [ Links ]
10. CHARIDIMOU A, GANG Q, WERRING DJ. Sporadic cerebral amyloid angiopathy revisited: recent insights into pathophysiology and clinical spectrum. J Neurol Neurosurg Psychiatry. 2012;83(número):124-37. [ Links ]
11. CASTRO CALDAS A, SILVA C, ALBUQUERQUE L, PIMENTEL J, SILVA V FJ. Cerebral Amyloid Angiopathy Associated with Inflammation: Report of 3 Cases and Systematic Review. J Stroke Cerebrovasc Dis. 2015;24(9):2039-48. [ Links ]
12. CHÁVEZ LAURA, OLVERA JUAN, MURGUÍA MARÍA VR. Angiopatía cerebral amiloide: informe de tres casos autopsia / Cerebral amyloid angiopathy. A report of three autopsy cases. Patologia (Mex). 1994;32(2):97-103. [ Links ]
13. BLANCO V, GARCÍA F, TORRES V, AMBROSONI F, BARTESAGHI V AN ET AL. Rapidly Progressive Dementia Secondary to Cerebral Amyloid Angiopathy angiopatía amiloide cerebral. Arch Med Interna. 2010;XXXII(2-3):50-2. [ Links ]
14. DE ANDRADE GC, SILVEIRA RL, PINHEIRO N, MELO ROCHA EM, HOMEM PITTELLA JE. Angiopatia amilóide cerebral simulando tumor cerebral: Relato de caso. Arq Neuropsiquiatr. 2006;64(1):153-6. [ Links ]
15. TAKADA LT, CAMIZ P, GRINBERG LT, LEITE C. Non-inflammatory cerebral amyloid angiopathy as a cause of rapidly progressive dementia: A case study. Dement Neuropsychol. 2009;3(4):352-7. [ Links ]
16. VERÓN P, DOUMIC J MM, A RC AND TA. Forma inflamatoria de angiopatía amiloide cerebral: reporte de un caso en Argentina. 2015;7(4):249-53. [ Links ]
17. CHUNG KK, ANDERSON NE, HUTCHINSON D, SYNEK B, BARBER PA. Cerebral amyloid angiopathy related inflammation: three case reports and a review. J Neurol Neurosurg Psychiatry. 2011;82(1):20-6. [ Links ]
18. JACKSON CA, SUDLOW CLM. Is hypertension a more frequent risk factor for deep than for lobar supratentorial intracerebral haemorrhage? J Neurol Neurosurg Psychiatry. 2006;77(número):1244-52. [ Links ]
19. YATES PA, VILLEMAGNE VL, ELLIS KA, DESMOND PM, MASTERS CL, ROWE CC. Cerebral microbleeds: A review of clinical, genetic, and neuroimaging associations. Front Neurol. 2014;4 JAN:1-13. [ Links ]
20. LINN J, HALPIN A, DEMAEREL P, RUHLAND J, GIESE A. D, DICHGANS M, ET AL. Prevalence of superficial siderosis in patients with cerebral amyloid angiopathy. Neurology. 2010;74(número):1346-50. [ Links ]
21. LINN J, HERMS J, DICHGANS M, BRÜCKMANN H, FESL G, FREILINGER T, ET AL. Subarachnoid hemosiderosis and superficial cortical hemosiderosis in cerebral amyloid angiopathy. Am J Neuroradiol. 2008;29(número):184-6. [ Links ]
22. CHARIDIMOU A, LINN J, VERNOOIJ MW, OPHERK C, AKOUDAD S, BARON JC, ET AL. Cortical superficial siderosis: Detection and clinical significance in cerebral amyloid angiopathy and related conditions. Brain. 2015;138(8):2126-39. [ Links ]
23. SAKAGUCHI H, UEDA A, KOSAKA T, YAMASHITA S, KIMURA E, YAMASHITA T, ET AL. Cerebral amyloid angiopathy-related inflammation presenting with steroid-responsive higher brain dysfunction: case report and review of the literature. J Neuroinflammation. 2011;8(1):116. [ Links ]
24. GREENBERG SM, VONSATTEL JP. Diagnosis of cerebral amyloid angiopathy. Sensitivity and specificity of cortical biopsy. Stroke. 1997;28(número):1418-22. [ Links ]
25. KNUDSEN KA, ROSAND J, KARLUK D, GREENBERG SM. Clinical diagnosis of cerebral amyloid angiopathy: validation of the Boston criteria. Neurology. 2001;56(número):537-9. [ Links ]
26. SCOLDING NJ, JOSEPH F, KIRBY PA, MAZANTI I, GRAY F, MIKOL J, ET AL. ABeta-related angiitis: Primary angiitis of the central nervous system associated with cerebral amyloid angiopathy. Brain. 2005;128(3):500-15. [ Links ]
27. SALVARANI C, BROWN RD, CALAMIA KT, CHRISTIANSON TJH, HUSTON J, MESCHIA JF, ET AL. Primary central nervous system vasculitis: comparison of patients with and without cerebral amyloid angiopathy. Rheumatology (Oxford). 2008;47(11):1671-7. [ Links ]
28. BIRCH K, BURROWS G, CRUICKSHANK A, EGNER W, HOLBROOK I, LEWIS E, ET AL. Cerebrospinal fluid total protein cannot reliably distinguish true subarachnoid haemorrhage from other causes of raised cerebrospinal fluid net bilirubin and net oxyhaemoglobin absorbances. Ann Clin Biochem An Int J Biochem Lab Med. 2014;51(número):657-61. [ Links ]
29. ARIMA H, TZOURIO C, ANDERSON C, WOODWARD M, BOUSSER MG, MACMAHON S, ET AL. Effects of perindopril-based lowering of blood pressure on intracerebral hemorrhage related to amyloid angiopathy: The progress trial. Stroke. 2010;41(número):394-6. [ Links ]
30. BIFFI A, HALPIN A, TOWFIGHI A, GILSON A, BUSL K, ROST N, ET AL. Aspirin and recurrent intracerebral hemorrhage in cerebral amyloid angiopathy. Neurology. 2010;75(número):693-8. [ Links ]
31. Shelton JS, Davis LT, Peebles RS, Tillman BF, Mobley BC. Cerebral Amyloid Angiopathy Presenting with Synchronous Bilateral Intracerebral Macrohemorrhages. Case Rep Neurol. 2015;7(3):233-7. [ Links ]
32. ISHII M, LAVI E, KAMEL H, GUPTA A, IADECOLA C, NAVI BB. Amyloid β-Related Central Nervous System Angiitis Presenting With an Isolated Seizure. The Neurohospitalist. 2014;4(2):86-9. [ Links ]
33. DE LA RIVA P, MORENO F, CARRERA N, BARANDIARÁN M, ARRUTI M, MARTÍ-MASSÓ JF. Respuesta al tratamiento con corticoides en un caso de angiopatía amiloide inflamatoria sin realización de biopsia. Rev Neurol. 2012;55(7):408-12. [ Links ]
34. CROSTA F, ORLANDI B, DE SANTIS F, PASSALACQUA G, DIFRANCESCO JC, PIAZZA F, ET AL. Cerebral Amyloid Angiopathy-Related Inflammation: Report of a Case with Very Difficult Therapeutic Management. Case Rep Neurol Med. 2015;2015(número):1-5. [ Links ]
35. GARCÍA D, GARCÍA R NB, T MM AND H. Hemorragia subaracnoidea espontánea de la convexidad cerebral: una serie clínica de 3 pacientes asociada con angiopatía amiloide cerebral. Neurología. 2008;(volumen-número):1-6. [ Links ]