Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Neurológica Colombiana
Print version ISSN 0120-8748
Acta Neurol Colomb. vol.32 no.4 Bogotá Oct./Dec. 2016
https://doi.org/10.22379/24224022118
https://doi.org/10.22379/24224022118
Revisión
Rivastigmina parches sola o combinada con memantina, comparada con memantina sola en pacientes con enfermedad de Alzheimer moderada y severa: revisión sistemática de la literatura
Rivastigmine patches alone or combined with memantine compared with memantine alone in patients with moderate to severe Alzheimer's disease: Systematic review of the literature
Margarita Otálora-Esteba (1), Carolina García-Alfonso (2), Mario Velasco (3), Laura Baquero (4), Camilo Castañeda-Cardona (5), Diego Rosselli (6)
(1) Médica general, asistente de investigación, Departamento de Epidemiología y Bioestadística, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá, Colombia
(2) Residente de neurología, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá, Colombia
(3) Médico general, Servicio de Urgencias, Hospital Universitario San Ignacio, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá, Colombia
(4) Estudiante de medicina, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá, Colombia
(5) Gerente de proyectos, Neuro Economix, Bogotá, Colombia
(6) Profesor asociado, Departamento de Epidemiología y Bioestadística, Facultad de Medicina, Pontificia Universidad Javeriana, Bogotá, Colombia
Recibido: 13/06/16. Aceptado: 17/11/16.
Correspondencia: Diego Rosselli, diego.rosselli@gmail.com
Resumen
Introducción: la enfermedad de Alzheimer (EA), una condición neurodegenerativa irreversible y progresiva, es la causa más frecuente de demencia y genera una gran carga económica anual. El objetivo de este estudio fue realizar una revisión sistemática de la literatura para determinar la seguridad y eficacia de rivastigmina parche, sola o en combinación con memantina, comparadas con la memantina en monoterapia para el tratamiento de la EA moderada y severa.
Métodos: se realizó una búsqueda sistemática de la literatura. Se incluyeron estudios clínicos controlados aleatorizados de pacientes con diagnóstico de EA moderada a severa, evaluando los desenlaces de eficacia y seguridad.
Resultados: los resultados de los estudios experimentales que comparan dosis de rivastigmina en parche, indican una posible diferencia en algunos desenlaces de eficacia, tales como desempeño de las actividades diarias, actividades instrumentales y funcionamiento general en pacientes con EA moderada y severa, sin diferencia significativa en los desenlaces de seguridad. Se observó una tendencia a favor de la terapia combinada en algunos desenlaces como cambio en puntuación de MMSE y actividades diarias instrumentales.
Discusión: la evidencia disponible apoya el uso de rivastigmina, y la combinación con memantina parece una opción terapéutica apropiada en casos seleccionados.
Palabras clave: enfermedad de Alzheimer, inhibidores de colinesterasa, memantina, resultado de tratamiento, revisión, seguridad de productos para el consumidor (DeCS).
Summary
Introduction: Alzheimer's disease (AD), an irreversible, progressive neurodegenerative condition, is the most common cause of dementia and generates a high economic burden. The aim of this study was to conduct a systematic review of the literature to determine the safety and efficacy of rivastigmine patch, alone or in combination with memantine, compared with memantine monotherapy for the treatment of moderate to severe AD.
Methods: A systematic search of the literature was conducted. Including randomized controlled trials of patients diagnosed with moderate to severe AD, evaluating outcomes of effectiveness and safety.
Results: The results of experimental studies comparing doses of rivastigmine patches indicate a possible difference in some of the outcomes of effectiveness such as performance in activities of daily living, instrumental activities, and overall functioning, in patients with moderate and severe AD, without significant difference in safety outcomes. A trend in favor of combination therapy in some of the outcomes, as change in MMSE score and instrumental daily activities, was observed.
Discussion: The available evidence supports the use of rivastigmine, and the association with memantine seems an appropriate therapeutic option in selected cases.
Key words: Alzheimer disease, holinesterase inhibitors, consumer product safety, memantine, review, treatment outcome (MeSH).
Introducción
La enfermedad de Alzheimer (EA) es la principal causa de demencia1,2. En Estados Unidos, se estima una prevalencia de 11 % en personas mayores de 65 años, y 32 % en mayores de 85. La Asociación Americana de Alzheimer estima que el costo en Estados Unidos para el año 2013 fue de 203 mil millones de dólares, con un costo promedio por paciente mayor de 65 años, en el programa Medicare en 2012, de 45.657 dólares3.
En Colombia, se estimó que con precios constantes de 2013, los costos del tratamiento total a ocho años serían de $33 millones de pesos sin cuidador y $99 millones de pesos incluyendo los gastos del cuidador. Adicionalmente, se estimó que el costo mínimo directo anual de la enfermedad estaría en el orden de 116 a 140 mil millones de pesos de 20134.
En general, los trastornos cognitivos aumentan su prevalencia como resultado del envejecimiento progresivo de la población. Entre 2001 y 2014 se estima que se duplicó el número de casos en países desarrollados, mientras que en países en vía de desarrollo este valor se habría cuadruplicado5,6. Por estas razones hay una necesidad creciente de tratamientos que retrasen la progresión del déficit cognitivo a mediano y largo plazo7,8.
El objetivo de este trabajo fue realizar una revisión sistemática de la literatura para determinar la seguridad y eficacia de rivastigmina parche (Exelon®) sola o en combinación con memantina, comparadas con la memantina en monoterapia, para tratamiento de EA moderada y severa.
Materiales y Métodos
Se realizó una búsqueda de la literatura en: Medline, Embase, Cochrane Database of Systematic Reviews, Lilacs, Cochrane Central Register of Randomized Controlled Trials, Cochrane Database of Abstracts of Reviews of Effects, Clinicaltrials.gov y WHO ICTRP platform. Los criterios de búsqueda en texto libre utilizados fueron "Alzheimer" y "rivastigmine", sin ninguna restricción aplicada. Adicionalmente se realizó una búsqueda en "bola de nieve" de las referencias de los artículos seleccionados.
Se incluyeron estudios clínicos controlados aleatorizados que compararan rivastigmina parche de cualquier posología, ya fuera sola o combinada con memantina, con la memantina en monoterapia, en pacientes con diagnóstico de EA moderada a severa por criterios clínicos (NINCDS-ADRDA) y radiológicos9 y puntuación MMSE. En los estudios que incluyeran EA leve, estos pacientes no fueron tenidos en cuenta. Los estudios debían evaluar desenlaces de eficacia medida a través de escalas específicas para evaluación de actividades diarias (ADCS-ADL-SIV, ADCS-ADL, ADCS-IADL)10,11, función cognitiva (ADAS-Cog, MMSE)12-14, impresión clínica de cambio (CIBIC, CIBIC-plus, CGIC)15-17, severidad de la demencia (NPI)18,19, lenguaje (SIB, VFT)20-22 y otros componentes23-25; así como seguridad (presencia de efectos adversos, descontinuación por efectos adversos y muerte). Fueron excluidos los estudios dirigidos a la evaluación de subpoblaciones de pacientes, o que incluyeran en la muestra pacientes con demencia de otras causas.
Después de eliminar duplicados, las referencias fueron tamizadas por título y resumen por cuatro revisores de forma independiente; los desacuerdos se resolvieron mediante consenso. Se revisaron los textos completos verificando los criterios de inclusión y exclusión para la selección definitiva.
Por medio de la herramienta riesgo de sesgo de la colaboración Cochrane (ECA) se evaluó la calidad de los artículos incluidos y se extrajo la información siguiendo los lineamientos del manual metodológico del Instituto de Evaluación de Tecnologías en Salud (IETS) de Colombia para la realización de evaluaciones de eficacia y seguridad26,27.
La metodología y los resultados obtenidos se sometieron a la evaluación de un panel de cuatro neurólogos y dos geriatras para la validación y contextualización de los hallazgos.
Resultados
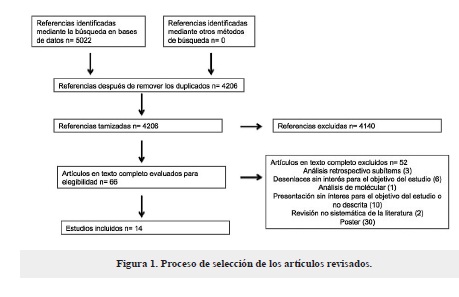
De la búsqueda de la literatura en las 8 bases de datos descritas, 14 referencias cumplieron los criterios de inclusión y exclusión (figura 1). Todos los estudios, menos uno (35) mostraban resultados de eficacia, e igualmente todos, menos uno (38) presentaban resultados de seguridad. Los resultados obtenidos sobre la eficacia de la monoterapia con parches y la combinación con memantina fueron heterogéneos, dado que se encontraron múltiples comparaciones y desenlaces primarios diferentes con distintas herramientas de medición. Al someter los resultados a la evaluación por el panel de expertos se determinó que los desenlaces de mayor interés eran: cambio en el puntaje de ADCS-ADL, ADAS-ADL-SIV, ADAS-Cog, y SIB, así como los eventos adversos serios (desenlaces críticos según calificación GRADE).
Eficacia
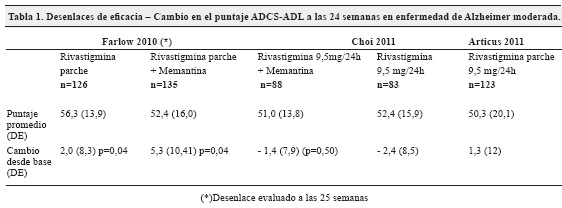
De los 7 estudios que evaluaron la eficacia y seguridad de la intervención en EA moderada solo dos evaluaron el desempeño de las actividades diarias con la escala ADCS-ADL. Los resultados no son concluyentes acerca de la superioridad de la monoterapia sobre la terapia combinada o viceversa28,29 (tabla 1).
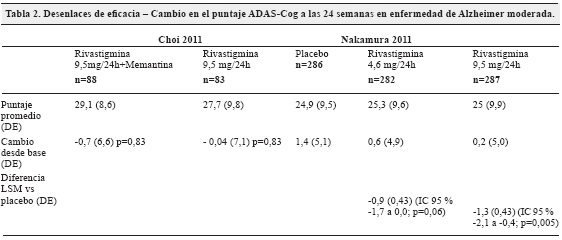
La comparación de rivastigmina en parches de 4,6 mg/24h (5 cm2) y 9,5 mg/24 h (10 cm2) contra placebo mostró un cambio en el puntaje ADAS-Cog estadísticamente significativo a favor de la rivastigmina a las 24 semanas, con una leve superioridad del parche de 10 cm230. Mientras que la comparación de rivastigmina en monoterapia (parches de 4,6 mg/24h (5 cm2) y 9,5 mg/24 h (10 cm2)) contra la terapia combinada con memantina de 20 mg no mostró una diferencia estadísticamente significativa29 (tabla 2).
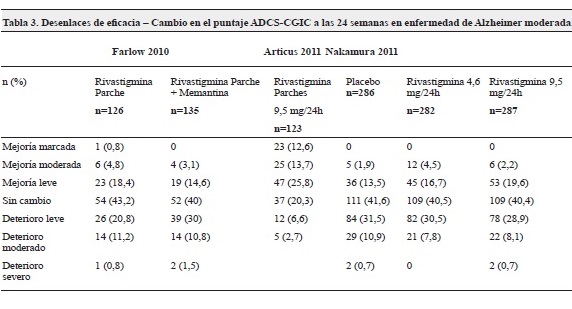
Sobre la eficacia del uso concomitante de memantina no se observaron cambios estadísticamente significativos en los desenlaces ADCS-CGIC y MMSE a las 24 semanas30,31 y 25 semanas29 (tablas 3,4).
La comparación de rivastigmina en parches de 4,6 mg/24h y 9,5 mg/24h contra placebo mostró una tendencia favorable en el puntaje CIBIC-Plus con un OR de 1,34 (IC 95 % 0,98 -1,83) para rivastigmina de 4,6 mg/24h y 1,33 (IC 95 % 0,98-1,82) para parches de 9,5 mg/24 h. Así mismo, en el puntaje de la escala de Crichton modificada se observó una diferencia estadísticamente significativa en el brazo de rivastigmina de 9,5 mg/24h con un cambio promedio de 1,68 puntos; DE ± 7,43 (p=0,040)32.
La comparación de rivastigmina en monoterapia (5 cm2 y 10 cm2) contra terapia combinada con memantina de 20 mg mostró una disminución en el puntaje del inventario de agitación de Cohen Mansfield de -1,2 puntos; DE ± 6,8 (p=0,01) a favor de la monoterapia29.
En cuanto a la eficacia reportada para la EA severa, la comparación de la monoterapia con inhibidores de la colinesterasa (ICE), como rivastigmina, donepezilo y galantamina, contra la terapia combinada con memantina de liberación extendida tampoco mostró una diferencia estadísticamente significativa a las 24 semanas. En este estudio no se discriminan los resultados sobre cuál de las combinaciones es más favorable, por lo que no es posible determinar la eficacia de la asociación exclusiva con rivastigmina29.
Al comparar rivastigmina parche 13,3 mg/24h (15 cm2) contra rivastigmina parche 4,6 mg/24h (5 cm2) se observó una diferencia a favor del grupo de mayor dosis a las 24 semanas en el cambio en puntaje ADAS-ADL-SIV (-2,6 puntos; DE ±6,8; p=0,0247); así como en el cambio en el puntaje en la escala SIB (-1,6 puntos; DE ±13,5; p<0,0001).
No se observó diferencia estadísticamente significativa en el cambio en el puntaje en la escala NPI 1232. Estos resultados se mantuvieron en el estudio de extensión abierto (cambio en el puntaje ADAS-ADL-SIV de -3,9 puntos; DE ±8,0; p<0,0001 y escala SIB de -4,7; DE ±16,8; p<0;0001)1.
Sobre la percepción clínica de cambio medida con la escala ADCS-CGIC a las 24 semanas33 y 48 semanas1 no se observaron diferencias estadísticamente significativas entre los dos grupos, la mayoría de pacientes se mantuvieron sin cambios o presentaron deterioro leve. En la evaluación retrospectiva sobre el uso concomitante con memantina, el análisis ANCOVA confirmó que no hubo interacción significativa (p> 0,1) entre el tratamiento del estudio y el uso de memantina en la SIB o ADCS-ADL-SIV34.
Por otro lado, la comparación de rivastigmina en parches de 13,3 mg/24 h (15 cm2) contra parches de 9,5 mg/24 h (10 cm2) favoreció al grupo de mayor dosis en el desempeño de actividades instrumentales a las 24 y 48 semanas (cambio en el puntaje promedio en la escala ADCS-IADL de -1,5 y -4,4; así como en la escala DSLM de 1,7 (IC 95 % 0,5-2,9; p=0,005) y 2,2 (IC 95 % 0,8-3,6; p=0,002) respectivamente)7.
Se observó un cambio estadísticamente significativo a favor del parche de mayor dosis en los cambios cognitivos a las 24 semanas (cambio en el puntaje ADAS-Cog de 1,0 DSLM -1,3 (IC 95 % -2,5--2,0; p=0,027)), mientras que el cambio a las 48 semanas no fue estadísticamente significativo (p=0,227). No se observaron diferencias en el cambio en el puntaje de la NPI-107.
Sobre la comparación de ICE y memantina de liberación extendida contra la asociación de ICE y placebo no se encontraron diferencias significativas en el desempeño de actividades diarias a las 24 semanas (cambio en el puntaje ADCS-ADL de 0,7; DE ±6,9; p=0,177). Sin embargo, se observó una diferencia estadísticamente significativa en la evaluación cognitiva a favor de la terapia combinada con memantina en el mismo horizonte temporal (cambio en el puntaje SIB de 2,7; DE ±11,2; p= 0,001); en el puntaje del test de fluidez verbal o VFT (0,3 ±2,8; LSMD 0,5 (IC 95 % 0,2-0,9; p= 0,004); y en el cambio del puntaje de la escala CIBIC-Plus (3,8 ±1,2; p= 0,008)33.
Seguridad
Los eventos adversos serios reportados para las dos indicaciones (EA moderada y severa) variaron entre 0,94 % y 22,7 % (tablas 5, 6). Los estudios en escenarios clínicos reales mostraron un perfil de seguridad similar al reportado en los ensayos clínicos35,36.
Los hallazgos sugieren una asociación directamente proporcional entre el número y severidad de los eventos con respecto a la dosis administrada.
La mortalidad reportada varió entre 0,3 % y 2 %, ninguno de los casos reportados fue asociado a la administración de rivastigmina o memantina1,7,32-34,37,38.
Discusión
Los resultados de los estudios experimentales que comparan dosis de rivastigmina en parches indican que existe una posible diferencia en algunos de los desenlaces de eficacia, como desempeño en actividades de la vida diaria e instrumentales, así como el funcionamiento global en los pacientes con EA moderada y severa, sin una diferencia significativa en los desenlaces de seguridad, incluso en el seguimiento a largo plazo1,7,30,32,38,39. En cuanto a eficacia, se observó un aumento del deterioro cognitivo tanto en el grupo de la intervención como en el grupo control, hecho que los autores atribuyen al estadio avanzado de la enfermedad y a su historia natural1.
Sobre la terapia combinada con memantina existe poca información especialmente para la indicación en EA severa, los resultados del análisis retrospectivo del estudio ACTION apoyan los resultados del estudio primario en lo referente a eficacia, a favor de la dosis de 13,3 mg/24 h34. Para la indicación de EA moderada la información obtenida de los estudios no muestra diferencias en la tolerancia de la terapia combinada en comparación con rivastigmina en monoterapia36. Con respecto a los desenlaces de eficacia se observa una tendencia a favor de la terapia combinada en algunos de los desenlaces, como cambio en el puntaje de MMSE, y actividades instrumentales diarias28,29,37. Se encontró un único estudio que evaluó la eficacia de memantina de liberación extendida en combinación con ICE en comparación con placebo en pacientes con EA moderada a severa con mejoría en medidas de cognición y estado clínico global, comportamiento y fluidez verbal33.
Recientemente Cochrane publicó una revisión sistemática sobre rivastigmina en el tratamiento de EA que concluye que la intervención de rivastigmina presenta mejores resultados en comparación con placebo en los desenlaces de función cognitiva (ADAS Cog y MMSE), actividades de la vida diaria (PSA y ADCS ADL) e impresión clínica global (CIBIC plus). En la comparación entre la presentación en cápsulas y parches se encontraron diferencias significativas en los desenlaces de seguridad, especialmente los que afectan el sistema gastrointestinal, a favor de la presentación en parches40.
La pobre adherencia en las terapias prolongadas es la principal causa de fracaso terapéutico. En el caso de los pacientes con EA la adherencia representa un mayor reto, dado que el deterioro inherente a la enfermedad los hace más susceptibles41. La rivastigmina es el único ICE disponible en administración transdérmica, no inferior en eficacia a la presentación en cápsulas42, esta vía de administración supone beneficios sobre la administración oral43. Esto facilitaría la administración de dosis óptimas, disminuiría la polimedicación oral y la sobredosis accidental44. El impacto en la adherencia de la administración transdérmica fue valorado en un estudio que observó una preferencia del paciente y los cuidadores por el uso de parches; se reportó una mejor adherencia en términos de cumplimiento de dosis y facilidad para la administración41. Además podría contribuir a disminuir la carga para el cuidador en términos de tiempo y satisfacción a la hora de realizar las actividades del cuidado de los pacientes45. La heterogeneidad de los datos dificulta su interpretación, dada la gran variedad de instrumentos disponibles para la evaluación de los desenlaces en EA. Los cambios cognitivos y comportamentales en la EA son considerados dimensiones heterogéneas e independientes, y suponen un reto a la hora de su estudio, al existir un vacío en la literatura científica sobre la evaluación simultánea de las manifestaciones cognitivas y comportamentales específicas46. Existe incertidumbre sobre la correlación entre el puntaje de los instrumentos y los cambios clínicos observados por el cuidador o el médico tratante, producto de la heterogeneidad de las medidas, las diferencias inter-aplicador y las características insidiosas de la enfermedad47-49.
Los hallazgos encontrados en este estudio reúnen la evidencia disponible sobre la utilización de la terapia con rivastigmina en parches y la terapia combinada con memantina para el tratamiento de la EA moderada y severa. En resumen, aunque hacen falta estudios adicionales, la evidencia disponible apoya el uso de rivastigmina; su titulación en ascenso, y la asociación con memantina parece una opción terapéutica adecuada en casos seleccionados50. Adicionalmente se reconocen los beneficios potenciales sobre la adherencia, preferencia y administración de dosis estables por medio de la vía de administración transdérmica51,52.
Agradecimientos
A los doctores: Robinson Cuadros, Olga Lucia Pedraza, Guillermo Barrios, Noemí Mesa, María Eugenia Toro, Carlos Cano y Mauricio Medina.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Referencias
1. Farlow MR, Grossberg GT, Sadowsky CH, Meng X, Velting DM. A 24-week, open-label extension study to investigate the long-ter, safety, tolerability, adn efficacy of 13.3 mg/24 h rivastigmine patch in patients with severe Alzheimer disease. Alzheimer Dis Assoc Disord. 2015;29(2):110-6. [ Links ]
2. Thies W, Bleiler L. 2013 Alzheimer's disease facts and figures. Alzheimer's Dement. 2013;9(2):208-45. [ Links ]
3. Alzheimer's, Association. 2010 Alzheimer's disease facts and figures. Alzheimer's Dement. 2010;6(2):158-94. [ Links ]
4. Prada SI, Takeuchi Y, Ariza Y. Costo monetario del tratamiento de la enfermedad de Alzheimer en Colombia. Acta Neurol Colomb. 2014;30(1):247-55. [ Links ]
5. Allegri RF, Arizaga RL, Bavec C V, Colli LP, Demey I, Golimstok Á, et al. Enfermedad de Alzheimer. Guía de práctica clínica. Neurol Arg. 2011;3(2):120-37. [ Links ]
6. Ferri CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguli M, et al. Global prevalence of dementia: a Delphi consensus study. Lancet. 2005;366(9503):2112-7. [ Links ]
7. Cummings J, Froelich L, Black SE, Bakchine S, Bellelli G, Molinuevo JL, et al. Randomized, double-blind, parallel-group, 48-week study for efficacy and safety of a higher dose rivastigmine patch (15 vs. 10 cm2) in Alzheimer's disease. Dement Geriatr Cogn Disord. 2012;33(5):341-53. [ Links ]
8. Ruiz de Sánchez C, Nariño D, Muñoz Cerón JF. Epidemiología y carga de la enfermedad de Alzheimer. Acta Neurol Colomb. 2010;26(Sup 3:1):87-94. [ Links ]
9. Súarez-Revelo X, Ochoa-Gomez JF, Tobón-Quintero CA, Duque-Grajales JE. Conectividad funcional en adultos mayores a partir de resonancia magnética funcional como un posible indicador para la enfermedad de Alzheimer. Acta Neurol Colomb. 2014;30:273-81. [ Links ]
10. Robert P, Ferris S, Gauthier S, Ihl R, Winblad B, Tennigkeit F. Review of Alzheimer's disease scales: is there a need for a new multi-domain scale for therapy evaluation in medical practice? Alzheimers Res Ther. 2010;2(4):24. [ Links ]
11. Doraiswamy PM, Kaiser L, Bieber F, Garman RL. The Alzheimer's disease assessment scale: evaluation of psychometric properties and patterns of cognitive decline in multicenter clinical trials of mild to moderate Alzheimer's disease. Alzheimer Dis Assoc Disord. 2001;15(4):174-83. [ Links ]
12. MacKenzie DM, Copp P, Shaw RJ, Goodwin GM. Brief cognitive screening of the elderly: a comparison of the Mini-Mental State Examination (MMSE), Abbreviated Mental Test (AMT) and Mental Status Questionnaire (MSQ). Psychol Med. 1996;26(2):427-30. [ Links ]
13. Rosselli D, Ardila A, Pradilla-Ardila G, Morillo L, Bautista L, Rey O, et al. El examen mental abreviado (Mini-Mental State Examination) como prueba de tamizaje para el diagnóstico de demencia: estudio poblacional colombiano. Rev Neurol. 2000;30(5):428-32. [ Links ]
14. Graham D, Cully J, Snow A, Massman P, Doody R. The Alzheimer's Disease Assessment Scale-Cognitive subscale: normative data for older adult controls. Alzheimer Dis Assoc Disord. 2004;18(4):236-40. [ Links ]
15. Sheehan B. Assesment scales in dementia. Ther Adv Neurol Disord. 2012;5(6):349-58. [ Links ]
16. Reisberg B. Global measures: utility in defining and measuring treatment response in dementia. Int Psychogeriatrics. 2007;19(3):421-56. [ Links ]
17. Busner J, Targum SD. The Clinical Global Impressions Scale: applying a research tool in clinical practice. Psychiatry (Edgmont). 2007;4(7):28-37. [ Links ]
18. Medeiros K de, Robert P, Gauthier S, Stella F, Politis A, Leoutsakos J, et al. The Neuropsychiatric Inventory-Clinician rating scale (NPI-C): reliability and validity of a revised assessment of neuropsychiatric symptoms in dementia. Int Psychogeriatrics. 2010;22(6):984-94. [ Links ]
19. Peavy GM, Salmon D, Rice V, Galasko D, Samuel W, Taylor K, et al. Neuropsychological assessment of severely demented elderly: the severe cognitive impairment profile. Arch Neurol. 1996;53(4):367-72. [ Links ]
20. Ferris S, Ihl R, Robert P, Winblad B, Gatz G, Tennigkeit F, et al. Severe Impairment Battery Language scale: a language assessment tool for Alzheimer's disease patients. Alzheimer's Dement. 2009;5(5):375-9. [ Links ]
21. Shao Z, Janse E, Visser K, Meyer AS. What do verbal fluency tasks measure? Predictors of verbal fluency performance in older adults. Front Psychol. 2014;5:772-82. [ Links ]
22. Saxton J, Kastango KB, Hugonot-Diener L, Boller F, Verny M, Sarles CE, et al. Development of a short form of the Severe Impairment Battery. Am J Geriatr Psychiatry. 2005;13(11):999-1005. [ Links ]
23. Lock A, Nielsen H, Kragh-Sørensen P. Procedures in evaluating dementia - A study of conjoint application of two rating scales (SCAG and BCRS) and psychometric tests. Acta Psychiatr Scand. 1998;78(5):592-8. [ Links ]
24. Salthouse TA. What cognitive abilities are involved in trail-making performance? Intelligence. 2011;39(4):222-32. [ Links ]
25. Donaldson C, Atkinson A, Bond J, Wright K. QALYs and long-term care for elderly people in the UK: Scales for assesment of quality of life. Age Ageing. 1988;17(6):379-87. [ Links ]
26. Díaz M, Peña E, Mejía A, Flórez I. Manual para la elaboración de evaluaciones de efectividad, seguridad y validez diagnóstica de tecnologías en salud. Bogotá DC: Instituto de Evaluación Tecnológica en Salud - IETS; 2014. [ Links ]
27. Liberati A, Altman DG, Tetzlaff J, Mulrow C, Gøtzsche PC, Ioannidis JPA, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. J Clin Epidemiol. 2009;62(10):e1-34. [ Links ]
28. Choi SH, Park KW, Na DL, Han HJ, Kim E-J, Shim YS, et al. Tolerability and efficacy of memantine add on therapy to rivastigmine transdermal patches in mild to moderate Alzheimer's disease: a multicenter, randomized, open-label, parallel-group study. Curr Med Res Opin. 2011;27(7):1375-83. [ Links ]
29. Farlow MR, Alva G, Meng X, Olin JT. A 25-week, open-label trial investigating rivastigmine transdermal patches with concomitant memantine in mild-to-moderate Alzheimer's disease: a post hoc analysis. Curr Med Res Opin. 2010;26(2):263-9. [ Links ]
30. Nakamura Y, Imai Y, Shigeta M, Graf A, Shirahase T, Kim H, et al. A 24 week, randomized, double blind, placebo controlled study to evaluate the efficacy, safety and tolerability of the rivastigmine patch in Japanese patients with Alzheimer's disease. Dement Geriatr Cogn Dis Extra. 2011;1(1):163-79. [ Links ]
31. Articus K, Baier M, Tracik F, Kühn F, Preuß UW, Kurz A, et al. A 24-week, multicentre, open evaluation of the clinical effectiveness of the rivastigmine patch in patients with probable Alzheimer's disease. Int J Clin Pract. 2011;65(7):790-6. [ Links ]
32. Farlow MR, Grossberg GT, Sadowsky CH, Meng X, Somogyi M. A 24-week, randomized, controlled trial of rivastigmine patch 13.3 mg/24 h versus 4.6 mg/24 h in severe Alzheimer's dementia. CNS Neurosci Ther. 2013;19(10):745-52. [ Links ]
33. Grossberg GT, Manes F, Allegri RF, Gutiérrez-Robledo LM, Gloger S, Xie L, et al. The safety, tolerability, and efficacy of once-daily memantine (28 mg): A multinational, randomized, double blind, placebo controlled trial in patients with moderate to severe alzheimer's disease taking cholinesterase inhibitors. CNS Drugs. 2013;27(6):469-78. [ Links ]
34. Grossberg GT, Farlow MR, Meng X, Velting DM. Evaluating high dose rivastigmine patch in severe Alzheimer's sisease : Analyses with concomitant memantine usage as a factor. Curr Alzheimer Res. 2015;12(10):53-60. [ Links ]
35. Kulkantrakorn K, Tanyakitpisal P, Towanabut S, Dejthevaporn C, Rangseekajee P, Pongpakdee S, et al. Rivastigmine patch for treatment of Alzheimer's disease in clinical practice in Thailand. Psychogeriatrics. 2013;13(1):1-8. [ Links ]
36. Safirstein B, Meng X, Olin JT. Rivastigmine and concomitant memantine in alzheimer's disease: Safety and tolerability. CNS Spectr. 2010;15(9):594-8. [ Links ]
37. Gareri P, Putignano D, Castagna A, Cotroneo AM, DePalo G, Fabbo A, et al. Retrospective study on the benefits of combined memantine and cholinesterase inhibitor treatment in aged patients affected with Alzheimer's disease: The MEMAGE Study. J Alzheimers Dis. 2014;41(2):633-40. [ Links ]
38. Micca JL, Galvin JE, Velting DM, Meng X. Efficacy of 13.3 mg/24 h versus 4.6 mg/24 h rivastigmine patch on activities of daily living in severe Alzheimer's disease. SAGE Open Med. 2014;2(2050312114561569):1-7. [ Links ]
39. Seibert J, Tracik F, Articus K, Spittler S. Effectiveness and tolerability of transdermal rivastigmine in the treatment of Alzheimer's disease in daily practice. Neuropsychiatr Dis Treat. 2012;8:141-7. [ Links ]
40. Birks JS, Evans JG. Rivastigmine for Alzheimer's disease. Cochrane Database Syst Rev. 2015;(4):1-197. [ Links ]
41. Molinuevo JL, Arranz FJ. Impact of transdermal drug delivery on treatment adherence in patients with Alzheimer's disease. Expert Rev Neurother. 2012;12(1):31-7. [ Links ]
42. Winblad B, Cummings J, Andreasen N, Grossberg G, Onofrj M, Sadowsky C, et al. A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer's disease - rivastigmine patch versus capsule. Int J Geriatr Psychiatry. 2007;22(5):456-67. [ Links ]
43. Kurz A, Farlow M, Lefèvre G. Pharmacokinetics of a novel transdermal rivastigmine patch for the treatment of Alzheimer's disease: a review. Int J Clin Pract. 2009;63(5):799-805. [ Links ]
44. Mercier F, Lefèvre G, Huang H-LA, Schmidli H, Amzal B, Appel-Dingemanse S. Rivastigmine exposure provided by a transdermal patch versus capsules. Curr Med Res Opin. 2007;23(12):3199-204. [ Links ]
45. Adler G, Mueller B, Articus K. The transdermal formulation of rivastigmine improves caregiver burden and treatment adherence of patients with Alzheimer's disease under daily practice conditions. Int J Clin Pract. 2014;68(4):465-70. [ Links ]
46. Spalletta G, Baldinetti F, Buccione I, Fadda L, Perri R, Scalmana S, et al. Cognition and behaviour are independent and heterogeneous dimensions in Alzheimer's disease. J Neurol. 2004;251(6):688-95. [ Links ]
47. Cano Gutiérrez CA, Matallana Eslava DL, Reyes Gavilán P, Montañés Ríos P. Cambios en las actividades instrumentales de la vida diaria en la enfermedad de Alzheimer. Acta Neurol Colomb 2010;26:Sup(3:1):112-21. [ Links ]
48. Schulz R, O'Brien A, Czaja S, Ory M, Norris R, Martire LM, et al. Dementia caregiver intervention research: in search of clinical significance. Gerontologist. 2002;42(5):589-602. [ Links ]
49. Guyatt GH, Osoba D, Wu AW, Wyrwich KW, Norman GR. Methods to explain the clinical significance of health status measures. Mayo Clin Proc. 2002;77(4):371-83. [ Links ]
50. Atri A, Shaughnessy LW, Locascio JJ, Growdon JH. Long-term course and effectiveness of combination therapy in Alzheimer disease. Alzheimer Dis Assoc Disord. 2008;22(3):209-21. [ Links ]
51. Cagnin A, Cester A, Costa B, Ermani M, Gabelli C, Gambina G. Effectiveness of switching to the rivastigmine transdermal patch from oral cholinesterase inhibitors: a naturalistic prospective study in Alzheimer's disease. Neurol Sci. 2014;36:457-63. [ Links ]
52. Dhillon S. Rivastigmine transdermal patch. Drugs. 2011;71(9):1209-31. [ Links ]