INTRODUCCIÓN
La distonía es un trastorno del movimiento hipercinético caracterizado por contracciones musculares sostenidas o intermitentes que producen movimientos y posturas anormales, repetitivas, que puede llevar a movimientos complejos y sostenidos, en algunos casos con características de ritmicidad, patrón y asociados a dolor. Usualmente afecta la calidad de vida y la funcionalidad.
También se describen en distonías focales o segmentarias, trucos sensoriales que pueden ayudar a reducir la amplitud del movimiento y a aliviar el dolor y posturas 1.
La distonía puede clasificarse etiológicamente en trastornos primarios (o hereditarios) y secundarios, como manifestación de una enfermedad neurológica o lesión cerebral. En el capítulo de la clasificación actual de las distonías de este consenso se revisa con más detalle este tema 2.
El tratamiento de la distonía depende de su distribución; las distonías focales o segmentarias son mejor tratadas con toxina botulínica y las distonías generalizadas pueden ser tratadas con medicamentos orales o terapias quirúrgicas en casos específicos. El objetivo de este capítulo es revisar las opciones quirúrgicas enfocadas en la estimulación cerebral profunda (ECP), donde debemos tener en cuenta los requisitos con base en la evidencia actual. Otras opciones que se deben tener en cuenta en casos muy selectivos, son la lesión de globo pálido interno, denervación periférica de raíces nerviosas (rizotomía), lesión selectiva de divisiones primarias de raíces cervicales (ramisectomía), denervación supraselectiva, o procedimientos de lesión muscular como miotomía o miectomía 3,4.
HISTORIA
Una de las primeras aproximaciones quirúrgicas para la distonía fue la miotomía, que se realizó por primera vez en 1642 para el tratamiento del compromiso cervical cortando el músculo esternocleidomastoideo. Posteriormente se intentó la neurectomía periférica selectiva del músculo hiperactivo. Este tipo de cirugías tenían como objetivo denervar los músculos distónicos, tratando de preservar su funcionalidad, objetivo que casi nunca se lograba. Con el paso del tiempo la miotomía y la neurectomía se tornaron en procedimientos raramente ofrecidos como opciones terapéuticas debido a su asociación con múltiples efectos secundarios como debilidad y disfagia.
Las opciones quirúrgicas a nivel cerebral se basan en ablaciones focales en partes profundas del cerebro, incluyendo globus pallidus, tálamo e incluso cerebelo, con buena respuesta clínica aunque no están exentos de complicaciones irreversibles y en algunos casos peor que la misma enfermedad 1,5. Los primeros procedimientos ablativos comenzaron en los años 30 como tratamiento alternativo para la enfermedad de Parkinson (PD). Tal vez el primer caso en el cual se realizó ablación tratando de controlar posturas distónicas se enfocó en la lesión del GPi a comienzos de los 40, para un paciente con probable corea de Huntigton. Posteriormente se hicieron lesiones tratando de controlar los movimientos hipercinéticos, en este último objetivo se observó un mejor control del temblor 5,6. Dado que la enfermedad de Parkinson era y ha sido el movimiento anormal más discapacitante y frecuente comparativamente con otros trastornos del movimiento, la opción quirúrgica se ha enfocado desde entonces en esta patología. Cuando se introdujo la levodopa en los años 60, la eficacia de la medicación llevó a que se perdiera interés por la cirugía al menos por unos años. A mediados de los 70 y comienzos de los 80 los efectos secundarios con el fenómeno de fin de dosis anticipado, las discinesias y otras complicaciones volvieron a enfocar nuevamente la atención en la búsqueda de otras maneras de controlar la progresión de la enfermedad 7.
En los años 60 y 70, en los laboratorios de investigación se empezó a realizar el microregistro de las áreas profundas del cerebro, logrando diferenciar los diferentes tipos de frecuencia y amplitud de las ondas 6. Con este instrumento a mediados de los 80 se implantaron los primeros electrodos y se realizaran pruebas de ECP, observándose control del temblor en pacientes con EP, tomando fuerza nuevamente la cirugía, llevando a que en la actualidad sea una opción nivel 1 A en pacientes con EP.
En cuanto a la distonía, el primer caso implantado se realizó en 1996 por el Dr. Philippe Coubes, neurocirujano londinense, cuando a un paciente con estatus distonicus incontrolable, lo llevó a implante de electrodos y ECP en GPi. Los resultados fueron un éxito; 3 años después reportó una serie de 7 casos con resultados prometedores 5,8. Desde entonces múltiples series de casos y estudios con nivel de evidencia se han publicado 9,10.
Gracias al avance de la tecnología, hoy la ECP es un procedimiento seguro y eficaz en casos de distonía idiopática aislada y algunas de origen genético como la DYT1, pero también en algunos casos de distonía segmentaria y secundaria. Se han publicado múltiples estudios, la mayoría de ellos aplicando escalas validadas antes y después del procedimiento como la Burke-Fahn-Marsden Dystonia Rating Scale (BFMDRS) y la Toronto Western Spasmodic Torticollis Rating Scale (TWSTRS) 9-11.
Evidencia y soportes
Actualmente la ECP del GPi es un procedimiento que ha sido aprobado por la Food and Drug Administration (FDA) y European Medicinal Agency (EMA) para la distonía generalizada como tratamiento compasivo. La recomendación es nivel IB, con grado de recomendación A, apoyado en varios ensayos clínicos de distonías generalizadas de origen genético (DYT1). Para este tipo de distonías se ha aplicado la escala BFMDRS, con evaluación ciego y con video, y con evaluación doble ciego con estimulación falsa o simulada, después de 3 meses de seguimiento 12,13. Los seguimientos con ensayos abiertos al año, 3, 5 y 10 años, corroboran a largo plazo la mejoría no solo de la parte motora, sino también de la funcionalidad y calidad de vida 14-17.
Un estudio multicéntrico, controlado aleatorizado, reclutó 40 pacientes con distonía primaria (DP) o segmentaria, en el cual la ECP de GPi demostró una mejora significativa a los 3 meses de seguimiento frente a la estimulación fingida aplicando la escala BFMDRS (-15,8 ± 14,1 puntos) 13. En otro estudio multicéntrico, francés, prospectivo y controlado incluyó a 22 pacientes con DP, usando la misma escala mostró una mejoría del 51 % que se mantuvo a los 3 años de seguimiento 12.
Alemania, Noruega y Austria aportaron 62 pacientes para otro estudio con distonía cervical (DC) refractaria a tratamiento. La escala usada fue la TWSTRS y la evaluación fue estimulación real versus fingida por los primeros tres meses, mostrando beneficio con significancia estadística (-5*1 points [SD 5*1], 95 % CI -7*0 to -3*5 para el grupo activo vs (-1*3 [2*4], -2*2 to -0*4, p=0*0024 para estimulación fingida), con una media de diferencia entre los dos grupos de 3*8 puntos 17.
Los mismos autores de los artículos anteriores, publicaron una serie de 55 pacientes, 6 con DYT6, 9 con DYT1 y 38 con distonías aisladas idiopáticas, quienes fueron llevados a ECP evaluados antes y después de la cirugía con la escala BFMDRS. Los resultados mostraron beneficios del 30 %, 60 % y 52 % respectivamente con seguimiento temprano (1-16 meses) y del 42 %, 44 % y 60 % con el seguimiento tardío (22-92 meses) 18.
Otra diana que se ha utilizado en ECP para distonía es el núcleo subtalámico (NST). En un estudio prospectivo, 9 pacientes con distonía cervical primaria reportaron una mejoría en la TWSTRS con una media de 53.1 (± 2,57) pasando a 19,6 (± 5,48) a los 12 meses 19. El mismo autor publica el seguimiento a 36 meses con 20 pacientes usando tanto la escala anotada como la BFMDRS, con mejoría a los 36 meses en 66 % con la primera y 70 % con la segunda, mostrando resultados muy parecidos a los obtenidos a los 6 meses. Al mismo tiempo comparando las escalas se observa que ambas son reproducibles 20. Esto se correlaciona con otras series de casos que han reportado resultados similares donde además se observa que no solo mejoran las posturas anormales, sino también la calidad de vida, sin afectar las funciones cognitivas 21-25.
En cuanto a otros tipos de distonía, varios estudios han demostrado que los pacientes con distonía mioclonus y distonía tardía tienen un buen resultado 26. La evidencia de mejoría en la gravedad y la discapacidad con DBS es alrededor del 50 a 60 % según la escala de distonía de Burke-Fahn-Marsden (BFM) 26,27. Los resultados combinados de múltiples estudios publicados, arrojó una cifra de 466 pacientes, para todo tipo de distonía, mostrando que el porcentaje medio de mejoría de todo el grupo fue del 60,7 %. Dentro de este grupo, los 91 pacientes con distonía DYT1 positivo tuvieron el mayor porcentaje de mejoría, mientras que para distonías secundarias varió entre 17 y 90 % de beneficio con un rango muy variable, encontrando que las de peor pronóstico fueron las secundarias a encefalopatía y las de mejor respuesta las distonías tardías 28. Otra revisión más reciente muestra no solo el tiempo de evolución de las diferentes distonías, sino que también muestra la respuesta con ECP en otras dianas como tálamo para distonía mioclonus 21. En una publicación de 10 pacientes, reportaron mejoría en ambos síntomas tanto a corto (47 %) como a largo plazo (48 %) 29. En otro estudio de mioclonus-dystonia genéticamente probado, se observó que tanto el mioclonus como la distonía mejoraron entre el 60 y 90 % basados en la Unified Myoclonus Rating Scale30.
Una serie de pacientes con distonía segmentaria que no mejoraron con denervación periférica, fueron llevados a ECP de GPi, con mejoría del 57,5 % según la TWSTRS (p <0,05) y en un 69,5 % según BFMDRS (p <0,05) con seguimiento promedio de 40,5 meses 31. En el estudio multicéntrico canadiense de ECP en distonía cervical, acorde a la escala TWSTRS, la mejoría motora fue de aproximadamente el 59 %, mejorando también la calidad de vida y disminuyendo la depresión 32. La mayoría de los estudios realizados donde se aplica la escala BFMDRS como parámetro de medición (en total 24 con 523 pacientes), son recopilados en un meta-análisis, mostrando que los cambios en el porcentaje y el total absoluto mejoran la función motora y la discapacidad. En el mismo metanálisis, todos los estudios con menos de 10 pacientes fueron excluidos e igualmente se evitó hacer análisis donde se encontraran pacientes incluidos en publicaciones donde se pudiesen repetir los resultados 33.
En cuanto al síndrome de Meige refractario, varias publicaciones muestran que la ECP puede ser una opción. Aunque son series de casos y se ha usado principalmente GPi, en un estudio con 75 pacientes que fueron llevados a ECP en GPi o STN, la mejoría acorde a la BFMDRS fue de 66,9 % a los 30 meses 34, mientras que en otro estudio de 15 pacientes, evaluado retrospectivamente, muestran que la ECP en NST es efectiva, disminuyendo un 74 % acorde a la BFMDRS 35.
Para la distonía tardía hay múltiples reportes de series de casos y casos donde se muestra beneficio con la estimulación en GPi. En las series de Vidailhet y Volkmann, se reportan varios casos 14,15. En otro estudio retrospectivo se observó mejoria acorde a la BFMDRS total en un 85,1 ± 13,5 % 36-37. Otra serie de casos de 10 pacientes con seguimiento a 65,6±30,4 meses, se observó disminución en el puntaje de la BFMDRS en subescalas de movilidad y discapacidad en un 87 % ± 17 y 84% ± 22, encontrando que además mejoran escalas de calidad de vida, depresión y ansiedad 38.
Por último, las distonías secundarias y asociadas a enfermedades metabólicas, las cuales muestran componente motor, cognitivo, afectivo y neuropsiquiátrico, tienen una complejidad variable, secundaria a múltiples etiologías. También debemos tener en cuenta que el componente motor no es solo distonía, en la gran mayoría tienen sintomatología parkinsoniana, coreico, temblor e incluso balismo y atáxico. Hay múltiples reportes de casos y series de casos con beneficio variable y poco objetivo puesto que no hay una herramienta que evalúe realmente el beneficio 39-41.
Otras distonías menos frecuentes, tales como calambre del escribano, distonía de Lubag (DYT3), hemidistonía vascular, han sido llevadas a cirugía reportando beneficio 42-45.
Aunque GPi y STN son los principales dianas quirúrgicas en la distonía, el hecho es que la estimulación puede producir efectos secundarios como bradicinesia, disartria, trastornos de la marcha, disminución cognitiva y aumento de peso entre otros. Esta es la razón por la cual hay un creciente interés en buscar otros objetivos posibles 46.
Selección de pacientes y factores pronóstico
Con la experiencia de más de 2 décadas y con cientos de pacientes llevados a cirugía, podemos dejar en claro varios puntos.
Los datos epidemiológicos reflejan resultados clínicos evidentes según cada caso, y aunque en algunos pacientes el cambio parece ser pequeño (a mayor puntaje en la escala menor porcentaje de cambio), el impacto en la funcionalidad y la calidad de vida merece ser analizado por separado 33. Si aplicamos la validez estadística, los cambios en las puntuaciones y el nivel de evidencia, la ECP del GPi se establece como la mejor opción para la distonía generalizada 28,33.
Para que un paciente se considere candidato a cirugía debe cumplir con los siguientes requisitos 47:
1) Diagnóstico inequívoco de distonía realizado por un neurólogo de trastornos del movimiento.
2) Evidencia de fracaso con medicamentos orales, sin respuesta a toxina botulínica o contraindicación a la misma.
3) Discapacidad significativa, a pesar del manejo médico óptimo.
4) Descartar otras causas potencialmente tratables (ya expuestas en capítulos de diagnóstico y tratamiento con medicamentos).
5) Descartar contraindicaciones al procedimiento tales como, pobre pronóstico, compromiso afectivo o psicótico no controlado.
6) Contar con el apoyo de la familia y aceptación clara, manifiesta y firmada por el paciente o su tutor. Las expectativas de los pacientes deben ser claras y reales y así mismo debe explicársele concienzudamente al paciente tanto el probable beneficio como las probables complicaciones
Adicionalmente se ha recomendado que todos los pacientes sean evaluados por un grupo multidisciplinario conformado para cirugía de trastornos del movimiento, que debe contar con la participación del neurólogo especialista en trastornos del movimiento, neurocirujano funcional, psiquiatra, neuropsicólogo y terapeutas. Los objetivos del grupo son confirmar el diagnóstico y clasificar clínicamente la distonía, descartar cualquier trastorno cognitivo o psiquiátrico y buscar posibles contraindicaciones neuroquirúrgicas tales como lesión estructural o en los ganglios basales que no permitan una adecuada planeación y realización del procedimiento 21,48.
Si hay algún factor predictivo de complicación se debe controlar, entre ellos la hipertensión arterial que debe ser tratada eficazmente. A menor control de tensión, mayor riesgo de sangrado y hemorragia intracraneana.
En cuanto a factores pronóstico, adicional a la junta y al concepto realizado por el grupo de trastornos del movimiento, es bueno tener en cuenta: la edad: a medida que pase el tiempo, habrá más riesgos de complicaciones tanto a nivel central como periférico, con más retracciones osteotendinosas y menos posibilidades de recuperar posturas y funcionabilidad; el objetivo es que el paciente sea llevado a cirugía tempranamente. Las distonías de inicio infantil o juvenil (antes de los 21 años) responden mucho mejor 49.
Los pacientes con puntuaciones más altas en la escala BFMDRS pueden mostrar un puntaje de recuperación más alto, sin embargo, el porcentaje puede ser menor comparativamente con aquellos que puntúan menos; por lo que el solo puntaje o porcentaje de beneficio no es suficiente para medir el impacto final. Adicionalmente aquellos con puntajes bajos deben ser bien analizados y evaluar si realmente son candidatos para cirugía en el momento de la evaluación o se debe esperar. La terapia física ayuda a que los pacientes se mantengan funcionales y con rangos de movimiento lo más amplio posibles. A mayor discapacidad menos probabilidad de recuperación, aunque si se han mantenido los rangos de movilidad es probable que haya una mayor recuperación 50,51.
En cuanto a la etiología de la distonía, se sabe que las distonías genéticas tienen mejor pronóstico que las secundarias, los pacientes con posturas distónicas por hipoxia, hiperbilirrubinemia, toxicidad, entre otras, no responden de la misma manera 28.
En cuanto al procedimiento es claro que la colocación óptima de los electrodos en el GPi parece ser el punto más crítico. Los electrodos que quedan cerca de cápsula interna pueden tener un umbral de estimulación bajo con escaso efecto terapéutico. Aun así, hay pacientes con los electrodos colocados óptimamente que pueden tener una respuesta subóptima y necesitar implante de otro electrodo ya sea en el mismo núcleo o en otro. También es importante anotar, que el objetivo de la cirugía no es disminuir los medicamentos, aunque si se debe pensar en re-ajustarlos. Retirar medicamentos abruptamente puede llevar a complicaciones.
En el caso de estatus distónico; condición aguda e infrecuente de posturas distónicas generalizadas que involucra la función respiratoria, produce rabdomiolisis y otras complicaciones que pueden amenazar la vida. Una de las opciones terapéuticas es la ECP, dadas las pocas opciones que hay para tratar esta condición 52.
Calidad de vida
La distonía afecta múltiples aspectos de la vida del individuo. Las distonías deformantes, producen dolor e interfieren con las funciones de la vida diaria y básicas cotidianas, comprometiendo la interacción social y el afecto del paciente.
Diferentes escalas se han utilizado para evaluar el impacto de este trastorno del movimiento en la calidad de vida (Funcionamiento físico, psicológico, social y ocupacional 53.
En un estudio acerca del impacto de la distonía utilizando las medidas SF-36 y EuroQol en 130 adultos con diversas formas de distonía, mostró que el EuroQol reveló resultados significativamente inferiores en casi todos los aspectos en comparación con la población general, mientras que el SF 36 no tuvo significación estadística 54. Otro estudio comparó la calidad de vida en pacientes antes y después de la cirugía, mostrando mejoría del 36% en el funcionamiento físico, el dolor, la vitalidad, la interacción social y en la subescala general de salud mental utilizando la Escala SF 36 55.
FACTORES A TENER EN CUENTA
Manejo postoperatorio
El uso de antibióticos que usualmente se inician en el preoperatorio inmediato, no se recomienda por tiempo prolongado y se sugiere suspender en el posoperatorio inmediato.
En cuanto a la hospitalización, varía ampliamente de región a región. Es así como en Europa pueden tener al paciente hospitalizado hasta tres semanas después de la cirugía, cuando están seguros de la adecuada cicatrización y el inicio de la programación. En la contraparte están los norteamericanos, quienes le dan salida al día siguiente de la cirugía si no ha habido algún evento que obligue a mantener al paciente hospitalizado. Es claro que al paciente se le deben dar indicaciones de cuidado, explicar riesgos y signos de infección y manejar adecuadamente el dolor.
Neuroimágenes
Al igual que en otras cirugías en las que se requiere implante de electrodos, se sugiere hacer una neuroimagen de control en el posoperatorio inmediato, entre otras razones para observar la posición de electrodos, revisar probables efectos indeseables como sangrados, neumoencéfalo, edema, y en caso de futuro desplazamiento o ruptura del electrodo tener un patrón de referencia. ¿Cuál neuroimagen usar?, ya sea tomografia o resonancia, depende del criterio del neurocirujano y de las especificaciones que le permita el generador.
Algunos programas, permiten que las neuroimágenes del posoperatorio sean fusionadas con los realizados antes de la cirugía y así evaluar con exactitud el sitio donde quedó implantado el electrodo.
La compatibilidad de sistemas de neuroestimulación con resonancia debe ser verificadas para cada uno de los dispositivos.
Programación
Comparativamente con la enfermedad de Parkinson o temblor, la respuesta a la ECP puede demorar un poco más y requerir más controles en el caso de la distonía.
Para el control de la distonía, puede ser necesario voltajes más altos, lo que hará que el gasto de la batería sea mayor y si es recargable puede requerir recargas más frecuentes.
¿En qué momento se debe iniciar la programación?, no hay consenso. Mientras que algunos grupos prefieren iniciar la programación tempranamente, otros prefieren esperar a que pase el edema y el efecto lesional que puede durar hasta 3 semanas. Se ha observado que aquellos pacientes que presentan una mejor respuesta por el efecto lesional, presentan una mayor probabilidad de buena respuesta a los 6 meses.
Complicaciones
Las complicaciones en la ECP para distonía, son similares a las observadas en intervenciones similares para EP o temblor. Varían desde el 0 hasta el 40 % y va desde la cefalea poscirugía hasta el fallecimiento del paciente. Se pueden clasificar de acuerdo a la relación con:
Cirugía: cefalea, hemorragia sintomática o asintomática, dolor, convulsiones, desplazamiento del electrodo, hematoma subcutáneo, neumoencéfalo, parestesias, evento vascular isquémico, complicaciones cardiacas, infarto venoso, fractura ósea.
Estimulación: parestesias temporales o permanentes, disartria, alteraciones en equilibrio y en la marcha, paresias, sialorrea, disfonía, trastornos del sueño, deterioro mental.
Sistema implantado: fractura del electrodo, irritación y erosión en sitio de implantación y/o de generador, infección, ruptura de extensión, estimulación intermitente, pérdida del efecto o falla en la estimulación, falla del generador.
Otras: hidrocéfalo, fístula de líquido cefalorraquídeo, alteraciones visuales.
Mientras que las complicaciones en la cirugía son usualmente tempranas, puede haber infección en el trayecto del sistema hasta un año después. Las complicaciones del generador y del sistema aunque pueden ser tempranas, usualmente son proporcionales al tiempo de duración del implante. Las de la estimulación suelen presentarse al comienzo. Del 100 % de las complicaciones, menos del 1 % son serias o pueden poner en riesgo la vida del paciente y más del 75 % resuelven en los primeros días, quedando menos del 20 % con alguna complicación con la cual debe lidiarse.
En el caso de distonía, cuando se implantan en pacientes en la primera década y a comienzos de la segunda, debe tenerse en cuenta que la extensión y aun el electrodo pueden migrar debido al crecimiento del paciente 56.
Lesión, denervación, miotomía y miectomía
La lesión se realizó en épocas pretéritas, en la actualidad se usa solo en casos especiales tales como inmunosupresión, anticoagulación, imposibilidad para seguir estrechamente al paciente y programarlo.
En cuanto a la miectomía, denervación selectiva o ramisectomía, rizotomía cervical anterior y descompresión microvascular del nervio accesorio; son procedimientos periféricos que no tienen estudios que muestren eficacia y beneficio sin efectos secundarios mayores. En todos los casos de distonía cervical, con temblor distónico cefálico, o con componente mioclónico, la primera opción es la toxina botulínica seguido de la ECP, dejando el uso de los procedimientos periféricos solo cuando no hay beneficio y se afecta de manera importante la calidad de vida y la función del paciente o cuando hay síntomas residuales que requieran pequeños ajustes 57-60.
Programas y dispositivos que ayudan en el proceso del tratamiento con ECP
Al igual que en la EP, los nuevos dispositivos ayudan a que la cirugía para distonía sea más efectiva con menos efectos secundarios y con baterías que pueden ser recargadas y dan una vida media más larga. A continuación hablaremos brevemente de estos nuevos dispositivos.
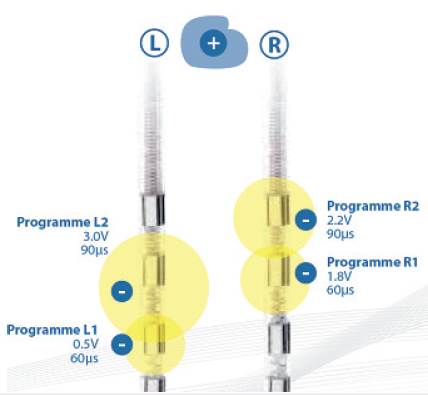
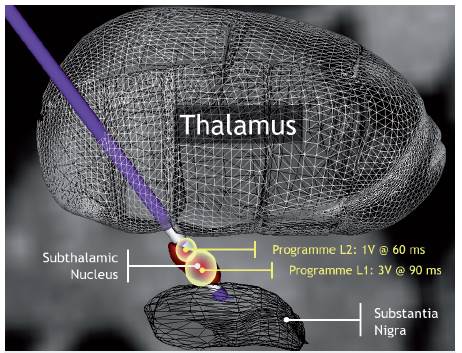
1. Electrodos: los actuales electrodos, constan de 4 ó 8 contactos circulares (figura 1) que llevan patrones de estimulación con determinados rangos de voltaje, ancho de pulso y frecuencia, que pueden afectar las vías no deseadas como la cápsula interna, produciendo posturas tetánicas intolerables. Una opción que se desarrolló y con la que se cuenta en la actualidad es el "interleaving", o control de corriente independiente múltiple, que permite establecer dos programas de estimulación simultáneos, tratando de capturar más síntomas con menos efectos secundarios (Figuras 2 y 3). Los electrodos de 8 contactos, dispuestos en una mayor longitud, con una mayor extensión aumentan las probabilidades de estimulación. Los nuevos electrodos, del mismo diámetro, pero con más contactos de menos superficie y ocupando un tercio del diámetro, permiten dirigir no solo la corriente, sino también el porcentaje de corriente tomando diferentes formas y llevando a que el área estimulada sea la que requiere el paciente, disminuyendo el riesgo de efectos secundarios (figura 4).

Figura 1 Electrodo de 8 contactos circulares Figura tomada con permiso de Boston Scientific Corporation
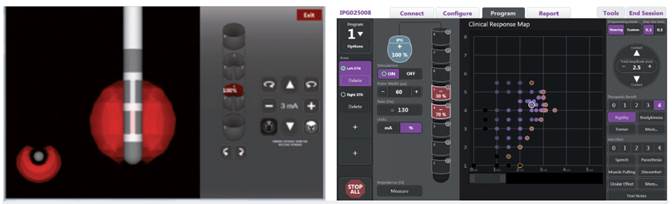
Figura 4 Electrodos con 8 contactos de estimulación dirigida. Figura tomada con permiso de Boston Scientific Corporation
2. Parámetros de estimulación: los parámetros de estimulación deben variar de acuerdo a la enfermedad y los síntomas del paciente; es así como tal vez para un paciente con temblor el aumento de la frecuencia mejore este síntoma, sin embargo puede empeorar la marcha y no ayudar en la distonía. Los nuevos generadores han aumentado el rango de variables, tanto de frecuencia como de ancho de pulso, permitiendo que acorde a la respuesta neuronal se pueda ajustar los parámetros.
3. Modelos de seguimiento clínico: la objetividad en cuanto a la severidad de las manifestaciones clínicas es variable, tornándose en algo realmente subjetivo y mezclando síntomas no motores con motores. Basados en predictores de descargas (similar a los modelos usados en epilepsia), ayudan a predecir la mejor programación acorde a la respuesta clínica. En este desarrollo ha sido importante los Campos Locales de Potenciales (Local Field Potencials) que registran actividad gangliobasal, correlacionada con descargas corticales registradas en electrodos exteriorizados. En Enfermedad de Parkinson, supresión de descargas beta han mostrado disminución de bradicinecia y rigidez mientras que para distonía, supresión de actividad teta-alfa (5 a 12 hz), similar a lo que ocurre con gesto antagonista, ayuda en la mejoría de movimientos hipercinéticos (figura 5).
4. Programas de seguimiento computacional: programas de correlación entre los registros computacionales de descarga y neuroimágenes (fusión de antes y después de la cirugía) ayudan a definir la programación. Se ha observado que ayudan a predecir el mejor sitio de programación con la mejor respuesta clínica, ayudando además a optimizar la vida media y recarga de los generadores. Nuevos programas pueden registrar, analizar y correlacionar la descargas neuronales con la clínica disminuyendo
5. Estimulación adaptativa de asa cerrada: modelos de seguimiento computacional han ayudado a encontrar frecuencias de onda que se producen en la fase tónica de la distonía y que se correlacionan con actividad clínica. Parámetros de estimulación adaptativa se hacen basados en retroalimentación; el electrodo ayudará en desincronizar la fase actividad oscilatoria. Clínicamente se observa mejoría en cuestión de horas a dias y ayuda en optimización de la programación (Figura 6) 61,62.
CONCLUSIÓN
La distonía es un trastorno del movimiento hipercinético con múltiples etiologías y manifestaciones clínicas variable.
El tratamiento depende del tipo de distonía y la etiología, siendo la cirugía una opción durante el siglo pasado que se ha depurado y evolucionado. En la actualidad la ECP ha demostrado resultados positivos en distonía primaria y en algunos casos secundarios. La evidencia muestra que el objetivo quirúrgico es el GPi, con perspectivas de que otro núcleo como el NST también pueda ser a futuro una opción. La investigación nos muestra que el cerebelo, el tálamo y otros están siendo estudiados.
Los avances tecnológicos aplicados a las biociencias seguramente nos ayudarán a encontrar más caminos para controlar los movimientos anormales.