INTRODUCCIÓN
Los meningiomas corresponden a un tema tan apasionante y de alta consideración por sus características únicas, que desde muy tempranas épocas ha sido asunto de investigación y en el que se ha logrado diversos avances en el conocimiento sobre el mismo, así pues, al revisar la literatura se encuentran textos que desde antaño se han destacado, "Pocos tumores hay tan atractivos como el meningioma. Su descripción temprana, en los siglos XVIII y XIX, el conocimiento de su existencia en momias de la época precristiana, lo incierto de su histogénesis, su múltiple localización y su variado aspecto microscópico, hacen de él un campo de continuo interés" 1.
Podemos definir los meningiomas como neoplasias que se originan en las células meningoteliales (aracnoides) en la superficie interna de la duramadre 2. Los meningiomas representan entre el 13 % al 19 % de todos los tumores cerebrales primarios 3.
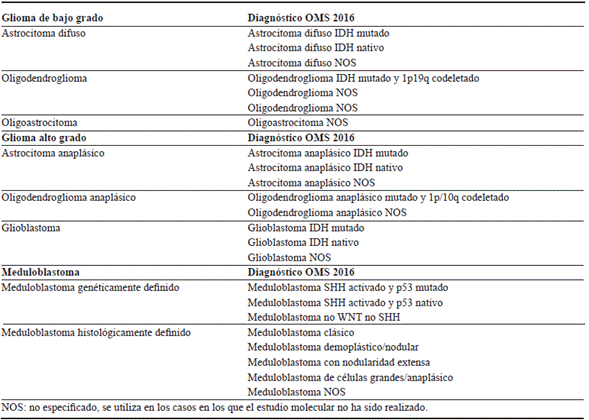
Durante las últimas dos décadas a través de intensas investigaciones en el campo de la tumorigenesis y de los tumoral primarios del sistema nervioso central se han reportado alteraciones genéticas y epigenéticas que determinan subgrupos de tumores con diferente evolución que corresponden a marcadores moleculares pronósticos y subgrupos con diferente respuesta a tratamientos que corresponden a los marcadores moleculares predictivos 4. Lo que llevó a que en el 2016 la Organización Mundial de la Salud incorporara por primera vez marcadores moleculares para la definición de entidades tumorales cerebrales, que originó una nueva clasificación para los tumores del SNC y generó agrupaciones considerando los parámetros moleculares 5-7, como se observa de forma resumida en las tablas 1 y 2, específicamente se correlacionan los diferentes 15 tipos de meningiomas, en el presente artículo, se menciona especificamente sobre el meningioma cordoide.
Tabla 1 Clasificación de tumores del Sistema Nervioso Central según la Organización Mundial de la Salud 2016.
El meningioma cordoide fue documentado por primera vez en 1988 por Kepes, et al., 8, quienes describieron a 7 pacientes entre los 8 y 19 años con irregularidades hematológicas, en particular relacionados con la enfermedad de Castleman 9. El meningioma cordoide representa una rara variante que comprende menos del 0,5 % y el 1,0 % de todos los meningiomas intracraneales 10-11, son más comunes en pacientes menores de 18 años 12, aunque se presentan en todas las edades siendo más agresivos a menor edad 2 sin diferencias por sexo 13. El meningioma cordoide se compone de células fusiformes o epitelioides dispuestas en racimos y los cables de cordoma como en una matriz mixoide ofrecen a menudo un prominente infiltrado lymphoplasmacellular 14. El meningioma cordoide tiene mayor predisposición por la región supratentorial e intraventricular 15-16, usualmente su remisión quirúrgica lleva a la ausencia del cuadro clínico 17, sin embargo, obedece a la ubicación cerca a importantes áreas del encéfalo o de vasos sanguíneos, lo que define el tamaño de la resección, cabe resaltar que el meningioma cordoide presenta un comportamiento agresivo y con una alta probabilidad de hacer recurrencia localmente 18-20. Por lo que se recomienda que cuando la recesión es incompleta se practique radioterapia postoperatoria 21-22. Histológicamente, la variante cordoide se compone de cordones o trabéculas de células eosinóficas o vacuolizadas embebidos en una matriz mucoide abundante, no obstante, morfológicamente existen otros tumores intracraneales similares tales como el glioma cordoide, condrosarcoma extraesquelético, ependimoma mixopapilar, los tumores metastásicos 23-24 y el cordoma, este último presenta adicionalmente un gran parecido histológico con el meningioma cordoide 25. Por lo que es la inmunohistoquímica la que hace el diagnóstico diferencial, se ha documentado para meningioma cordoide EMA/CK y S-100 positivas 25. También se ha demostrado que el D2-40 un anticuerpo monoclonal, es útil diferenciando condrosarcoma mixoide extraesquelético y cordoma 25. Esto último resulta importante para hacer diagnóstico diferencial, pues aunque tienen histología similar el comportamiento y las terapias biológicas son diferentes 26.
Se ha encontrado que el síntoma más común en los pacientes con meningioma cordoide es la cefalea severa que no mejora con tratamiento convencional y los demás síntomas dependen de la localización y tamaño del tumor, sin manifestaciones clínicas específicas 13. Solo en los casos asociados a enfermedad de Castleman se correlaciona con anemia hipocrómicas resistente al tratamiento con hierro, se han documentado algunos casos de disgammaglobulinemia con retraso del crecimiento 27 y se han reportado episodios de convulsiones tónico-clónicos generalizadas, pero este hallazgo es excepcional 28,29.
Presentación del caso clínico
Presentamos un caso clínico correspondiente a un hombre de 51 años de edad, que consulta al servicio por un cuadro clínico de 18 meses de evolución, consistente en parestesias en miembro inferior derecho y cefalea intensa que no mejoraba con ninguno de los diversos tratamientos, sin ninguna otra sintomatología asociada. Con antecedente de hipertensión arterial con un adecuado tratamiento y de hernia discal a nivel de L5/S1 con monoparesia derecha. Sin ningún otro antecedente patológico o quirúrgico.
A los 18 meses de iniciado el cuadro clínico presentó un único episodio convulsivo focal, sin ninguna otra característica y sin ningún otro síntoma, frente a lo cual se le realizó resonancia nuclear magnética como se observa en la (figura 1) en la que se aprecia gran masa tumoral extra axial de 6,0 cm x 5,0 cm sobre el área motora izquierda, región parietal, bien vascularizada con efecto compresivo. Se programó a neurocirugía en donde se encontró lesión dependiente de la hoz del cerebelo que es removida en su totalidad y se envió a patología, la cirugía fue exitosa sin ninguna complicación durante la misma ni en el posoperatorio.
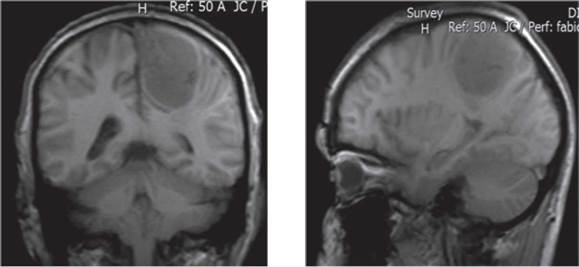
Figura 1 Resonancia nuclear magnética en la que se aprecia gran masa tumoral extra axial de 6,0 x 5,0 cm sobre el área motora izquierda, región parietal, bien vascularizada con efecto compresivo.
A la revaloración del paciente se observó desaparición progresiva de los síntomas neurológicos presentados y una mejoría en la calidad de vida del paciente.
Anatomía patológica
Histológicamente la lesión se asemeja a tejido derivado de la notocorda, con cordones y trabéculas de células epitelioides, dentro de un estroma rico en mucina con infiltrado inflamatorio crónico interpuesto.
Presentamos el siguiente análisis realizado sobre la muestra obtenida del paciente de inmunohistoquímica con vimentina, S100 y GFAP, en donde se observó un patrón de inmunohistoquímica congruente con la histología convencional descrita. Se obtuvo de igual forma, tinción positiva con coloración de PAS y Alcian Blue en las áreas de depósito de mucina. Tal como se puede observar en la figura 2.
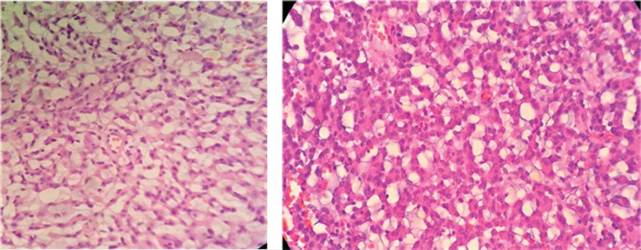
Figura 2 Células de citoplasma claro en un estroma mixoide. Tinción de hematoxilina-eosina. Izquierda vista a 10 x, derecha la vista a 40 x.
Cabe resaltar que el análisis inmunohistoquímico con Ki67 del paciente no superó el 10 %, lo cual se asocia con menos probabilidad de recidiva.
DISCUSIÓN
El meningioma cordoide es un tumor de rara ocurrencia, lo cual hace a estos casos diferentes de los meningiomas meningoendoteliales, lo que resalta lo particular del caso.
Adicionalmente los meningiomas cordoide por su baja recurrencia y baja prevalencia se han conocido como meningioma atípico.
El mayor predictor de la recurrencia tumoral es la extensión de la resección, una serie de estudios realizados por Coulce, et al., demostró recidivas hasta del 42 % de los tumores cuando se realizó resección subtotal.
El segundo factor predictor de recidiva es la cantidad de elementos cordoides presentes en el tumor, cuando este componente es superior al 50 %, la posibilidad de recidiva en algunas series alcanzó hasta el 85 %.
El Ki67 es reconocido como el factor predictor de recurrencia menos sensible para este tipo de neoplasias. Sin embargo, un Ki67 elevado (>25 %) se ha asociado a riesgo mayor de evolución a meningioma anaplásico.
Frente al caso reportado, se resalta la remisión total de los síntomas neurológicos y el impacto en la mejoría de la calidad de vida del paciente.















