INTRODUCCIÓN
La disfagia o trastorno de la deglución hace referencia a cualquier dificultad en una o en las tres fases principales del proceso deglutorio: oral, faríngea y esofágica 1. En términos prácticos la disfagia es toda alteración en el proceso del tragar, donde hay dificultad para mover el bolo alimenticio de manera segura desde la cavidad oral al estómago sin que aparezca aspiración de saliva, alimentos o líquidos a laringe, tráquea y pulmón 1-3; en otros términos la disfagia implica una alteración en la eficiencia y seguridad de la deglución. La disfagia es un signo y síntoma transversal a todas las edades y sexo, siendo consecuencia directa o complicación asociada de varias enfermedades, trastornos y lesiones 2.
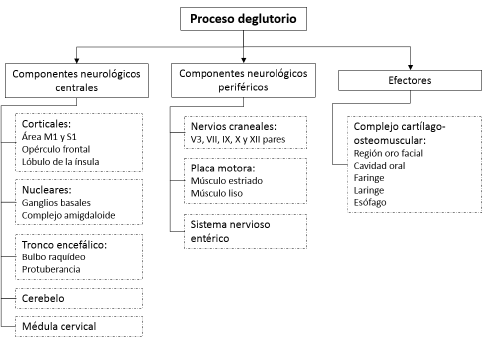
El proceso deglutorio va más allá de las acciones musculares de la faringe, siendo el resultado de una serie de componentes neurológicos centrales y periféricos, donde la faringe en compañía de otras estructuras de aparato digestivo, son los efectores que transportan con seguridad el bolo alimenticio de la cavidad oral al estómago. En la figura 1 se muestran los componentes y subcomponentes involucrados en el proceso deglutorio.
M1: área motora primaria, S1: área sensitiva primaria, V3: tercera rama del trigémino (nervio mandibular), VII: nervio facial, IX: nervio glosofaríngeo, X: nervio vago (neumogástrico), XII: nervio hipogloso.
La etiología de la disfagia se agrupa bajo los términos de disfagia neuromuscular y disfagia neurogénica 3. La neuromuscular implica algún compromiso en los mecanismos efectores del acto deglutorio por alteraciones en la placa motora o en los músculos de la faringe y/o del esófago.
La neurogénica es el resultado de toda disrupción en los mecanismos neurológicos de la deglución por compromiso del sistema nervioso central y/o sistema nervioso periférico 3. En el mundo se reporta una incidencia anual de disfagia neurogénica entre 400.000 a 800.000 casos 3.
Una buena historia clínica puede identificar la ubicación y causa de la disfagia en el 80 % de los casos 4. Sin embargo, la disfagia es uno de los trastornos más descuidados por los profesionales de la salud en cuanto a diagnóstico, tratamiento y seguimiento (siendo las últimas dos, las que presentan mayores dificultades) 5.
El objetivo de esta revisión de tema, desde una óptica epidemiológica y clínica de la disfagia, es invitar a los profesionales de la salud a conocer sobre disfagia neurogénica y neuromuscular, su etiología, manifestaciones, consecuencias y aspectos clínicos para su reconocimiento. Se realizó una búsqueda en PubMed, Embase, Ebsco Host, Medline, Acces Medicine y SciELO, con los términos dysphagia, dysphagia assessment, dysphagia oral, dysphagia oropharyngeal y swallowing disorders.
DISFAGIA: CONCEPTOS, SÍNTOMAS Y SIGNOS
El término disfagia fue acuñado por el Dr. James Parkinson en el año 1817 3. Desde su origen como término semiológico, ha estado estrechamente vinculada a la neurología clínica, y dicha relación va más allá del síndrome parkinsoniano.
La disfagia es toda alteración del tránsito de los alimentos y líquidos en el proceso deglutorio, en la que puede existir una sensación de adherencia y obstrucción del paso de los alimentos a través de boca, faringe y esófago, afectando la seguridad de la vía aérea 1-3,6-9.
El paciente con disfagia puede experimentar un amplio espectro de síntomas y signos. El espectro sintomático de la disfagia incluye 10,11: dificultad para iniciar la deglución, presencia de alimentos sólidos atrapados en orofaringe, regurgitación nasal de líquidos, tos frecuente acompañada o no de asfixia inmediatamente después de tragar, presencia de tos húmeda al ingerir líquidos, voz húmeda o sofocada durante o después de la deglución, sensaciones en faringe o esófago (tipo comida atorada o pegada), cambio en los hábitos alimenticios, infecciones respiratorias repetidas, neumonía, rectificación o arqueo de la espalda/cuello, incremento de frecuencia respiratoria o presencia de cianosis, apnea y/o toma de descansos frecuentes durante la alimentación, desaturación de oxígeno, aumento o disminución de la frecuencia cardiaca normal, llanto durante las comidas (en neonatos e infantes), reducción en la capacidad de respuesta o de interacción durante la sesión de alimentación (en neonatos e infantes), deshidratación, dificultad para masticar alimentos según textura, desplazamiento alterado de la laringe durante una deglución voluntaria, y fuerza para aclarar la garganta e intensidad de la tos. Sin embargo, la disfagia no siempre es evidente y puede presentarse de manera sutil como pérdida de peso, notable aumento en el tiempo necesario para comer, movimientos laterales o de inclinación leve de la cabeza al comer, necesidad repetida de tomar agua con los alimentos, hasta la presencia recurrente de infecciones respiratorias 11. Algunos de estos síntomas indican aspiración (una complicación en sí), como lo es la tos y su intensidad, la asfixia y cambios en la voz (voz sofocada o gangosa) 10.
Desde la neurología clínica se deben tener presente dos fenómenos contradictorios al examen físico de pacientes con disfagia 11: a) la aparente normalidad de los movimientos linguales y elevación del paladar al examen físico oral no descarta la presencia de una disfagia; y b) la presencia o ausencia del reflejo nauseoso, no descarta ni confirma una disfagia. La presencia de este reflejo no asegura la correcta coordinación del mecanismo deglutorio, y no significa a su vez, que se está evitando aspiraciones. Por lo tanto, no es un dato suficiente para certificar una deglución segura. Otra recomendación para los profesionales en salud en general es que la disfagia no debe ser considerada como una consecuencia esperable del proceso de envejecimiento normal 7.
TIPOS DE DISFAGIA
A partir de las características que rodean el trastorno de la deglución, existen diferentes clasificaciones y sub-clasificaciones. En cuanto a la ubicación fisiopatológica o fase alterada en el trastorno de la deglución, la disfagia se clasifica en:
- Disfagia oral y faríngea (disfagia orofaríngea): llamada también disfagia de transferencia, donde el signo primordial es la dificultad en iniciar la deglución 7, además la necesidad de intentos repetidos para deglutir, presencia de regurgitación nasal durante la deglución, tos o ahogo inmediatamente después de intentar tragar 3. Existe mala formación y control del bolo dentro de la cavidad oral, provocando retención en la boca y derrame del bolo a través de labios, acompañada de ptialismo y sialorrea (la sialorrea y dificultad para iniciar la deglución son características de una alteración de la fase oral). Además, la retención del bolo puede producirse en la faringe, secundario a problemas en la propulsión lingual, faríngea o alteración en la apertura del esfínter esofágico superior (alteración fase faríngea) 6. La patología del músculo estriado por lo general implica la orofaringe y el esófago cervical produciendo manifestaciones clínicas de disfagia orofaríngea, y no disfagia esofágica.
- Disfagia esofágica: es la dificultad para deglutir que aparece segundos después, tras iniciar una deglución 7.
Cuando el esófago se distiende, la luz esofágica es de 2 cm anteroposterior y 3 cm transversal. Se produce generalmente por trastornos de la propulsión, compromiso peristáltico, lesiones circunferenciales o inhibición de la deglución esofágica por compromiso de musculatura lisa del esófago torácico y parte del esófago cervical 6.
EPIDEMIOLOGIA DE LA DISFAGIA NEUROGÉNICA Y NEUROMUSCULAR
En niños la disfagia puede ser del desarrollo o adquirida, por causa neurogénica o neuromuscular. La disfunción motora oral con dificultades para la alimentación y el tragar se encuentra en cerca del 20 % de los neonatos prematuros 12. En niños y adolescentes con parálisis cerebral infantil la prevalencia de disfagia se estima entre el 58 % al 90 % 13 , presentando compromiso de fase oral y faríngea 14. En niños, posterior a un trauma cráneo encefálico (TEC), se reporta una incidencia de disfagia del 4,5 %, la que asciende a un 68 % a 76 % en TEC grave 1.
En adultos la disfagia es aún más frecuente por etiología neurogénica (resultado de procesos que alteran uno o todos los componentes neurológicos del proceso deglutorio, figura 1). La tabla 1 muestra las p atologías neurológicas más frecuentes y la disfagia asociada.
Tabla 1 Frecuencia de disfagia en algunas entidades neurológicas

ACV: ataque cerebro vascular, TEC: trauma encéfalo craneano, EM: esclerosis múltiple, EP: enfermedad de Parkinson.
Entre el 27 % al 50 % de todos los pacientes con ACV presentan disfagia 15,16. Los pacientes con ACV y disfagia tienen más riesgo de discapacidad grave o muerte 17,18. Tanto el ACV unilateral como bilateral en los hemisferios cerebrales producen disfagia, al igual que lesiones en tallo cerebral.
Los pacientes con TEC, independiente del nivel de gravedad, potencialmente experimentan disfagia 19. El riesgo de disfagia en los pacientes con esclerosis múltiple (EM) aumenta a medida que la enfermedad progresa (en EM con compromiso funcional grave la presencia de disfagia asciende al 65 %) 20,21.
En los adultos mayores autónomos se reporta una prevalencia de disfagia del 10 %, y en adultos mayores residentes de hogares geriátricos la prevalencia de desórdenes de la deglución es del 50 % 22,23. Sin embargo, otros autores precisan que la prevalencia estimada de disfagia en personas con edad mayor o igual a 65 años se encuentra entre el 7 % y 22 % 24. En este grupo etario, los más susceptibles a disfagia y a mayor riesgo de complicaciones asociadas a la misma son los adultos mayores con procesos neurodegenerativos (demencias y enfermedad de Parkinson) 25,26. Se reporta que los tipos de demencia con mayor presencia de disfagia son la demencia frontotemporal (en fase avanzada), demencia tipo Alzheimer (en fase temprana y tardía), demencia multiinfarto, demencia por cuerpos de Lewy (DL) y demencia por EP 26,27. Adicionalmente, la parálisis supranuclear progresiva (PSP) afecta todas las fases de la deglución 28.
La EP puede producir disfagia orofaríngea y/o esofágica por la degeneración de vías dopaminérgicas en la sustancia nigra, cuerpo estriado y en el sistema nervioso entérico. Cuando se evalúa la deglución en pacientes con EP de manera instrumental con videofluoroscopia se reportan anomalías en la fase orofaríngea en el 75 % al 97 % de los pacientes 29. La presencia de disfagia en pacientes con EP no se observa en fases iniciales, en comparación a otros trastornos de los ganglios basales como PSP, degeneración cortico-basal, atrofia sistémica múltiple y DL, donde la disfagia es un síntoma y signo temprano (en EP la latencia promedio de aparición de disfagia es a los 130 meses en comparación con la PSP que es de 42 meses) 3,30.
Generalmente la disfagia por enfermedades neuromusculares es un síntoma más, dentro de otras manifestaciones globales o sistémicas. Las miopatías inflamatorias más frecuentes son la dermatomiositis y polimiositis, y casi siempre son manifestaciones de un proceso maligno de base (10 % a 15 % en dermatomiositis y 5 % a 10 % en polimiositis). Se reporta que más del 50 % de personas mayores a 65 años con alguna de estas dos miopatías inflamatorias poseen cáncer 3. El compromiso de la musculatura faríngea y del esófago en ambas miopatías es un indicador de mal pronóstico 3. La disfagia se presenta entre el 20 % al 55 % de los pacientes con dermatomiositis y en el 18 % de los pacientes con polimiositis 31; cuando la miositis posee cuerpos de inclusión la presencia de disfagia asciende entre el 44 % al 65 % 32,33.
En pacientes con miastenia gravis (MG) la disfagia es una consecuencia y a la vez un factor precipitante de crisis miasténicas 34. Pacientes con compromiso de musculatura bulbar cursan con disfagia en un 6 % a 30 % 34.
En procedimientos quirúrgicos como endarterectomía puede aparecer la disfagia. Un estudio del año 2005 reportó que un 60 % de los pacientes pos endarterectomía carotidea, tras examen cuidadoso otorrinolaringológico, mostraron alteraciones leves y transitorias en la deglución, donde puede persistir en el 17 %, y un 9 % pueden necesitar rehabilitación de disfagia 35. En inyecciones de toxina botulínica para distonía cervical, la disfagia es una complicación relacionada 36.
COMPLICACIONES DE LA DISFAGIA: IMPACTO EN LA SALUD DE LOS PACIENTES
La disfagia es una condición potencialmente peligrosa que lleva al paciente a varias complicaciones 37: neumonía, infecciones respiratorias a repetición, enfermedad respiratoria crónica, mala nutrición o mala hidratación (la que a su vez lleva a úlceras, mala respuesta inmune y retraso en la cicatrización), obstrucción de las vías respiratorias, retraso en el desarrollo motor y cognitivo (en menores de 5 años) 1,12 y pérdida de peso. Adicionalmente, se suman situaciones como mayor necesidad de recursos en salud, uso frecuente de antibióticos, uso de dispositivos invasivos para alimentación o sometimiento a procedimientos quirúrgicos en disfagia grave y profunda para fuentes y/o dispositivos alternos de nutrición 38, y riesgo de muerte. En pacientes post ACV y disfagia se ha reportado que la estancia hospitalaria se triplica en duración y aumenta la tasa de complicaciones 17.
Los pacientes con disfagia post ACV son el grupo de pacientes donde más se han analizado las complicaciones por disfagia. Se reporta como complicación más frecuente la aspiración, seguida de malnutrición y desnutrición 39. El 50 % de estos pacientes mueren o se recuperan espontáneamente dentro de los 14 días posteriores al evento, quedando la mitad con algún tipo de déficit en la deglución que altera su funcionamiento, recuperación y calidad de vida 40. Se reporta que cuando un déficit estructural vascular por un ACV produce disfagia secundaria, el riesgo relativo (RR) de neumonía es de 3,17, pero cuando el mismo paciente presenta adicionalmente signos de aspiración y disfagia, el RR de neumonía alcanza un RR de 11,5 41. Otros estudios 42-44 con énfasis clínico y de recomendaciones a la práctica asistencial, han sugerido que el grupo de pacientes con mayor riesgo de neumonía son aquellos con ACV y disfagia, más una de las siguientes variables: comorbilidad con enfermedad pulmonar obstructiva crónica, antecedente de tabaquismo activo o de tos crónica previa, edad avanzada y/o pérdida de autonomía en su proceso de alimentación (ej. alimentación asistida).
La aspiración es una complicación potencialmente mortal en pacientes con ACV, como en otro tipo de patologías de índole neurogénico y neuromuscular que produzcan disfagia. El problema de la aspiración es que lleva al paciente a desarrollar neumonía aspirativa. En pacientes con disfagia post ACV la ocurrencia de aspiración en general es del 30 % al 55 % 3. Si se conoce la ubicación y lateralidad del ACV la presencia de aspiración cambia: en ACV cerebral unilateral la presencia de aspiración es del 36 %, en ACV cerebral bilateral es del 46 %, y cuando el ACV se ubica en tallo cerebral la aspiración aparece en el 50 % (incluso llegando al 80 %) 3. Los pacientes con lesión vascular subcortical post ACV tienen mayor frecuencia de disfagia y aspiración, en comparación con aquellos con únicamente lesiones corticales. El riesgo de neumonía es siete veces mayor en personas con ACV y aspiración 3.
Los pacientes con EP tienen alto riesgo de aspiración. La aspiración evidente se produce en el 15 % a 56 % de los pacientes, y aspiración silente en el 15 % a 33 % 29. Además en los pacientes con EP y sin disfagia clínica es frecuente encontrar residuos en las valleculas, hasta en un 88 % de las veces 3, lo cual aumenta el riesgo de micro y macro aspiración.
Otra complicación son los problemas nutricionales. Entre el 16 % al 49 % de los pacientes con disfagia post ACV pueden tener desnutrición 45, en especial pacientes con diabetes, ACV previo y antecedente de uso de sonda para alimentación 46. Otro autor reporta que los déficits nutricionales en pacientes con disfagia post ACV se presentan entre el 48 % al 65 % 3.
El compromiso muscular faríngeo y/o esofágico en pacientes con polimiositis es un signo de mal pronóstico. Se reporta una tasa de mortalidad a un año del 31 % en pacientes con miopatía inflamatoria y disfagia 47.
La presencia de disfagia no debe ser interpretada como un asunto banal, o ser asumido como un fenómeno "normal" y "esperado" en todos los pacientes con enfermedades neurológicas y neuromusculares, por lo tanto, es crucial su identificación y conocer sus complicaciones.
ALTERACIONES DE LA DEGLUCIÓN CARACTERÍSTICAS SEGÚN ETIOLOGÍA
Neuromuscular
- La etiología reportada abarca miopatías inflamatorias y mitocondriales, distrofias musculares, desórdenes de la unión neuromuscular, escleroderma, síndrome del hombre rígido, amiloidosis y la variante Miller Fisher del síndrome de Guillain Barré 3,6.
- Un defecto en el inicio de la deglución se atribuye generalmente a debilidad lingual por MG o a una enfermedad de motoneurona inferior, y raramente a una miositis. También puede ser causada por una metástasis en la base de cráneo o disección de la carótida que comprima el XII par 11.
- La presencia de disfagia más regurgitación nasal de líquidos y patrón nasal de la voz, indica MG, parálisis del X nervio craneal o parálisis bulbar/pseudobulbar 11.
- En MG la disfagia es resultado de disfunción en cualquiera de las fases de la deglución (oral, faríngea, esofágica). Cuando es compromiso en la fase oral, la característica es debilidad y fatiga en lengua o en músculos masticatorios 3.
- Además de la debilidad lingual, un hallazgo casi propio de las causas neuromusculares, también se presenta debilidad de la musculatura faríngea.
Neurogénica
- La etiología reportada abarca malformaciones del SNC, enfermedades de los ganglios basales, parálisis cerebral, neuro infecciones, tumores primarios del SNC, enfermedad motoneuronal, procesos desmielinizantes centrales, ataxias, enfermedad cerebro vascular, entre otros 3,6.
- Se reportan tres fenómenos básicos propios de la alteración: respuesta deglutoria prolongada, cierre laríngeo retardado y débil propulsión del bolo con riesgo de aspiración 48.
- Disfagia por desaceleración (lentitud) y descoordinación indican una etiología corticoespinal, como PSP o ACV uni o bilateral 11.
- Alteración en la sincronización entre deglución y respiración, con vía aérea abierta al paso de alimento a través de la faringe posterior, y la disminución en la frecuencia temporal de la deglución, con acumulación de saliva en la boca, indican enfermedades de los ganglios basales 11.
- Aumento en el umbral deglutorio y retraso en la fase faríngea se reportan en lesiones de la ínsula 3.
- En pacientes post ACV son signos compatibles con la presencia de disfagia: sialorrea, movimiento excesivo de la lengua, mal control lingual, acumulación de comida en cavidad oral, debilidad facial, dificultad para hablar, presencia de tos o asfixia al comer, voz ronca o entrecortada y masticación prolongada 39. El ACV que afecta el hemisferio no dominante tiende a producir más deterioro de la motilidad faríngea. Los ACV de hemisferio izquierdo tienen mayor efecto sobre la etapa oral de la deglución 49. El infarto bilateral por ACV del opérculo frontoparietal (síndrome de Foix-Chavany-Marie) produce una incapacidad total en la realización de movimientos voluntarios de rostro, mandíbula, lengua y faringe, preservándose los movimientos involuntarios 3.
- Los pacientes con EM poseen anomalías en la fase oral de la deglución, incluso en una forma leve de la enfermedad. Cuando la discapacidad aumenta por la severidad inflamatoria de la EM se producen anomalías en la fase faríngea, alterándose la secuencia deglutoria, sensibilidad faríngea y función de los músculos constrictores 3.
- Los pacientes con disfagia por EP tienen dificultad en la formación del bolo, inicio retardado de la deglución, movimientos repetitivos linguales, dismotilidad faríngea, alteración en la relajación del músculo crico faríngeo, tienden a tragar durante la inspiración, e inhalan post deglución 50. Cuando la disfagia por EP es esofágica se reporta anomalías en la manometría, tránsito disminuido, espasmo esofágico difuso, contracciones ineficaces, aperistalsis y disfunción del esfínter esofágico inferior 3.
- La esclerosis lateral amiotrófica (ELA) produce anomalías en la fase oral de la deglución, compromiso en la función labial y motilidad lingual. A medida que la debilidad muscular progresa, aparece compromiso de mandíbula, músculos supra hioideos, hasta debilidad faríngea y laríngea, espasmo del esfínter esofágico superior e hiperreflexia/hipertonía del músculo crico faríngeo 3.
Herramientas clínicas
En la práctica asistencial las pruebas habituales para detectar disfagia se pueden agrupar en pruebas clínicas (no instrumentales) y en pruebas instrumentales. La prueba clínica habitual es el bedside swallow examination (evaluación clínica de la deglución a la cabecera del paciente), que consiste en una lista de chequeo clínico ejecutada por profesionales entrenados en deglución (según el centro y el país pueden ser fonoaudiólogos, enfermeros, médicos, entre otros) 51. Otro instrumento clínico, de fácil aplicación y rápida interpretación en pacientes con disfagia de cualquier etiología es la Eating Aseessment Tool (EAT-10) 52. Herramienta validada en Colombia en el año 2015-2016 53. Las pruebas instrumentales habituales son: estudio de la deglución por videofluoroscopia, videoendoscopia, esofagograma, gammagrafía (escaneo de radionucleótido con leche en caso de neonatos y lactantes), manometría faríngea/esofágica, pH-metría de 24 horas y esofagoscopia.
La evaluación clínica depende del entrenamiento y experiencia del personal asistencial entrenado que la realiza. Hay gran variedad en la evaluación clínica, pero debe incluir: examen de nervios craneales, examen sensorial y motor de la cavidad oral, y evaluación de la deglución orofaríngea usando diferentes alimentos y líquidos 54. Debe realizarse procesos de inspección, palpación y auscultación de las estructuras del sistema digestivo y respiratorio superior, rostro y cuello, más la revisión neurológica de cabeza y cuello. El examen físico posee mayor capacidad de identificar signos de disfagia orofaringea 55. Estar atento a signos de parálisis bulbar, compromiso de pares craneanos, disartria, disfonía, ptosis palpebral, adenopatías, atrofia lingual, asimetría facial, debilidad muscular, alteraciones de la sensibilidad cutánea y sensibilidad sensorial gustativa, infecciones que limiten la masticación, problemas en la formación del bolo y tránsito faríngeo, y presencia de signos sistémicos relacionados.
La prueba de referencia es la videofluoroscopia (estudio de la deglución modificada con bario), y consiste en el estudio radiográfico del paciente mientras mastica y traga varias texturas y cantidades de líquidos y sólidos que contienen bario 37. La exploración analiza toda la secuencia deglutoria. La videofluoroscopia más que confirmar o no la presencia de disfagia, su gran utilidad y objetivo es la detección de aspiración 56 y el diagnóstico de disfagia orofaríngea en pacientes neurológicos. El segundo método instrumental es la videoendoscopia digestiva superior que evalúa mediante observación directa, la capacidad deglutoria en la fase faríngea, excluyendo el escenario oral y esofágico57.
Ante la sospecha de disfagia orofaríngea, el procedimiento de elección es la videofluoroscopia 6. Según las necesidades, se debe completar con evaluación otolaringoscópica y neurológica. Ante la sospecha de disfagia esofágica, el procedimiento de elección es la endoscopia digestiva superior 6.
En el año 2010 Ickenstein, et al., 58 enfatizaron el valor de la evaluación de la deglución en pacientes hospitalizados por ACV, el cual debe iniciar desde el primer día de admisión hospitalaria realizado por personal de enfermería, a las 72 horas de admisión una evaluación clínica de la deglución realizada por un terapeuta (fonoaudiólogo) entrenado en deglución, y antes del quinto día de hospitalización una evaluación instrumental realizada por médico entrenado.
CONCLUSIONES
La deglución va más allá del control faríngeo, e incluye una serie de componentes neurológicos centrales, periféricos y efectores, que deben ser evaluados con rigor a nivel clínico y semiológico, para poder identificar, clasificar y tratar la disfagia. La disfagia es una condición que debe reconocerse de manera activa en la neurología clínica y quirúrgica, es transversal al ciclo vital y es causada por un gran espectro de entidades, muchas de ellas como la EP, ACV, EM y TEC con una unión indefectible. La sensibilización, actualización y argumentación en el tema es necesario en pro de una atención integral de los pacientes.