INTRODUCCIÓN
El síndrome de Gilles de la Tourette es un trastorno neuropsiquiátrico idiopático caracterizado por trastornos en el movimiento 1,2. Este síndrome, resultado de una mala comunicación entre estructuras cerebrales 3, destaca por la presencia de tics motores y vocales, a menudo precedidos de sensación de ansia de hacerlos 4, acompañados, en el 90 % de los casos 5, de comorbilidades psiquiátricas como: trastornos obsesivo-compulsivos (TOC), déficit de atención e hiperactividad (TDAH), ansiedad, trastornos emocionales o depresión 1,2,5,6.
Este trastorno se debe a una disfunción en el circuito de los ganglios basales, en la comunicación cortico-basal-tálamo-cortical, donde se constató un aumento en el número de conexiones excitatorias y una pérdida de conexiones inhibitorias entre el globo pálido y el tálamo 2,3,7.
Existen varias teorías sobre la etiología de la patología. Se propuso que una aberrante activación de las neuronas del núcleo estriado y la parte compacta de la sustancia negra mesencefálica (por un aumento de dopamina) o un desequilibrio entre los receptores de dopamina, D1 (excitatorios) y D2 (inhibitorios), son los responsables de la disminución de la actividad inhibitoria del globo pálido sobre el tálamo, fomentando la hiperactividad de las neuronas del córtex motor 2.
Si bien el tratamiento en estos casos depende del grado de severidad de los tics y los trastornos asociados, por lo general, en casos leves, suele consistir en terapias de comportamiento y medicación, que incluye inyecciones de toxina botulínica; sin embargo, estas últimas no han demostrado ser efectivas en la mayoría de los casos, pudiendo además provocar una variedad de efectos adversos (acatisia, distonía, parkinsonismos, aumento de peso, hipotensión, sedación, hiperprolactinemia, etc.) 4-6,9.
En los últimos años, y en casos severos, ha aumentado el interés por la estimulación cerebral profunda (ECP), técnica que consiste en el emplazamiento bilateral de electrodos en una región neuroanatómica para dar estimulación continua, de alta frecuencia, a través de un generador de pulsos implantado de forma subcutánea 3,10. En 1999 se emplea esta técnica por primera vez, estimulando la porción medial del tálamo y con resultados positivos 1,3,5. Hasta ese momento solo había sido utilizada como tratamiento de otras condiciones neurológicas como la enfermedad de Parkinson 2,11. Desde entonces, en cuanto al Síndrome de Tourette, varias áreas han sido centro de atención y objetivo de estimulación dentro del conjunto de los ganglios basales 3,4,9,12. De entre todas ellas, el tálamo (única vía de eferencias de todo este conjunto de núcleos) 13 y el globo pálido interno (principal vía eferente hacia el tálamo) 13 parecen ser las regiones que mejores resultados proporcionan en cuanto a reducción de tics, aunque sigue existiendo discusión en torno a este tema 1,3,8,12.
Es importante remarcar que esta técnica solamente está aprobada como tratamiento para Parkinson, temblores esenciales, Distonía y TOC, pero, al día de hoy, ha crecido el interés para ser incluida como herramienta terapéutica en el Síndrome de Tourette, a pesar de que existen varias cuestiones por investigar en cuanto a seguridad, eficacia, efectividad y coste-efectividad de esta técnica, así como conocer cuáles son los mecanismos que producen su efecto terapéutico 10,14.
El objetivo del presente trabajo es analizar la bibliografía científica actual acerca de la ECP del globo pálido interno en la reducción de tics y comorbilidades asociadas en el Síndrome de Tourette.
MATERIAL Y MÉTODOS
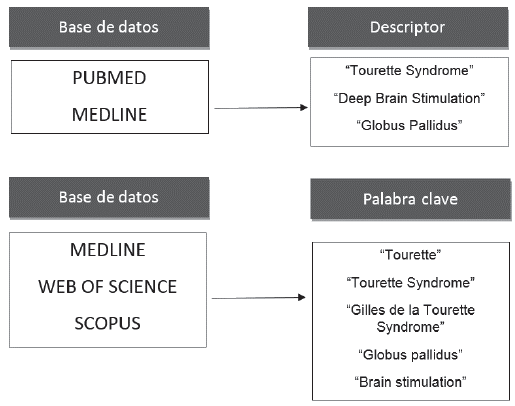
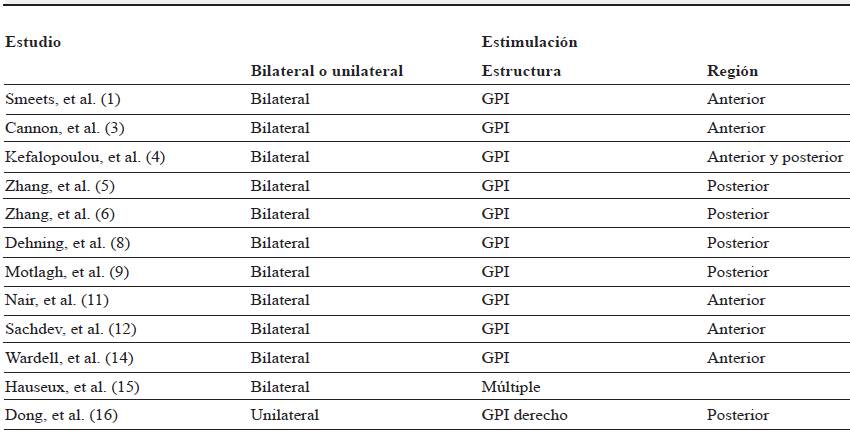
De acuerdo con el objetivo citado anteriormente, se realizó una búsqueda bibliográfica, durante los meses de febrero y marzo de 2017, en las bases de datos: Medline, Vubmed, Scopus y Web of Science. Para ello, se diseñó una ecuación de búsqueda en la que se utilizaron los términos "Tourette Syndrome", 'Deep Brain Stimulation", "Globus Valli-dus" como descriptores en Pubmed y Medline y, por otro lado, en las bases de datos Medline, Web Of Science y Scopus, los términos "Tourette", "Gilles de la Tourette Syndrome", "globus pallidus" y "brain stimulation" se emplearon como palabras clave (figura 1). Se obtuvo un total de 12 artículos.
Se seleccionaron aquellos artículos publicados desde el 2012 cuya muestra fueran humanos y cuyo idioma de publicación fuese el inglés, excluyendo todos aquellos a los que no fuese posible el acceso al texto completo, en los que únicamente se describiesen protocolos sin llevar a cabo el ensayo, las revisiones sistemáticas, las cartas al editor, aquellos artículos que, tras su lectura, se concluye no se ajustaban al objetivo del presente trabajo y los estudios repetidos en otras bases de datos.
RESULTADOS Y DISCUSIÓN
Se hace notable que, en los últimos cinco años, la investigación realizada en torno a la ECP del globo pálido interno es escasa y que todavía hay una marcada carencia de ensayos controlados aleatorizados. Entre los artículos analizados para la elaboración de la presente revisión encontramos: 8 ensayos clínicos 1,3,4,6,8,9,11,12, 3 series de caso 5,15,16 y 1 estudio de simulación 14.
Tras la lectura y análisis de los artículos seleccionados, se observa que poco más de un centenar de personas participaron en el total de estudios, ya que las muestras son, por lo general, pequeñas; extendiéndose desde los 2 participantes 16 hasta los 24 6. Existe un claro predominio de participación masculina frente a la femenina; de los 106 participantes que conforman el total de los estudios, 86 son varones y 20 mujeres. Esto tiene clara concordancia con la prevalencia de la enfermedad, la cual afecta en general más al sexo masculino, en una razón de 4,3: 1 16. El rango de edades de los participantes abarca desde los 12 15 (solo 1 paciente; siendo, tras ello, la edad de 15 años 11 la que conforma el mínimo) hasta los 57 años 1 (tabla 1).
Tabla 1 Características de los pacientes
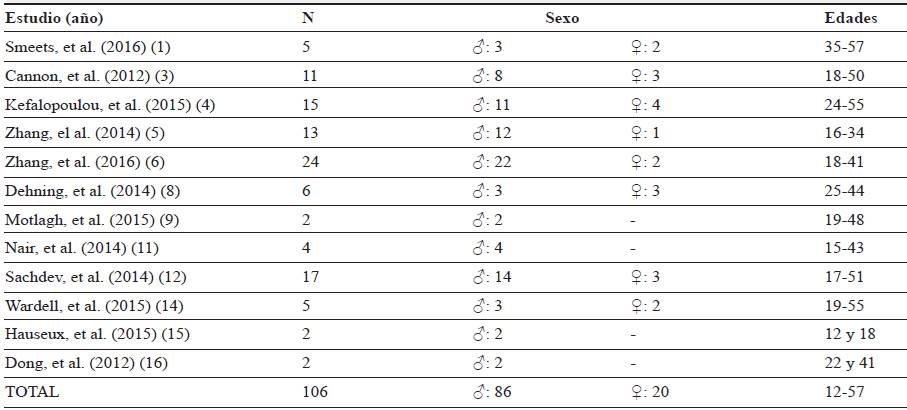
Nota: -, no especificado en el artículo; N, número de integrantes; σ, desviación estándar; ♂, hombres; ♀, mujeres.
Fuente: autores.
Los síntomas del síndrome de Tourette suelen aparecer entre los 4 y los 7 años; alcanza su máxima severidad en la pubertad y remite entre el 80 % 1,16 y el 95 % 8 de los pacientes en la edad adulta temprana 4-6,10. En los artículos analizados, las edades de aparición de los síntomas se sitúan en el rango de los 2 4,8,15 hasta los 29 años 6, aunque solo en 3 de los estudios se sobrepasan los 20 años y son 4 pacientes en total: dos con 20 años 5,6, uno con 23 4 y uno con 29 6; teniendo esto en consideración, la máxima edad a la que aparece sintomatología característica de este síndrome es a los 13 5,6.
Hasta ahora, la estructura ideal para la ECP en este trastorno continúa sin estar definida. De entre todas, el tálamo es el núcleo que parece gozar de mayor aceptación, tanto por ser el área de preferencia desde un principio, como por la mayor investigación realizada en cuanto a su electroestimulación 10. Con todo, dentro de las posibles estructuras candidatas a la técnica, el globo pálido interno es el objetivo de análisis de esta revisión.
En la ECP, los electrodos, por definición, se colocan de forma bilateral (en ambos hemisferios); todos los estudios lo llevan a la práctica, a excepción de uno 16, en el cual los electrodos se colocan de forma unilateral y en el hemisferio derecho. La justificación de ello reside en que los resultados obtenidos son similares a la estimulación bilateral, el coste del procedimiento es mucho menor, la estimulación del hemisferio izquierdo aumenta la probabilidad de problemas en el lenguaje y el globo pálido interno derecho es la región que suele estar más afectada y ocasionar los tics en los pacientes 16.
Dentro del globo pálido interno se diferencian dos regiones diana para la colocación de electrodos, localizadas a través de sistemas estereotácticos: anterior (anteromedial; límbica) y posterior (posterolateral ventral; motora). 5 estudios se centran en la primera, otros 5 en la segunda y los 2 restantes estimulan ambas regiones; en el de Hauseux, et al. 15, las estructuras seleccionadas variaron a lo largo del proceso de investigación por diversas complicaciones que surgen durante su desarrollo. Las diferentes regiones estimuladas en las investigaciones analizadas se muestran en la tabla 2.
Tanto electrodos como generadores de impulsos se implantan a través de intervenciones quirúrgicas bajo anestesia general o local. Las zonas de emplazamiento de los generadores son la región subclavicular 3,5,6,8,11,12,16 y la región abdominal 1,4,8,15. En los artículos analizados, los modelos de electrodos (3387 o 3389) y los generadores de pulsos empleados (Activa PC, Soletra, Kinetra o IPG) pertenecen al mismo fabricante (Medtronic), salvo en el estudio de Nair, et al. 11, donde se hace uso, a mayores, de otro modelo de electrodos: ANS. El voltaje empleado para la estimulación se extiende desde un mínimo de 0,1 v 5,9 hasta un máximo de 5,6 1; el ancho de los pulsos va desde los 60 μs 3,4,9,11,14 hasta los 450 15; en cuanto a la frecuencia, van desde un mínimo de 20 14 hasta un máximo de 200 Hz 9. En la tabla 3 se recogen todos los datos referentes a los parámetros de estimulación, así como al tipo de anestesia empleada para la implantación de los diferentes dispositivos.
Tabla 3 Parámetros utilizados en la intervención
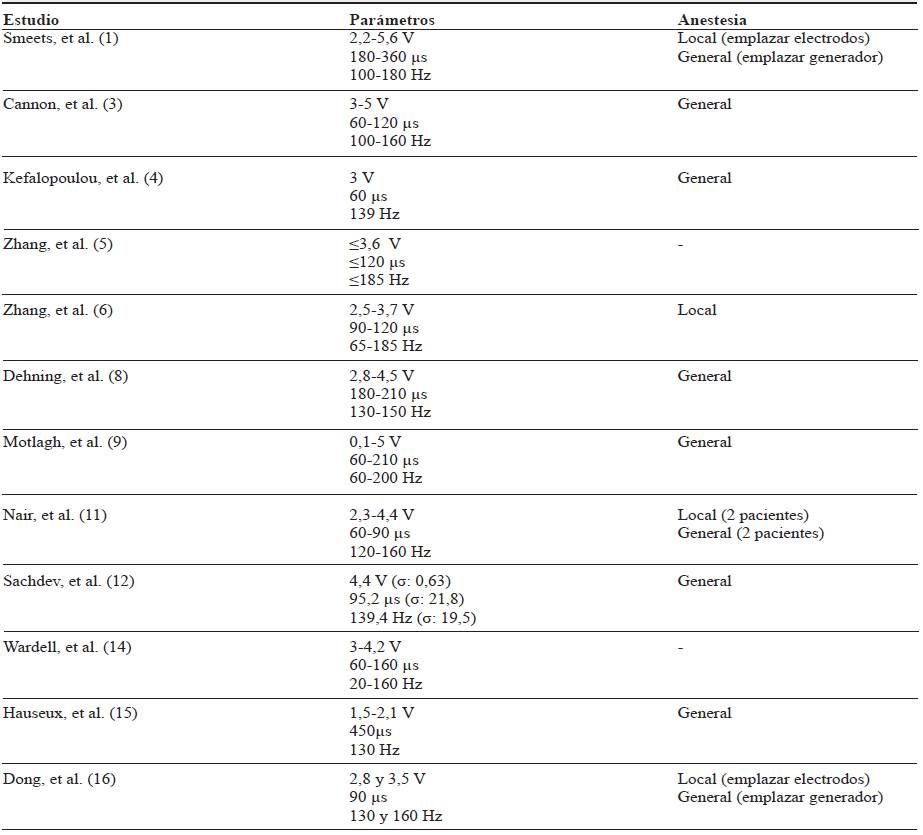
Nota: -, no especificado en el artículo; V, voltios; μs, microsegundos; Hz, Hercios; σ, desviación eestándar.
Fuente: autores.
Dentro del cuadro de complicaciones derivadas de la ECP que se pueden observar en los diferentes artículos, destacan: infecciones en las zonas de implantes de los generadores 1,5,6, piosis en la cabeza 5, pérdida de peso 1, aumento de peso 14, fatiga 6, mareo 6,12, agitación 1,5,12, convulsiones 6, aumento de tics 3,12, problemas visuales 6, problemas fónicos 14,15, roturas del generador 3,12, ansiedad 4,5,12,14,15, disfunción sexual 6, depresión 15 o ausencia de mejoría 8,9. Todas ellas se resuelven: corrigiendo el emplazamiento de electrodos o cambiando el dispositivo generador de impulsos 3,12,15, modificando los parámetros 1,5,6, cesando la estimulación 3,6,8,9,12 (hechos que marcan la diferencia entre la elección del tálamo o el globo pálido interno como estructura objetivo para la estimulación, puesto que el tálamo es efectivo en la reducción de tics pero no para la reducción de las comorbilidades 1) o a través de fármacos 1,4.
En lo relativo a los periodos de seguimiento de los pacientes, hay cierta variedad entre estudios (se extienden desde la primera semana posintervención 6,12 hasta más allá de los 60 meses 5,8,15), no así en cuanto a las variables a medir, donde se comparte el interés por cuantificar la reducción en la severidad de los tics, tanto vocales como motores, así como las limitaciones a las que se ven sometidos los pacientes a causa de ellos, a través de la Yale Global Tic Severity Scale (YGTSS), escala de referencia en el Síndrome de Tourette; presente en todos y cada uno de ellos. Se hace uso de otras escalas para la medición de diversas variables tales como la severidad de los TOC, TDAH, depresión, ansiedad, la calidad de vida o la funcionalidad de los pacientes (figura 2).
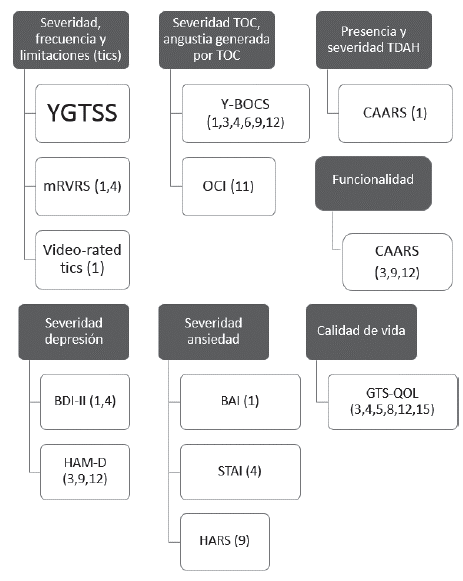
Nota: TOC, trastornos obsesivo-compulsivos; TDAH, trastorno de déficit de atención e hiperactividad; YGTSS, Yale Global Tic Severity Scale; mRVRS, modified Rush Video-based Tic Rating Scale; Y-BOCS, Yale-Brown Obsessive-Compulsive Scale; CAARS, Corners' Adult ADHD Rating Scale; BDI-II, Beck Depression Inventory (2nd edition); BAI, Beck Anxiety Inventory; HAM-D, Hamilton Rating Scale for Depression; GTS-QOL, The Gilles de la Tourette Syndrome-Quality of Life Scale; GAF, Global Assessment of Functioning; STAI, State-Trait Anxiety Inventory; HARS, Hamilton Anxiety Rating Scale; OCI, Obsessive-Compulsive Inventory. Fuente: autores.
Figura 2 Escalas
Tras la reunión de datos de preintervención, las intervenciones y la evaluación final de cada uno de los estudios, se observa que en 9 de los estudios se obtienen mejoras significativas (valor p<0,05 o disminuciones mayores del 50 %) en la YGTSS e, incluso, en el estudio de Nair, et al. 11 se objetivan remisiones completas en tics tanto motores como vocales, del mismo modo que en las limitaciones que estos causan (tablas 4 y 5). En los estudios de Smeets, et al. 1, y Kefalopoulou, et al. 4, estas mejoras también se reflejan en la escala modified Rush Video-based tic Rating Scale (mRVRS) con valores p-0,041 y p<0,0001, respectivamente.
Tabla 4 Resultados a través de la Escala YGTSS 1
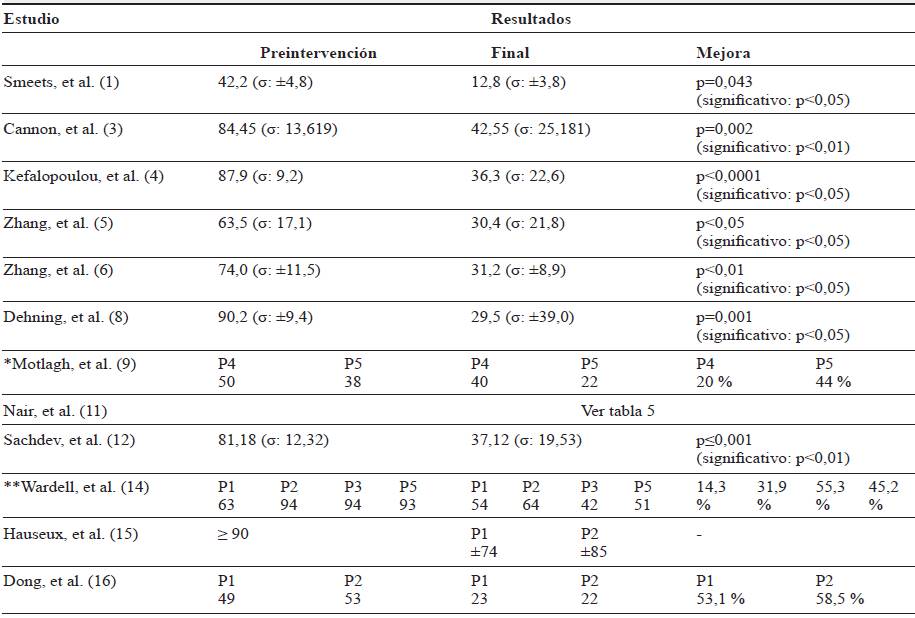
Nota: YGTSS, Yale Global Tic Severity Scale; σ, desviación estándar; P1, P2, P3, P4, paciente 1, 2, 3, 4; *, resultados de los 2 pacientes con estimulación en el GPI y YGTSS con resultados sobre 50; **, resultados de 4 de los 5 pacientes (uno de ellos sólo tiene datos pre intervención).
Fuente: autores.
Tabla 5 Resultados a través de la Escala YGTSS 2
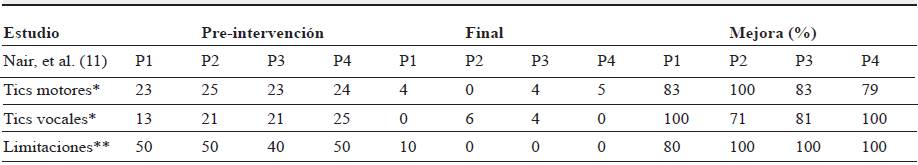
Nota: *, puntuación sobre 25; **, puntuación sobre 50; P1, P2, P3, P4, paciente 1, 2, 3, 4.
Fuente: autores.
En lo referente al resto de escalas, los resultados muestran mejoras estadísticamente significativas en cuanto a: la reducción de severidad de TOCS 3,4,6,9,11,12, depresión 3,4,12 (sin mejoras en los estudios de Smeets, et al. 1, y Motlagh, et al. 9) y en la calidad de vida de los pacientes 3,4,5,8,12 (sin mejoras en el estudio de Hauseux, et al. 15. En el resto de variables analizadas en los diferentes artículos, hay mejoras, pero no estadísticamente significativas (tabla 6).
Tabla 6 Otras escalas utilizadas para la medición de los resultados
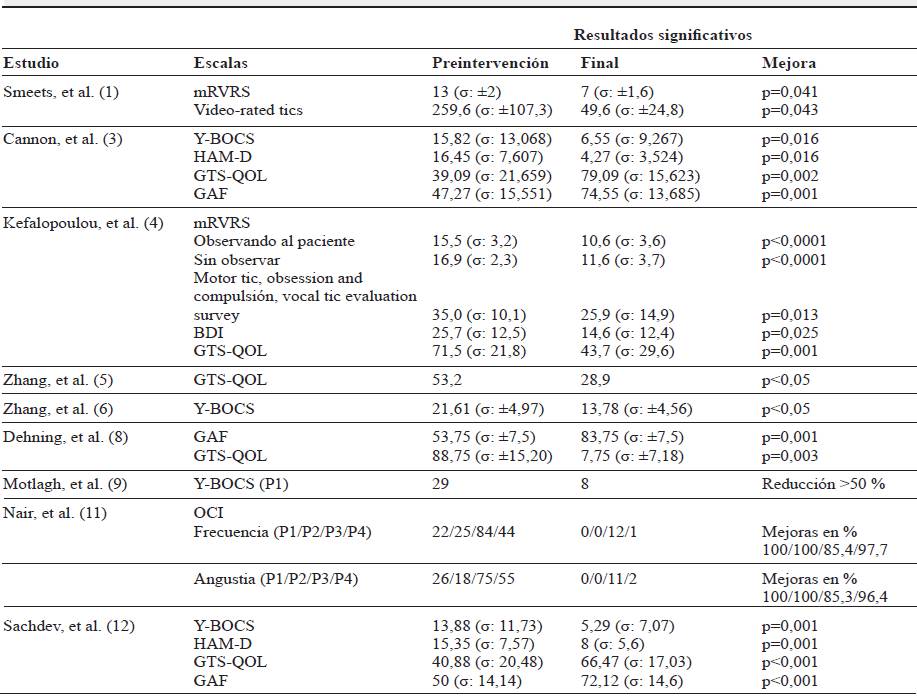
Nota: σ, desviación estándar; P1, paciente 1; mRVRS, modified Rush Video-based Tic Rating Scale; Y-BOCS, Yale-Brown Obsessive-Compulsive Scale; HAM-D, Hamilton Rating Scale for Depression; GTS-QOL, The Gilles de la Tourette Syndrome-Quality of Life Scale; GAF, Global Assessment of Functioning; BDI-II, Beck Depression Inventory (2nd edition); OCI, Obsessive-Compulsive Inventory.
Fuente: autores.
Tal como se ha mencionado, a pesar de la región estimulada dentro del globo pálido interno, así como del tipo de estimulación seleccionada (bilateral o unilateral) y las complicaciones que fueron surgiendo, los resultados obtenidos revelan una mejora general en lo referente a tics y a las limitaciones que estos provocan en los pacientes, reflejándose o bien como reducciones estadísticamente significativas (resultados con un valor de p<0,05) 1,3-6,8,12, o bien como reducciones mayores del 50 % en la YGTSS 9,11,14,16.
En cuanto a las comorbilidades psiquiátricas presentes en el Síndrome de Tourette, las diversas escalas empleadas muestran resultados esperanzadores, con mejoras estadísticamente significativas, o mayores del 50 %, en la reducción de los ToC 3,4,6,9,11,12, la depresión 3,4,12 y la calidad de vida 3-5,12.
Aun con todo, hay falta de uniformidad de resultados entre los estudios analizados, encontrándonos con pacientes con remisiones completas de tics vocales 1,11 y motores 1 (aunque la mayoría no queda libre de tics, pero sí se reducen la severidad, número y frecuencia de los mismos) y con pacientes que no experimentan mejora alguna o que, incluso, empeoran 1,3,4,6,8,11,12,14,15.
CONCLUSIONES
Para concluir, podemos afirmar que, a pesar de no existir evidencia suficiente por la carencia de estudios controlados aleatorizados, de resultados fiables y por la falta de uniformidad en los protocolos (de selección de pacientes y quirúrgicos) para llevar a cabo la neuroestimulación, la ECP en el globo pálido interno es una técnica que arroja resultados prometedores en el manejo de los tics y las comorbilidades que conforman este trastorno neuropsiquiátrico. Y no solo eso, sino que el número de pacientes que experimentan adversidades permanentes y se ven obligados a cesar el tratamiento es despreciable en comparación con todos aquellos que obtienen claros beneficios del mismo.
Se pone de manifiesto el hecho de que todavía queda mucho por investigar acerca de cuál es la fisiopatología y cuál es la estructura ideal a estimular para conseguir los mayores beneficios, sino la solución, en cuanto a la sintomatologia que caracteriza a este trastorno; esto debería convertirse en el foco de atención de las futuras investigaciones que se puedan llevar a cabo en este ámbito.
Basándonos en esta revisión, donde se toma al globo pálido interno como estructura objetivo de estudio dentro del compendio de los ganglios de la base, creemos que la ECP debería ser tenida en cuenta para su inclusión como tratamiento en el Síndrome de Gilles de la Tourette (así como ya lo es para patologías tales como la enfermedad de Parkinson, la distonía, los temblores esenciales, la epilepsia y los TOC) en pacientes con afectación severa y cuyo tratamiento farmacológico ha resultado ser ineficaz en el manejo de síntomas, abandonando de este modo el terreno experimental al que está actualmente sujeto.