INTRODUCCIÓN
La esclerosis múltiple (EM) es una enfermedad desmielinizante del sistema nervioso central (SNC) cuya fisiopatología está determinada por factores genéticos y ambientales 1-4. En Bogotá, la prevalencia se ha estimado en 4,4/100.000 habitantes 5. A pesar de que se han logrado avances importantes en su diagnóstico y manejo, algunos aspectos continúan siendo controversiales y requieren de un análisis cuidadoso de la evidencia, para no impactar de forma negativa la salud de los pacientes y la sostenibilidad de los sistemas de salud. En esta revisión de la literatura, se abordan algunos de los interrogantes más importantes en EM y se expone la evidencia que existe para responderlos.
1. ¿QUÉ ES LA EM AGRESIVA?
No existe una definición aceptada universalmente para la EM agresiva, entre 4 y 14 % de pacientes podrían tenerla 6,7. Se ha propuesto que se defina como una forma de recaída-remisión (RR) con una o más de las siguientes características 6,8:
Puntaje en la escala EDSS de 4,0 en los primeros cinco años desde el inicio.
Pobre respuesta a al menos un año completo de terapia con una o más terapias modificadoras de la enfermedad (TME).
Enfermedad progresiva con al menos un año con TME consistente en:
Dos o más recaídas incapacitantes con resolución incompleta.
Dos o más resonancias magnéticas (RM) que muestren nuevas lesiones o aumento del tamaño de lesiones en T2, o lesiones que realcen con el medio de contraste.
La EM maligna se ha definido como una "enfermedad con un curso rápidamente progresivo, que lleva a discapacidad significativa en múltiples sistemas neurológicos o muerte en un período relativamente corto luego del inicio de la enfermedad" 6,9. Debe diferenciarse de la EM agresiva por su deterioro y progresión rápidos desde el inicio 6.
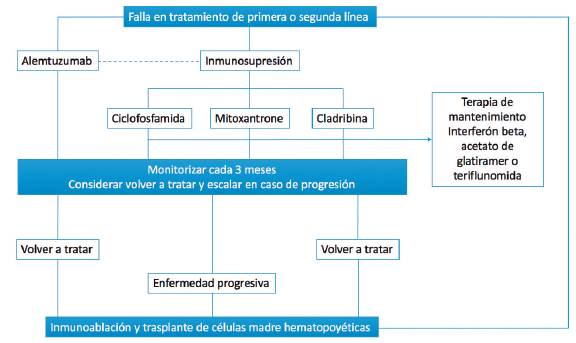
Los tratamientos iniciales utilizados para el manejo de la EM agresiva han sido mitoxantrona, cladribina, alemtuzumab y ciclofosfamida 6,8,10-12. Como alternativa en los casos refractarios, se ha propuesto el trasplante autólogo de médula ósea (TMO). No hay evidencia suficiente para establecer su eficacia y seguridad y hasta el momento es una terapia experimental, la mayoría de su evidencia proviene de estudios de cohortes y ensayos clínicos fase II 13-15. Los riesgos del TMO incluyen reactivación del virus varicela-zóster (VVZ), citomegalovirus y virus de Epstein-Barr 16, fatiga 14 y disfunción sexual 17,18. En la figura 1 se muestra el algoritmo de tratamiento de la EM agresiva.
2. ¿EXISTE LA EM BENIGNA?
El término EM benigna se creó como un indicador de la severidad de la enfermedad con el tiempo y se refiere a pacientes que permanecen libres de compromiso físico o cognoscitivo durante tiempos prolongados 19,20. Existen criterios clínicos que sugieren aplicar un punto de corte en la escala EDSS < 2 por mínimo 10 años de duración de la enfermedad, además de utilizar la RM como método de apoyo 20-22. Sin embargo, este término no corresponde al fenotipo de la enfermedad, algunos pacientes clasificados con EM benigna pueden desarrollar una EM-secundariamente progresiva (SP) y acumular discapacidad a lo largo del tiempo. La EM benigna no exime de la indicación de iniciar tratamiento modificador de la enfermedad, y se aconseja usar este término con cautela, pues estos pacientes pueden acumular una gran carga de discapacidad con el tiempo 23-25.
3. ¿LOS INTERFERONES ESTÁN EN DESUSO?
Los interferones se usan en pacientes con enfermedad en estadio temprano o en síndrome clínico aislado y reportan disminución o retraso de la aparición de una EM definitiva en al menos un año 26-28. Su efectividad a largo plazo está demostrada, al igual que su seguridad 29. Por su coeficiente de beneficio-riesgo son ampliamente usados en el mercado y existen TME con peores perfiles de seguridad y una eficacia similar 30. Las tasas de no adherencia al tratamiento oscilan entre 15 y 40 %, lo cual limita su eficiencia 28,31, sin embargo, las versiones pegiladas del medicamento permiten una mejor adherencia 30. Por lo tanto, la respuesta es no, estos medicamentos no están en desuso y siguen siendo relevantes.
4. ¿LOS MEDICAMENTOS GENÉRICOS SON INFERIORES A LOS INNOVADORES (ORIGINALES)?
En el 2016 existían 13 TME aprobadas para EM, pero el precio de los medicamentos sigue incrementando con el tiempo 32,33. En Colombia, 91,5 °% del gasto anual en salud para pacientes con EM está dirigido a TME y 58 % de los pacientes tienen tratamiento 34,35. Los genéricos deben demostrar equivalencia farmacéutica (entre 80-125 %) y bioequivalencia, por lo que se requieren menos estudios si se compara con el innovador 36. El acetato de glatiramer genérico ha mostrado resultados significativos en cuanto a eficacia y seguridad comparado con el Copaxone 33,36,37. El desarrollo de medicamentos biosimilares, a diferencia de los genéricos, requiere una mayor evidencia por lo que su producción es más lenta 32. La información con respecto a medicamentos genéricos en Latinoamérica es limitada, no obstante los ensayos realizados en otros países han sido satisfactorios para su aprobación. La inclusión de medicamentos genéricos en el mercado puede ayudar a regular el precio de los innovadores 35. Al igual que con todos los medicamentos -innovadores o genéricos-, la farmaco-vigilancia estricta es necesaria para detectar y reportar de forma temprana eventos y efectos adversos.
5. ¿ES SUPERIOR LA RM DE 3T A LA DE 1,5T EN EL DIAGNÓSTICO DE EM?
El desarrollo de la RM de 3T ha aumentado la precisión, velocidad y calidad de las imágenes. Su utilidad en la EM es controversial. Un estudio comparó la RM de 1,5T con la de 3T en la detección de atrofia cerebral en pacientes con EM. Se encontró que el volumen de atrofia cerebral de un mismo paciente era 35 %% mayor en la visualización con un resonador de 3T, y que la de 3T identificó una lesión inflamatoria perivenular con una sensibilidad de 90 %% y especificidad de 87 % 38,39. Sin embargo, un estudio publicado en 2018 en la revista Neurology por Hagens y colaboradores encontró que a pesar de que la RM de 3T detectó 15 %% más de lesiones comparado con la RM de 1,5T, esto no llevó a un aumento en el diagnóstico de EM 40. A pesar de que la RM de 3T tiene mayor sensibilidad en la detección de lesiones, no hay evidencia suficiente de que mejore el diagnóstico de EM en comparación con la RM de 1,5T.
6. ¿QUÉ UTILIDAD TIENE LA TOMOGRAFÍA DE COHERENCIA ÓPTICA (TCO) EN EM?
La TCO es una técnica que permite la obtención de imágenes de alta resolución de la retina y otras estructuras oculares 41. En el contexto de la EM, la TCO evalúa el nervio óptico y cuantifica el grosor de la capa peripapilar de fibras nerviosas de la retina (CFNR), que se ve reducido 42,43. Se ha encontrado una correlación inversa entre el grosor de la CFNR y discapacidad neurológica medida por la escala EDSS 44. Así mismo, los pacientes que presentaban una mayor progresión de la enfermedad, tenían una capa más delgada de CFNR que los que permanecían neurológicamente estables 45. La TCO ha surgido como una técnica de alta resolución de bajo costo, bien tolerada y con alta reproducibilidad, usada como predictor de daño visual y neurodegeneración en pacientes con EM, aunque no existe evidencia de su utilidad como un marcador de respuesta terapéutica 46-48. Igualmente, es de utilidad en la diferenciación entre la neuromielitis óptica y la esclerosis múltiple 49.
7. ¿CUÁL ES LA UTILIDAD DEL NEUROFILAMENTO (NF) EN EM?
Los NF representan el andamio proteico del citoesqueleto neuronal y determinan el calibre y la funcionalidad de los axones. La medición de la cadena liviana de neurofilamento (Nfl) refleja el daño neuroaxonal en la EM. Los niveles de Nfl en LCR y suero pueden ser medidos con una prueba de Elisa de cuarta generación, electroquimioluminisencia o la prueba SIMOA (single molecule array)50. Niveles elevados de Nfl se han correlacionado con la aparición de nuevas lesiones en RM, recaídas clínicas, discapacidad neurológica, respuesta a tratamiento y daño tisular en SNC 51, en tanto que puntajes altos en escala EDSS y progresión de la enfermedad se han correlacionado con niveles elevados de Nfl en LCR 52. El uso de una TME adecuada genera disminución en los niveles de NFl en LCR 52. Los niveles de cadena pesada de NF (NFP) se encuentran elevados en pacientes con EM variante RR, pero son llamativamente más altos en pacientes con formas progresivas de la enfermedad 53. Por esta razón, surgió la hipótesis de que los NFP reflejan la lesión axonal temprana causada por mecanismos inflamatorios, mientras que los NFP representan el daño neuronal crónico 53,54. Aunque los Nfl son útiles para medir la progresión de la enfermedad y la efectividad del tratamiento, su cuantificación no es una prueba de rutina en los pacientes con EM, ya que se debe realizar frecuentemente y esto aumentaría los costos para el sistema de salud 55,56.
8. ¿CÓMO SE MONITOREA AL PACIENTE ANTES DE INICIAR Y DURANTE EL TRATAMIENTO DE UNA EM?
El uso de las TME puede generar diferentes efectos sobre el organismo, por lo que se deben realizar exámenes paraclínicos antes y durante el tratamiento para monitorizarlo (tabla 1).
Tabla 1 Paraclínicos necesarios antes y durante el uso de las TME.

CH: cuadro hemático; PFH: pruebas de función hepática; PFR: pruebas de función renal; FT: función tiroidea; VVZ: varicelazóster virus; RMC: resonancia magnética cerebral; TBC: tuberculosis; JCV: virus de John Cunnningham; PA: presión arterial; EKG: electrocardiograma; UA: Uroanalisis; HPV: virus del papiloma humano.
Fuente: adaptado de Thompson, 2018; Wingerchuk, 2014; Cross, 2014; Rae-Grant, 2018 (106-109).
9. ¿CUÁLES SON LOS RIESGOS DE LINFOPENIA Y LESIÓN HEPÁTICA Y CÓMO SE MANEJAN?
La mayoría de las TME se asocian a linfopenia y lesión hepática con distinta severidad y frecuencia 57. Aunque usualmente estos efectos son leves, es necesario que el neurólogo conozca su frecuencia, sepa cómo abordarlos y cuándo se requiere descontinuar el medicamento. La linfopenia está especialmente descrita en los pacientes tratados con fingolimod, teriflunomida, alemtuzumab y dimetil fumarato, y se presenta entre 20 y 30 % de los pacientes que usan este último medicamento 58,59. Según los resultados de laboratorio en los exámenes de seguimiento, existe indicación de repetir los exámenes si el conteo linfocitario es inferior a 500 linfocitos x103/mL. Si el nivel de linfocitos no aumenta en seis meses se puede considerar descontinuar el tratamiento 58. Si la linfopenia está por debajo de 200 linfocitos x103/mL se debe interrumpir de inmediato el medicamento 57.
El daño hepático ocurre en todas las TME, pero su frecuencia es mayor en el dimetil fumarato, y se asocia con elevaciones de las transaminasas y bilirrubina sérica 60. Si la elevación es de 5 veces los valores normales, se repiten los niveles. Un aumento de 20 veces requiere descontinuarlos 57.
10. ¿CUÁLES SON LOS FACTORES DE RIESGO PARA LA LEUCOENCEFALOPATÍA MULTIFOCAL PROGRESIVA Y CUÁL ES EL CURSO QUE SE DEBE SEGUIR?
La leucoencefalopatía multifocal progresiva (LMP) es una enfermedad viral, mediada por reactivación del virus JC en un contexto de inmunosupresión severa 61,62. Las manifestaciones clínicas son variadas, cualquier área cerebral puede estar comprometida. El pronóstico es malo. La muerte es un desenlace frecuente si no se interviene. Sin embargo, al no existir actualmente tratamiento específico ni profilaxis para la LMP, el manejo consiste en suspender el medicamento, esperar la reactivación del sistema inmune y considerar inicio de plasmaféresis 61,63.
Inicialmente, el diagnóstico se realizaba con biopsia cerebral; todavía es el estándar de oro 64. Sin embargo, actualmente se diagnostica mediante características clínicas, radiológicas y PCR del virus en LCR; se requiere que los tres parámetros sean positivos para un diagnóstico definitivo. El riesgo de LMP es mayor con natalizumab, intermedio con dimetil fumarato y fingolimod, y muy bajo con el resto de los medicamentos 63. El riesgo de LMP y tratamiento con natalizumab se estratifica teniendo en cuenta el uso de medicamentos inmunodepresores en el pasado, tiempo de administración del natalizumab y presencia de anticuerpos anti-JCV (tabla 2). La presencia de estos no es una contraindicación absoluta para iniciar el tratamiento (son positivos en 50 %> de la población mundial), sin embargo, se aconseja cuantificarlos mediante el índice anti-JCV 63,65.
Tabla 2 Riesgo de LMP al tener en cuenta duración del tratamiento con natalizumab, índice de anticuerpos anti-JCV y uso previo de medicamentos inmunosupresores.
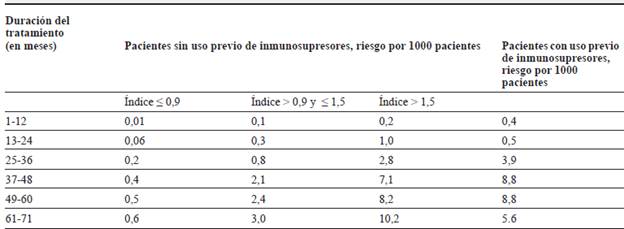
LMP: leucoencefalopatía multifocal progresiva; JCV: John-Cunningham virus. Fuente: adaptado de 65.
11. ¿HAY QUE DAR SUPLEMENTACIÓN DE VITAMINA D EN PACIENTES CON EM?
La vitamina D tiene funciones inmunomoduladoras y neuroprotectoras (tabla 3) 2,66. Se ha identificado que el alelo HLA-DRB1*15:01 es regulado por la vitamina D 1,2,67.
La producción de vitamina D se da mediante exposición a los rayos UV y la dieta, pero los rayos UV aportan una mayor cantidad y la exposición durante 20 minutos produce cerca de 10000 UI de vitamina D 66. Se ha sugerido mantener niveles de vitamina D por encima de 50 nmol/L en pacientes con EM 68,69. Los ensayos que han evaluado la relación entre EM y vitamina D son el BENEFIT, el EPIC, el BEYOND, el STAyCIS, el Southern Tasmanian MS Longitudinal Study, el Finnish Vitamin D Study, el SOLAR, el CHOLINE, el VITADEM, el EVIDIMS, el PrevANZ, el D-Lay-MS y el VIDAMS 69. Para concluir, no hay evidencia significativa para recomendar la suplementación con vitamina D en pacientes con EM, aunque esta parece ser segura a las dosis y con los esquemas de suplementación usados habitualmente 70,71.
12. ¿SE PUEDE SUSPENDER EL TRATAMIENTO INMUNOMODULADOR?
El perfil de seguridad de algunas TME como el interferón beta y el acetato de glatiramer es favorable a largo plazo. Sin embargo, las TME más recientes como natalizumab, fingolimod y alemtuzumab predisponen a un alto riesgo de LMP o autoinmunidad secundaria, principales razones por las que se suspenden 72. La actividad inflamatoria de la EM disminuye con el tiempo, por lo que en pacientes con EM-RR podría considerarse la suspensión de las TME si la enfermedad se ha estabilizado 72,73. No obstante, la suspensión de las TME en forma prematura se asocia con un riesgo de retorno a la actividad inflamatoria previa de la enfermedad 74-76. Es necesario aclarar que la enfermedad no desaparece con el tiempo, ni es potencialmente curable, por lo que debe haber seguimiento clínico y radiológico en todo caso 58,72. Ser mayor de 45 años, la ausencia de actividad clínica por cuatro años o más durante el tratamiento y la ausencia de lesiones activas en RM predicen ausencia de recaídas luego de suspender el interferón beta o acetato de glatiramer 72. Solo 10 °% de los pacientes vuelven a utilizar el medicamento y en casi todos los casos es por elección personal 73.
13. ¿SE DEBE MANTENER EL TRATAMIENTO INMUNOMODULADOR EN PACIENTES CON EM-SP?
En pacientes con EM-SP confirmada es posible suspender la TME, aunque se recomienda esperar al menos cinco años desde el diagnóstico 72,75. Medicamentos como la azatioprina, ciclosporina, ciclofosfamida, interferones, fingolimod, natalizumab, alemtuzumab y metotrexate no reducen la progresión de la EM-SP e incluso pueden ser deletéreos para el paciente 77-81. La mitoxantrona ha demostrado resultados positivos, sin embargo, se usa poco por su alta toxicidad y pobre perfil de seguridad 77,78,82. Se ha evaluado el uso de la cladribina, dirucotida y la molécula MIS416 para disminuir la progresión en pacientes con EM-SP, sin éxito 77,78,82. El mastinib y el siponimod han mostrado resultados en estudios clínicos de fases iniciales, pero la evidencia actual es insuficiente para recomendarlos 75,77,78,83. Todo lo anterior indica que no hay suficiente evidencia para mantener el tratamiento en EM-SP, especialmente al tener en cuenta los costos de los medicamentos y el equilibrio de riesgo-beneficio.
14. ¿CUÁNTO ES EL PERIODO IDEAL DE WASHOUT AL CAMBIAR DE TME EN EM?
El natalizumab es un medicamento efectivo para EM, pero causa inmunosupresión y aumenta el riesgo de desarrollar LMP. La mayoría de los pacientes que cambian el natalizumab lo hacen por miedo a desarrollar LMP, por lo que es importante conocer el protocolo de washout del medicamento 84. El concepto de washout o lavado sugiere que el paciente se beneficia de un periodo sin TME tras suspender el medicamento actual, para dar tiempo a que este se elimine y no haya efectos adversos combinados. Este concepto es particularmente importante en el caso de la suspensión del natalizumab. El periodo de lavado que cuenta con mejor evidencia es de ocho semanas antes de iniciar otro tratamiento 85,86. No se debe esperar más de ocho semanas para iniciar un nuevo tratamiento, pues se asocia a un aumento del riesgo de recaídas 85,87. En general, las demás TME no necesitan un período de washout, a menos que sea una situación especial 88.
15. ¿ESTÁN RECOMENDADAS LAS DIETAS LIBRES DE GLUTEN?
El gluten es una proteína que se encuentra en el trigo, importante en la fisiopatología de la enfermedad celiaca (EC), una enfermedad autoinmune 89. Existe la creencia de que, al ser la EM una enfermedad con componente auto-inmune, el gluten desempeña un factor etiológico, lo que hace frecuentes las dietas libres de gluten en pacientes con EM 90. Igualmente, hay un solapamiento genético, se han descrito 12 loci compartidos entre EM y EC, pero al menos cinco de estos tienen efectos opuestos 91. A pesar de que existe evidencia conflictiva respecto a la asociación entre EM y EC, no hay evidencia de aumento de la prevalencia de la sensibilidad al gluten en pacientes con EM 92,93. En la actualidad no existen experimentos aleatorizados que evalúen la asociación entre consumo de gluten y EM, por lo que no se pueden recomendar las dietas libres de gluten como intervenciones para mejorar el pronóstico o disminuir el riesgo 89,92.
16. ¿CUÁL ES EL PAPEL DE LAS VACUNAS EN EM?
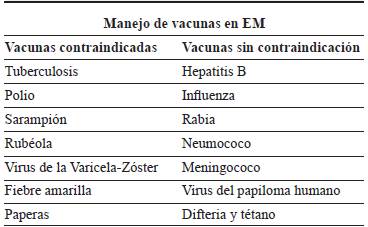
Los pacientes en tratamiento con ocrelizumab o alemtuzumab tienen riesgo de infección por el virus de hepatitis B (VHB), por lo que se deben medir anticuerpos y vacunar si es necesario. En cuanto al uso de otras TME, no hay evidencia de que aumenten el riesgo de infección por VHB 63,94-96. En cuanto al VVZ, debe evaluarse en pacientes con fingolimod 97. Es importante medir anticuerpos contra VVZ antes de iniciar este medicamento y vacunar según esté indicado 98,99. No hay evidencia de aumento de recaídas luego de la vacuna contra influenza 100-104. Así mismo, se deben aplicar las vacunas necesarias dependiendo de la edad, sexo y factores de riesgo, antes de iniciar tratamiento. Se deben evitar las vacunas vivas atenuadas, ya que pueden exacerbar la EM y causar infecciones 63,105. Si se requiere aplicar una de estas vacunas (tabla 2), debe realizarse cuatro semanas antes de iniciar una TME 63.