SIGLAS
EE: estado epiléptico
ILAE: International League Against Epilepsy
VEEG: video electroencefalografía
ACN: Asociación Colombiana de Neurología
RIQ: rango intercuartílico
BZD: benzodiacepinas
IM: intramuscular
IV: intravenoso
UCI: unidad de cuidado intensivo
SNC: sistema nervioso central
CPK: creatina-fosfocinasa
TAC: tomografia axial computarizada
RMN: resonancia magnética nuclear
DC: dieta cetogénica
DAM: dieta Atkins modificada
STESS: Status Epilepticus Severity Score
EMSE: Epidemiology based Mortality score in Status Epilepticus
END-IT: encephalitis, NCSE, diazepam resistance, image abnormalities and tracheal intubation
APACHE II: Acute Physiology and Chronic Health Evaluation II
Invima: Instituto Nacional de Vigilancia de Medicamentos y Alimentos
INTRODUCCIÓN
El estado epiléptico (EE) es una condición ocasionada por la falla en los mecanismos de supresión de las crisis epilépticas y/o el inicio de mecanismos anormales neuronales que prolongan las crisis. En la actualidad se considera estado epiléptico la presencia de crisis epilépticas de cinco o más minutos de duración o la presencia de dos o más crisis sin recuperación de la conciencia entre una y otra 1.
Se considera que es una urgencia neurológica y ello obliga al profesional de la salud a conocer las características de presentación para poder estabilizar al paciente (tabla 1) 2. La mortalidad varía entre el 2 % y el 50 %, según el grupo etario, siendo más letal en adultos mayores, y depende del diagnóstico temprano y el tratamiento oportuno 3. Se han reportado tasas de 14 pacientes por cada 100.000 personas/ año en la población general, con mayor frecuencia en sujetos mayores de 60 años (28 casos por cada 100.000 personas/ año), y se describe una relación genética, por antecedentes en los primeros grados de consanguinidad 4-7. En niños, se estima que al incidencia anual de EE oscila entre 17-23 por cada 100.000 niños 8,9, de los cuales el 10-40 % desarrollan EE refractario, con una mortalidad entre 16-42,5 % 10-12.
En el 2015 Trinka sugirió una clasificación que fue aceptada por la ILAE, la cual considera sus características clínicas, tiene en cuenta la semiología, su etiología, la correlación electroencefalográfica y la edad, como se detalla a continuación 13,14.
A. Presencia de síntomas prominentemente motores
1. EE convulsivo
IA. EE convulsivo generalizado
IB. Focal con evolución a bilateral
IC. Inicio desconocido focal o generalizada
2. Mioclónica
2A. Con coma
2B. Sin coma
3. Focal motora
3A. Crisis focales motoras repetitivas (jacksoniana)
3B. Epilepsia parcial continua
3C. EE versivo
3D. EE oculoclónico
3E. Paresia ictal focal
4. EE tónico
5. EE hiperkinético
B. Sin presencia de síntomas motores prominentes
1. EE no convulsivo
IA. con coma
IB. Sin coma
2. EE generalizado
2A. EE Ausencia típica
2B. EE de ausencia atípica
2C. EE ausencia mioclónica
3. Focal
3A. Sin compromiso de la conciencia
3B. EE de afasia
3C. Con compromiso de la conciencia
4. De inicio desconocido focal o generalizado 4A. EE autonómico
Efecto de la intervención (cambios en la video electroencefalografía-VEEG, posteriormente al medicamento)
En Latinoamérica y Colombia, los gobiernos y las sociedades médicas científicas han realizado esfuerzos orientados a unificar la mejor evidencia disponible con el fin de homogenizar los tratamientos y mejorar la calidad de vida de los pacientes. Sin embargo, una gran parte de los profesionales de la salud desconocen la existencia de estas herramientas, por lo cual persiste la heterogeneidad en los criterios diagnósticos y en el manejo. Por esto, surgen alternativas como los consensos de expertos que, a pesar de no tener las características de una guía de práctica clínica, pueden ser una opción al momento de conocer la experiencia en la vida real y teniendo en cuenta el contexto local. En este caso, el consenso de expertos en el tratamiento del EE tuvo en cuenta las consideraciones en relación con la disponibilidad de medicamentos en nuestro país, así como las características propias del sistema de salud colombiano, y contó con el apoyo de la Asociación Colombiana de Neurología (ACN). Esta iniciativa pretende mostrar una serie de sugerencias para que los profesionales de la salud (neurólogos y no neurólogos) puedan orientar el abordaje de un paciente con EE y mejorar la atención en esta patología. Es importante mencionar que este documento es de carácter científico y académico, pues es el resultado de la experiencia de un grupo de epileptólogos que se reunieron para discutir las características propias del EE y sus consideraciones para el manejo en Colombia. Así, el objetivo de este trabajo fue construir una serie de sugerencias para el tratamiento del EE, como resultado del consenso de expertos en epilepsia, teniendo en cuenta el contexto colombiano.
MÉTODOS
Se estructuró un grupo de expertos en diagnóstico y tratamiento del estado epiléptico (EE) constituido por 16 neurólogos-epileptólogos (14 de adultos y 2 pediátricos) integrantes del capítulo de epilepsia de la ACN. El consenso estuvo liderado por el grupo desarrollador, en el que participaron dos neurólogos-epileptólogos y un epidemiólogo, quienes diseñaron las preguntas y ejecutaron el consenso tanto metodológicamente como logísticamente.
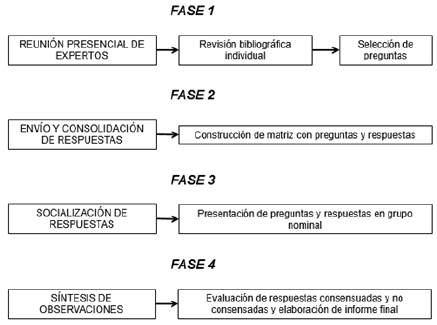
La ejecución del consenso se realizó en cuatro fases (figura 1). En la fase 1 el grupo desarrollador estructuró las preguntas, las cuales fueron enviadas a los expertos utilizando un cuestionario virtual. Una vez se obtuvieron las primeras respuestas y comentarios, en la fase 2 se consolidó la información de acuerdo con las respuestas. El sistema de calificación para cada opción se dio mediante escala tipo Likert entre 1 y 9 (1 significa extremadamente inapropiado, 2 y 3 usualmente inapropiado, 4, 5 y 6 equivoco, 7 y 8 usualmente apropiado y 9 extremadamente apropiado). Se construyó una matriz de información donde se consignaron las calificaciones, las cuales se analizaron con medianas y rangos intercuartílicos (RIQ). Las opciones puntuadas con medianas y RIQ entre 1 y 3 y entre 7 y 9 se consideraron consensuadas y las restantes se presentaron en la fase 3 (nominal), manteniendo el anonimato de los expertos, con el fin de discutir los resultados. Al finalizar, en la fase 4 (síntesis) los expertos aportaron la literatura revisada para la inclusión en este manuscrito y el grupo desarrollador estructuró este último.
RESULTADOS
Se incluyeron 17 expertos entre neurólogos, neuropediatras epileptólogos y neurofisiólogos. Con un promedio de experiencia en epilepsia de cuatro años y representando a cinco ciudades colombianas: Bogotá, Medellín, Bucaramanga, Cali y Pereira. Se presentaron inicialmente 26 preguntas, las cuales fueron evaluadas y, de acuerdo con su pertinencia, se consideraron posteriormente 15 de ellas. Una vez definidas, estas fueron revisadas y evaluadas individualmente por cada experto de manera enmascarada. Finalmente, en el consenso nominal/presencial se discutieron las respuestas para construir las sugerencias definitivas. De acuerdo con esto, a continuación se presentan las preguntas con sus respectivas respuestas.
1. ¿Qué maniobras se deben utilizar en la fase de estabilización del paciente con estado epiléptico?
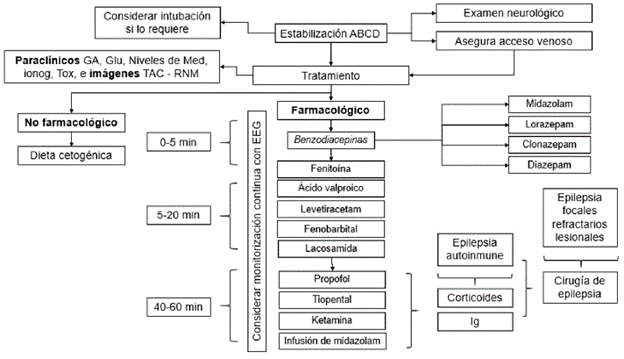
Se considera el paciente con EE como un paciente crítico, por lo cual se debe iniciar con el soporte básico de atención, aplicando maniobras del ABC y garantizando: asegurar vía aérea, oxigenación, monitorizar signos vitales y lograr un acceso venoso para colocación de líquidos y toma de exámenes de laboratorio 15.
Enfoque neurológico
Descripción detallada de la semiología de la crisis epiléptica y fenómenos asociados
Evaluar si el paciente tiene diagnóstico de epilepsia o si está debutando
Interrogar antecedentes patológicos, toxicológicos y fenómenos precipitantes
Se debe revisar los antecedentes del paciente para conocer si estaba recibiendo medicamento antiepiléptico (tipo y dosis), o está debutando con el EE, lo cual ayuda a la selección de la mejor opción terapéutica de acuerdo con la clínica. En pacientes que vienen recibiendo antiepilépticos, es importante examinar si hubo suspensión o cambios en la dosis, con el fin de considerar si el paciente necesitará el mismo medicamento para el control de EE 16.
En la población pediátrica, es frecuente el EE febril, por lo cual se hace fundamental establecer cuál es el foco primario e iniciar manejo antipirético como parte del abordaje y estabilización inicial del paciente.
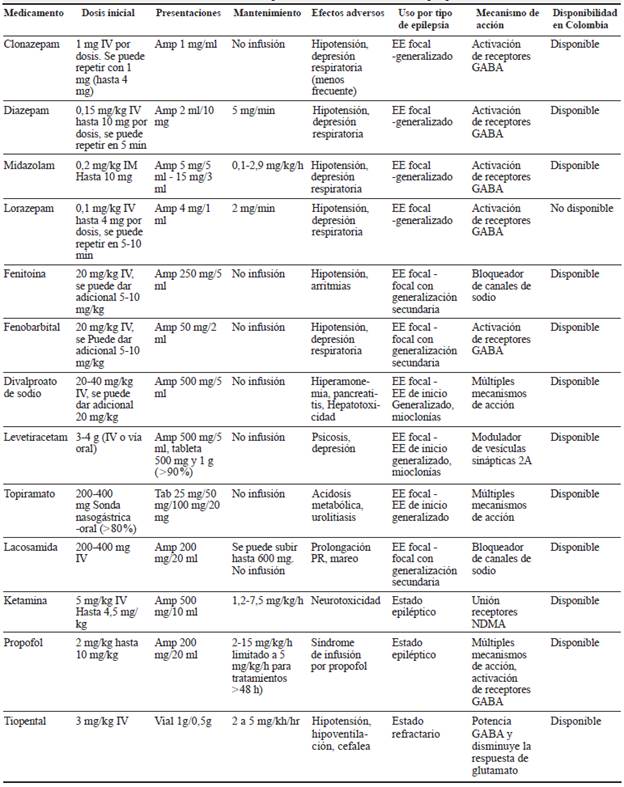
2. ¿Cuál antiepiléptico considera utilizar para el tratamiento en el estado epiléptico de 0-5 minutos?
Una vez de sospecha el EE, se deben considerar los tiempos de atención según la Liga Internacional contra la Epilepsia (ILAE, por sus siglas en inglés: International League Against Epilepsy) para iniciar tratamiento farmacológico, tan pronto se haya estabilizado el paciente (tabla 1).
El uso de las BZD debe estar sujeto a la disponibilidad de medicamentos y de la vía de administración más rápida, por la duración del efecto y el conocimiento en el manejo de las complicaciones. Se deben considerar los efectos adversos, la interacción medicamentosa y la edad del paciente (tabla 2) 18-20.
En el periodo neonatal, si bien no existe un consenso acerca de la definición de EE o el manejo antiepiléptico, en la mayoría de los casos se considera el uso de fenobarbital como la primera línea de manejo y, en forma menos frecuente, benzodiacepinas 21.
3. ¿Cuál antiepiléptico considera utilizar para el tratamiento en el estado epiléptico de inicio focal (5-20 minutos)?
Es importante tener en cuenta que si el EE se debe a suspensión del medicamento que venía recibiendo, este debe ser la primera línea de elección para el manejo del EE siempre y cuando sea el indicado. Se debe evaluar la edad del paciente, género, comorbilidades, embarazo e interacciones medicamentosa 17.
4. ¿Cuál antiepiléptico considera utilizar para el tratamiento en el estado epiléptico de inicio generalizado (5-20 minutos)?
En la población pediátrica, el uso de ácido valproico como segunda línea de manejo ha mostrado una efectividad similar e incluso superior a la observada con fenobarbital y levetiracetam 22. El levetiracetam, a pesar de tener estudios que muestran su efectividad en el manejo EE en niños, presenta una importante limitante en nuestro país teniendo en cuenta que la aprobación para su uso es en pacientes mayores de cuatro años 23. Se sugiere ácido valproico de primera línea en epilepsias mioclónicas tanto en niños como en adultos.
5. ¿Cuál antiepiléptico considera utilizar en el tratamiento en el estado epiléptico refractario (30-60 minutos)?
Los pacientes con estado epiléptico refractario deben estar hospitalizados en la unidad de cuidado intensivo (UCI) o bajo monitorización continua, donde se considere soporte ventilatorio de acuerdo con el estado del paciente 24,25. Es importante tener en cuenta la probabilidad de depresión respiratoria ocasionada por el medicamento y la necesidad imperante del monitoreo estricto 16.
La inducción a estado de coma es el manejo más frecuentemente utilizado tras la falla de la primera y la segunda línea de fármacos antiepilépticos; sin embargo, la ausencia de estudios clínicos controlados impide establecer un medicamento ideal que permita cumplir los objetivos de cese de crisis, supresión de actividad electroencefalográfica y duración del tratamiento. En niños, la primera opción para el manejo de estado epiléptico refractario son las BZD en infusión continua, seguido por el uso de barbitúricos (tiopental o pentobarbital) como segunda línea. El propofol, si bien esta reportado para el uso en adultos, en niños tiene un uso limitado, debido al síndrome de infusión de propofol, por lo que se recomienda su uso con precaución, particularmente en dosis superiores a 65 (g/kg/min. Como tercera línea de manejo se puede plantear el uso de ketamina 26.
6. ¿Cuál antiepiléptico o medicamento coadyuvante considera utilizar para el tratamiento del estado epiléptico superrefractario?
El estado superrefractario es el resultado del no control de los estados iniciales del EE. Por esta razón, se considera que al enfrentarse a la falla terapéutica en los tratamientos anteriores, se debe remitir el paciente a un nivel de mayor complejidad.
Los antiepilépticos sugeridos son: 1 midazolam (infusión continua) o propofol, teniendo en cuenta la experiencia y el perfil de eventos adversos, 2 tiopental, 3 ketamina (Tabla 2) y tratamientos coadyuvantes como los esteroides (metilprednisolona), inmunoglubulinas o plasmaférisis. En las epilepsias de probable origen autoinmune, dieta cetogénica y si es el caso evaluar las indicaciones de cirugía de epilepsia 27.
El uso de la ketamina en el estado epiléptico refractario y en el superrefractario es una opción en pacientes con trauma o que estén inestables hemodinámicamente.
7. ¿En qué momento del estado epiléptico considera utilizar brote-supresión?
Se debe considerar en estados epilépticos refractarios y superrefractarios, durante 12-24 horas bajo monitoreo video electroencefalograma (VEEG), según disponibilidad y complejidad en el servicio de salud.
El brote-supresión es inducido por medicamentos, en el VEEG se observan periodos de ausencia de la actividad eléctrica cerebral (electrodecremento generalizado) intercalados con periodos de brotes de actividad eléctrica. El 40 % de los pacientes son llevados a brote- supresión farmacológico, al no controlar el EE en etapas tempranas y por consiguiente son llevados a sedación profunda 28-30.
El mejor tratamiento del EE refractario sigue sin estar claro. Sin embargo, las guías actuales recomiendan el tratamiento con una infusión continua de un anestésico. Los fármacos anestésicos disponibles para infusión continua incluyen midazolam y propofol. La principal preocupación de una infusión de fármaco anestésico es que prolonga la duración de la ventilación mecánica, la inmovilización y la hipotensión. Se ha demostrado que el midazolam tiene un amplio margen de seguridad y es fácil de usar 31.
8. ¿Cuánto tiempo debe permanecer un paciente con estado epiléptico en brotesupresión?
Las guías actuales para el manejo de EE recomiendan el tratamiento con una infusión continua de un anestésico como el midazolam o el propofol. Se ha demostrado que el midazolam tiene un amplio margen de seguridad y es fácil de usar. El brote-supresión de origen farmacológico se logra en promedio en el 51 % de los pacientes y así se consigue un mejor control del EE. Sin embargo, existe evidencia de la relación del uso de medicamentos anestésicos y complicaciones intrahospitalarias, mortalidad y pobres resultados funcionales. El brote-supresión se recomienda durante un periodo de 24 a 48 horas seguido del descenso gradual del fármaco anestésico 32.
La recomendaciones actuales basado en en estudio retrospectivos, de Wolfgan y Cols 33, que las dosis más altas de anestésico utilizadas durante el primer ensayo de coma terapéutico, se asociaron de forma independiente con menos complicaciones intrahospitalarias (P = 0,003) y se asociaron con una menor duración de la ventilación mecánica y la duración total de la estancia. La duración del coma terapéutico se identificó como un predictor independiente de recurrencia de la crisis con un punto de corte óptimo a las 35 horas, por lo que concluyen que la duración más corta pero más profunda como tratamiento de Estado Epiléptico refractario puede ser más efectiva y más segura .
9. ¿En qué pacientes con estado epiléptico se considera hacer monitorización continua con VEEG?
La monitorización continua con VEEG debe hacerse en pacientes con:
EE - duración mayor a una hora
Sospecha de EE no convulsivo
EE refractario
EE superrefractario
Necesidad de llevar a un paciente a brote-supresión
Deterioro del estado de conciencia
Sospecha de recaída
Persistencia de crisis
Evaluación de la eficacia al tratamiento
Esta monitorización debe realizarse por al menos 24 horas, pues la literatura refiere una sensibilidad del 88 % para la detección de las crisis. La ampliación en el tiempo ha reportado sensibilidades de 6-12 horas: 82 °%, 12-24 horas: 88 °%, 24-48 horas: 93 °% y entre 48 y 96 horas: 96 <%.
Este monitoreo debe ser interpretado por un experto y en tiempo real; se sugiere un reporte cada 12 a 24 horas 28.
Es importante tener en cuenta que existen algunas patologías que aumentan el riesgo de presentar EE, entre las cuales se encuentran 28,34,35:
Pacientes sin patologías neurológicas hospitalizados en la UCI
Ataque cerebrovascular isquémico (1-10 °%)
Hemorragia subaracnoidea (10-14 °%)
Hemorragia intracraneal (1-21 %)
Trauma craneoencefálico moderado o severo (8-14 %)
Infecciones del SNC
Tumor cerebral
Encefalopatía hipóxico-isquémica (30 %)
Las crisis epilépticas en el VEEG ocurren aproximadamente en el 20 % de los casos, donde el paciente se encuentra en condiciones críticas y con vigilancia electroencefalográfica continua. Se ha demostrado que estas convulsiones pueden ocasionar impactos hemodinámicos y metabólicos, lo cual implica un peor pronóstico para el paciente. Por esto, se sugiere la monitorización por al menos 24 horas si el paciente no se encuentra en estado de coma, y 48 horas si sus condiciones son críticas y está en estado de coma 36.
La VEEG continua permite al clínico establecer el cese de la actividad epiléptica electroencefalográfica, y el seguimiento de la actividad de brote-supresión, en caso de que se requiera, es útil para guiar la inducción de coma farmacológico como también la identificación de crisis electrográficas, las cuales recurren frecuentemente durante la titulación y retiro de los agentes anestésicos. Existe evidencia de que un tercio de los niños con EE pueden desarrollar crisis electrográficas y de estos al menos la mitad desarrollan estado epiléptico no convulsivo 26.
10. ¿A cuánto tiempo del estado epiléptico está indicado la realización de la monitorización continua con VEEG?
La monitorización del paciente con EE se debe iniciar, preferiblemente, a partir de la primera hora si este no ha sido controlado o no recupera por completo el estado de conciencia.
Si por razones geográficas o disponibilidad de equipos no es posible hacer una monitorización continua con VEEG, el profesional de la salud a cargo debe mantener el control de EE e iniciar remisión a un centro de salud de con disponibilidad de VEEG.
Se considera que un paciente que no recupera el estado de conciencia en el contexto del EE, tiene una probabilidad del 50-70 °% de ser refractario, lo cual obliga a la monitorización continua para determinar su duración y finalización 32.
11. ¿Qué exámenes diagnósticos de sangre considera en el estado epiléptico?
Dentro del manejo integral del paciente con EE se deben solicitar los siguientes paraclínicos, con el fin de determinar la estabilidad del paciente y empezar el estudio de las causas más frecuentes del EE 4,16:
Hemograma
Gases arteriales
Glicemia
CPK (en sospecha de eventos paroxísticos no epilépticos)
Función hepática
Función renal
Ionograma
Tamizaje toxicológico (si se sospecha intoxicación, complementar en orina)
Niveles séricos de antiepiléptico
Es importante mencionar que la solicitud de estas pruebas diagnósticas es el complemento a una evaluación clínica; si el paciente viene con un acompañante, se debe interrogar los antecedentes del paciente, a efectos de identificar posibles factores desencadenantes como la suspensión de los medicamentos antiepilépticos (tabla 3).
12. ¿Qué imágenes diagnósticas considera en el paciente con estado epiléptico?
La realización de imágenes diagnósticas debe hacerse en pacientes sin diagnóstico o en quienes se sospeche una causa estructural intracerebral. Por esta razón, se sugiere realizar tomografia axial computarizada (TAC) cerebral y/o resonancia magnética nuclear (RMN) cerebral, de acuerdo con la disponibilidad, y si no está disponible, debe remitir al paciente cuando se haya estabilizado el EE. Una vez se estabilice el paciente y si existen indicaciones de continuar el estudio, pueden realizarse cortes especiales en RMN cerebral. De la misma forma, se debe considerar el uso del contraste en los casos en que se sospecha infección de SNC o en presencia de alguna lesión tumoral 37.
13. ¿Cuál o cuáles son las indicaciones para el inicio de estudios de cirugía de epilepsia en pacientes con estado epiléptico?
La elección de cirugía para epilepsia es el resultado de una evaluación multidisciplinaria en la cual el paciente, de acuerdo con sus características, puede ser candidato a este procedimiento. Dentro de esta indicaciones se encuentran:
Una vez se ha definido su indicación, se pueden realizar intervenciones como: lesionectomía, callosotomía, estimulación de nervio vago u otro tipo de neuromodulación y hemisferectomía 30,38).
14. ¿Cuál o cuáles son las indicaciones para inicio de dieta cetogénica en pacientes con estado epiléptico?
La dieta cetogénica (DC) es una terapia coadyuvante no farmacológica que ha demostrado ser efectiva en pacientes con estado epiléptico superrefractario; la DC y la DAM son dietas de alto contenido graso, bajas en carbohidratos, con adecuadas proteínas, diseñadas para imitar el estado de ayuno, y han probado ser terapias efectivas para algunos niños con epilepsia. Su eficacia en adultos se ha probado en algunos estudios abiertos, dentro de los que se encuentran series de casos de centros únicos de dieta cetogénica y Atkins modificada en estado epiléptico (EE) superrefractario 39-44.
Para iniciar la dieta se requiere: hemograma, perfil metabólico completo, perfil lipídico en ayunas, amilasa, lipasa, niveles de vitamina D, peso, talla, VEEG, consulta nutricionista, retirar dextrosa de líquidos IV, descontinuar formula enteral, minimizar carbohidratos de medicamentos, comenzar fórmula cetogénica, multivitamínicos y calcio a través de gastrostomía.
Thakur describió el mayor número de pacientes hasta el momento. Con un promedio de FAE usados previamente a la dieta de siete, los pacientes alcanzaron cetosis en tres días con DC, en proporción 4:1 o 3:1 (grasa a carbohidratos y gramos de proteínas). El tiempo de duración fue de 17 días, el 90 % de los pacientes resolvió el EE en los primeros tres días, e igualmente se encontró reducción de cinco días de anestésicos luego del inicio de dieta; el 50 °% de los pacientes hicieron transición a DAM 43. Los efectos adversos reportados incluyen neumonía por aspiración, reflujo gastroesofágico, constipación e hipertrigliceridemia y acidosis transitoria 41. La DAM es menos usada ya que tiene mayor cantidad de proteínas, por lo que limita su uso con gastrostomía; se usa cuando se hace transición posterior a la DC clásica. Las contraindicaciones son: condición metabólica inestable (hiponatremia persistente; hipernatremia, hipoglicemia, hipocalcemia, acidosis); inestabilidad hemodinámica o respiratoria; coagulopatía; pancreatitis, insuficiencia hepática; hiperlipidemia severa; intolerancia por alimentación enteral; embarazo; propofol en las últimas 24 horas; desorden de oxidación de ácidos grasos. Se debe tener precaución con VPA por déficit secundario de camaina e inhibidores de anhidrasa carbónicas por litiasis renal. Así, debe considerarse una herramienta de apoyo que ha de ser dirigida por manejo multidisciplinario, por un epileptólogo, neurólogo o neuropediatra en compañía de un nutricionista especialista en el tema 39,40,43-46. Los datos hasta la fecha muestran que es un tratamiento seguro, factible y efectivo, y está pendiente establecer que la intervención temprana con la DC y la transición a dieta Atkins modificada mejora la morbilidad y mortalidad 30,38.
15. ¿Qué consideraciones debe tener en el paciente con estado epiléptico con respecto al pronóstico?
El pronóstico del EE está relacionado con dos aspectos: primero, la atención oportuna y control inicial, y segundo, relacionado con las características propias del EE. Para el primer aspecto, la adecuada atención se relaciona con la duración y el control o resolución del EE. Por otro lado, existen variables no modificables como la edad de paciente, los antecedentes familiares y personales, el tipo de crisis y la refractariedad del EE. Una vez el paciente tenga control de su EE, se sugiere que en el primer año el neurólogo responsable de su manejo médico crónico haga un seguimiento al mes, a los tres meses y a los seis meses 47.
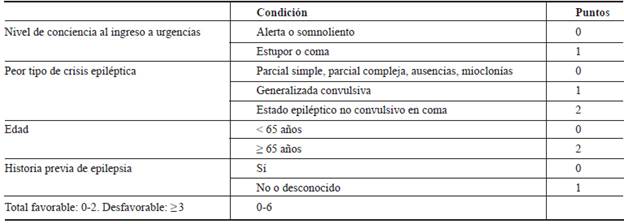
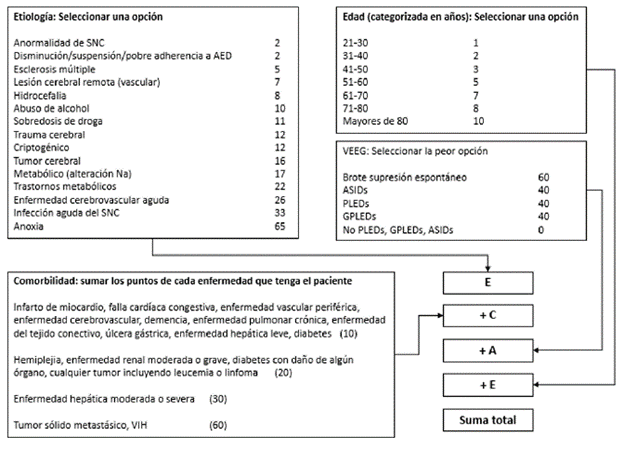
En la actualidad existen tres escalas de puntuación para hacer el pronóstico. La STESS (por sus siglas en inglés: Status Epilepticus Severity Score) 48 y la EMSE (por sus siglas en inglés: Epidemiology based Mortality score in Status Epilepticus) (figura 2) 49 fueron diseñadas para predecir mortalidad intrahospitalaria, en tanto que la END-IT (por sus siglas en inglés: Encephalitis, NCSE, Diazepam resistance, Image abnormalities and Tracheal intubation) fue diseñada para predecir desenlace funcional a los tres meses del alta hospitalaria 49. Otras escalas usadas para predecir mortalidad en la unidad de cuidados intensivos, como el Apache II (por sus siglas en inglés: Acute Physiology and Chronic Health Evaluation II), han demostrado pobre rendimiento pronóstico en pacientes con EE 51,52.
CONSIDERACIONES GENERALES
Es importante resaltar que el objetivo del manejo del EE es priorizar la vida del paciente, por lo cual se deben evaluar las poblaciones con condiciones especiales al momento de iniciar el tratamiento farmacológico (figura 3).
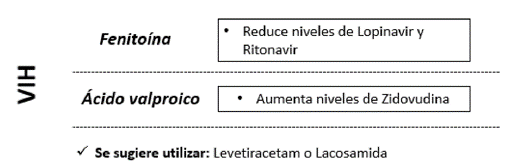
En los casos en que exista sospecha de embarazo o haya un embarazo instaurado (descartar preeclampsia / eclampsia), falla renal, falla hepática, cáncer o presencia de VIH, se sugiere evaluar el inicio de tratamientos con baja interacción farmacológica, que no afecten la tasa de filtración glomerular, preferiblemente con bajo metabolismo hepático y que tenga disponibilidad. En Colombia, hay disponibles levetiracetam y lacosamida, que aún no cuentan con indicación para EE, sin embargo, se ha descrito su uso off label con buenos resultados (figuras 4-7) 53-55.
En el embarazo, se ha demostrado que un episodio de EE es más riesgoso para la viabilidad del feto que la misma exposición a un medicamento como el ácido valproico, por lo cual, y considerando la vida de la materna, se debe garantizar el control del EE con el medicamento que esté disponible 54.
DISCUSIÓN
El EE es la complicación más frecuente de la epilepsia mal controlada, si no es tratada a tiempo genera una alta mortalidad del 9 al 27 % a los 30 días 37. La epilepsia es una enfermedad con alta carga en el sistema de salud, con prevalencias que oscilan entre 1 y 1,3 %, siendo el EE una de sus complicaciones más frecuentes. Los pacientes no siempre van a ser vistos en primera instancia por un neurólogo, lo que obliga a los profesionales de la salud a conocer el abordaje y tratamiento inicial, así como su posterior remisión si es el caso. Los primeros cinco minutos son claves para un diagnóstico adecuado y la selección de un buen antiepiléptico, pues es claro que entre más tiempo pase, menor es la probabilidad de controlar el EE y aumenta la mortalidad 30,38. La guías de práctica clínica actuales recomiendan que el tratamiento de primera línea son las benzodiazepinas, seguido de un fármaco antiepiléptico de más larga vida media 17. Para los neurólogos que están en centros de atención de III-IV nivel, es un reto evaluar el EE en pacientes con patologías asociadas y polimedicados con alta probabilidad de interacción farmacológica 13.
Es importante tener en cuenta que tratar un paciente con patologías crónicas como VIH o cáncer, que debutan con crisis epilépticas y EE, obliga a considerar el uso de medicamentos de nueva generación como levetiracetam o lacosamida, disponibles en presentación endovenosa, que son mejor tolerados y con menos frecuencia de interacciones con otros medicamentos (figura 3-6) 53-55.
En Colombia, el INVIMA tiene autorizados medicamentos como levetiracetam, lacosamida y topiramato para epilepsia refractaria que, según definición de la ILAE, es "aquella en la cual, se ha producido el fracaso de 2 ensayos de fármacos antiepilépticos, en monoterapia o en combinación, tolerados, apropiadamente elegidos y empleados de forma adecuada". Un gran porcentaje de pacientes con EE son pacientes con diagnóstico previo de epilepsia que no han respondido a los tratamientos iniciales, lo cual motiva a la utilización de medicamentos de nueva generación, con mecanismos de acción novedosos en el manejo del EE.
Finalmente, y como se mencionó, este consenso espera ser una herramienta de fácil acceso y entendimiento por parte de los profesionales de salud que tengan contacto con un paciente con EE, y puedan abordar de manera adecuada desde su diagnóstico hasta el tratamiento, teniendo en cuenta las particularidades con las cuales los pacientes pueden llegar a un servicio de salud en Colombia. De acuerdo con lo anterior, urge saber cuál es el fármaco ideal en EE. Para esta pregunta se debe considerar el tipo de crisis, la interacción con otros medicamentos, las complicaciones de las patologías de base, la biodisponibilidad, presentación, tolerancia y acceso a los medicamentos antiepilépticos. Por último, es importante determinar la continuidad de tratamiento con medicación oral y conocer la frecuencia de efectos adversos evaluando riesgo versus beneficio 56.
Mediante este consenso se espera ofrecer una herramienta para el manejo del EE, con fundamento en la experiencia de neurólogos-epileptólogos, con el fin de que un profesional en salud que se enfrente a un EE pueda iniciar un abordaje y manejo adecuado, bajo cualquier condición y con la disponibilidad de medicamentos existente.
CONCLUSIONES
El EE es la complicación más frecuente en pacientes con diagnóstico de epilepsia, cuando no reciben un tratamiento adecuado o en condiciones que facilitan las crisis repetitivas (encefalopatías epilépticas).
La falta de conocimiento en el diagnóstico y manejo del EE incrementa la morbilidad y mortalidad de los pacientes.
El conocimiento de las características, clasificación, métodos diagnósticos y algoritmos de manejo del EE lleva a una optimización de recursos y a un mejor pronóstico.
Es fundamental la difusión y socialización de esta información entre los profesionales de la salud que tengan contacto con pacientes con EE (médico general, médicos de urgencias, profesionales en formación y especialistas), quienes son los involucrados en el diagnóstico y manejo de pacientes con EE.
GLOSARIO
EE convulsivo: es un episodio convulsivo igual o mayor a cinco minutos de forma continua, o también cuando se presentan dos o más convulsiones sin una recuperación completa de la conciencia 57.
EE no convulsivo: el diagnóstico se considera de acuerdo con la variación del EE y en el cambio del estado de la conciencia y del estado mental, en relación con las descargas epileptiformes continuas evidenciadas en la video-electroencefalografía (VEEG) 58.
EE refractario: es la presencia de crisis permanentes que no responden al tratamiento farmacológico de primera y segunda línea 38.
EE super refractario: se define como la continuación o repetición durante 24 horas o más, después del inicio de la terapia anestésica 38.
EE focal: se caracteriza por no tener compromiso del estado de conciencia y puede tener manifestaciones clínicas motoras, sensitivas, psíquicas o autonómicas 38.
EE tónico-clónico generalizado: es el más común y el de mayor riesgo de muerte o complicaciones. Puede iniciarse de manera general o como consecuencia de una crisis focal con generalización secundaria a tónico-clónica 38.
EE mioclónico: es poco frecuente y puede ser una complicación de un EE generalizado primario o secundario a encefalopatía hipóxico-isquémica. Se presenta como sacudidas mioclónicas en salvas intermitentes o crisis mioclónicas asimétricas con alteración de la conciencia. Es más frecuente en encefalopatía hipóxica, siendo las mioclonías una manifestación de grave daño cerebral 38,58,59.
EE generalizado de ausencias: es un episodio prolongado de confusión, desorientación y obnubilación, en algunos casos unido a automatismo de parpadeo. Se presenta ocasionalmente en adultos con la suspensión de medicamentos, en tanto que en niños puede presentarse con deterioro de la conciencia y producir estados confusionales o estupor (por lo que también es llamado estupor de punta onda lenta). Con frecuencia puede manifestarse como una falta de equilibrio o cambios en el comportamiento que pueden confundirse con un trastorno psiquiátrico. El VEEG muestra descargas generalizadas de punta onda a 3 Hz y está asociado muchas veces con suspensión de benzodiazepinas 38,58.