INTRODUCCIÓN
La enfermedad de Parkinson (EP) es un desorden neurodegenerativo frecuente y complejo caracterizado por la presencia de síntomas motores y no motores, relacionados con el daño de múltiples estructuras del sistema nervioso central y periférico. La primera descripción detallada como una entidad nosológica definida data de 1817 y fue realizada por el médico londinense James Parkinson en un grupo de seis pacientes, quien la denominó "parálisis agitante" 1,2 y sería refinada más adelante por Jean Martin Charcot, quien acuñó el epónimo de enfermedad de Parkinson. Desde la descripción original, hace más de doscientos años, se mantienen vigentes los aspectos principales relacionados con las manifestaciones motoras de la enfermedad; no obstante, el conocimiento acerca de la patología, la patogénesis, la epidemiología, la genética y el tratamiento ha avanzado enormemente.
DEFINICIÓN
La EP idiopática es una condición neurodegenerativa, caracterizada clínicamente por la presencia de un fenotipo motor "típico" (parkinsonismo), con respuesta sostenida y consistente a la levodopa, además de síntomas no motores que muchas veces están presentes años o décadas antes que el fenotipo motor 1. El inicio de los síntomas motores es usualmente asimétrico y dicha asimetría se mantiene a lo largo de la evolución de la enfermedad. Los síntomas no motores incluyen trastornos del sueño (fragmentación, somnolencia diurna y trastorno del comportamiento del sueño de movimientos oculares rápidos o TC-MOR), síntomas cognitivos (disfunción ejecutiva, déficit en evocación, demencia y alucinaciones), trastornos del ánimo, disfunción autonómica (hipotensión ortostática, disfunción urogenital, estreñimiento e hiperhidrosis), así como trastornos senso-perceptivos (el más prominente es la hiposmia) y dolor 3.
Histopatológicamente, las características principales de la enfermedad son pérdida neuronal moderada a grave en la sustancia nigra pars compacta (SNpc) y presencia en la mayoría de los casos de depósitos de alfa-sinucleína en forma de cuerpos de Lewy y neuritas de Lewy. Desde el punto de vista patológico, también se ven afectadas otras áreas del sistema nervioso y varios sistemas de neurotransmisores, lo que explica muchos de los síntomas no motores de la enfermedad 1.
EPIDEMIOLOGÍA
Se trata de la segunda enfermedad neurodegenerativa más frecuente después de la enfermedad de Alzheimer. En el año 2016 se estimó que 6,1 millones de personas en el mundo sufrían la enfermedad, lo que representó un aumento de más del doble en comparación con la cifra de 1990 (2,5 millones). En el 2040 se estima que habrá alrededor de 17 millones de afectados. Esto hace que la enfermedad de Parkinson sea de todas las enfermedades neurológicas, la de más rápido crecimiento a nivel mundial según el estudio de carga global de la enfermedad 3. Este aumento puede explicarse por diversos factores, incluyendo el envejecimiento de la población, la exposición a factores de riesgo ambientales (como ciertos tóxicos y la disminución a escala global del tabaquismo) y mejoras en el diagnóstico y reporte de casos de la enfermedad, además de aumento de la supervivencia de los pacientes debido a la disponibilidad de tratamientos efectivos 4.
La edad es el factor de riesgo más consistentemente asociado con la EP. Existe un pico de prevalencia entre los 85 y los 89 años (1,7 % en hombres y 1,2 % en mujeres) y una disminución a partir de esta edad. Es más frecuente en hombres, con una relación hombre: mujer de 1,4 4. La tasa de prevalencia estandarizada por edad en Colombia se estimó recientemente entre 60 y 70 por 100.000 habitantes (lo que en el 2016 representaría 25.930 pacientes) en un estudio que utilizó modelos estadísticos 5. Sin embargo, en el estudio poblacional Epineuro, realizado mediante encuestas en dos fases, puerta a puerta, entre 1995 y 1996, se encontró una prevalencia de 470 por 100.000 habitantes 6; por otro lado, la prevalencia hallada en Antioquia en un estudio realizado en el 2003 utilizando el método de captura-recaptura fue de 30,7 por 100.000 (176,4 por 100.000 en mayores de 50 años) 7.
Un metaanálisis reciente incluyó 47 estudios puerta a puerta y basados en la población por muestreo aleatorio sobre prevalencia de EP 5. Se encontró una prevalencia general de 315 por 100.000 y un aumento de la prevalencia ajustada a la edad, así: 41 por 100.000 en individuos de 40 a 49 años; 107 por 100.000 de 50 a 59 años; 428 por 100.000 de 60 a 69 años; 1087 por 100.000 de 70 a 79 años; 1903 por 100.000 en mayores de 80 años. La incidencia varía entre 10 y 18 por 100.000 persona-año en diferentes localizaciones geográficas.
El riesgo de la enfermedad parece estar determinado por interacciones complejas entre factores del individuo (como la edad y la presencia de ciertos polimorfismos genéticos o mutaciones) y factores del ambiente. En cuanto a los factores de riesgo genéticos, el que cuenta con evidencia más robusta es la presencia de mutaciones en el gen GBA (que codifica para la enzima lisosomal beta-glucocerebrosidasa). Otros genes identificados están relacionados con las formas monogénicas de la enfermedad (como LRRK-2 y SNCA). Un metaanálisis reciente que abarcó más de 13.000 pacientes con enfermedad de Parkinson encontró asociación entre 24 locus y modificación del riesgo de la enfermedad 8.
MANIFESTACIONES CLÍNICAS
La enfermedad de Parkinson es una entidad compleja que abarca diversas manifestaciones relacionadas con el compromiso de múltiples sistemas de neurotransmisores. A pesar de los avances hechos en la comprensión de la patogénesis y la fisiopatología de la enfermedad, además de la identificación de una fase premotora en la que hacen aparición síntomas como el estreñimiento, la depresión y el TC-MOR, el diagnóstico sigue estando centrado en el síndrome parkinsoniano y hasta la actualidad no es posible hacerlo antes la aparición de los síntomas motores.
El síndrome parkinsoniano se caracteriza por la presencia de bradicinesia (definida como la lentitud para el inicio del movimiento, que se acompaña de una disminución progresiva de la amplitud y velocidad de las acciones repetitivas) y al menos otra manifestación motora entre rigidez y temblor de reposo con una frecuencia entre 4 y 6 Hz 9,10.
Una vez aparecen los síntomas motores, ya existe una pérdida de neuronas dopaminérgicas de la SNpc de entre 50 y 80 °%. El modelo de progresión patológica de la enfermedad propuesto por Braak y colaboradores señala que el proceso neurodegenerativo entra al sistema nervioso central a través de las terminaciones nerviosas del bulbo olfatorio o del sistema nervioso entérico. Posteriormente, compromete estructuras caudales como el núcleo motor dorsal del nervio vago y se propaga en sentido rostral para finalmente comprometer la corteza cerebral 9.
La fase prodrómica de la enfermedad, que ocurre en una fracción de los pacientes, está caracterizada por la presencia de depresión, estreñimiento, trastornos del olfato (hiposmia) y del sueño (TC-MOR). Una vez se hacen manifiestos los síntomas motores y se llega al diagnóstico, hay una respuesta sustancial y consistente a la levodopa que dura en promedio entre tres y cinco años antes de la aparición de complicaciones motoras relacionadas con el tratamiento, dentro de las que se encuentran las fluctuaciones motoras y las discinesias 11,12.
DIAGNÓSTICO
Los avances en el conocimiento de la fisiopatología y el reconocimiento de los síntomas no motores han hecho que en los últimos años se haya cambiado la concepción acerca de la definición de la enfermedad 13. Por esta razón, en el 2013 se creó un grupo de trabajo dentro de la Sociedad Internacional de Trastornos del Movimiento (MDS, por sus siglas en inglés) para desarrollar nuevos criterios diagnósticos a la luz del nuevo conocimiento. En el 2015 se publicaron dichos criterios, los cuales siguen centrando el diagnóstico en el síndrome motor, pero incorporan síntomas no motores, así como ayudas diagnósticas que tengan demostrada especificidad para el diagnóstico diferencial entre enfermedad de Parkinson y otras causas de parkinsonismo. Asimismo, tienen en cuenta que la precisión diagnóstica en manos de expertos en trastornos del movimiento (que es el estándar de referencia) oscila entre el 75 y el 95 °% y que existen dos fuentes principales de errores diagnósticos: por un lado, la falta de reconocimiento de otros parkinsonismos neurodegenerativos, especialmente en fases iniciales (como la parálisis supranuclear progresiva, la atrofia de múltiples sistemas y el síndrome corticobasal), y la asignación del diagnóstico de EP en ausencia de un verdadero proceso neurodegenerativo (como el temblor esencial y el temblor distónico). Estos nuevos criterios también tienen niveles de certeza diagnóstica y dan instrucciones para la evaluación de las diferentes manifestaciones motoras y aunque están diseñados para ser utilizados en investigación, pretenden facilitar el proceso diagnóstico para médicos con menor experiencia en trastornos del movimiento tras un adecuado entrenamiento 14.
Recientemente se publicó un estudio de validación de los criterios MDS 2015 que encontró una precisión diagnóstica del 92 °%, sensibilidad del 94,5 °% y especificidad del 88,5 % (comparados con el estándar de referencia que es el diagnóstico por un clínico con más de 10 años de experiencia en el diagnóstico de enfermedad de Parkinson) 15. A continuación, se amplía la descripción y la forma de utilización de los mencionados criterios:
CRITERIOS OFICIALES DE LA SOCIEDAD INTERNACIONAL DE PARKINSON Y TRASTORNOS DEL MOVIMIENTO PARA EL DIAGNÓSTICO CLÍNICO DE LA ENFERMEDAD DE PARKINSON 14
Los criterios nuevos enfatizan en:
A. El síndrome motor como característica central
La característica central es el síndrome motor por el cual la EP es clínicamente definida. Sin embargo, en muchos pacientes existen síntomas no motores y a menudo pueden dominar la presentación clínica. Muchas de estas manifestaciones han sido incorporadas ahora en los criterios diagnósticos.
Los criterios utilizan dos pasos para el diagnóstico:
B. Estándar de referencia: el examen por un experto
Entre el 75 y el 95 % de los pacientes diagnosticados con EP por expertos han sido confirmados por autopsia. El diagnóstico preciso varía considerablemente de acuerdo con la duración de la enfermedad, la edad, la experticia del médico y la evolución en el entendimiento de la enfermedad. Los criterios MDS 2015 fueron diseñados para minimizar los errores diagnósticos. Hasta que no hayan disponibles marcadores diagnósticos validados, la opinión de expertos clínicos seguirá el estándar de referencia para el diagnóstico en vida.
C. Niveles de certeza
Los criterios MDS 2015 incluyen distintos niveles de certeza diagnóstica. Estos son:
Enfermedad de Parkinson clínicamente establecida: la probabilidad de tener EP en los pacientes que cumplan estos criterios se espera que sea del 90 °%.
Enfermedad de Parkinson clínicamente probable: el objetivo de esta categoría es que al menos el 80 °% de los pacientes diagnosticados como probable EP tengan un diagnóstico correcto, equilibrando sensibilidad y especificidad.
D. Otras características claves
Características negativas y positivas: los criterios incluyen características negativas (exclusiones absolutas o banderas rojas) que están en contra de un diagnóstico de EP, y características positivas (criterios de soporte) que están a favor de dicho diagnóstico.
Ponderación: no todas las características son de igual importancia para el diagnóstico, por tanto, las características diagnósticas negativas se dividieron en exclusión absoluta (signos altamente específicos de un diagnóstico alternativo incompatible con cualquier nivel diagnóstico de EP) y banderas rojas (signos potenciales de patología alternativa con especificidad baja o incierta). Las banderas rojas excluyen un probable diagnóstico de EP solamente cuando no pueden ser contrarrestadas por los criterios de soporte.
interpretación de características: algunos criterios de exclusión incluyen diferentes interpretaciones que pueden ser aplicadas a situaciones determinadas (por ejemplo, el paciente que toma quetiapina en dosis bajas para dormir podría no constituir verdaderamente un parkinsonismo inducido por drogas) o que tienen una explicación alternativa que actúa como un factor de confusión (por ejemplo, pérdida sensorial cortical después de un ataque cerebrovascular).
Tiempo: la precisión diagnóstica generalmente aumenta con el tiempo. Al inicio de la enfermedad, la respuesta al tratamiento y la progresión pueden no ser muy evidentes y ciertas características clave de otras enfermedades neurodegenerativas podrían no haber aparecido aún. Asimismo, algunos hallazgos tienen diferentes implicaciones según el tiempo de evolución de la enfermedad. Si bien existen manifestaciones que son incompatibles con una EP temprana, estas pueden ser relativamente comunes en fases avanzadas (por ejemplo, inestabilidad postural o disfunción autonómica). Por tanto, muchos criterios individuales incluyen un componente de duración.
Demencia: los criterios no consideran la demencia como una característica que excluya EP. La excepción es la presencia de demencia frontotemporal, a pesar de que pueda ocurrir al inicio del parkinsonismo.
Pruebas diagnósticas auxiliares: en la actualidad, el diagnóstico de la EP es clínico y los criterios MDS 2015 fueron diseñados para ser aplicados sin necesidad de pruebas diagnósticas auxiliares. Sin embargo, en ciertos contextos, pueden realizarse algunas ayudas diagnósticas para resolver casos dudosos.
Los criterios MDS 2015 permiten incluir un test auxiliar confiable cuyos resultados pueden aplicarse como un criterio de soporte. Para cumplir estas características, un marcador debe haber sido evaluado y cumplir con una especificidad del 80 % o mayor en el diagnóstico diferencial de parkinsonismo (comparado con el estándar de referencia clínico o patológico) en varios estudios. Hoy en día, la pérdida olfatoria demostrada por un test validado y la tomografía por emisión de fotón único (SPECT) con 123I-MIBG consiguen superar este umbral, pero otros podrían llegar a calificar, como la ecografía transcraneal.
A continuación, se explica paso a paso la aplicación de los criterios diagnósticos.
CRITERIOS PARA LA ENFERMEDAD DE PARKINSON
Criterios para parkinsonismo
El prerrequisito para aplicar los criterios MDS 2015 es el diagnóstico de parkinsonismo, el cual se basa en tres manifestaciones motoras cardinales: bradicinesia en combinación con temblor en reposo y/o rigidez. Estas características deben demostrarse claramente y no se deben atribuir a factores de confusión.
Definición de manifestaciones cardinales de parkinsonismo
Bradicinesia: se define como enlentecimiento del movimiento y decremento en la amplitud o velocidad, o bloqueos en la continuidad del movimiento.
Rigidez: es una resistencia al movimiento pasivo de extremidades con el paciente en una posición relajada, que puede ser en rueda dentada o tubo de plomo.
Temblor en reposo: de 4 a 6 Hz en la extremidad totalmente relajada, el cual se suprime durante la iniciación del movimiento. Puede observarse un temblor en reposo parkinsoniano en la mano con postura prolongada (temblor reemergente). Sin embargo, para que este criterio aplique debe demostrarse la presencia de temblor en reposo.
Aunque la inestabilidad postural es una característica del parkinsonismo, no hace parte de los criterios MDS 2015 para parkinsonismo causado por EP. A menudo ocurre en etapas tardías, pero su presencia temprana sugiere un diagnóstico alternativo.
Criterios diagnósticos para EP
Una vez se ha establecido que el paciente tiene parkinsonismo, se aplican los criterios MDS 2015 para determinar si este es secundario a EP.
El diagnóstico para EP clínicamente establecida requiere:
El diagnóstico para EP clínicamente probable requiere:
Ausencia de criterios de exclusión absolutos
Presencia de banderas rojas contrarrestadas por criterios de soporte. Por ejemplo, si está presente una bandera roja, debe haber un criterio de soporte; si están presentes dos banderas rojas, son necesarios al menos dos criterios de soporte. Si hay más de dos banderas rojas, no se puede diagnosticar la EP clínicamente probable.
Criterios de soporte
1. Mejoría de síntomas clara y dramática con terapia dopaminérgica: para conseguir este criterio, durante el tratamiento inicial, los pacientes deben retornar a un nivel normal o cercano a lo normal de funcionalidad. Otros criterios válidos son:
Mejoría significativa con dosis mayores o empeoramiento significativo con dosis menores: esto puede documentarse objetivamente (se define como una mejoría mayor al 30 °% en la parte III de la Escala Unificada para EP (UPDRS, por sus siglas en inglés), o subjetivamente, con una clara historia de marcados cambios proporcionada por un paciente confiable o cuidador.
Fluctuaciones on/off inequívocas, incluyendo en algún momento deterioro de fin de dosis predecible.
Pruebas farmacológicas
Las pruebas farmacológicas con agentes dopaminérgicos consisten en la evaluación de los efectos clínicos de la facilitación rápida de la transmisión dopaminérgica central 16. Los dos fármacos empleados en este tipo de pruebas son la levodopa y la apormofina. Se requiere una mejoría de al menos un 30 °% a nivel motor en la UPDRS para considerar una prueba como positiva. Una prueba negativa no excluye el diagnóstico de enfermedad de Parkinson, por lo que, en estos casos, se hace necesario dar tratamiento con levodopa por al menos tres meses, a una dosis mínima de 600 mg día, para evaluar si el paciente realmente responde o no a este medicamento. La positividad a estas pruebas no excluye la opción de otros parkinsonismos (sobre todo la atrofia multisistémica) que ocasionalmente pueden presentar una respuesta temporal a agentes dopaminérgicos.
2. Presencia de discinesias inducidas por levodopa
3. Temblor de reposo de una extremidad: esto es incluido por dos razones, es menos común en otras enfermedades y podría tener menor respuesta a la terapia.
4. Resultados positivos de al menos un test diagnóstico auxiliar: especificidad > 80 °%. Estas pruebas son:
Pérdida olfatoria medida por una prueba validada, en el rango claramente hipósmico o anósmico, ajustado por edad y sexo. No disponible en Colombia.
SPECT con 123I- MIBG, claramente documentando denervación simpática cardiaca. Actualmente, no disponible en Colombia.
Ecografía transcraneal del parénquima cerebral: es una técnica no invasiva, cómoda para el paciente, fiable y reproducible en manos expertas, con amplia experiencia clínica y literatura científica que la respalda; requiere validación para cada población, en Colombia aún no está validada. Este marcador, sin ser exclusivo, se asocia fuertemente a la enfermedad de Parkinson (sensibilidad 88-90 °% y especificidad 84-93 °%), así como a sus manifestaciones premotoras y otros factores de riesgo asociados con esta patología (nivel de evidencia IA). Las guías internacionales recomiendan, con nivel de evidencia IA, la ecografía del parénquima cerebral para el diagnóstico de la enfermedad de Parkinson y su diagnóstico diferencial con otras entidades (temblor esencial, parkinsonismo vascular, parkinsonismos atípicos). En el caso de los parkinsonismos atípicos, existen anomalías específicas (hiperecogenicidad del núcleo lenticular, dilatación del tercer ventrículo) que permiten un diagnóstico positivo de estos frente a la enfermedad de Parkinson 17-20.
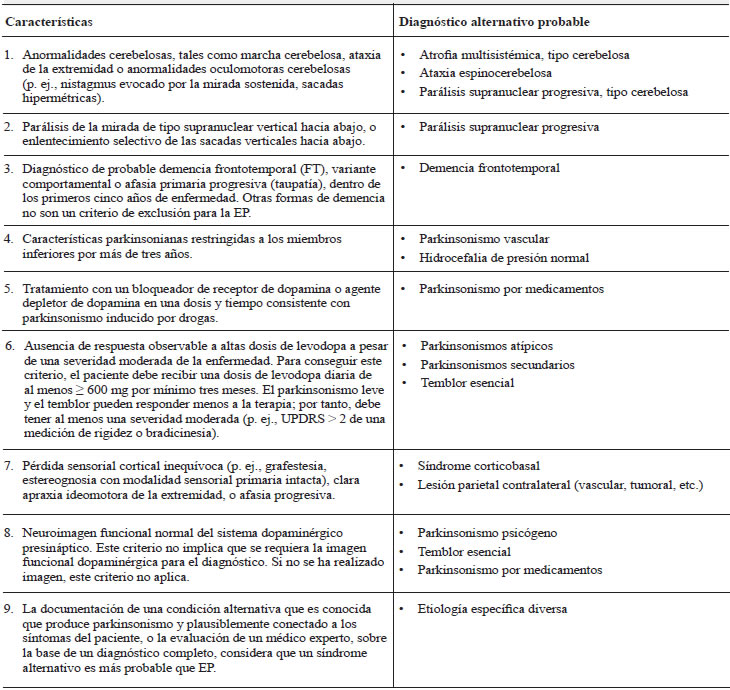
Criterios de exclusión absoluta
En la tabla 1 se detallan los criterios de exclusión absoluta y el probable diagnóstico alternativo que sugiere cada uno de ellos.
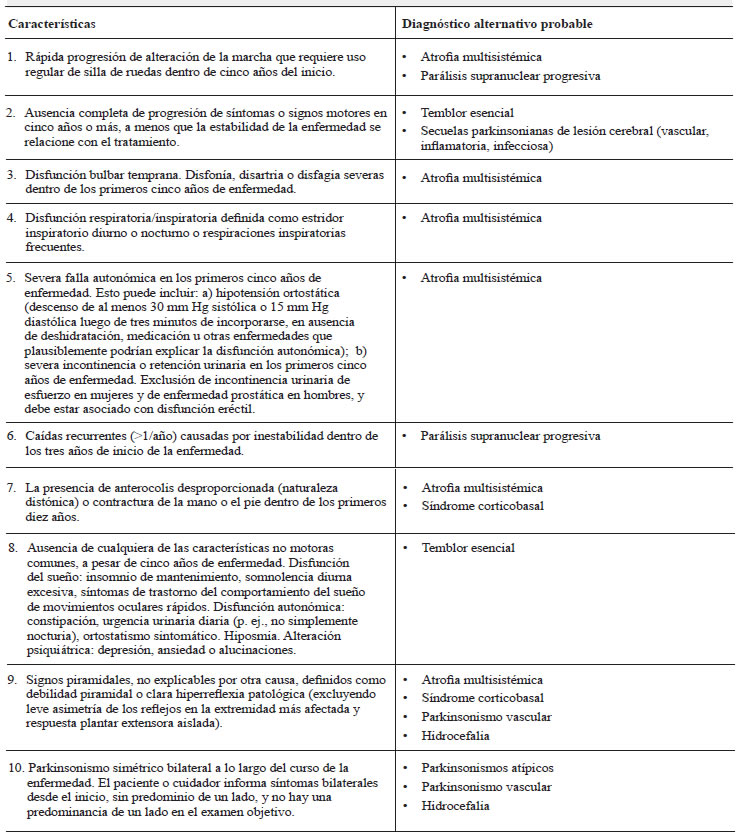
Banderas rojas
En la tabla 2 se enumeran las banderas rojas para diagnósticos alternativos así como el diagnóstico que sugiere cada una de ellas. La presencia de tres o más banderas rojas excluye el diagnóstico de EP.
Aplicación de los criterios
1. ¿El paciente tiene parkinsonismo, según la definición de los criterios de MDS 2015?
Si la respuesta es "NO": no es posible diagnosticar EP. En caso afirmativo:
2. ¿Existen criterios de exclusión absolutos presentes?
Si la respuesta es "SÍ", no se puede diagnosticar EP probable o clínicamente establecida
En caso negativo:
3. Número de banderas rojas presentes _____
4. Número de criterios de apoyo presentes _____
5. ¿Hay por lo menos dos criterios de apoyo y no hay banderas rojas (señales de alerta)?
Si la respuesta es "SÍ" el paciente cumple criterios para EP clínicamente establecida.
En caso negativo:
6. ¿Hay más de 2 banderas rojas?
Si la respuesta es "SÍ" la EP probable no puede ser diagnosticada.
En caso negativo:
7. ¿El número de banderas rojas es igual o menor que el número de criterios de apoyo?
En caso afirmativo, el paciente cumple con los criterios de EP probable.