La enfermedad de Parkinson (EP) es una condición multifacética que puede generar síntomas motores y no motores en todas sus etapas 1. Las opciones de tratamiento de esta condición deben ser planeadas con el objetivo de mejorar sus síntomas y ofrecer una mejor calidad de vida para las personas que la padecen. Tanto la Academia Americana de Neurología en su revisión más reciente 2, como la Federación Europea de Sociedades Neurológicas 3 y la Sociedad Internacional de Parkinson y Trastornos del Movimiento (MDS, por sus siglas en inglés) 4 se han encargado de establecer los parámetros óptimos de tratamiento para esta condición, tanto para su fase temprana como para la tardía.
Uno de los hitos fundamentales en el desarrollo de los tratamientos de la EP fue el descubrimiento post mórtem de una deficiencia marcada del número de neuronas productoras de dopamina en los pacientes con esta enfermedad 5. Este hallazgo realizado por Ehringer y Hornykiewicz en 1960 inspiró siete años después a Cotzias y colaboradores para utilizar levodopa en dosis altas para tratar los síntomas motores de la enfermedad, y aún hoy, más de cincuenta años después, la levodopa continúa siendo la piedra angular del tratamiento farmacológico para la EP 6. En tabla 1 se resumen los principales hechos de la historia del tratamiento farmacológico.
Tabla 1 Hitos en la historia del tratamiento farmacológico de la enfermedad de Parkinson.
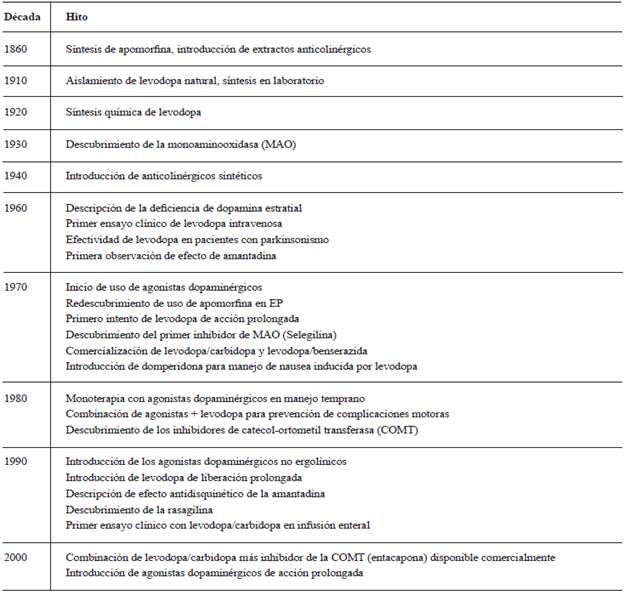
Fuente: adaptada de 7.
En la actualidad hay un debate importante acerca de cuál es el punto en el que se considera EP inicial y cuándo se considera avanzada. A pesar de que existe falta de consenso, se considera que con independencia del tiempo de evolución, la enfermedad puede ser catalogada como avanzada cuando aparecen las complicaciones motoras (disquinesias y fluctuaciones) 8. El concepto de enfermedad avanzada se ampliará en capítulo correspondiente.
Otro punto importante de discusión es sobre el momento de iniciar el tratamiento: si este debe empezar tan pronto los síntomas motores de la enfermedad se manifiestan o cuando se genere discapacidad en el paciente. De acuerdo con la evidencia de estudios antiguos que sugerían neurotoxicidad asociada al uso de levodopa, ausencia de tratamientos con efectos modificadores de la enfermedad y riesgo de complicaciones motoras, inicialmente la tendencia era posponer el tratamiento hasta que se presentara algún grado de discapacidad 9,10.
Existen argumentos en contra de retrasar el inicio del medicamento hasta que genere alguna interferencia en las actividades diarias. En un estudio realizado por Grosset y colaboradores en el Reino Unido se analizaron 198 paciente sin tratamiento con EP temprana. Estos pacientes se asignaron a dos grupos: uno recibió tratamiento temprano y otro tardío. En las evaluaciones realizadas a los 8 y los 19 meses, el puntaje de la escala de calidad de vida en EP (PDQ39) empeoró significativamente en el grupo que no recibió tratamiento inicial 11. Esta información, sin embargo, debe ser interpretada con cautela ya que no se utilizaron controles ni aleatorización. En cuanto a las intervenciones farmacológicas, en el estudio ADAGIO, en el que se analizó el posible efecto de la rasagilina en la EP inicial, se observó una mejoría en la calidad de vida y en las medidas motoras en los pacientes que iniciaron esta terapia tempranamente, comparados con los que no la utilizaron con dosis de 1 y 2 mg. Además, este estudio sugiere un posible efecto modificador de la enfermedad con 1 mg/día, pero este no ocurrió con 2 mg/día, lo que pone en duda la efectividad este efecto, que no se ha podido soportar en otros estudios 12. Es muy importante aclarar que a la fecha ningún medicamento ha mostrado un efecto modificador de la enfermedad (llamado de manera errónea efecto neuroprotector). En el caso del estudio ADAGIO y del DATATOP de la selegilina, el efecto sintomático se confundió con efecto protector 4.
A la fecha, el argumento más sólido para iniciar el tratamiento de manera temprana, tan pronto aparezcan los síntomas motores, proviene del estudio ELLDOPA 13. Se asignaron cuatro grupos de pacientes, uno con placebo y tres con diferentes dosis de levodopa para el manejo de EP temprana. El tratamiento se administró durante 40 semanas y los pacientes que recibieron levodopa mejoraron significativamente en las escalas motoras. Al final de este tiempo se suspendieron los tratamientos y en la semana 42 se evaluaron los cuatro grupos. Los pacientes que recibieron levodopa empeoraron en el desempeño motor, pero no tan severamente como el grupo placebo, lo que sugiere que el uso temprano de levodopa puede producir un efecto modificador benéfico de la EP temprana. Sin embargo, esto no ha sido replicado en otros estudios. Por las razones anteriormente expuestas, se recomienda iniciar tratamiento para la EP tan pronto los síntomas motores aparezcan y se diagnostique.
Una vez se toma la decisión de iniciar tratamiento para la EP, se deben considerar las diferentes categorías de tratamiento disponibles 14, como se presenta a continuación.
A. Preventiva: dirigida a interferir la causa de muerte de las células de la sustancia nigra, para intentar prevenir la progresión de la enfermedad. Aunque se han realizado estudios con este fin, estos han concluido que en la actualidad no hay evidencia de que algún medicamento sea neuroprotector en la EP.
B. Sintomática: dirigida a restaurar la función dopa-minérgica estriatal con medicamentos dopaminérgicos o con procedimiento quirúrgico orientado a modificar los mecanismos fisiopatológicos de la enfermedad a través de diferentes técnicas quirúrgicas (lesión o estimulación).
C. Modificadora: busca aportar nuevas células o estimular células normales o enfermas. No existe ninguna terapia aprobada que logre la neurorestauración. En este sentido, la implantación de células madre aún se encuentra en etapa de investigación, con resultados por establecer, por lo cual no está indicada en ninguna de las fases de la enfermedad.
TRATAMIENTO SINTOMÁTICO DE LA EP
En el consenso nacional de tratamiento de EP del año 2014 15 se mencionaron pautas aún vigentes sobre el tratamiento sintomático que se actualizan con nueva evidencia disponible.
Cuando los síntomas de la enfermedad se presentan, debe haberse perdido al menos un 80 % del total de células dopaminérgicas de la sustancia nigra. El hecho de que en la EP se conserven las células del estriado, en las que se encuentran los receptores dopaminérgicos, permite una terapéutica sustitutiva con medicamentos dopaminérgicos. El objetivo de la terapia sintomática es mejorar la incapacidad funcional (lentitud en las tareas motoras, dificultad para la marcha, etc.). El tratamiento debe ser individualizado y depende de las características de cada paciente. El objetivo no es eliminar todos los síntomas y signos, lo cual usualmente no es posible, sino mantener una situación funcional aceptable del paciente, adaptado a las necesidades de cada uno 16.
A continuación se describirán brevemente los aspectos relacionados con el tratamiento inicial de la EP de cada uno de los medicamentos, basados en las últimas recomendaciones de la literatura mundial 8,9,19,20.
INHIBIDORES DE LA MONOAMINO OXIDASA B
Son medicamentos que aumentan la vida media de la dopamina en la sinapsis, lo que disminuye su degradación. Tanto la selegilina como la rasagilina tienen evidencia clase 1 de utilidad como monoterapia en enfermedad de Parkinson inicial. Demoran el uso de levodopa al menos un año, especialmente la rasagilina. Producen una mejoría moderada y son eficaces en la enfermedad de Parkinson con síntomas leves. No hay evidencia sobre la utilidad de estos medicamentos en la prevención de complicaciones motoras. Tienen un buen perfil de seguridad y no requieren monitoria específica. Se recomienda precaución para usar la selegilina en pacientes con demencia, enfermedad cardíaca o hipotensión ortostática.
La dosis usual de selegilina es de 5 a 10 mg/día y la de rasagilina es de 0,5 a 1 mg/día.
AGONISTAS DOPAMINÉRGICOS
Estos medicamentos simulan la acción de la dopamina en los receptores postsinápticos. Se dividen en dos grupos:
a. Ergolínicos: derivados del Ergot. Entre ellos están: bromocriptina, cabergolina, pergolida y lisuride.
Su principal problema es la relación con fibrosis valvular cardíaca, lo que obliga a hacer uso cauteloso de estos, en especial de la cabergolina y de la pergolida. En la actualidad se recomienda usar estos medicamentos como último recurso, informar al paciente sobre los riesgos cardíacos, con monitoria ecocardiográfica anual, y deben ser suspendidos si se demuestran cambios patológicos valvulares no presentes al inicio del tratamiento.
b. No ergolínicos: entre ellos se encuentran pramipexol, ropirinol y rotigotina (parches), piribedil y apomorfina, aunque este último solo se usa en enfermedad avanzada 19. Tienen un perfil de efectos secundarios diferentes y ofrecen mejor respuesta sintomática.
Estos medicamentos son útiles como terapia de inicio para la enfermedad de Parkinson leve- moderada, pueden mantenerse en monoterapia, con buena calidad de respuesta hasta por tres años en promedio, antes de ser necesario adicionar levodopa. Se ha demostrado que previenen las complicaciones motoras de la levodopa y también son útiles para su tratamiento (evidencia clase 1 para los agonistas disponibles en el país). Sin embargo, tienen efectos secundarios en alrededor del 20 %% de las personas que los usan, por lo que es necesario suspenderlos o limitar la dosis en un número importante de los pacientes. Se deben usar a las dosis adecuadas para obtener la respuesta buscada; si se usan subdosificados, pueden llegar a empeorar los síntomas de la enfermedad. Es importante monitorear efectos secundarios como somnolencia con episodios súbitos de sueño, alteraciones comportamentales como juego patológico, hipersexualidad, pornografía, compras compulsivas y conductas obsesivas anormales (punding). Para su inicio se hacen incrementos graduales de la dosis hasta llegar a la dosis terapéutica, para lograr tolerancia a efectos secundarios. Es importante anotar que la mala respuesta, los efectos adversos o la no tolerancia a un agonista no predicen el resultado con otro diferente.
Las dosis terapéuticas de los agonistas dopaminérgicos disponibles en Colombia son:
LEVODOPA
La levodopa, en combinación con un inhibidor periférico de la dopamina decarboxilasa (carbidopa o benserazida), se considera el medicamento más potente y seguro para mejorar los síntomas motores de la enfermedad de Parkinson (evidencia clase 1), comparado con cualquier otro de los medicamentos disponibles. En etapas tempranas de la enfermedad se indica su uso en las siguientes condiciones, ya sea en monoterapia o como complemento de otra terapia que venga tomando el paciente:
Cuando no se logre mejoría con los fármacos mencionados previamente, no se debe esperar mucho tiempo para tomar esta decisión, en especial si está comprometida la funcionalidad del paciente. No se debe tener miedo de las complicaciones motoras, ya que estas también tienen relación directa con el tiempo de evolución y severidad de la enfermedad.
Cuando con el tiempo, por la evolución natural de la enfermedad de Parkinson, se pierda la respuesta a los tratamientos previamente mencionados, si el paciente viene en tratamiento con un agonista dopaminérgico, no se recomienda suspenderlo, ya que este puede ayudar a reducir la dosis total de levodopa.
Cuando la enfermedad de Parkinson es tan severa que no se espera buena respuesta con otros tratamientos se debe iniciar con levodopa.
Como recomendaciones para prevenir complicaciones motoras (especialmente disquinesias), se recomienda no superar los 400 mg de levodopa al día y se debe fraccionar en varias dosis al día. Sin embargo, se recomienda restringir la dosis de levodopa en las fases iniciales a entre 5 y 9 mg/ kg al día; es decir, alrededor de 300 a 400 mg/día y con titulación lenta y gradual, especialmente en la población geriátrica, y evitar ascensos por encima de 9 mg/kg al día en la fase inicial. También se debe intentar demorar su uso para prevenir complicaciones motoras, siempre y cuando se pueda ofrecer buen control sintomático al paciente con otras terapias, es decir, nunca se debe comprometer la funcionalidad y calidad de vida del paciente para demorar su introducción. Es muy importante recalcar que la progresión de la enfermedad de Parkinson es uno de los principales factores de riesgo para desarrollar complicaciones motoras.
ANTICOLINÉRGICOS
Aunque se han usado por muchos años, la evidencia muestra que pueden ser útiles en monoterapia (evidencia clase 2), pero su efecto es leve y no se ha logrado demostrar que sean mejores que otros medicamentos. Además, inducen deterioro cognitivo en pacientes mayores 20. Su efecto sobre el temblor, que era su principal indicación, no es consistente en los diferentes estudios. Dado su bajo poder y el alto riesgo de efectos adversos no es recomendable su uso en EP.
AMANTADINA
Aunque se ha demostrado que este medicamento puede generar mejoría de los síntomas (evidencia clase 2), tiene una baja potencia y los pacientes rápidamente requieren que se introduzca un segundo fármaco. Aunque es útil, otros medicamentos pueden tener mejor efecto y mejor perfil de seguridad. Hoy en día se considera que su mayor utilidad está en el manejo de las disquinesias asociadas a levodopa.
PAUTAS PARA EL TRATAMIENTO INICIAL DE LA ENFERMEDAD DE PARKINSON
Manejo inicial
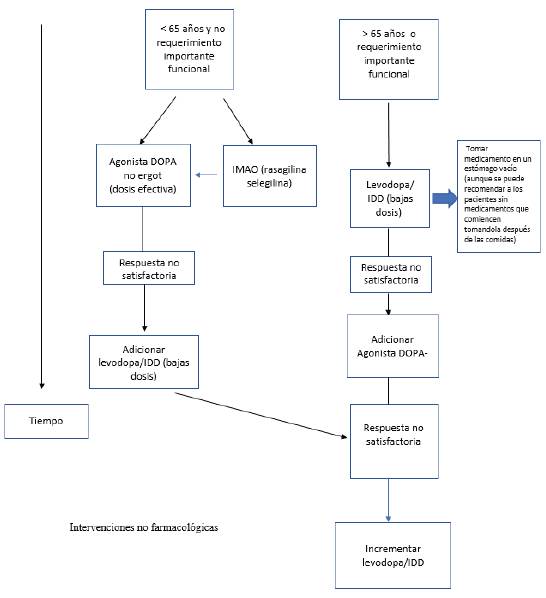
En pacientes menores de 65 años y que tienen poca incapacidad (estadíos I y II de Hoehn y Yahr), se podría iniciar un periodo de tratamiento en monoterapia con IMAO o agonistas dopaminérgicos, de preferencia los no ergolínicos por el perfil de efectos secundarios, además de rehabilitación física y ocupacional según sea el caso. Esto, buscando estabilizar o mejorar los síntomas durante un tiempo, que puede ser de meses o años, y retrasar el inicio de levodopa hasta que el agonista no controle satisfactoriamente la enfermedad. La gran mayoría de los pacientes requerirá adicionar levodopa a su terapia según la progresión de la enfermedad.
En pacientes mayores de 65 años y en todos aquellos con discapacidad moderada a severa, de acuerdo con criterio clínico, y que requieran mejoría rápida de los síntomas, debería comenzarse el tratamiento con levodopa, que se debe titular hasta la dosis mínima efectiva y tolerada en cada paciente. En los primeros años de tratamiento se requieren tres o más tomas diarias. Según la respuesta al tratamiento, una vez estabilizado el paciente, se puede adicionar un agonista dopaminérgico, lo que permitirá un ahorro en las dosis de levodopa. En ocasiones, hay necesidad de adicionar bloqueadores periféricos de la dopamina para mejorar la tolerancia a la levodopa (domperidona).
Según la evidencia clínica, se recomienda seguir con el siguiente esquema de tratamiento inicial (figura 1):
Intervenciones no farmacológicas
El tratamiento de rehabilitación del paciente con enfermedad de Parkinson se debe realizar de una forma integral, lo que implica el abordaje de los trastornos motores, las alteraciones del lenguaje y de los trastornos deglutorios. Por lo anterior, se utilizarán distintas modalidades terapéuticas que pueden agruparse como se muestra a continuación.
FISIOTERAPIA
En una revisión sistemática de Cochrane 21 ha quedado demostrado el beneficio del tratamiento fisioterápico y el ejercicio terapéutico en la EP. Según el estudio en mención, el tratamiento fisioterapéutico produce una mejoría significativa a corto plazo, inferior a tres meses, de la marcha, el equilibrio, la movilidad y la discapacidad. Incluye una variedad de intervenciones, dentro de las que se encuentran:
- Fisioterapia convencional: modalidades guiadas por fisioterapeutas que incluyen estiramientos, reeducación de la marcha y uso de ejercicios con mecanoterapia convencional. Es efectiva para mejorar la velocidad de marcha y el puntaje de la UPDRS 21.
- Estiramiento en cinta rodante: es efectiva y mejora los parámetros de la marcha de la velocidad y la longitud del paso 22.
- Estiramiento con ejercicios de resistencia progresivos: esta modalidad de ejercicio tiene importantes efectos beneficiosos sobre la fuerza muscular y el acondicionamiento cardiorrespiratorio 23.
- Entrenamiento del movimiento mediante feedback con claves externas: dirigida a pacientes con congelaciones de la marcha y las caídas. Puede ser eficaz sobre la velocidad y los congelamientos de la marcha, así como sobre la UPDRS-III. Las señales auditivas son más efectivas que las visuales para tratar los trastornos de la marcha (especialmente cadencia y velocidad) de los pacientes con EP; la longitud del paso mejora con ambos tipos de claves 24.
- Tai Chi: ampliamente utilizado en el tratamiento de la EP. Ofrece beneficio sobre la función motora, el equilibrio y la movilidad 25.
- Danza: produce mejoría en la marcha y en la funcionalidad de los pacientes. La danza combina estrategias de movimiento con técnicas de retroalimentación, equilibrio y ejercicio físico 26.
TERAPIA OCUPACIONAL
El objetivo de la terapia ocupacional es desarrollar estrategias para ayudar a los pacientes a adaptarse a su entorno, de manera que mejore la autonomía en sus actividades cotidianas. Suele estar enfocada en el entrenamiento en las actividades de la vida diaria. Algunas de ellas son 27:
- Ejercicio y actividad física para mejorar las actividades de la vida diaria: mejoría en el control motor, en la estabilidad postural y en el equilibrio. Hay escasa evidencia de que a corto plazo el ejercicio intenso sea más ventajoso que el menos intenso. Ejercicios que incluyen la realización de actividades multimodales o múltiples (entrenamiento de autocuidado o alimentación) con ciertos beneficios sobre las actividades de la vida diaria.
- Utilización de señales ambientales, estímulos y objetos para mejorar de la realización de tareas: los estímulos auditivos rítmicos mejoran la realización de tareas simples en la EP. El uso de señales externas en el hogar tiene efectos sobre el control motor.
TERAPIA DEGLUTORIA
El diagnóstico y el tratamiento de la disfagia orofaríngea son fundamentales en el programa de rehabilitación del paciente con EP, debido a su elevada prevalencia, el impacto en la calidad de vida y la gravedad de sus complicaciones, ya que la neumonía por aspiración es la principal causa de muerte. Se recomienda 28:
- Flexión cervical y el uso de espesantes, lo que mejora la seguridad de la deglución.
- Entrenamiento de la musculatura espiratoria durante cuatro semanas. Produce una mejoría, según la escala de aspiración y deglución mediante videofluoroscopia.
- Electroestimulación de superficie de la musculatura suprahioidea. No es superior a la terapia convencional, según los resultados de dos ensayos clínicos.
- Técnicas de feedback visual como la visualización de una grabación del trastorno deglutorio del paciente mejoran la seguridad deglutoria.
- La estimulación termotáctil del istmo de las fauces antes de la deglución mejora los parámetros temporales de la videofluoroscopia.