En el contexto de la enfermedad de Parkinson avanzada emergen diversas situaciones clínicas que generan un desafío para el médico tratante. Dentro de estas, hay unas que no son modificables con el tratamiento farmacológico (inestabilidad postural, deformidades, síntomas axiales) y otras que se encuentran bajo el grupo de complicaciones motoras que pueden eventualmente responder al manejo terapéutico. Las complicaciones motoras se pueden dividir en dos categorías: fluctuaciones motoras (variación del estado motor "ON"/"OFF" según cambios en el efecto de la levodopa) y discinesias asociadas a levodopa 1. Las fluctuaciones de síntomas no motores (autonómicos, neuropsiquiátricos, sensitivos/dolor) también se han descrito hasta en dos tercios de los pacientes que experimentan fluctuaciones motoras, e impactan de forma importante en la independencia y la calidad de vida 2.
La aparición de complicaciones motoras asociadas a la levodopa es casi invariable durante la progresión de la enfermedad de Parkinson; tanto así, que su ausencia puede sugerir que el paciente cursa con un síndrome parkinsoniano atípico y no con enfermedad de Parkinson idiopática 3. La frecuencia de las complicaciones motoras es, aproximadamente, del 40 al 50 °% después de 4-6 años de tratamiento con levodopa y de hasta un 90 °% después de 8 años 4. Entre los factores predictores descritos para la aparición más temprana de fluctuaciones motoras y discinesias, se encuentran la duración mayor de la enfermedad y el haber recibido dosis más altas de levodopa desde el inicio (mayor de 400 mg/día) 5,6.
En las fases iniciales de la enfermedad, la duración de la respuesta a la levodopa suele ser prolongada, lo que permite un adecuado control sintomático de los pacientes con solo tres tomas diarias de esta, gracias a que aun se conserva la capacidad del sistema nigroestriado de convertir la levodopa en dopamina y almacenarla en las vesículas presinápticas, para posteriormente liberarla de forma fisiológica 7. En esta estapa de la enfermedad, la respuesta clínica a una dosis de levodopa puede mantener su efecto por mucho tiempo, a pesar de que la vida media de este fármaco solo sea de 90 a 120 minutos. Este efecto se denomina respuesta de larga duración a la levodopa, que puede extenderse tanto como hasta dos a cuatro semanas después de la suspensión de esta 8. A medida que la degeneración neuronal progresa, el sistema nigroestriado también va perdiendo la habilidad de almacenamiento y liberación fisiológica de la dopamina, lo que lleva a que la respuesta clínica a la levodopa se acorte, se haga más impredecible y errática, y conduce a la aparición de fluctuaciones motoras y discinesias 7,9.
Las fluctuaciones motoras en la enfermedad de Parkinson avanzada se definen como los beneficios variables y en ocasiones no tan predecibles del tratamiento farmacológico con levodopa para combatir los síntomas cardinales de bradicinesia, rigidez y temblor. El estado "ON" se define como la mejoría de los síntomas con la terapia dopaminérgica, mientras que el estado "OFF" se define como la reaparición de síntomas parkinsonianos cuando el efecto de la medicación se disminuye o se acaba 10. La respuesta a la dosis de levodopa se puede dividir en tres etapas: primero, el beneficio inicial o de inicio de dosis, cuando el paciente apenas empieza a percibir la mejoría con el fármaco; segundo, el periodo de máximo beneficio de los síntomas parkinsonianos, que es llamado pico de dosis; y tercero, cuando el beneficio del medicamento se comienza a perder, a lo que se denomina fin de la dosis. Las fluctuaciones motoras pueden afectar cualquiera de estas tres etapas 1.
Entre las fluctuaciones motoras se encuentra el deterioro de fin de dosis, una de las primeras complicaciones que experimentan los pacientes a medida que la enfermedad avanza y que se manifiesta como una disminución predecible del tiempo en "ON" tras cada toma de levodopa, secundaria a la terminación más temprana del efecto del medicamento 3 (tabla 1). Esto se empieza a notar inicialmente unas cuatro o cinco horas después de la última toma, pero con el tiempo y la progresión de la enfermedad se va acortando aun más. La acinesia matutina también es una expresión del deterioro de fin de dosis. Por otro lado, también se encuentran los "OFF" impredecibles o súbitos, que no tienen relación con la administración del medicamento y en muchas ocasiones son desencadenados por estrés emocional. El incremento en la latencia de la respuesta entre la toma del medicamento (más de 30 minutos) y la aparición de los efectos benéficos de la levodopa se conoce como "ON" retardado o retraso en el inicio del efecto, en tanto que la ausencia total de respuesta es la falla de dosis o fenómeno "NO-ON". Las fluctuaciones "ON-OFF", que se definen como la alternancia rápida, predecible o impredecible de estado "ON" a estado "OFF" aparecen con el progreso de la enfermedad, incluso hasta generar un efecto conocido como yo-yoing, con múltiples variaciones de estado "ON" a "OFF" y viceversa 1.
Algunas de estas fluctuaciones se pueden explicar frecuentemente por factores gastrointestinales, como la variabilidad de la absorción de la levodopa secundaria a la administración conjunta de aminoácidos dietarios que compiten por receptores similares, de manera que la absorción de la levodopa disminuye, además de presentarse un retraso en el vaciamiento gástrico que está descrito en pacientes con enfermedad de Parkinson, incluso desde etapas iniciales 11. Estos pacientes tendrán entonces una respuesta de "ON" insuficiente o ausente, sobre todo al consumir comidas de alto contenido proteico. Por otra parte, es importante buscar y tratar la infección por helicobacter pylori, ya que se ha evidenciado que podría contribuir a este proceso.
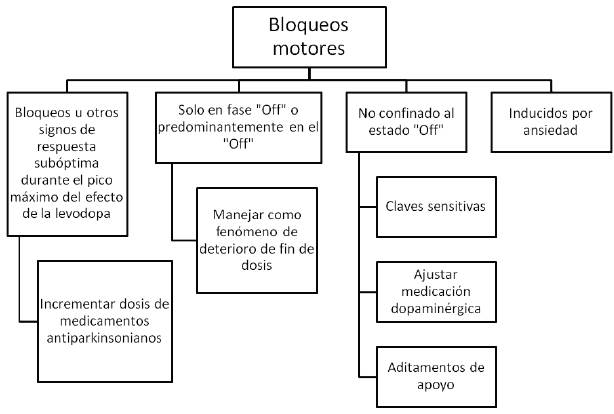
Algunos pacientes pueden experimentar un empeoramiento transitorio de los síntomas al inicio de la dosis, con una duración corta y generalmente precediendo el inicio del efecto benéfico. Otros pacientes pueden experimentar una exacerbación o rebote de los síntomas al final de la dosis. A este fenómeno se le conoce como súper "OFF". Los bloqueos motores o episodios de congelamiento son otro problema que puede ocurrir y se definen como la dificultad transitoria para iniciar el movimiento voluntario. Estos episodios son particularmente evidentes en la deambulación; por ejemplo, al iniciar la marcha, al intentar realizar giros o al tratar de atravesar una puerta estrecha. Estos episodios de bloqueos motores pueden ocurrir durante la realización de otras actividades, como hablar o escribir, pueden ser desencadenados por estrés emocional o ansiedad, y aunque son mucho más comunes durante el estado "OFF", también pueden aparecer en el estado "ON" 12.
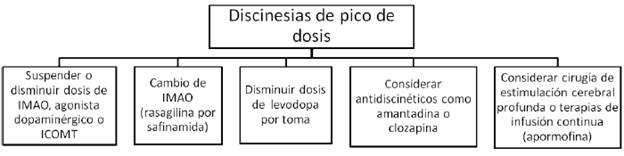
Aproximadamente al mismo tiempo que emergen las primeras fluctuaciones motoras, los pacientes con enfermedad de Parkinson empiezan a experimentar discinesias, que son movimientos involuntarios hipercinéticos inducidos por levodopa. Típicamente, aparecen como una combinación de movimientos coreiformes, balismo y posturas distónicas. Las discinesias pueden ocurrir en cualquiera de las etapas de la respuesta a la levodopa, aunque son mucho más frecuentes en el pico del beneficio de la dosis (discinesias de pico de dosis). Pueden igualmente ocurrir durante todo el estado "ON" (discinesias de beneficio) o al principio y al final de la dosis (discinesias bifásicas) 13; estas últimas relacionadas con disminución en los niveles de dopamina y característicamente afectan las piernas, con movimientos balísticos y distonía. Las posturas distónicas también pueden ocurrir en la etapa "OFF" o como un fenómeno de deterioro de fin de dosis. En este caso, aparecen más frecuentemente posturas distónicas fijas, en ocasiones asociadas a dolor, especialmente en las horas de la mañana (distonía matutina).
TRATAMIENTO DE LAS COMPLICACIONES MOTORAS
Las recomendaciones actuales para el manejo de las complicaciones motoras se basan en las guías clínicas más recientes de la Sociedad Internacional de Enfermedad de Parkinson y Trastornos del Movimiento (MDS, por sus siglas en inglés) 14 y la Federación Europea de Sociedades Neurológicas (EFNS) 15. A continuación presentamos algoritmos de manejo recomendados para cada una de las complicaciones motoras descritas (figuras 1-7):
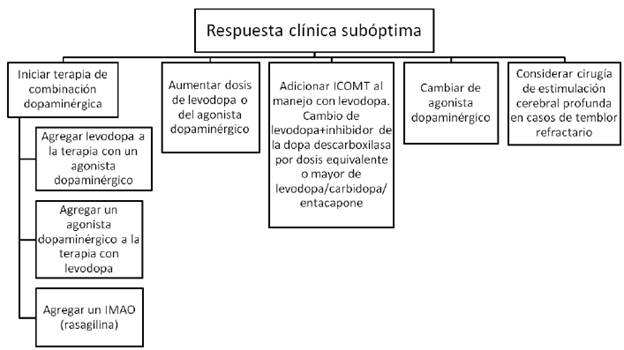
IMAO= inhibidores de la monoamino oxidasa (rasagilina o safinamida). ICOMT= inhibidores de la enzima catecol ortometil transferasa (levodopa/carbidopa/entacapone).
FIGURA 1 ESTRATEGIAS EN CASO DE RESPUESTA CLÍNICA SUBÓPTIMA AL TRATAMIENTO.
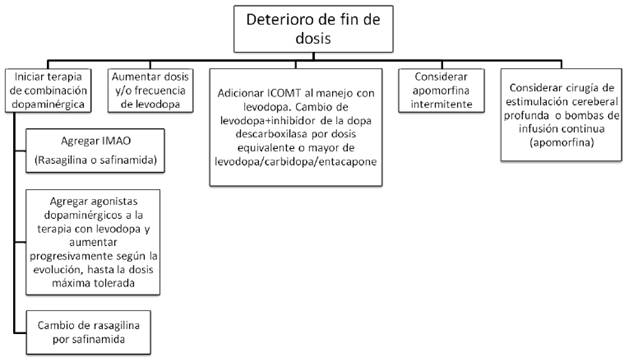
IMAO= inhibidores de la monoamino oxidasa (rasagilina o safinamida). ICOMT= inhibidores de la catecol ortometil transferasa (levodopa/carbidopa/entacapone).
FIGURA 2 ESTRATEGIAS DE MANEJO PARA EL DETERIORO DE FIN DE DOSIS.
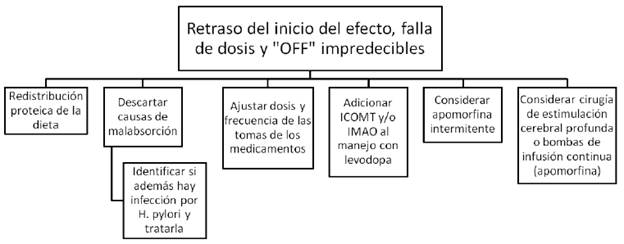
IMAO= inhibidores de la monoamino oxidasa (rasagilina o safinamida). ICOMT= inhibidores de la catecol ortometil transferasa (levodopa/carbidopa/entacapone).
FIGURA 3 ESTRATEGIAS DE MANEJO PARA EL RETRASO DEL INICIO DEL EFECTO, LA FALLA DE DOSIS "NO-ON" Y LOS EPISODIOS DE OFF IMPREDECIBLES
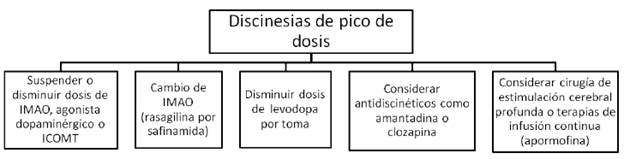
IMAO= inhibidores de la monoamino oxidasa (rasagilina o safinamida). ICOMT= inhibidores de la catecol ortometil transferasa (levodopa/carbidopa/entacapone).
FIGURA 5 MANEJO DE LAS DISCINESIAS DE PICO DE DOSIS Y DE BENEFICIO
IMAO= inhibidores de la monoamino oxidasa (rasagilina o safinamida). ICOMT= inhibidores de la catecol ortometil transferasa (levodopa/carbidopa/entacapone).
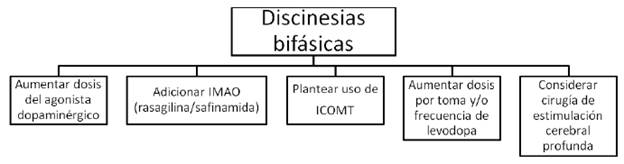
FIGURA 6 MANEJO DE LAS DISCINESIAS BIFÁSICAS
TERAPIAS AVANZADAS PARA EL MANEJO DE LA ENFERMEDAD DE PARKINSON
Apomorfina subcutánea
La apomorfina es un agonista dopaminérgico que se viene usando desde hace más 25 años en el tratamiento de la enfermedad de Parkinson avanzada con complicaciones motoras complejas, por lo cual sigue siendo de gran importancia en el tratamiento de esta etapa de la enfermedad. A continuación se resumen las indicaciones y la forma de uso de la apomorfina subcutánea intermitente (tabla 2) y continua (tabla 3). Para detalles sobre la terapia remitirse al Consenso de la Asociación Colombiana de Neurología sobre el uso de apomorfina en la enfermedad de Parkinson 16.
Tabla 2 Protocolo para inicio de apomorfina intermitente

-NOTA: Una vez se inicia la terapia intermitente no es necesario suspender otros agonistas dopaminérgicos.
Cirugía funcional en enfermedad de Parkinson
La estimulación cerebral profunda (ECP) en la enfermedad de Parkinson se ha convertido en una terapia estándar, aprobada por las diferentes entidades regulatorias tanto en Europa como en los Estados Unidos y Colombia. Tiene unas indicaciones muy precisas y requiere un grupo multidisciplinario para asegurar una apropiada selección de los pacientes y un desenlace y seguimiento adecuados. Este grupo debe estar conformado por un neurocirujano funcional, un neurólogo con experiencia en trastornos del movimiento y cirugía de Parkinson, neuropsicología y psiquiatría. Se estima que más del 30 °% de los casos en los que la ECP no es exitosa se debe a una selección inapropiada de los pacientes 17.
La evidencia que respalda la cirugía de ECP es robusta en cuanto al control de las complicaciones motoras de la enfermedad de Parkinson, con un nivel de recomendación A, tanto en globo pálido interno como en núcleo subtalámico bilateral. Se ha estimado que el aumento en el tiempo en "ON" sin discinesias es en promedio de 4-5 horas diarias 18-21, asociado a un mejoría significativa en la calidad de vida, especialmente si se hace en el momento adecuado, cuando los pacientes empiezan a presentar complicaciones motoras que no mejoran a pesar del tratamiento farmacológico convencional 22.
Los mejores resultados de la cirugía se han reportado en pacientes con enfermedad de Parkinson con complicaciones motoras y las siguientes características 23:
Excelente respuesta a la levodopa, entendida como una mejoria del 30 °% en la UPDRS en el test de levodopa, sin la presencia de síntomas axiales residuales
Jóvenes
Ningún compromiso cognitivo, o compromiso cognitivo leve
Ausencia de compromiso psiquiátrico o compromiso psiquiátrico bien controlado
En la selección de paciente se deben evaluar los siguientes elementos:
Diagnóstico: pacientes que cumplan criterios de enfermedad de Parkinson con complicaciones motoras como fluctuaciones motoras y discinesias que no mejoraron con el tratamiento farmacológico convencional 24,25, o pacientes con enfermedad de Parkinson que persistan con temblor residual a pesar del manejo médico adecuado. Los parkinsonismos diferentes a la enfermedad de Parkinson (Parkinson plus o parkinsonismos secundarios) no son candidatos para estimulación cerebral profunda ya que en estos pacientes no se ha evidenciado mejoría con esta terapia 26.
Edad: se ha considerado como edad límite 70 años, dadas las comorbilidades inherentes a este grupo etario. No obstante, esta condición es relativa, pues evaluando riesgo-beneficio en pacientes con enfermedad de Parkinson que presentan temblor refractario, estos pordrían ser candidatos en edades más avanzadas, siempre y cuando cumplan con las otras condiciones para el procedimiento y el grupo esté comprometido con el adecuado seguimiento del paciente 27.
Duración de la enfermedad: el estudio que ha mostrado la evidencia más contundente en pacientes con menor duración de la enfermedad incluyó pacientes con enfermedad de Parkinson de mínimo cuatro años de evolución que cursaban con fluctuaciones motoras o discinesias 22, por lo que este sería el tiempo mínimo requerido en pacientes muy cuidadosamente seleccionados por un grupo interdisciplinario. Al incluir candidatos con menor tiempo de evolución se corre el riesgo de operar erróneamente casos de parkinsonismo atípico.
Respuesta a levodopa: se ha considerado que la respuesta a la levodopa es el mejor predictor de respuesta a la cirugía. Se entiende como buena respuesta una mejoría en la escala UPDRS parte 3 del 30 °%, como mínimo, con el test de levodopa y que no haya presencia de síntomas axiales prominentes en el estado «ON» 28.
Deterioro cognitivo: la demencia contraindica la cirugía. El deterioro cognitivo mínimo y los pacientes con deterioro cognitivo sin repercusión funcional podrían ser considerados para ECP después de una adecuada selección 29.
Alteraciones psiquiátricas: no hay una contraindicación clara; se recomienda si presenta algún desorden psiquiátrico estar compensado para optar por la cirugía. Sin embargo, se requiere que los pacientes sometidos a cirugía, especialmente en el núcleo subtalámico, tengan una vigilancia psiquiátrica especial, ya que pueden ser propensos a depresión, suicidio, y otros cambios de comportamiento como discontrol de impulsos 30.