INTRODUCCIÓN
Los síntomas no motores de la enfermedad de Parkinson que con frecuencia anticipan a los clásicos síntomas motores han alcanzado una relevancia clínica mayor debido al impacto en la salud y en la calidad de vida del paciente y de sus cuidadores.
La enfermedad de Parkinson es una sinucleinopatía cuyos mecanismos neurobiológicos y patogénicos producen una severa y progresiva disfunción de la conectividad ganglio basal y cortical cerebral, con alteración de múltiples neurotransmisores como dopamina, serotonina, acetil-colina y noradrenalina, lo que explica el amplio espectro sintomático cognitivo, motor, afectivo y comportamental relacionados tanto con la enfermedad de Parkinson con demencia como con la demencia de cuerpos de Lewy 1, dos condiciones neurológicas que comparten similar mecanismo patogénico, pero con una diferencia entre la secuencia temporal de síntomas, siendo primero el compromiso motor para la enfermedad de Parkinson con demencia y primero lo cognitivo en la demencia de cuerpos de Lewy 2. Los estudios de neuropatología han encontrado explicación a la heterogeneidad clínica al demostrar la coexistencia de patología de cuerpos de Lewy con patología tipo Alzheimer (59 °%) y con lesiones microvasculares 3.
EPIDEMIOLOGÍA
La enfermedad de Parkinson por su complejidad sintomática es causa de una significativa discapacidad funcional. Estudios recientes han documentado con preocupación un rápido crecimiento de la prevalencia, de manera tal que el número de afectados se duplicó entre 1990 y el 2015, y se espera que siga la misma tendencia en los siguientes años debido al envejecimiento poblacional. La prevalencia del deterioro cognitivo mínimo en pacientes con EP está en un rango de 20 % a 50 %, con un alto riesgo de desarrollar demencia posteriormente 4.
La prevalencia puntual de demencia asociada a EP (D-EP) se estima en alrededor del 25-30 %, con un incremento proporcional en relación con la edad y el tiempo de evolución de la enfermedad, de modo que a los 20 años se alcanza una prevalencia acumulada del 83 %. Esta cifra justifica la práctica regular de pruebas de tamizaje cognoscitivo en los diferentes niveles de atención, con el fin de hacer un abordaje terapéutico y preventivo dirigido tanto al paciente como a su familia 5. El compromiso cognoscitivo no solamente es uno de los síntomas de mayor impacto en reducción de la calidad de vida, sino que también aumenta el riesgo de mortalidad 6.
ESPECTRO CLÍNICO DEL COMPROMISO COGNITIVO EN LA ENFERMEDAD DE PARKINSON
Se ha planteado que si bien los pacientes pueden tener una cognición normal o cambios mínimos al inicio de la enfermedad, pueden desarrollar deterioro de sus funciones mentales en los años siguientes. El perfil clínico de estos pacientes refleja un compromiso subcortical con un componente no amnésico que afecta las funciones ejecutivas, las habilidades visuoespaciales, la atención, la lentificación en la velocidad de procesamiento/respuesta y dificultad en la recuperación de la información, con un menor compromiso en la memoria declarativa, el lenguaje y las praxias 4,7. No obstante, este puede ser heterogéneo y algunos pacientes pueden exhibir un perfil cortical con significativa alteración en dominios mnésicos y de lenguaje.
La disfunción ejecutiva, una de las alteraciones cognoscitivas más importantes en la enfermedad de Parkinson, presente incluso en las etapas tempranas de la enfermedad 8, afecta la resolución de problemas, la planeación y secuenciación, el mantenimiento y modificación de reglas, así como la manipulación en la memoria de trabajo y la inhibición de la respuesta. Los síntomas disejecutivos se relacionan con disfunción de las proyecciones estriatales dopaminérgicas a la corteza prefrontal 9.
Comprender la complejidad de la heterogeneidad clínica compartimentalizando las funciones cerebrales no es tarea sencilla, pues la conectividad funcional de las diversas redes neuronales interactúa y estas se sobreponen entre sí con el fin de ejecutar una tarea cognoscitiva específica 10. El modelo cognitivo de la hipótesis dual plantea que el déficit cognitivo leve de la enfermedad de Parkinson es de un perfil dopamina-dependiente estrechamente relacionado con el déficit ejecutivo y de memoria de trabajo, mientras que la demencia asociada al Parkinson sería un estado diferente que implicaría la afectación de otros sistemas y neurotransmisores, con el resultado de déficits en los movimientos aprendidos (apraxia), en el reconocimiento (agnosia) y en el lenguaje (afasia) en estos pacientes 9.
No ha sido fácil identificar subtipos cognitivo-motores de la enfermedad de Parkinson que sean marcadores o predictores de deterioro cognoscitivo, debido a la diversidad de estudios transversales, de cohorte o longitudinales, así como de instrumentos neuropsicológicos que se han implementado para dar cuenta de esto.
El orden secuencial de los síntomas o la latencia entre el compromiso motor del cognitivo sugiere una demencia asociada a la enfermedad de Parkinson cuando los síntomas motores anticipan en varios años el deterioro cognitivo. En la demencia de cuerpos de Lewy, el patrón característico es una alteración cognitiva fluctuante y la presencia de alucinaciones visuales tempranas que anticipan el compromiso motor, aunque en el caso en que este sea primero el cuadro demencial se instaura a corto plazo (menos de dos años).
Para definir los subtipos de la enfermedad se utilizan dos estrategias: la primera, una clasificación basada en observaciones clínicas de cómo los signos y síntomas tienden a agruparse, y la segunda, simplemente descriptiva de los síntomas cardinales de la enfermedad. Se han identificado varios subtipos con base en la edad de inicio, la velocidad de progresión definida por el puntaje en la Escala Unificada para la Enfermedad de Parkinson (UPDRS), la duración de la enfermedad, la predominancia de temblor o de inestabilidad postural, la rigidez y complicaciones motoras, así como otros trastornos del afecto, de la conducta o la presencia de deterioro cognitivo 11,12.
Los subtipos descritos dividen a los pacientes entre los que acusan predominio de temblor (TD) y los que evidencian predomino de inestabilidad postural y alteración de la marcha (PIGD). Y algunas veces un tercer grupo indeterminado 13. La asociación entre el subtipo motor y los síntomas no motores ha mostrado que la forma de PIGD se asocia con mayor compromiso funcional por la severidad de los síntomas axiales, las alteraciones de la marcha y la inestabilidad postural que junto con la cognición empeoran al tiempo que la enfermedad progresa 14.
La alteración cognitiva en la enfermedad de Parkinson se ha definido de forma práctica como deterioro cognitivo leve (DCL-EP) o demencia (D-EP), de acuerdo con si hay o no compromiso que afecte las actividades de la vida diaria. A su vez, el DCL-EP puede restringirse a un solo dominio, principalmente al ejecutivo, o ser multidominio. Se establece así una clara diferencia con el DCL relacionado con otras enfermedades donde se divide en perfil amnésico y no amnésico 15.
Los déficits cognitivos también han sido divididos entre frontales y posteriores. Estos últimos han sido de mayor relevancia pues se ha descrito que los déficits que reflejan la disfunción cognitiva en zonas posteriores del cerebro tales como la fluidez verbal semántica y los déficits visuoespaciales suelen tener peor pronóstico en relación con el deterioro cognitivo 16. Las alucinaciones visuales no menores hacen parte de los criterios de demencia en la enfermedad de Parkinson, sin embargo, las alucinaciones menores referidas como sensaciones de presencia o de paso o de contacto, ilusiones o delusiones son muy frecuentes también, aun en pacientes sin demencia, y se han relacionado con el potencial desarrollo de demencia 17.
Estudios transversales de asociación entre el subtipo clínico motor con síntomas no motores han reportado que el fenotipo PIGD se relaciona con mayor deterioro en la esfera cognitiva y más riesgo de caídas (Odds ratio 3,317, intervalo de confianza 95 %, 0,82-13,47) en relación con el Parkinson tremórico 18,19. En este grupo o subtipo cognitivo motor parece que predomina el déficit colinérgico tanto en el núcleo pedúnculo pontino como en la neocor-teza, lo que evidencia diferencias entre el subtipo PIGD y el tremórico al comparar los dominios evaluados en las pruebas de tamizaje como el Minimental State Examination (MMSE) y el test de MoCA en tareas visuoespaciales como la copia del cubo y el dibujo del reloj, así como en tareas de lenguaje, denominación y resta consecutiva 15. En pacientes con EP cuyo perfil cognitivo se asocia con disfunción atencional y ejecutiva se ha reportado mayor variabilidad en la marcha, disminución en la velocidad y mayor riesgo de caídas cuando caminan y ejecutan tareas cognitivas de forma simultánea 20.
Estudios de neuroimagen y de patología han demostrado afectación de circuitos frontoestriatales dopaminérgicos, degeneración de circuitos corticales colinérgicos, así como del sistema límbico-paralímbico 21. Cambios estructurales medidos por resonancia de la degeneración del núcleo basal de Meynert (núcleo colinérgico) y sus conexiones con el sistema límbico, anticipan y predicen la aparición futura de compromiso cognoscitivo en la enfermedad de Parkinson 22.
Los pacientes con EP pueden tener síntomas cognitivos y comportamentales secundarios al uso de medicamentos usados para el tratamiento de esta enfermedad, como aquellos que tienen acción anticolinérgica (biperideno, amantadina) y agonistas dopaminérgicos (delirio, alucinaciones, impulsividad). Sin embargo, muchos pacientes utilizan crónicamente medicamentos para el tratamiento de enfermedades coexistentes con efecto anticolinérgico o bloqueadores dopaminérgicos. Debe hacerse un inventario detallado de fármacos, entre los cuales los más usuales son algunos antidepresivos, procinéticos gastrointestinales y reguladores de la función vesical 23.
COMPORTAMENTAL EN LA ENFERMEDAD DE PARKINSON
La alta prevalencia de compromiso cognoscitivo con la progresión de la enfermedad de Parkinson hace necesario educar al paciente y su familia acerca de síntomas de alarma. Así, en cada visita médica se debe realizar un inventario completo y detallado de síntomas cognoscitivos y comportamentales, con independencia de la aplicación de pruebas específicas.
La prueba cognitiva ideal de tamizaje deberá ser corta, de uso libre y fácil acceso, multidominio, con validación completa y sensibilidad para detectar oportunamente cambios menores en la función cognoscitiva que puedan diferenciar a los pacientes que mantienen su cognición intacta de aquellos que tienen un compromiso cognoscitivo mínimo, ya que estos tienen mayor riesgo de desarrollar demencia con el tiempo. Por tal razón, disponer de escalas de tamizaje sensibles resulta fundamental en la práctica clínica 24. El porcentaje de pacientes con enfermedad de Parkinson que tienen cada año evaluación cognoscitiva con las herramientas cognitivas recomendadas se ha establecido como un estándar de calidad de atención en la población de pacientes con EP 25.
El espectro del compromiso cognoscitivo en la enfermedad de Parkinson abarca desde el déficit cognoscitivo mínimo hasta el estado demencial, con una gran variabilidad del perfil clínico, así como en la forma de progresión. Por consiguiente, es necesario complementar con más datos clínicos, genéticos, imágenes y biomarcadores específicos que ayuden a configurar el riesgo individual de una demencia subsecuente 26.
Hacer referencia genérica a un deterioro cognoscitivo con impacto funcional en las actividades cotidianas del paciente permite comprender mejor la verdadera dimensión de lo que sucede, dado que el concepto de deterioro cognitivo leve (DCL) infravalora el impacto que puede tener este en las actividades de un paciente en particular. Así también la calificación de demencia de acuerdo con el nivel educativo, ocupacional y con el tipo de apoyo familiar puede atenuar su significancia e impacto cuando existe un trato holístico y comprensivo.
Uno de los principales objetivos del tamizaje cognitivo debe ser identificar patrones clínicos que generen riesgo en las actividades cotidianas del paciente, relacionados con conductas, comportamientos, toma de decisiones o dificultades en el procesamiento motor o visoespacial (como conducir) antes del establecimiento de un estado demencial.
Esa búsqueda debe estructurarse de acuerdo con el estadio clínico del paciente y en relación con los niveles de atención y complejidad de la red de salud.
El análisis basal en los niveles 1-2 de la red de salud, además de una completa historia clínica y un inventario detallado de síntomas de alarma, complementado con unos test sencillos como el MOCA, el MMSE o el CA test, que tienen validación local o regional, permiten detectar pacientes con síntomas cognitivos de alarma correspondientes a una alteración cognitiva de grado moderado o mayor, dado que estas pruebas no tienen la sensibilidad suficiente para detectar cambios mínimos de alarma en la población de pacientes con enfermedad de Parkinson. Entre estas escalas de tamizaje masivo, el MOCA y el CA Test tienen ventaja frente al MMSE dado que son más sensibles para detectar la disfunción ejecutiva. Sin embargo es claro que pierden sensibilidad con el tiempo para la detección de algunos síntomas cognitivos, por lo cual no se consideran seguras para el seguimiento de pacientes a largo plazo.
La Sociedad de Movimientos Anormales (MDS) define una serie de niveles para establecer un compromiso cognitivo a partir de criterios clínicos, cognitivos y funcionales: el nivel I, basado en instrumentos de evaluación general recomendados en pacientes con EP, y el nivel II, donde la evaluación neuropsicológica es más exhaustiva y por lo tanto con mayor confiabilidad, pues explorará dominios como atención, memoria de trabajo, funciones ejecutivas, lenguaje, memoria y las funciones visuoespaciales 27. Son muchas las escalas usadas en evaluación cognitiva en la enfermedad de Parkinson, pero solo cuatro de ellas tiene validación completa y se recomiendan por la MDS 9:
NIVEL I: COGNICIÓN GLOBAL
Numerosos instrumentos se han usado para definir de forma global el grado de deterioro en pacientes con EP. Sin embargo, se han recomendado instrumentos como el Test Cognitivo de Montreal (MoCA), la Escala de Medición Cognitiva para Pacientes con EP (Scopa-Cog), la Escala para Demencia de Mattis 2 (DRS-2) y la Evaluación Cognitiva para EP (PD-CRS). Es importante tener en cuenta que los puntos de corte para cada instrumento pueden variar, no solamente por el tipo de dominios que evalúan, sino también por las características de la población evaluada. La diversidad de instrumentos ha generado el uso de diferentes puntos de corte que finalmente van a impactar la estimación de la frecuencia del DCL en estos pacientes.
Recientemente, en población colombiana mayor de 50 años, se validó el test cognitivo corto (CA Test) para la detección del deterioro cognitivo mínimo en la atención primaria. Si bien esta prueba no ha sido recomendada por la MDS para ser usada en pacientes con EP, sí puede caracterizar el compromiso cognitivo inicial en estadios tempranos. Este instrumento consta de tres partes: una de recuerdo inmediato, con una lista de cinco palabras que se repiten dos veces y después de unos minutos se realiza la evocación espontánea. Una segunda, el test de dibujo del reloj con la marcación de números y manecillas a las 11:10 minutos. Y tercero, la tarea de fluidez verbal fonológica con las letras M y P. El puntaje total es de 21 puntos, de los cuales 15 son del componente mnésico. Comparativamente con el MOCA Test, el CA Test tuvo un desempeño similar, con una sensibilidad de 83 %% y una especificidad de 75 %% en la población estudiada, y cuenta con una ventaja que es útil en la atención primaria y es el tiempo de administración de cuatro minutos 28.
El MOCA Test se creó originalmente para detectar deterioro cognitivo mínimo en la población general 29. El instrumento consta de diferentes dominios que al ser sumados tienen una calificación total de 30 puntos. La prueba se divide en habilidades visuoespaciales-ejecutivas (copia del cubo un punto, TMT B abreviado un punto y test del reloj tres puntos); denominación (tres puntos); atención y concentración (dígitos en progresión un punto, en regresión un punto, ejecución continua auditiva un punto, resta consecutiva tres puntos); lenguaje (repetición de frases dos puntos; fluidez verbal fonológica letra P un punto); abstracción verbal (semejanzas dos puntos); memoria evocación (cinco palabras, cinco puntos); orientación (tiempo cuatro puntos y lugar dos puntos). Según la versión original, el puntaje sugerido como punto de corte para normalidad es de 26/30. Se adiciona una corrección de un punto por escolaridad menor a 12 años. No obstante, los años de escolaridad y las características sociodemográficas de la población de estudio deben ser tenidos en cuenta para la interpretación de los resultados 30.
En población colombiana, los puntos de corte planteados originalmente no son los mismos. En un trabajo reciente de evaluación de confiabilidad y validez del MoCA en un grupo de adultos mayores de 50 años en Bogotá, con diferentes niveles educativos, se estableció que el MoCA tiene moderada confiabilidad test-retest (Lin=0-62), buena consistencia interna (Alpha de Cronbach=0,85) y es capaz de discriminar entre grupos con diferentes niveles de deterioro cognitivo, demostrando adecuada sensibilidad y especificidad, lo que permite considerarlo útil para el tami-zaje de adultos mayores de 50 años 31. En tal medida, el estudio en mención estableció que los sujetos con primaria y menor escolaridad tienen una media de 21 y 22 puntos, bachillerato completo o incompleto 23/24 y universitarios 24/25. Para demencia, se encontró que el mismo punto de corte propuesto por Nasreddine y colaboradores 29 también aplica para la población colombiana.
Estudios en pacientes con EP han reportado el MoCA Test como una herramienta eficaz en la detección del deterioro cognitivo, al obtener un coeficiente de correlación intraclase test-retest de 0,79 y un coeficiente de correlación interobservador de 0,81, lo cual sugiere que es un instrumento confiable y válido en este tipo de pacientes (32). Igualmente, al compararlo con otros instrumentos de tamizaje cognitivo como el MMSE, se estableció que aproximadamente la mitad de los pacientes con resultados normales en el MMSE tenían un deterioro cognitivo según el MoCA y el punto de corte. Estos resultados sugieren que el test de MoCA es más sensible que el MMSE para la detección del deterioro cognitivo en EP 33. Igualmente, se ha estudiado el MoCA y el MMSE como instrumentos de tamizaje en una cohorte de pacientes con EP a lo largo de tres años, y se ha encontrado que el MoCA es más sensible para detectar cambios tempranos en pacientes con EP. Por el contrario, el MMSE es más sensible para detectar la declinación en el tiempo de estos pacientes 34.
El uso del MoCA en el tamizaje de pacientes con EP ha reportado que el punto de corte de <26/30 tiene un 90 % de sensibilidad, 75 %% de especificidad y un valor predictivo negativo de 95 %% 35. En otro estudio se reportó un buen desempeño del instrumento en la detección de demencia en pacientes con EP (D-EP), al tener una aceptable sensibilidad (0,83), pero baja especificidad (0,53) usando un punto de corte de 26/27 en detectar DCL-EP 36. Estudios de correlación también han usado el test de MoCA como instrumento de tamizaje cognitivo al compararlo con el MMSE entre sujetos no dementes con EP y DCL-EP con imagen por PET, y han reportado que sujetos con rangos normales en el MMSE y resultados anormales en las pruebas ejecutivas del MoCA tienen evidencia de denervación dopa-minérgica en el núcleo caudado, por lo que recomiendan la evaluación con el MoCA para detectar este tipo de perfil disejecutivo 37.
La escala de medición cognitiva para pacientes con EP (Scopa-Cog) 38 fue desarrollada como un instrumento corto, práctico y sensible a los déficits que exhiben los pacientes con EP. La escala consta de 10 ítems con un puntaje total de 43 puntos, con puntuaciones altas indicativas de mejor desempeño. Estos ítems están construidos para no ser afectados por el componente motor fino: memoria (verbal y visual) con evocación inmediata y tardía con puntuación máxima de 22, atención (series inversas) puntuación máxima 4, función ejecutiva (planificación motora, fluidez verbal por categorías y cambio de tarea) puntuación máxima de 12 y el ensamblaje de figuras para las funciones visuoespaciales con máxima puntuación de 5 puntos. La validación al castellano por Martínez-Martín y colaboradores 39 se realizó en un estudio multicéntrico transversal con 387 pacientes con EP, en estadios I y II de Hoehn & Yahr (70 %). La media de la edad fue de 65,8 años y 8,1 años de enfermedad. La consistencia interna fue satisfactoria (alpha = 0,83) y la correlación ítem-total, igual o superior a 0,45. Adicionalmente, la Scopa-Cog en castellano discriminó entre estadios de Hoehn & Yahr, grupos de edad, edad de inicio de la enfermedad y años de estudio. El error estándar de la medida fue de 3,02. El punto de corte propuesto de 19/20 puntos mostró un 76 %% de sensibilidad y especificidad para demencia.
Por otro lado, la Evaluación Cognitiva para EP (PD-CRS) es una escala diseñada para evaluar la heterogeneidad cognitiva alterada a lo largo de la enfermedad. El proceso de validación se realizó en una muestra prospectiva y representativa de 92 sujetos con EP (edad 71,2 +- 9 años, años de educación 8,9 +- 5, duración de la enfermedad 8,2 +- 5 años, puntaje de la Escala de Mattis para la demencia (MDRS) 123 +- 17) y 61 sujetos control pareados por edad y nivel educativo. La escala PD-CRS obtuvo una muy buena aceptabilidad, consistencia interna y test-retest y confiablidad interobservadores.
La validez concurrente entre la PD-CRS y la MDRS (ICC = 0,84) fue muy fuerte, mientras que con el MMSE fue modesta (ICC = 0,43). Esta escala cuenta con una calificación total así como calificaciones parciales que indicarían el compromiso de circuitos frontosubcorticales y disfunción cortical, lo cual puede estar presente incluso en estadios tempranos de la enfermedad. Esta prueba incluye siete tareas: atención sostenida, memoria de trabajo, fluidez verbal alternante y de acción, dibujo del reloj y memoria verbal tanto en codificación como evocación diferida. Además, dos tareas que evalúan las funciones corticales-instrumentales como son la denominación por confrontación visual y la copia del reloj 39.
Finalmente, la Escala para la Demencia de Mattis - 2 (MDRS-2), ampliamente conocida como una batería multidimensional para evaluar el compromiso cognitivo en personas mayores, es otro de los instrumentos recomendados por la MDS. Esta escala consiste en 36 tareas divididas en cinco subescalas: atención, iniciación/perseveración, construcción, conceptualización y memoria. La puntuación máxima por subescala es de 37, 37, 6, 39 y 25 puntos respectivamente. El puntaje total está entre 0 y 144 y se deriva de la sumatoria de las puntuaciones parciales.
Los ítems de la escala están organizados jerárquicamente en orden descendente de dificultad, de tal forma que el mayor puntaje es asignado en la sección cuando el participante contesta los primeros ítems correctamente. El tiempo estimado para completarla es de 10-15 minutos en sujetos sanos y de 35-40 minutos en sujetos con compromiso cognitivo. En un estudio reciente que compara el MOCA Test y la MDRS-2 para deterioro cognitivo leve y demencia en EP, se determinó que la MDRS-2 es favorable en relación con el MOCA test por sus valores de sensibilidad = 0,83 y especificidad = 0,53. La MDRS-2 podría ser una herramienta efectiva para caracterizar el puntaje total y el perfil cognitivo en estadios mínimo y moderado-severo de los pacientes con EP 40.
Estudios longitudinales en DCL-EP han planteado que este fue predictor de progresión al presentar fallas en funciones relacionadas con lenguaje (tarea semántica del CAMCOG), habilidades construccionales y visuoespaciales (copia y dibujo) y memoria declarativa 41. Factores que podrían contribuir a esta progresión también se relacionan con la edad avanzada, la severidad de los síntomas motores, así como la presencia de síntomas motores relacionados con el subtipo rígido-acinético (PIGD), la presencia de alucinaciones visuales y los déficits cognitivos asociados al perfil cortical-posterior.
De tal forma, las alteraciones de la atención y el dominio ejecutivo que se relacionan con los déficits fron-toestriatales, podrían considerarse un perfil más estable 9. Por el contrario, otros estudios han encontrado que la progresión a una demencia también se asociaría con un pobre desempeño en tareas ejecutivas como la fluidez verbal, así como otras pruebas asociadas con flexibilidad mental, inhibición y formación de conceptos (TMT B, Wisconsin Card Sorting Test, Stroop test) 43,44. Sin embargo, no todos los pacientes con EP progresan finalmente a un estado demencial. Aarsland y colaboradores 17 reportaron que el 15 %% de los pacientes permanecen intactos durante todo el proceso de la enfermedad. De los instrumentos que más se usan para el seguimiento, la MDS recomienda la Escala de Evaluación para Demencia de Mattis (MDRS-2) así como el MOCA test.
NIVEL II: EVALUACIÓN NEUROPSICOLÓGICA
El concepto de DCL-EP hace referencia a las alteraciones en diferentes dominios cognitivos que suponen un substrato neurobiológico y un curso diferentes. Los criterios recomendados para esta clasificación irían más allá de los criterios actuales de amnésico y no amnésico 27. Para el diagnóstico de DCL-EP, según el nivel II y basado en el criterio del grupo de trabajo de la MDS, así como en los subtipos cognitivos, se requiere aplicar una valoración neuropsicológica formal, exhaustiva y que abarque por lo menos dos pruebas por cada dominio: atención y memoria de trabajo, lenguaje, memoria, funciones visuoespaciales y funcionamiento ejecutivo.
Para hacer el diagnóstico de DCL-EP el compromiso debe ser evidente en al menos dos pruebas aplicadas. Si pertenecen a un solo dominio se considera DCL-EP monodomino, y si las pruebas afectadas están en varios dominios se considera DCL-EP multidominio. Las alteraciones en el desempeño se consideran significativas cuando la calificación está por lo menos una o dos desviaciones estándar por debajo de las puntuaciones previas o de acuerdo con el seguimiento realizado al paciente, teniendo en cuenta los valores de referencia para edad, escolaridad, sexo y normas culturales, cuando esto aplique.
En los pacientes que no tienen puntajes previos, se considera que una desviación estándar por debajo de los valores de referencia y que reportan cambios en la cognición es suficiente para diagnosticar DCL-EP (tabla 1). La recomendación del uso de dos pruebas en cada dominio cognitivo (10 pruebas en total) para el nivel II incrementa la sensibilidad y permite clasificar el desempeño del paciente dentro de los subtipos cognitivos 44 (tabla 2). Es ideal que todos los pacientes diagnosticados con la enfermedad puedan acceder a una valoración neuropsicológica, pues ello permite tener una línea de referencia sobre el estado de sus capacidades y habilidades cognitivas de tal forma que cuando los datos se comparan en el tiempo y curso de la enfermedad, se puede llegar a establecer un índice de cambio confiable (RIC) 45,46.
Tabla 1 Criterios para el diagnóstico para el deterioro cognitivo leve en la enfermedad de Parkinson (DCL-EP)

Fuente: 2
Tabla 2 Instrumentos para la evaluación neuropsicológica 50 recomendados en pacientes con enfermedad de Parkinson 44
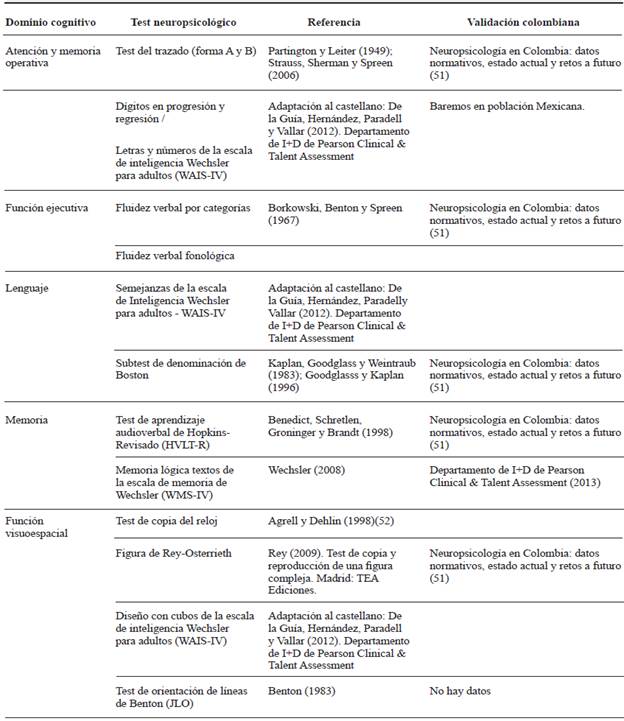
Fuente: Consultar referencias 44 y 50.
Igualmente, en el caso de pacientes con enfermedad de Parkinson avanzada y que son candidatos a la implantación de un sistema de estimulación cerebral profunda (ECP), se recomienda realizar una evaluación neuropsicológica previa y posterior a la cirugía. El propósito va más allá de determinar si el paciente es candidato o no para la intervención, se hace con la finalidad de discutir los riesgos y beneficios del procedimiento, expectativas sobre la respuesta esperada y el impacto que el procedimiento puede tener en la calidad de vida del paciente y su familia.
La valoración prequirúrgica tiene como objetivo identificar potenciales riesgos o contraindicaciones cognitivas, comportamentales y/o emocionales para el DBS. La valoración neuropsicológica se convierte entonces en una herramienta útil, no solo para estratificar el estado cognoscitivo del paciente, sino también para hacer educación en los pacientes y sus familias sobre el riesgo cognitivo, comportamental y emocional asociado per se a la evolución de la enfermedad de Parkinson a través del tiempo, así como al riesgo asociado al DBS en relación con el impacto que esto puede generar en la calidad de vida del paciente, a pesar de la mejoría en algunos aspectos motores 47.
Se ha establecido de manera sistemática que la cognición, así como algunos trastornos del afecto y comportamentales, puede verse afectada diferencialmente en relación con la zona seleccionada para la estimulación cerebral profunda (DBS). Tanto el núcleo intermedio ventral (VIM) como el segmento interno del globo pálido (GPI) son más seguros, mientras que el núcleo subtalámico (STN) se considera que tiene mayor riesgo de comprometer el funcionamiento ejecutivo, la fluidez verbal semántica y fonológica y la memoria 48,49.
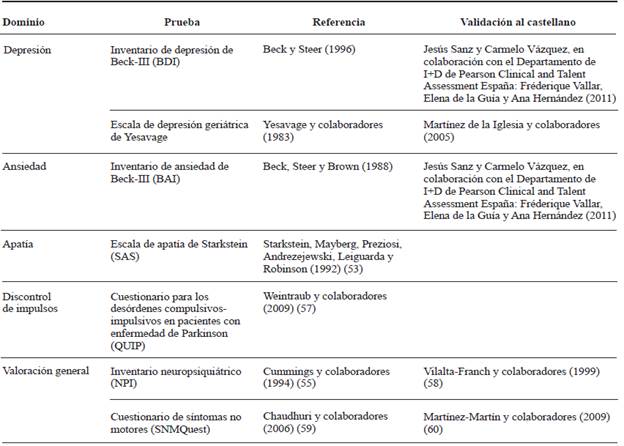
Tanto los síntomas motores como los no motores pueden afectar el desempeño de los pacientes en las tareas cognitivas. La depresión, la ansiedad, la apatía y el discontrol de impulsos son frecuentes en pacientes con EP, con o sin deterioro cognitivo, y pueden interferir en la ejecución y el desempeño en las pruebas neuropsicológicas, de tal forma que deben tenerse en cuenta para una apropiada clasificación del estado cognitivo.
Los instrumentos más usados en la práctica clínica para establecer la presencia o no de estas comorbilidades son: el inventario de ansiedad de Beck (BAI-II), el inventario de depresión de Beck (BDI-II), la escala de apatía de Starkstein (SAS) 53 y, de forma general, el inventario neuropsiquiátrico de Cummings (NPI) 54 y el cuestionario de síntomas no motores (SNMQuest) (tabla 3).
INSTRUMENTOS PARA EVALUAR EL COMPROMISO FUNCIONAL
Es importante evaluar de forma rutinaria y exhaustiva, mediante entrevistas, las actividades de la vida diaria (AVD), así como el desempeño funcional, lo que determina el grado de compromiso y se relaciona con el rendimiento cognitivo global 61. Es usual que los pacientes con DCL-EP presenten mayores dificultades en las actividades instrumentales de la vida diaria (AIVD). Según Marras y colaboradores 55, para complementar la caracterización del patrón y la severidad del compromiso cognitivo se requiere correlacionar la evaluación de la funcionalidad del paciente en sus actividades diarias con el funcionamiento cognitivo.
Para precisar el compromiso funcional es importante evitar la sobre o infravaloración del compromiso funcional y usar instrumentos apropiados que incluyan el componente motor propio de la enfermedad. Para tal fin, se recomienda el uso de la escala para la valoración funcional de pacientes con EP, denominada escala cognitiva funcional para pacientes con EP (PD-CFRS) 62.
La escala PD-CFRS tiene 12 ítems que exploran los aspectos funcionales que pueden ser más sensibles al compromiso cognitivo leve en pacientes con EP. La escala tiene un tiempo de administración de 5 a 10 minutos y se completa mediante una entrevista por un evaluador entrenado. Todos los ítems hacen referencia a las últimas dos semanas antes de la evaluación. El puntaje parcial de cada ítem está entre 0 = nunca, 1 = a veces, 2 = muchas veces y 8 = nunca ha realizado esa actividad. El puntaje total es de 24 puntos, la suma total de las puntuaciones parciales. La calificación de 8 indica que no se ha realizado esa actividad, por lo que su puntaje equivale al promedio de las que se califican con 0, 1 ó 2
NIVELES DE EVIDENCIA Y RECOMENDACIÓN DEL TRATAMIENTO DE LA DISFUNCIÓN COGNITIVA Y LA DEMENCIA EN LA ENFERMEDAD DE PARKINSON
La presencia de un estado demencial (tablas 4 y 5) implica mayor morbilidad sistémica, incremento de la comorbilidad psiquiátrica, necesidad de cuidadores en casa, pérdida de la calidad de vida del paciente y sus cuidadores y alto costo en la atención integral de la salud.
El abordaje terapéutico integral necesita visualizar de forma individual y precisa la red de apoyo que respalda al paciente y la complejidad clínica y sintomática de cada caso, a través de un inventario periódico de síntomas que permita contener y controlar los síntomas que tengan mayor impacto y riesgo para el paciente.
Mantener el mejor balance en el control de síntomas motores y no motores en la EP representa un reto constante, para lo cual se requiere, idealmente, un equipo terapéutico multidisciplinar y un seguimiento cercano que permita realizar ajustes oportunos 63.
Con el fin de tener el mejor escenario terapéutico para los síntomas cognitivos o la D-EP, es necesario tratar las enfermedades sistémicas concurrentes o los síntomas psiquiátricos que coexisten, como ansiedad, depresión, apatía, psicosis, delirio o alucinaciones, cambios comportamentales, discontrol de impulsos, deambulación nocturna o trastornos de la conducta alimentaria. Así también se deben vigilar rutinariamente las interacciones de medicinas o los efectos secundarios de estas, principalmente de los medicamentos que puedan causar o agravar el estado cognoscitivo del paciente.
TRATAMIENTO FARMACOLÓGICO
Las opciones farmacológicas disponibles para el tratamiento de la demencia asociada a Parkinson se desarrollaron inicialmente para el tratamiento de la demencia tipo Alzheimer, sin embargo, han demostrado mejorar la cognición, síntomas neuropsiquiátricos y síntomas funcionales.
De los inhibidores de colinesterasa es la rivastigmina la que tiene la mejor evidencia por seguridad y eficacia clínica 64. La galantamina y el donepezilo no cuentan con suficiente evidencia y su recomendación es sólo de posible utilidad para el tratamiento de la demencia en Parkinson, debido a que algunos estudios mostraron resultados en la impresión global de cambio e incremento en las funciones cognitivas. El donepezilo y la rivastigmina tienen beneficios adicionales al reducir síntomas comportamentales, la carga de los cuidadores y mejorar las actividades de la vida diaria. Un uso potencial que se está estudiando de los inhibidores de colinesterasa es el de mejorar la disfunción de la marcha y reducir la caídas, al incrementar el estímulo colinérgico en las zonas cerebrales relacionadas con el control motor y cognitivo de la marcha 65.
Con la memantina, un antagonista N-methyl-D-aspartate (NMDA), la recomendación sobre su eficacia es aún débil, al no demostrar mejoría en las funciones cognitivas 66.
La evidencia disponible para el tratamiento farmacológico del compromiso cognitivo leve en la enfermedad de Parkinson (PD-MCI), que aún no califica para criterios de demencia, sugiere que la rivastigmina puede mostrar algún beneficio frente al placebo, pero por las características de los estudios la evidencia es insuficiente. Algo similar sucede con la rasagilina, un inhibidor de la MAO-B con menor respaldo. Queda en proceso de investigación 64,67.
INTERVENCIONES NO FARMACOLÓGICAS
La estimulación magnética transcraneal directa (t-DCS) sobre la corteza prefrontal dorsolateral (CPFDL) mostró mejoría del compromiso cognoscitivo, pero la calidad del estudio fue insuficiente, por lo cual no hay evidencia actual para recomendarla (68). Igualmente, la estimulación magnética transcraneal repetitiva (r-TMS) ha reportado resultados contradictorios, pues si bien ha demostrado efectividad en el tratamiento de los síntomas motores en la EP evaluados con la MDS-UPDRS, los beneficios son sostenidos en un plazo de seis semanas, pero no se tiene suficiente evidencia de un efecto más prolongado. Es importante tener en cuenta que los mecanismos de la acción de la r-TMS aún permanecen sin esclarecer y por lo tanto son susceptibles a las diferencias individuales en la patofisiología de la enfermedad, lo que puede generar respuestas disímiles entre los pacientes 69.
El espectro de las intervenciones cognitivas ha sido evaluado y se ha desarrollado para pacientes con EP en diferentes estadios. Las intervenciones incluyen entrenamiento cognitivo (mediante tareas estandarizadas de lápiz y papel o computarizadas) que tienen como objetivo proveer sesiones grupales o individuales para mejorar o mantener las funciones cognitivas específicas afectadas por la enfermedad. Además, existen otros tipos de intervenciones cognitivas que pueden ser más especializadas o en combinación con la psicoeducación. La rehabilitación cognitiva que intenta lograr la reincorporación del sujeto a su entorno diario, así como desarrollar estrategias para mejorar o mantener la funcionalidad en las actividades diarias, o, finalmente, la estimulación cognitiva, que se hace en grupos pequeños para la estabilización o mejoramiento de la cognición global y el funcionamiento social en pacientes con deterioro demencial 70.
Las recomendaciones en este sentido sugieren que los mayores resultados en esta área deben ser acompañados de intervenciones que tengan en cuenta el fenotipo de los pacientes, el patrón de compromiso cognitivo, así como la definición apropiada de cuándo debe darse la intervención y las variables clínicas para mejorar o mantener 71.