GENERALIDADES
Además de los síntomas motores clásicos de la enfermedad de Parkinson (EP), los pacientes experimentan una gran cantidad de síntomas no motores. La mayoría de estos trastornos ocurre durante el curso de la enfermedad, pero algunos pueden presentarse inclusive en la etapa premotora 1.
La enfermedad de Parkinson (EP) se asocia frecuentemente con síntomas depresivos o aun con trastorno depresivo mayor. Los mecanismos subyacentes de la depresión en la enfermedad de Parkinson no se conocen en detalle, pero cambios en la estructura cerebral, niveles de neuro-transmisores e inflamación, así como señalización celular se han implicado en ello 2. Sin embargo, factores psico-sociales e inclusive el dolor también pueden tener relación con esta. La depresión ocurre en alrededor del 35 % de los pacientes y es frecuentemente un cuadro persistente 3, con un impacto importante en la capacidad funcional, así como en la calidad de vida de los pacientes con EP y sus cuidadores 4,5. Debido a la superposición de síntomas de la EP y la depresión, el trastorno depresivo puede ser subestimado, e incluso si se reconoce, a menudo se trata de manera inadecuada 6. La etiología de la depresión asociada a la EP es desconocida. Sin embargo, su aparición antes del desarrollo de los síntomas motores, su asociación con formas hereditarias de la EP, así como la falta de relación con la severidad de los síntomas motores en la EP, sustentan un componente biológico significativo 7.
En la EP hay alteraciones en diversos sistemas de neuro-transmisión, como el dopaminérgico y las vías serotoninérgicas y noradrenérgicas, probablemente vinculados a rasgos neuroconductuales específicos y que pueden contribuir a la alta aparición de depresión en la EP 8. Sin embargo, no hay evidencia convincente para sugerir que la etiología de la depresión en la EP es diferente de la de pacientes sin EP, y se ha afirmado que ambas entidades comparten muchos factores patógenos comunes 9. Es concebible que las alteraciones de neurotransmisores en la depresión asociada a la EP difieran un poco de los de depresión "común" con respecto a localización, distribución y severidad 10. Aún no se sabe sin embargo si tales funciones explican las diferencias correspondientes a fenomenologías diferentes.
Los cambios en los sistemas dopaminérgicos, noradrenérgicos y serotoninérgicos en pacientes con EP podrían ayudar a explicar la incidencia de la depresión en estos individuos 11. Los antidepresivos que tienen efecto sero-toninérgico así como noradrenérgico son los fármacos de elección para tratar la depresión en la EP. No obstante, los medicamentos antiparkinsonianos pueden tener efectos beneficiosos no solamente en los síntomas motores de la enfermedad, sino también en el estado de ánimo del paciente 12.
Puntos para recordar...
- La depresión es una entidad frecuente en la enfermedad de Parkinson (ocurre en aproximadamente el 35 % de los pacientes) y no debe pasar desapercibida.
- La depresión leve es un factor de riesgo para desarrollar depresión moderada/severa, por lo cual debe ser adecuadamente enfocada y tratada.
- La fisiopatología de la depresión en la EP, aunque no claramente definida, incluye distintos mecanismos, entre ellos cambios en neurotransmisores, patología de cuerpos de Lewy, inflamación y alteración en factores neurotróficos.
- En el tratamiento de la depresión en la EP no solamente son efectivos los antidepresivos habituales, sino también algunos fármacos antiparkinsonianos y medidas no farmacológicas variadas.
EPIDEMIOLOGÍA
La depresión es la alteración neuropsiquiátrica más frecuente en la enfermedad de Parkinson y se ha demostrado que es más común en esta que en otras enfermedades crónicas y trastornos incapacitantes 13. Estudios previos han concluido que entre el 4 y el 60 % de los pacientes presentan síntomas depresivos 14 y hasta el 26 % tomaban antidepresivos. La depresión es uno de los factores más importantes que afectan la calidad de vida en esta enfermedad 15.
La mayoría de los estudios de depresión en diferentes poblaciones han mostrado que esta es más frecuente en pacientes con enfermedad de Parkinson que en la población normal sana. La prevalencia estimada de depresión en la EP oscila entre 2,7 y 90 %, según algunas revisiones sistemáticas 16, aunque en general la mayoría de los reportes informan que dichos síntomas están presentes en un 20-35 % de estos pacientes. Si se subdivide la enfermedad se encuentran prevalencias de trastorno depresivo mayor (17 %), síntomas depresivos menores (22 °/0) y distimia (13 °/0) 17.
En Colombia, se han realizado dos estudios que informaron la prevalencia de la EP. En el primero (estudio EPI-NEURO), del año 2003, se mostró una prevalencia de 4,4 por cada 1000 habitantes, y en el 2004 en el departamento de Antioquia se encontró una prevalencia de 30,7 por cada 100.000 habitantes 18,19. Sin embargo, ninguno de los dos estudios hace referencia a la presentación o asociación de depresión en estos pacientes. Diazgranados y colaboradores 19 informaron en una muestra de 83 pacientes de un centro de referencia de la ciudad de Cali que 17,1 % de estos pacientes presentaban depresión. Se aclaró que en dicho porcentaje no se estudió su relación con el estado on/off del paciente. Asimismo, en un estudio realizado en Bogotá por Sánchez y colaboradores 20 se encontró un 71,4 % de pacientes con depresión en una muestra de 58 pacientes. El síntoma no motor más frecuente en estos pacientes era la depresión.
La evidencia de algunos estudios longitudinales realizados sugiere que la depresión suele ser persistente en los pacientes con EP, puede empeorar con el tiempo 21 y su aparición en una etapa temprana de la vida se asocia con un mayor riesgo de EP. La depresión ocurre en una etapa temprana de la EP en aproximadamente 10 a 15 % de los pacientes 22, y la evidencia emergente muestra que puede ser el síntoma de presentación de EP 23.
Se han encontrado diversos factores de riesgo específicos y no específicos de la EP asociados a depresión, incluidos el estado marital (soltero), el cáncer, el puntaje alto en UPDRS, las discinesias, la pobre calidad de sueño, la ansiedad 24, el sexo femenino, pacientes que cursan etapas avanzadas de la EP y presencia de deterioro cognitivo 25,26.
La depresión también ha demostrado ser determinante en pacientes con EP, con el resultado de una calidad de vida reducida, peor estado funcional y peor función cognitiva 27. Además, se ha relacionado con un aumento de la mortalidad 28. Si bien existe mayor evidencia para el impacto de los trastornos depresivos en la calidad de vida, algunos estudios encontraron que la ansiedad es el principal trastorno neuropsiquiátrico relacionado que contribuye al deterioro de la calidad de vida 29.
La depresión es la alteración neuropsiquiátrica más frecuente, presente hasta en el 60 % de los pacientes con EP, y afecta de manera significativa su calidad de vida.
FISIOPATOLOGÍA
Existe evidencia convincente de una base neurobiológica para la depresión en la EP. Se ha encontrado metabolismo reducido del córtex frontal y temporal y del núcleo caudado, en comparación con el paciente no deprimido, en tomografía por emisión de positrones, así como niveles reducidos de ácido 5-hidroxiindolacético en el líquido cefalorraquídeo de pacientes con EP 30.
La depresión en personas mayores de 65 años es compleja y puede verse afectada por problemas psicosociales, factores genéticos y cambios en el cerebro, así como por otras afecciones médicas del paciente 31. Varios cambios en el cerebro podrían contribuir a la depresión en la vejez, incluidos trastornos monoaminérgicos, enfermedad cerebrovascular, enfermedad de Alzheimer, patologías con cuerpos de Lewy, cambios funcionales en los circuitos límbico y subcortical, atrofia del hipocampo, alteraciones de la neurogenesis y factores neurotróficos, ademásde estrés tóxico con hipercortisolemia e inflamación 32.
DOLOR
Dos tercios de los pacientes con EP reportan sentir dolor, incluyendo dolor musculoesquelético y síndromes de dolor neurogénico o psicogénico 33. El dolor crónico contribuye a la depresión en personas en general, y también podría influir en el aumento de esta en pacientes con EP. De hecho, se ha identificado una fuerte asociación entre el dolor y la depresión en pacientes con EP 34. Este hallazgo también podría tener implicaciones para el tratamiento de estos pacientes, ya que es posible que el tratamiento del dolor también alivie la depresión en personas con EP, y el tratamiento de la depresión puede reducir el dolor.
ESCALAS
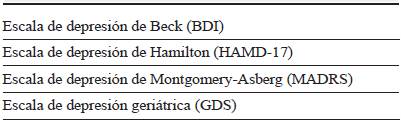
Las escalas hoy disponibles pueden servir como herramientas para monitorizar cambios a lo largo del tiempo y determinar el efecto de las estrategias terapéuticas en los pacientes con EP y depresión 35. Se han publicado varias revisiones de escalas de evaluación (tabla 1) y clasificación para esta última. Una evaluación de los métodos de detección de la depresión, realizada por la Academia Americana de Neurología (AAN) en el año 2006, concluyó que la escala de inventario de depresión de Beck (BDI), la escala de depresión de Hamilton (HAMD-17) y la escala de depresión de Montgomery-Asberg (MADRS) tuvieron la más alta precisión diagnóstica y fueron adecuadas para la detección de pacientes con EP 25. En el 2007 la Movement Disorders Society (MDS) concluyó que el HAMD-17, MADRS y escala de depresión geriátrica (GDS) también son apropiadas como escalas de detección de depresión en EP 36,37.
TRATAMIENTOS
Tratamiento farmacológico
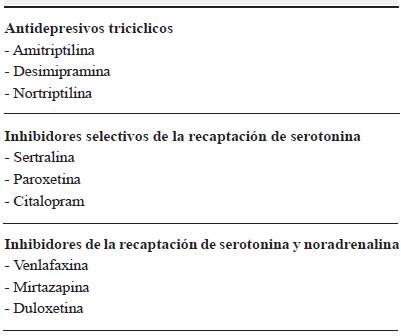
Aunque la prevalencia de depresión en los pacientes con EP es alta y tiene un impacto significativo en la calidad de vida, la evidencia para orientar su tratamiento por el momento es insuficiente. Se ha reportado eficacia con los antidepresivos tricíclicos (ATC) desipramina y nortriptilina, los inhibidores de la recaptación de serotonina y noradrenalina (IRSN) como venlafaxina y los inhibidores selectivos de la recaptación de serotonina (ISRS) citalopram, sertralina y paroxetina en algunos estudios clínicos aleatorizados, doble ciego, controlados con placebo 38-40 (tabla 2). Los tamaños de las muestras de estos estudios fueron pequeños y todavía no son claramente concluyentes con respecto a la eficacia de los antidepresivos individuales si se comparan entre sí.
En una reciente revisión sistemática sobre tratamientos para la depresión en la EP, en la que se compararon 13 tratamientos 41, los ISRS mostraron una mejoría estadísticamente significativa de la depresión. Otros estudios concluyen que los ATC tenían un nivel similar de eficacia a los ISRS 42.
La guía actual de la AAN establece que la amitriptilina puede utilizarse para el tratamiento de la depresión en la EP. Asimismo, señala la falta de evidencia suficiente para hacer recomendaciones sobre otros tratamientos farmacológicos 36.
Un metaanálisis más reciente, que utilizó una metodología ligeramente diferente, comparó la eficacia y tolerabilidad de diferentes medicamentos para la depresión en la EP y concluyó que los ATC podrían ser una buena opción a la hora de iniciar un tratamiento antidepresivo en la EP, debido a su equilibrio favorable entre beneficio y tolerabilidad, seguido de pramipexol, IRNS e ISRS 43. Otros metaanálisis concluyeron que si bien ambos ISRS y ATC son efectivos, los ISRS han sido mejor tolerados en EP y que el efecto antidepresivo es más significativo para los ISRS y no para el ATC 44.
Estudios con sertralina 39 y citalopram 42 no mostraron grandes diferencias con respecto a placebo; sin embargo, tenían muestras muy pequeñas. Los estudios con fluoxetina, uno de ellos con dosis de 20 mg, aleatorizado, comparado con estimulación magnética transcraneal (EMT), muestran similar eficacia con ambas terapias después de dos semanas de tratamiento 45.
Se debe recordar que los ISRS producen aumento de riesgo de temblor en un 4-5 % de los pacientes (particularmente con la fluoxetina) y que existe cierto riesgo de síndrome serotoninérgico al combinarlos con selegilina o rasagilina, por lo cual se sugiere vigilancia estricta en estos casos.
Los inhibidores duales (mirtazapina, duloxetina y venlafaxina) han mostrado mejoría de la depresión y algunos además evidencian impacto en la apatía, lo que constituye un beneficio agregado en estos pacientes 46.
Medicamentos antiparkinsonianos con efecto antidepresivo
La posible implicación de la dopamina en la patogenia de la depresión en pacientes con EP sugiere que el tratamiento dopaminérgico podría mejorar la depresión en estos individuos. Si bien no existen pruebas convincentes de la eficacia de la levodopa en el tratamiento de la depresión, sí hay algunos estudios que sugieren que los agonistas de la dopamina son eficaces en el tratamiento de la depresión en pacientes con EP 47.
Existe además evidencia de que los agonistas dopa pueden mejorar la depresión en comparación con placebo, con la mayoría de la evidencia disponible para pramipexol oral 48 y rotigotina transdérmica 49. Estos hallazgos se han comprobado en algunos estudios, en los cuales el pramipexol condujo a una reducción estadísticamente significativa en las puntuaciones de depresión en comparación con el placebo. La mejora real en la depresión fue modesta, pero parece ser independiente de la mejoría motora 50. El pramipexol fue bien tolerado y el beneficio adicional de este medicamento en términos de mejoría motora lo convierte en una buena opción como antidepresivo de primera línea en pacientes con EP y depresión.
Estudios aleatorizados doble ciego controlados de sertralina vs. pramipexol muestran similar eficacia en la disminución de síntomas depresivos con ambas medicaciones, pero con pramipexol se observa mayor tasa de remisión y, adicionalmente, se ven beneficios en la escala UPDRS III y en escalas de calidad de vida 48. La rotigotina también ha sido evaluada en estudios aleatorizados, doble ciego controlados, observándose disminución de los síntomas depresivos y excelente tolerabilidad de los pacientes 51. Otros agonistas de la dopamina, como el ropinirol (no disponible en Colombia actualmente) también parece tener propiedades antidepresivas. Sin embargo, solo un estudio no controlado con placebo ha proporcionado evidencia para respaldar la eficacia de este medicamento en el tratamiento de la depresión 52. Finalmente, en un estudio aleatorizado, doble ciego, controlado con placebo, el inhibidor de la monoaminooxidasa B selegilina ejerció una acción antidepresiva retardada en pacientes con EP que estaban clínicamente deprimidos 53. La importancia de los agentes dopaminérgicos en la aparición de los trastornos del estado de ánimo de la EP también se refleja en el desarrollo de depresión en el contexto del síndrome de abstinencia de dopamina y aumento de las tasas de apatía y depresión después de la rápida reducción de la medicación posteriormente a la cirugía de estimulación cerebral profunda (ECP), o de efectos adversos como el discontrol de impulsos 54.
Tratamiento no farmacológico
Un enfoque multidisciplinario mejora las puntuaciones de las escalas de depresión en la EP 55 y debe incluir educación sobre los trastornos del estado de ánimo y su relación con EP, uso de habilidades para hacer frente a estos síntomas y apoyo emocional 56. Cada vez se tiene más evidencia sobre el papel de las opciones no farmacológicas para el tratamiento de estos trastornos. Actualmente existe evidencia para la terapia cognitiva conductual (TCC) y hay algunos reportes positivos con otras estrategias de intervención no farmacológicas que incluyen estimulación magnética transcraneal (EMT) y ECP 57.
Una revisión sistemática de la TCC para la depresión en la EP, que incluyó dos ensayos controlados aleatorizados, encontró reducciones significativas en las puntuaciones de escalas para depresión con un mantenimiento del efecto al seguimiento a uno y seis meses 58. La EMT para el tratamiento de los síntomas del estado de ánimo en la EP también se ha evaluado en una serie de pequeños estudios, con algunos resultados alentadores. Aunque resalta la necesidad de estudios a mayor escala 59.
Otras opciones terapéuticas incluyen la terapia elec-troconvulsiva (TEC), el tratamiento más eficaz para la depresión mayor idiopática refractaria 60,61. Un efecto positivo de la TEC en los síntomas motores se observó en un estudio controlado de pacientes con EP 62, en tanto que otros estudios no controlados han informado los efectos beneficiosos de la TEC, aunque faltan estudios sistemáticos aleatorizados y controlados para corroborar dicho efecto. El principal efecto adverso de la TEC es el deterioro de la memoria (que suele ser transitorio) y el delirio ocasional, un evento que podría ser más común en pacientes con EP que en pacientes deprimidos que no tienen otro trastorno neurológico de base. La TEC solo debe considerarse en pacientes con depresión severa que no responden a otros tratamientos para la depresión, por el riesgo de eventos adversos asociados 63.
La estimulación magnética transcraneal repetitiva (EMTr) es un método no invasivo y tiene algunos efectos antidepresivos en pacientes con depresión idiopática que no responden a otros tratamientos. Aunque la técnica es bien tolerada y los resultados son alentadores, en el momento no es posible hacer recomendaciones específicas con respecto a este procedimiento hasta contar con estudios adecuados 45,64.
La estimulación cerebral profunda (ECP) del núcleo subtalámico mejora los síntomas motores y la calidad de vida en pacientes con EP avanzada, pero las personas que reciben el tratamiento parecen tener un mayor riesgo de suicidio 54. Un estudio internacional, multicéntrico y retrospectivo de pacientes sometidos a ECP del núcleo subtalámico encontró altas tasas de suicidio (0,45 %) e intento de suicidio (0,90 %) en individuos tratados 65. Además, la tasa de suicidio de pacientes en el año después de la operación (0,26 %) fue mucho mayor de lo esperado, según los datos de la OMS (0,02 %). En contraste con la estimulación subtalámica, que puede empeorar la depresión, la estimulación palidal podría mejorar la depresión en pacientes con EP. La estimulación palidal sería por tanto una mejor opción para el tratamiento de pacientes con EP que tienen síntomas psiquiátricos comórbidos, sin embargo, se sugiere una valoración integral a la hora de definir el blanco terapéutico. Es muy importante recordar que la depresión mayor activa es una contraindicación relativa de la ECP 54,65,66. Se indica además seguimiento y vigilancia adecuada de estos pacientes.
Para recordar...
Los pacientes con EP sometidos a ECP deben realizar seguimiento estricto, no solamente en síntomas motores, sino también en su sintomatología no motora, vigilando síntomas depresivos y conductas autolesivas.
CONCLUSIONES
La comprensión de las características, la fisiopatología y el manejo de la depresión en la EP están en progreso, pero el manejo apropiado de esta característica neuropsiquiátrica aún plantea una importante necesidad insatisfecha en los pacientes con EP. Su alta prevalencia e impacto en la calidad de vida destacan la importancia de una detección precoz, la identificación de biomarcadores y factores de riesgo y una mejor evidencia en los enfoques de tratamiento. La detección temprana y exhaustiva así como la evaluación y el tratamiento adecuados pueden proporcionar una mejoría sustancial en estos pacientes. La validación de escalas clínicas, el desarrollo de biomarcadores y los ensayos a mayor escala pueden orientar el manejo de la depresión con tratamientos farmacológicos y no farmacológicos.
Se han desarrollado estrategias generales para el manejo de pacientes con EP y depresión. La evidencia emergente sugiere que los agonistas dopaminérgicos podrían proporcionar algún beneficio en pacientes con EP y depresión y que los antidepresivos que actúan en los sistemas serotoninérgi-cos y noradrenérgicos pueden reducir la depresión. Además de realizar estudios con sustento estadístico adecuado para investigar los efectos de los medicamentos antidepresivos en pacientes con EP, los estudios futuros deben explorar los beneficios de otras estrategias de manejo, incluidas las terapias psicosociales, los medicamentos que modulan los factores inflamatorios y neurotróficos, así como las estrategias de estimulación cerebral (como la TCC, la TEC y la ECP) para los pacientes con EP y depresión.
Ansiedad y apatía en la enfermedad de Parkinson
La ansiedad y la apatía también son síntomas frecuentes en pacientes con EP 67,68. De hecho, los estudios han demostrado que la depresión a menudo coexiste con la ansiedad 69 y la apatía 70. Las presentaciones clínicas de la depresión comparten algunas similitudes con la ansiedad y la apatía, como fatiga, agitación, lentificación psicomotora, falta de expresión facial y dificultad para concentrarse 71. Se ha sugerido que la depresión y la ansiedad pueden ser dos entidades relacionadas, pero también pueden ser independientes, ya que se asocian con diferentes características demográficas y clínicas en la EP 30. Del mismo modo, un reciente metaanálisis mostró que la mitad de los pacientes con EP con apatía no sufrían de depresión concomitante, lo que implica que la apatía puede ser una entidad clínica separada 70. Las observaciones clínicas y los estudios de comportamiento parecen sugerir distintas etiologías que implican una superposición considerable entre estos trastornos del estado de ánimo. Sin embargo, el mecanismo y la neurobiología exacta de estos tres trastornos del estado de ánimo en la EP sigue sin dilucidarse 72.
Para recordar...
Las presentaciones clínicas de la depresión comparten algunas similitudes con la ansiedad y la apatía, como fatiga, agitación, retraso psicomotor, falta de expresión facial y dificultad para concentrarse.
Ansiedad
Los trastornos de ansiedad con frecuencia ocurren en asociación con la EP y pueden ser causas importantes de morbilidad. Las tasas de prevalencia reales son inciertas, pero las estimaciones sugieren que hasta el 40 % de los pacientes con EP experimentan ansiedad. Este porcentaje es mayor de lo esperado, particularmente para una población anciana. Prácticamente todos los tipos de trastornos de ansiedad se han descrito en la EP, pero el trastorno de pánico, el trastorno de ansiedad generalizada (TAG) y la fobia social parecen ser los más comunes 73. Se ha reportado que los pacientes presentan hasta un 30 % trastorno de pánico y hasta un 11 % de TAG 69.
Aunque la mayoría de los pacientes con fluctuaciones motoras experimentan mayor ansiedad durante la fase de off, este no es un fenómeno universal. Con frecuencia, la ansiedad se desarrolla antes que las características motoras, lo que sugiere que puede no representar dificultades psicológicas y sociales para adaptarse a la enfermedad, sino estar vinculada a procesos neurobiológicos específicos que ocurren en la EP. La mayoría de las pruebas apuntan a trastornos en los sistemas noradrenérgicos, pero también pueden estar involucrados otros neurotransmisores (por ejemplo, serotonina y dopamina). Los estudios sugieren que los trastornos del hemisferio derecho pueden ser particularmente importantes para la génesis de la ansiedad, especialmente el pánico y el trastorno obsesivo compulsivo. La ansiedad y la depresión coexisten frecuentemente en la EP. La relación entre la ansiedad y la demencia en la EP no está clara, pero la evidencia actual sugiere que la disfunción cognitiva no está relacionada con la presencia de síntomas de ansiedad en este trastorno 73.
La ansiedad se asocia con un aumento de los síntomas motores subjetivos, problemas más graves de la marcha, discinesias, congelamiento y fluctuaciones de on/off, por lo cual tiene un impacto negativo en la calidad de vida relacionada con la salud y está fuertemente asociada con los síndromes depresivos. Dado que se han utilizado diversas escalas de ansiedad en pacientes con EP, la MDS encargó un grupo de trabajo para evaluar las propiedades clínicas de estas escalas en la EP. Se realizó una revisión sistemática para identificar las escalas de ansiedad que han sido validadas o utilizadas en pacientes con EP y se identificaron seis escalas para calificar la ansiedad. Estas fueron: el inventario de ansiedad de Beck; la escala de ansiedad y depresión hospitalaria; la escala de ansiedad de autoevaluación y el inventario del estado de ansiedad de Zung; el inventario del estado de rasgos de ansiedad de Spielberger y la escala de calificación de ansiedad de Hamilton (tabla 3). Además, el artículo 5 (ansiedad) del inventario neuropsiquiátrico (NPI-Q) se incluyó en la revisión. Ninguna escala cumplió con los criterios para ser "recomendada" y todas las escalas se clasificaron como "sugeridas". Falta información clinimétrica esencial para todas ellas. El grupo de trabajo recomienda estudios adicionales de estos instrumentos. En caso de que las escalas actuales no sean adecuadas, se debe considerar el desarrollo de una nueva escala para evaluar la ansiedad en la EP 74.
Los tratamientos utilizados han sido los mismos antidepresivos con efecto ansiolítico o ansiolíticos puros tales como benzodiacepinas.
APATÍA
La apatía es un síntoma neuropsiquiátrico reportado con frecuencia en la EP, pero se discute su prevalencia y los correlatos clínicos. Las estimaciones informadas de la prevalencia difieren enormemente entre los estudios, con un rango de 17 % a 60 %. Se define como una falta de motivación, caracterizada por una disminución de la conducta y la cognición orientadas hacia un objetivo y una expresión emocional reducida 75.
Se ha propuesto que la apatía puede manifestarse en trastornos neurológicos como síntoma y también como síndrome. Los criterios diagnósticos específicos para un síndrome de apatía incluyen una falta primaria de motivación que se manifiesta en tres dominios. El dominio del comportamiento incluye falta de esfuerzo, falta de productividad y dependencia de otros para estructurar las actividades. El dominio cognitivo incluye pérdida de interés en nuevas experiencias y falta de preocupación por los problemas personales. El dominio afectivo incluye afecto aplanado y falta de respuesta a eventos positivos o negativos. Se enfatiza la falta primaria de motivación, que no se explica únicamente por el deterioro intelectual, la angustia emocional o la disminución de la conciencia, como la somnolencia o el delirio 76.
Su relación con la depresión y el deterioro cognitivo ha sugerido que la apatía en la EP sea secundaria a estos problemas, sin embargo, cerca de la mitad de los pacientes con apatía no sufren depresión o deterioro cognitivo concomitantes, lo que confirma que es un síndrome clínico separado en la EP, por lo cual reconocerlo puede llegar a ser muy importante para el tratamiento, buscando mejorar la calidad de vida del paciente, reducir la carga del cuidador, aliviar la discapacidad al aumentar la motivación para el cuidado personal y reducir el deterioro cognitivo al mejorar el funcionamiento ejecutivo 76.
La apatía se asocia con edad avanzada, peor función cognitiva, aumento de los síntomas motores, discapacidad más grave y, potencialmente, menor calidad de vida y mayor carga para el cuidador. La relación entre la apatía y el tratamiento dopaminérgico actualmente no está clara. Mientras que estudios informan que una mayor dosis equivalente de levodopa, en particular de agonistas de la dopamina, se asocia con puntuaciones de apatía más bajas, otros en contraste muestran que el uso de levodopa fue significativamente mayor en pacientes con apatía en comparación con los que no tenían; sin embargo, no se dispone de datos decisivos sobre el beneficio de los agonistas de la dopamina en la apatía relacionada con la EP y cualquier beneficio siempre tendrá que ser equilibrado con respecto a los efectos secundarios. Además del reemplazo de dopamina, se han sugerido otras opciones de tratamiento, incluidos los anticolinérgicos, los antidepresivos y las estrategias de tratamiento no farmacológico como el ejercicio y el entrenamiento cognitivo 76.
Para recordar...
La mitad de los pacientes con apatía no sufren de depresión concomitante o deterioro cognitivo, lo que confirma que es un síndrome clínico separado en la EP. La apatía se asocia con la edad avanzada, peor función cognitiva, depresión, aumento de los síntomas motores, discapacidad más grave y, potencialmente, menor calidad de vida y mayor carga para el cuidador.