INTRODUCCIÓN
Los trastornos secundarios a la disfunción del sistema nervioso autónomo son frecuentes en la enfermedad de Parkinson (EP), con una prevalencia variable entre 14 y 80 % de las personas con este diagnóstico, y afectan en forma importante la funcionalidad, la autonomía personal y calidad de vida 1. Hasta un 21 % de los pacientes con EP presentan como primera manifestación un síntoma no motor, entre los que se incluyen los síntomas autonómicos 2. A pesar de que históricamente los síntomas y signos motores han sido el eje de la evaluación clínica y la expresión más conocida de la EP, síntomas no motores como el estreñimiento o la incontinencia urinaria ya eran mencionados en la descripción original de James Parkinson en 1917 3.
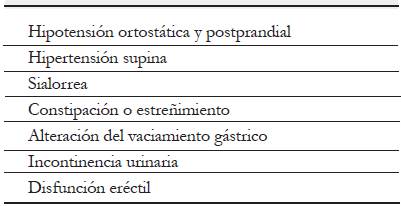
La presentación clínica de los síntomas autonómicos es heterogénea y compromete varios niveles del sistema nervioso autónomo (SNA) (tabla 1). Los más frecuentes son la constipación y la incontinencia urinaria 4. Los síntomas pueden iniciar en fases presintomáticas motoras de la EP junto con síntomas prodrómicos como la hiposmia y el trastorno del sueño REM. Sin embargo, la progresión en el tiempo es diferente en cada persona afectada.
La evaluación del SNA no se puede realizar en forma "directa", como sí se puede hacer en el sistema nervioso periférico, verbigracia con exámenes de velocidades de conducción nerviosa y electromiografía. Acá la evaluación se realiza a través de la función específica que realizan estas terminales nerviosas 5.
DISFUNCIÓN CARDIOVASCULAR AUTONÓMICA
Hipotensión ortostática
Se define como la disminución de la presión arterial sistólica (PAS) en 20 mmHg y/o disminución de la presión arterial diastólica (PAD) en 10 mmHG a los tres minutos de cambiar de posición supino a de pie 6.
Se presenta en 30-60 % de pacientes con EP y es más frecuente en edades más avanzadas y personas con EP de mayor duración y severidad 7, lo cual es causa de morbimortalidad por caídas, deterioro funcional y pérdida de calidad de vida 8.
Hipotensión postprandial
La hipotensión postprandial es la baja de la tensión arterial sistólica en más de 20 mmHg en las dos horas posteriores a la ingesta de alimentos. Es más frecuente que aparezca a los 30-50 minutos de la ingesta de una comida principal 9. Puede ocurrir en forma independiente a la hipotensión ortostática, es decir, la baja de presión no necesariamente se asocia con cambios posicionales. En cuanto a la expresión clínica, se sospecha cuando hay aumento de síntomas parkinsonianos luego de la toma de alimentos similar a periodos off. Otras manifestaciones son las propias por la baja de presión arterial, como síncopes o episodios pres-incopales. Otras manifestaciones clínicas más inespecíficas son astenia, mareo y, finalmente, manifestaciones clínicas por bajo gasto cardiaco que comprometan un territorio vascular con angina o ictus 10.
Tratamiento
Se debe considerar que los fármacos dopaminérgicos como la levodopa pueden aumentar o ser la causa de la hipotensión, especialmente si hay ingesta concomitante de medicamentos como los antihipertensivos. Por el rol fundamental de los medicamentos dopaminérgicos en la calidad de vida del paciente, el primer paso es evaluar la pertinencia de la toma de medicamentos concomitantes como los antihipertensivos. En muchas ocasiones, son medicamentos que el paciente ha tomado por años y, por ser consideradas terapias crónicas estables, no se ha analizado su continuidad.
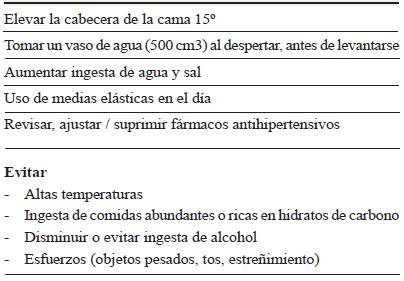
Una vez revisados los medicamentos concomitantes, la tarea es optimizar los medicamentos dopaminérgicos para alcanzar el mayor efecto clínico con la mínima dosis efectiva. En este paso se debe tener especial cuidado en no comprometer el beneficio sobre los síntomas motores o no motores 11. Si no es factible el ajuste de estos medicamentos, debemos tomar medidas terapéuticas, iniciando con medidas generales de manejo que tienen como fin mantener la normotensión, generalmente a través del aumento del volumen intravascular. En un gran porcentaje de los pacientes, estas medidas generales son suficientes para lograr la mejoría sintomática (tabla 2). Cuando estas medidas sean insuficientes, y el paciente persista sintomático, se indicarían las opciones farmacológicas 6.
Tratamiento farmacológico
La eficacia de estos medicamentos no se establece por las cifras de presión arterial objetivo, sino por la evolución clínica o el aumento en el tiempo en bipedestación del paciente sin que aparezcan los síntomas. La evidencia actual es insuficiente en cuanto a eficacia y seguridad, los más utilizados se describen a continuación 13,14:
Fludrocortisona: se utiliza por su efecto antidiurético, mineralocorticoide intenso y glucocorticoide leve, que actúa incrementando la reabsorción renal de sodio y aumentando el volumen intravascular y extracelular, el volumen minuto cardíaco y la PA. Se debe tener especial precaución en pacientes con insuficiencia cardiaca 14. La dosis inicial de 0,1 mg/día puede aumentarse hasta la máxima dosis recomendada de 0,5 mg/día. La dosificación es de 1-2 veces por día y se requieren siete días para observar su efecto terapéutico. Dentro de los efectos secundarios se puede presentar hipertensión arterial supina, edema de tobillos, dolor de cabeza, falla cardiaca congestiva, hipocalemia e hipomagnesemia 1, por lo que se requiere reposición de estos 10,15.
Midodrina: se trata de un od-agonista que origina vasoconstricción arteriolar, se administra por vía oral. La dosis inicial es de 2,5 mg, tres veces al día, y se va titulando hasta 10 mg, tres veces al día, en lo posible antes de cada comida. Debe evitarse su administración nocturna o antes de cuatro horas de irse a la cama, pues incrementa la PA con el decúbito que suele estar elevada en pacientes con hipotensión ortostática 16,17.
Desmopresina: es un fármaco sintético análogo a la vasopresina, que actúa sobre los receptores V2 de los túbulos renales que median el efecto antidiurético de la hormona. Su administración previene la poliuria y la pérdida de peso nocturna y aumenta la presión matutina al incorporarse sin elevar la PA en decúbito. Se usa en forma intranasal, en una dosis nocturna de 5 a 40 Dado que puede producir hiponatremia, debe monitorizarse diariamente los 4-5 primeros días, y posteriormente en forma mensual. Lo ideal es iniciar su uso con el paciente hospitalizado 16,18,19.
Domperidona: es un antagonista dopaminérgico. En un estudio controlado aleatorizado en pacientes con EP demostró mejorar la hipotensión ortostática, con mejores resultados que la propia fludrocortisona (nivel 2b, grado B) 15. Por sus efectos secundarios cardiacos, su uso se encuentra limitado al tratamiento de las náuseas y vómitos 13.
Piridostigmina: aumenta la acetilcolina ganglionar en la vía eferente simpática. Su evidencia para el tratamiento de la hipotensión ortostática en pacientes con EP es escaso (nivel 5, grado D). La dosis es de 30 mg, dos veces al día, hasta 60 mg tres veces al día. Su efecto es mayor si se combina con midodrina 20.
Eritropoyetina: al estimular la médula ósea, produce un incremento del hematocrito y de la PA. Tal vez debido al aumento del volumen intravascular y de la viscosidad sanguínea, inhibe la producción de óxido nítrico e incrementa la reabsorción renal de sodio. Mejora algunos síntomas no motores como la apatía y la fatiga. Se administra en forma subcutánea, 25 a 75 U/kg, tres veces por semana. Entre la segunda y la sexta semana, el hematocrito aumenta un 10 %> y la PA 10-15 mmHg, lo que permite una reducción en la dosis. Durante los primeros meses de tratamiento, suele detectarse una deficiencia de hierro que requiere suplemento 21,22.
Droxidopa: es un fármaco precursor de la norepinefrina. En febrero del 2014, la Food and Drug Administration (FDA) aprobó su uso en Estados Unidos para el tratamiento de la hipotensión ortostática neurogénica sintomática, en pacientes con insuficiencia autonómica primaria (EP, Atrofia Multisistémica, Falla autonómica pura), deficiencia de dopamina beta-hidroxilasa y neuropatías autonómicas no diabéticas. Se administra en forma de cápsulas, en una dosis de 100 a 600 mg, tres veces diarias. Puede provocar el aumento de la PA supina 23. Actualmente no se encuentra disponible en Colombia.
HIPERTENSIÓN SUPINA
Los pacientes con EP e hipotensión ortostática presentan una tensión arterial media más elevada en decúbito supino, con episodios de hipertensión arterial 24 causados por alteración en el barorreflejo cardiovagal 25.
Tratamiento de la hipertensión supina
Adoptar medidas preventivas como elevar la cabecera de la cama 15-20 cm, evitar la ropa ajustada para dormir o evitar la ingesta de fármacos como midodrine en la noche. Si se requiere el uso de fármacos, la primera elección en el tratamiento es el uso de medicamentos hipotensores de acción periférica como los parches de nitroglicerina. La dosis debe ser de 0,1-0,2 mg/h 26.
SÍNTOMAS GASTROINTESTINALES
El deterioro de la actividad vagal es el responsable de la mayoría de las complicaciones gastrointestinales 4.
Sialorrea
Es producida por la hipocinesia secundaria a las alteraciones de la deglución 27. La asociación de antimuscarínicos de acción periférica puede ser efectiva. La benzotropina, el glucopirrolato o el trihexifenidilo también son útiles. El que mayor evidencia presenta es el glucopirrolato, en dosis de 1 mg tres veces al día (nivel 1b, grado A) 28 con eficacia a corto plazo.
El tratamiento de elección es la infiltración con toxina botulínica en las glándulas parótidas y submandibulares 29. La infiltración aislada de ambas glándulas parótidas ha demostrado ser suficiente para controlar la sialorrea 30 en la mayoría de los pacientes.
Disfagia
En estadios avanzados de la EP se pueden presentar trastornos deglutorios en más del 50 °% de los casos. La rigidez y la bradicinesia de la musculatura orolingual generan dificultad en la masticación y disminución del peristaltismo esofágico. La disfagia precoz es sospechosa de otras enfermedades neurodegenerativas como la observada en parálisis supranuclear progresiva 31. El tratamiento con levodopa aumenta la motilidad esofágica y acelera el paso de los alimentos al estómago, con alguna mejoría de las alteraciones deglutorias vinculadas con la hipocinesia. Se deben adoptar medidas preventivas en caso de disfagia (tabla 3) 32,33.
RETRASO DEL VACIAMIENTO GÁSTRICO
Afecta al 70-100 % de los pacientes con EP y en muchos casos es asintomático. Se manifiesta en forma de saciedad temprana, anorexia, dolor abdominal, náuseas, vómitos y fluctuaciones motoras por disminución de la biodisponibilidad de levodopa 34. La levodopa disminuye el vaciamiento gástrico y la motilidad intestinal, y por sí misma es inductora de náuseas y vómitos 35. Las comidas ricas en grasas y carbohidratos también retrasan el vaciamiento gástrico. Dentro de las medidas terapéuticas se recomienda disminuir la cantidad de comida en cada ingesta y aumentar la frecuencia 36. Los fármacos anticolinérgicos, que a veces se utilizan para el tratamiento de síntomas motores como el temblor o para el tratamiento de la disfunción urinaria, empeoran este síntoma. El vaciamiento gástrico puede incrementarse con la utilización de domperidona, fármaco antidopaminérgico que, por carecer de efectos centrales, no empeora los síntomas motores 34. Un efecto secundario para tener en cuenta es la posibilidad de inducir arritmias ventriculares por prolongación del QT, por lo que se recomienda tomar dosis máxima de 10 mg tres veces al día, vía oral o en forma de supositorios de 30 mg, dos veces al día, evitando su uso en pacientes que tomen otros medicamentos que prolonguen el intervalo QT 37.
Ondansetron: menos efectivo que la domperidona en el tratamiento de las náuseas, no tiene efecto procinético 38.
Eritromicina intravenosa: es el agente procinético más potente. Podría indicarse en pacientes hospitalizados con gastroparesia grave 39. Como efectos adversos, puede producir dolor abdominal, náuseas y retrasar el tránsito intestinal, además de ejercer su acción antibiótica.
ESTREÑIMIENTO
Se define como menos de tres deposiciones en una semana, y con este criterio afecta a entre el 54 % y el 90 % de los pacientes con EP 31. Para evitar el estreñimiento, se debe aumentar el volumen de las heces y disminuir su consistencia. Como medidas preventivas, se recomienda aumentar la ingesta hídrica, tomar una dieta rica en fibra e incrementar la actividad física 4.
Laxantes osmóticos: el macrogol (polietilenglicol) ha demostrado su eficacia y seguridad en estudios doble ciego, aleatorizado frente a placebo 40. Se emplearán enemas cuando el tratamiento por vía oral no sea eficaz.
DISFUNCIÓN URINARIA
Se presenta en el 67 % de los pacientes con EP, las principales manifestaciones son nocturia, seguida de urgencia e incontinencia urinaria por hiperreflexia en el musculo detrusor frente a un 16 % que presentan hiporreflexia. La disfunción vesical y el volumen residual postmiccional aumentan con la gravedad de la EP 41.
En casos de nocturia, debe limitarse la ingesta hídrica nocturna. Si hay hiperreflexia del detrusor, pueden emplearse distintos fármacos (42:
Anticolinérgicos no selectivos sobre los receptores muscarinicos M3: oxibutinina 5 mg 1 vez al día, tolteridona: 2 mg día y trospio 20 mg 2 veces al día.
Anticolinérgicos selectivos sobre los receptores muscarínicos: M3: solifenacina. Tienen una menor tasa de efectos adversos, de elección. 5mg 1 vez a día.
Agonistas p3-adrenergicos: mirabegron 50 mg día.
Toxina botulínica A: intradetrusor vía cistoscopia 100UI cada 6-12 meses 43.
DISFUNCIÓN SEXUAL
Se define como la incapacidad de alcanzar y mantener una erección durante el tiempo suficiente para tener una relación sexual. El riesgo de disfunción sexual es de 1,52 veces para la edad. La disfunción eréctil es el doble de frecuente en la EP que en sus controles sanos 44. Las alteraciones en la erección van precedidas por un periodo de hipersexualidad, al que puede asociarse la eyaculación precoz 42,45. Se deben suspender algunos fármacos, como β-bloqueantes, bloqueantes a1-adrenergicos, tiacidas, ansiolíticos, digoxina y antidepresivos, y descartar la presencia de hipotensión ortostática antes de iniciar este tratamiento 4. El uso de sildenafilo 50 mg, aproximadamente una hora antes de la actividad sexual, mejora la disfunción eréctil 46. Otra alternativa es el tadalafilo, 5 mg cada día.
TRASTORNO DE LA TERMORREGULACIÓN Y LA SUDORACIÓN
Pueden producirse episodios paroxísticos de hipersudoración desencadenados por los off motores y asociados, periodos on con discinesias. El tratamiento con ajuste de levodopa o agonistas dopaminérgicos mejora este síntoma. Los anticolinérgicos no son efectivos. Se debe recomendar evitar ambientes muy cálidos y mantenerse hidratado. La infiltración con toxina botulínica es útil en el control de la hiperhidrosis focal 47.