INTRODUCCIÓN
La incidencia de encefalopatía hipóxica isquémica (EHI) se ha estimado en 2,5, y en 5 a 10 casos por cada 1000 nacidos vivos, en países desarrollados y en vías de desarrollo, respectivamente. Se asocia con parálisis cerebral en aproximadamente 14,5 % de los casos 1-3. Algunos han cuestionado el término EHI y sugieren el uso de encefalopatía neonatal dado que, por la complejidad del trastorno, no se puede asegurar en qué proporción la hipoxia o la isquemia hayan sido los mecanismos etiológicos entre toda la cascada de eventos que derivan en las secuelas neurológicas de estos niños 4-6.
Luego de que por muchos años no existiera ningún tipo de intervención para EHI, en el 2005 surgió la terapia de hipotermia terapéutica, que se encuentra soportada por más de seis metaanálisis que muestran disminución en la mortalidad, así como en algunos desenlaces neurológicos a largo plazo como déficit cognitivo y parálisis cerebral a los 18 y 24 meses 7-13. Se ha estimado un número necesario para tratar de entre seis y ocho neonatos, a fin de prevenir un caso de muerte o discapacidad grave 7,14.
Los criterios propuestos para ingresar a un neonato a terapia de hipotermia se han derivado de los estudios originales TOBY 2 y CoolCap 15, y son: encefalopatía neonatal moderada o grave en neonatos con edad gestacional ≥ 35 semanas de gestación y edad postnatal ≤ 6 horas; antecedentes de evento centinela (desprendimiento prematuro de placenta, rotura uterina, prolapso de cordón o nudo verdadero de cordón umbilical) o estado fetal no tranquilizador (registro cardiotocográfico fetal anormal); y alteración del estado al nacimiento o lo que se ha conocido como mala adaptación neonatal, bien sea APGAR ≤ 5 a los 10 minutos de edad postnatal, o los criterios bioquímicos marcadores de asfixia perinatal: pH ≤ 7,0 y déficit de base ≥ -16mEq/L, necesidad de ventilación mecánica durante por lo menos 10 minutos después del nacimiento o necesidad de reanimación cardiopulmonar avanzada 2,6,15.
Estos criterios, sin embargo, se han venido modificando luego de la publicación de los estudios originales, dado que se ha visto que pacientes que no los cumplen estrictamente podrían beneficiarse de la terapia. Para citar ejemplos, se ha sugerido que neonatos EHI podrían beneficiarse incluso luego de > 6 horas de nacidos 16; por otro lado, los criterios bioquímicos se han hecho más laxos, con base en lo evidenciado en modelos animales con estado fetal no tranquilizador hasta ≥ 13 17. Entre otros cambios, se ha propuesto modificar el criterio de APGAR para considerar el valor ≤ 5 al minuto 5, teniendo en cuanta que la definición de asfixia neonatal propuesta por la ACOG se realiza con el APGAR al minuto 5 y no al minuto 10; de allí que cambiar este criterio podría aumentar sustancialmente el número de pacientes que se beneficien de la terapia 18. Puesto que muchos de los criterios son por su definición sometidos a la subjetividad del operador, se ha descrito que no siempre se correlacionan directamente entre sí y, sobre todo, que tienen un papel discutido como predictores de morbilidad neurológica, hasta el punto de que ninguno se considera una prueba definitiva para el diagnóstico 6,19,20.
Dado lo anterior, y con el fin de objetivar el comportamiento durante la terapia, se plantea la necesidad de hacer una monitorización estricta del estado neurológico del paciente, que sea más objetiva y que se correlacione minuto a minuto con la fisiología cerebral. Para ello se ha propuesto el uso de la oximetría de espectroscopia cerebral de infrarrojo (NIRS) 21,22, que ofrece información en tiempo real sobre el metabolismo cerebral. Aún faltan estudios para definir el impacto del monitoreo NIRS en los desenlaces de los pacientes durante la terapia de hipotermia o durante la EHI 23-25.
Por otra parte, el electroencefalograma de amplitud integrada (aEEG) se considera un marcador biológico valioso, ya que se correlaciona directamente con la severidad de la encefalopatía, siendo un marcador pronóstico tanto positivo como negativo en pacientes sometidos o no a terapia de hipotermia 26,27. En especial, es una herramienta indispensable para la identificación de eventos de progresión ictal, que en más de la mitad de los casos no tienen ninguna representación clínica, pero que marcan de forma negativa el pronóstico neurológico de los bebés a largo plazo 27.
En definitiva, el protocolo de la terapia de hipotermia exige un cumplimiento estricto de los criterios de inclusión; sin embargo, con el advenimiento de la experiencia en la terapia y con ella los desenlaces clínicos a largo plazo, es posible que surjan algunos cambios en los criterios de ingreso y en la monitorización durante la terapia. Por esa razón es importante describir y estudiar la forma en la que se aplican los criterios de ingreso al protocolo de hipotermia corporal total, especialmente en el ámbito local, lo que fue el objetivo del presente estudio.
MATERIALES Y MÉTODOS
Se realizó un estudio descriptivo que incluyó todos los pacientes con EHI ingresados a terapia de hipotermia corporal total en dos instituciones de la ciudad de Medellín: el Hospital General de Medellín (HGM) y la Clínica Universitaria Bolivariana (CUB), durante el periodo 2017-2018. Estas dos instituciones fueron centro de referencia en dicho lapso para la ciudad de Medellín y la región, habida cuenta que recibieron nacidos de todos los municipios del departamento de Antioquia.
La CUB atendió 6500 partos durante el 2017 28 y el HGM un total de 5100 partos 29, que en la mayoría de los casos correspondieron a partos de alto riesgo.
Según el DANE 30, durante el 2017 nacieron 76.684 niños en Antioquia y 42.702 en Medellín. Con la incidencia de EHI referenciada en la literatura, se podría estimar unos 190 casos para toda la región en ese periodo anual, un número inferior de pacientes al recolectado en este estudio.
El acceso a la información clínica fue de dos maneras: la primera, obteniendo el número de historia clínica a partir de un censo de pacientes de la unidad neonatal, y la segunda, rastreando los códigos de egreso CIE10 correspondientes a EHI. Los datos obtenidos fueron consignados en una tabla de variables en Excel 2016, por dos investigadores de forma independiente, y de allí se exportaron al programa estadístico SPSS para su análisis. A efectos de evitar errores en el registro, cada variable estaba estrictamente descrita, estandarizada y sujeta a control de error y se realizó una prueba piloto con cinco historias clínicas.
Las variables incluidas en este estudio fueron: sexo; peso; evento centinela; presencia o no de expulsivo prolongado (si la historia clínica lo refería); APGAR a los minutos 1, 5 y 10; necesidad de maniobras de reanimación avanzada durante el periodo de adaptación neonatal; presencia o no de líquido meconiado; pH y base exceso de los primeros gases reportados; concentración de calcio sérico total y magnesio sérico; tipo de crisis epiléptica; el primer trazado reportado en las primeras seis horas de registro; el NIRS cerebral y los hallazgos en la resonancia magnética.
Las variables cualitativas incluidas se describieron como frecuencias, en tanto que de las cuantitativas aquellas con distribución normal se describieron como medias, con sus respectivas desviaciones estándar. Finalmente, aquellas que no tenían distribución normal se describieron como medianas con sus intervalos intercuartílicos.
El protocolo del presente estudio fue aprobado por el Comité de Ética de la Universidad de Antioquia, así como por el Comité de Investigaciones de los dos hospitales donde se tomaron datos. Se siguió la normatividad nacional respectiva 31. Se protegió la confidencialidad de la información de los pacientes de la muestra.
RESULTADOS
En total se recolectó información correspondiente a 256 pacientes, 152 de una de las instituciones y 104 de la otra, que corresponden al total de casos ingresados a terapia de hipotermia en los dos centros durante el periodo del estudio.
Del total de pacientes incluidos, 182 (71 %) eran varones, y el peso al ingreso fue de 3015 g (DE 482). Como se observa en la tabla 1, tres cuartas partes de los pacientes no tenían evento centinela, mientras que una cuarta parte de los registros refería la presencia de expulsivo prolongado. Cerca de 20 % necesitaron maniobras de reanimación avanzada para la adaptación neonatal y, aproximadamente, en uno de cada cuatro el líquido amniótico estaba meconiado. La mediana para el APGAR a los minutos 1, 5 y 10 fue de 2, 5 y 6, respectivamente. Cuatro de cada diez pacientes presentaron crisis epilépticas y solo 5 % manifestaron estatus epiléptico.
Tabla 1 Características clínicas de los recién nacidos con encefalopatía hipóxico-isquémica ingresados a terapia de hipotermia corporal total
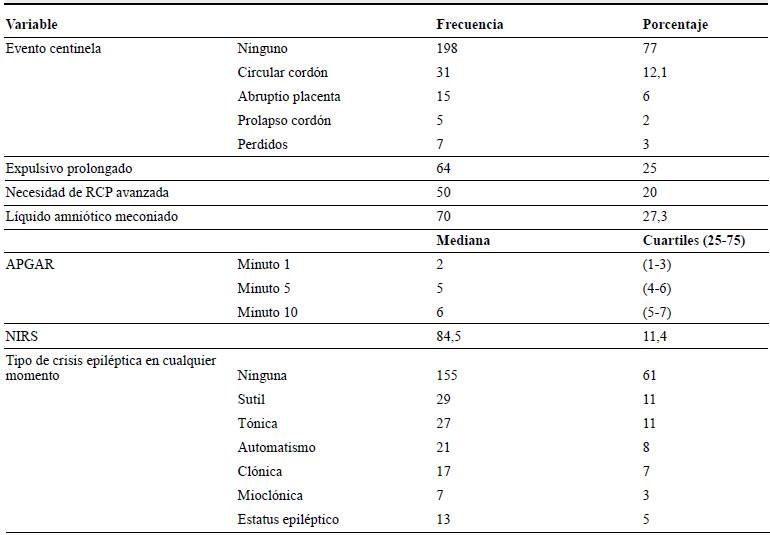
Elaboración propia
La media de pH sérico fue de 7,1 (DE 0,2) y la base exceso fue de -15,1 (DE 6,7). El valor de media para el NIRS fue de 84,5 (DE 11,4). El trazado aEEG más común en las primeras seis horas de registro fue el patrón discontinuo anormal y los hallazgos en la resonancia magnética fueron normales en la mitad de los casos (tabla 2).
Tabla 2 Primer registro aEEG y hallazgos en RMN cerebral
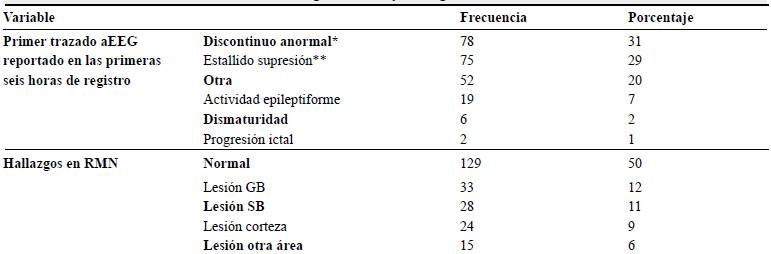
Elaboración propia
* Discontinuo anormal: amplitud mínima variable, en su mayoría < 5uv con amplitud máxima superior a 10 uv. ** Estallido supresión: actividad discontinua con una amplitud mínima sin variabilidad alrededor de 2 uv y brotes de > 25 uv.
En los pacientes en los que se evidenció un trazado compatible con estallido supresión en el aEEG, 47 % tenían un APGAR entre 0 y 4 en el minuto 5 (tabla 3).
DISCUSIÓN
Este estudio incluyó tamaño de muestra grande de neonatos con EHI, que incluso supera la estimación oficial de la incidencia para el departamento de Antioquia, debido quizá a la afluencia de pacientes de departamentos vecinos. El primar hallazgo es la deficiencia en la adherencia de los clínicos a los criterios de ingreso a la terapia de hipotermia corporal total con respecto a la propuesta de la Sociedad Iberoamericana de Neonatología (SIBEN) en ambas instituciones incluidas. El predominio del sexo masculino es concordante con la literatura publicada, la cual ha reportado que entre 53 % y 64 % de casos son varones 32, y se considera que el sexo es un factor de riesgo para EHI 33-38.
La gran mayoría de los pacientes evaluados no tuvo un reporte de evento centinela asociado (77 %). En el grupo restante se encontró como evento centinela circular a cuello, desprendimiento placentario y prolapso de cordón. Un 25 % de los pacientes tenía antecedente de expulsivo prolongado como evento significativo a la hora de definir el ingreso a la terapia en las historias clínicas revisadas, aun sin ser considerado un evento centinela en la literatura científica. Cuando se determinó la presencia o no de expulsivo prolongado, la revisión de la historia clínica no permitió establecer cuáles fueron los criterios empleados para definir expulsivo prolongado en cada paciente. Según los criterios vigentes del Colegio Americano de Obstetras y Ginecólogos (ACOG), un expulsivo prolongado hace referencia a una duración de la segunda etapa del parto de 3 + 1 horas (una hora para analgesia epidural) para nulíparas y 2 + 1 horas (una hora para analgesia epidural) para multíparas 39. Se podría considerar que la falta de aplicación y de uniformidad en la definición de expulsivo prolongado da lugar a un sesgo de medición que puede subvalorar o sobrevalorar la variable. La literatura ha mostrado valores de hasta un 64 % de niños sin evento centinela conocido 34,40. Es posible que la diferencia en este criterio básico para definir EHI sea el resultado de un registro incompleto de información, ocasionado por el hecho de que las dos instituciones incluidas son centros de referencia y no el sitio de atención del parto.
A los pacientes ingresados se les encontró un valor de media de 6 para el puntaje APGAR al minuto 10, lo que pone en evidencia que hubo pacientes ingresados que no cumplieron con el criterio de APGAR ≤ 5 a los 10 minutos, como lo ha sugerido la SIBEN 6. Si se tiene en cuenta que todos los pacientes de la muestra desarrollaron un cuadro clínico de asfixia, lo anterior da lugar a una discusión del papel del APGAR y su corte como criterio objetivo y de utilización masiva. Por tal razón, tomar el criterio de APGAR al minuto 5 (que en nuestro estudio tuvo una media de 5), y no el del minuto 10 como está estipulado, sugeriría que el puntaje de este último estaría persistentemente bajo como se puede ver en nuestros resultados. Proponemos que se tenga en cuenta también el APGAR al minuto 5, como lo precisó la ACOG para definir la asfixia perinatal 39,41. Incluso, a la fecha nuevas publicaciones han propuesto otros puntajes APGAR, como el APGAR expandido y el combinado que utilizan los mismos elementos que el convencional e incluye las intervenciones que el paciente requiere al momento del parto, los cuales mejorarían la sensibilidad y especificidad en la predicción de asfixia al nacer 19,42-46.
Adicionalmente, el patrón estallido supresión se evidenció con mayor frecuencia en los pacientes con el puntaje APGAR < 5 a los 5 minutos que en aquellos con APGAR ≥ 5. Como ya se mencionó, dar valor al APGAR al minuto 5 se articula de manera adecuada a la definición de asfixia perinatal dada por la ACOG, pues sugiere anormalidades severas en el aEEG. Nuevamente, queda en evidencia que estos puntajes permiten una orientación objetiva del estado del paciente, pero la valoración individual que hace el clínico de cada caso es un determinante definitorio para el ingreso o no a la terapia de hipotermia. Los niveles de electrolitos reportados en nuestro estudio fueron magnesio y calcio, los pacientes al ingreso del protocolo tenían un calcio sérico con valores heterogéneos, pero ninguno necesitó reposición urgente por hipocalcemia como sí lo han mostrado otras publicaciones 41,47,48. El ion magnesio no mostró alteración alguna.
La frecuencia encontrada en nuestra muestra respecto a la necesidad de maniobras de reanimación avanzada en la adaptación neonatal (20 %) duplica el 11 % reportado por la literatura 33, resultado que pudo ser condicionado por la mayor gravedad de los casos que se atienden en los dos centros incluidos al tratarse de lugares de referencia para la atención obstétrica de alto riesgo, sumado a la alta frecuencia de embarazos sin atención prenatal adecuada 49.
La presencia de líquido amniótico con meconio no pudo ser medida con la gradación correspondiente, situación que limita el análisis, dado que la literatura define que es el meconio grado III es el que realmente sería un factor de riesgo para el desarrollo de encefalopatía 50,51.
En cuanto a la crisis epilépticas, se evidenció un valor cercano a lo reportado en estudios previos: un 39,5 % de los pacientes en hipotermia las presentaron 16,52; sin embargo, dicha variable está sometida a la subjetividad del clínico que las describe 53. Por otra parte, el NIRS es un método que hasta ahora la literatura muestra útil, pero en nuestro estudio la pequeña proporción de pacientes impidió encontrar datos que dieran pie para llegar a conclusiones al respecto.
Dentro de las fortalezas del estudio se puede resaltar el número de pacientes incluidos, que puede considerarse una muestra representativa de este fenómeno clínico, y la estandarización realizada para la medición de las variables. En contraste, es una debilidad el diseño retrospectivo, pues supone dificultades al momento de obtener toda la información, sumado a que como ambos centros eran sitios de referencia, en muchas ocasiones no se contaba con todos los datos de cada paciente con exactitud. Como debilidad debe señalarse la falta de un seguimiento de los casos para evaluar los desenlaces a corto y mediano plazo.
CONCLUSIONES
El estudio pone en evidencia la subjetividad de los clínicos al momento de ingresar los pacientes a la terapia de hipotermia. De esta manera, es importante que los profesionales encargados de indicar la terapia accedan a estos resultados y consideren el impacto de fallar en la escogencia de los pacientes candidatos a la terapia.
Queda en evidencia además que es necesario aumentar la rigurosidad a la hora de registrar la información relacionada con la atención del parto y los eventos perinatales, ya que esto permitiría mejorar la escogencia de los pacientes que realmente son candidatos para recibir la terapia.
Finalmente, es indispensable el uso de herramientas diagnósticas tempranas, especialmente, el aEEG y el NIRS, cuyas anormalidades son objetivas y pueden ayudar a mejorar las discrepancias en la elección de los pacientes.
NIRS es un método que hasta ahora la literatura muestra útil, pero en nuestro estudio la pequeña proporción de pacientes impidió encontrar datos significativos, por lo que hace falta una muestra mayor.















