INTRODUCCIÓN
La mielitis transversa longitudinalmente extensa (MTLE) es una afección del cordón medular que afecta a tres o más cuerpos vertebrales 1. Algunas características permiten orientar la etiología, dependiendo del compromiso intramedular: lesiones anteriores típicas de oclusión vascular; compromiso de cordones laterales y posteriores típico de la esclerosis múltiple (EM); lesión central que orienta hacia el espectro de la neuromielitis óptica (NMOSD); cordones posteriores que se alteran más frecuentemente por deficiencias de ácido fólico y vitamina B12; compromiso por sífilis predominantemente posterior. La prevalencia de neurosífilis es de 2,1 % en los infectados por VIH y de 0,7 % en los no infectados 2.
La neurosífilis puede darse en cualquier etapa de la enfermedad (del 30 % en el estadio primario al 90 % en la fase terciaria) 3 y afectar desde la retina hasta la médula espinal. Se ha encontrado que los individuos con sífilis temprana presentan alteraciones en el líquido cefalorraquídeo (pleocitosis e hiperproteinorraquia), lo cual indica avidez de la bacteria por el SNC 3. Son pocos los casos de neurosífilis con compromiso medular cuando se deja de lado la afección de los cordones posteriores (tabes dorsal) 1.
El ácido fólico es una vitamina hidrosoluble (B9) ampliamente distribuida en una gran variedad de alimentos disponibles en nuestra cotidianidad. La deiciencia de este nutriente se asocia con compromiso hematológico (anemia megaloblástica) y neurológico (psicosis, depresión, demencia, neuropatía y mielopatía). La principal causa del déficit está dada por la limitación en la absorción (cirugía bariátrica, alcoholismo y quimioterapia) 4.
Se presenta a continuación el caso de un paciente que ingresa con una mielopatía longitudinalmente extensa a quien se le diagnostica neurosífilis y deficiencia de ácido fólico.
Presentación del caso
Hombre de 66 años, carpintero de profesión, que refiere debilidad de miembros inferiores de un mes de evolución. Progresivamente perdió el control esfinteriano (retención urinaria y estreñimiento), además de la sensibilidad y la capacidad de movilizarse, hasta ser dependiente de sus familiares para el aseo personal. Es hipertenso sin tratamiento farmacológico. Tres meses antes fue hospitalizado luego de un episodio de diplopía y vértigo. Después de que se estudiara su caso, se le diagnosticó ataque cerebrovascular isquémico. Tras ello el paciente evolucionó de forma adecuada y al alta logró caminar con apoyo (bastón).
El examen físico de ingreso reveló los siguientes hallazgos: skew deviation en plano horizontal sin restricción de movimientos oculares; cover test positivo; los demás pares craneales sin anormalidad. La fuerza en miembros inferiores fue 2/5 bilateral, arreflexia patelar y aquiliana, respuesta plantar flexora bilateral, nivel sensitivo hasta T9 con sensibilidad abolida en todas sus modalidades. No se hicieron otros hallazgos de importancia a la exploración.
Laboratorios: ELISA para VIH negativo; VDRL sérica reactiva; vitamina B12, TSH, T4L, hemograma, ionograma, función renal y hepática dentro de los límites normales. Ácido fólico sérico 1,2 ng/ml (4,6-34,9 ng/ml). Los anticuerpos Anti-DNA, ENAS, ANAS, anticuerpos contra herpes simple y citomegalovirus se reportaron negativos. En LCR el VDRL fue reactivo con hiperproteinorraquia (103 mg/dl). Las bandas oligoclonales e IgG contra acuaporina 4 (AQ-4) también resultaron negativas.
La resonancia magnética de neuroeje evidenció lesión hiperintensa centromedular C3-C7 y torácica T2-T5 Y T7-T10. La imagen cerebral muestra lesión hiperintensa en T2 y FLAIR en tálamo medial izquierdo (figuras 1, 2 y 3).
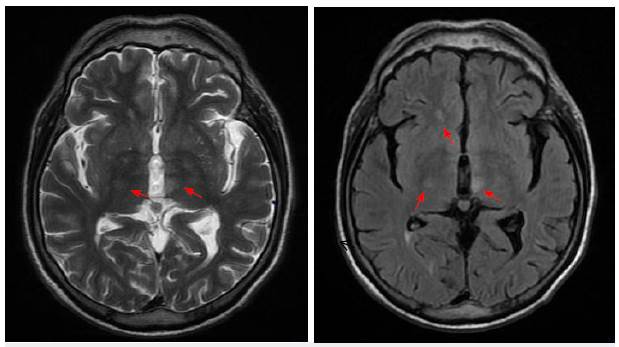
Figura 1 Corte axial en T2 con lesiones talámicas bilaterales hiperintensas (flechas), el aumento de señal en FLAIR sugiere gliosis (cabeza de flecha). Imagen propia del caso (Clínica La Misericordia).
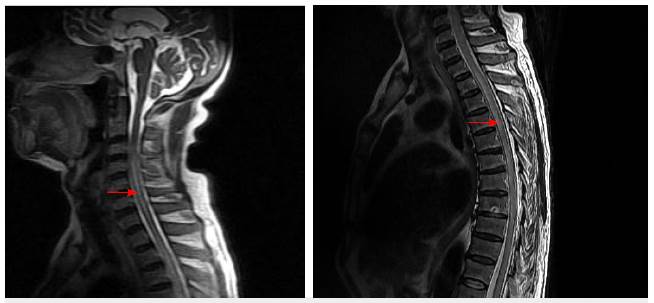
Figura 2 RM cervical potenciada en T2 con lesión medular extensa (flecha) desde C3-C7, en región dorsal, compromiso D2-D5 Y D7-D10. Imagen propia del caso (Clínica La Misericordia).
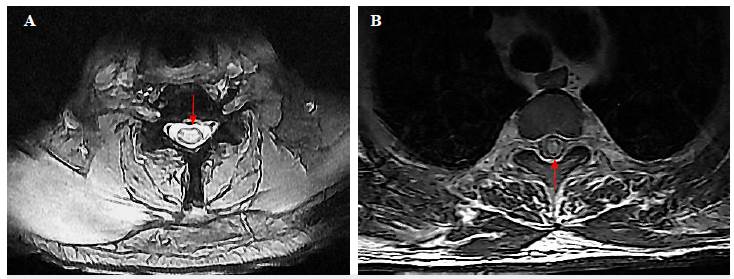
Figura 3 A. RM columna cervical a nivel C4 en T2 con extenso compromiso central del cordón. B. T1 contrastado con extenso compromiso central medular (flecha) y realce leptomeníngeo a nivel de D4 (cabeza de flecha). Imagen propia del caso (Clínica La Misericordia).
Se completaron 14 días de penicilina cristalina a dosis de 24 millones UI/día y suplencia con ácido fólico 4 mg/día. Al alta, el paciente no había presentado mejoría.
DISCUSIÓN
El paciente no presentó compromiso de miembros superiores. Dada la clínica consistente con cuadro mielopático completo a nivel torácico 5, se decidió realizar RM en la cual se encontraron lesiones extensas en columna cervical y torácica, de acuerdo con lo cual en primera instancia, tal y como se reporta en estos pacientes no caucásicos, la principal entidad patológica que tener en cuenta es la NMOSD 6-8 que también se puede presentar sin anticuerpos contra acuaporina-4.
Es importante tener en cuenta que aun cuando la NMOSD representa el 50 % de los casos de MTLE 5, se deben descartar primero causas infecciosas, metabólicas o autoinmunes e incluir imagen cerebral, puesto que la RM muestra anormalidades en el 50 % de los casos de NMOSD sin que estas cumplan con criterios diagnósticos para EM ni neuromielitis óptica 1.
La RM del paciente cuyo caso se reporta aquí muestra una lesión talámica de origen isquémico que explica la diplopía con la cual debutó en la hospitalización previa. Se evidencian bajos niveles séricos de ácido fólico que son una causa poco frecuente de mielopatía, sobre todo cuando se tienen niveles normales de vitamina B12. Esto último se considera un cofactor importante para el metabolismo de tetrahidrofolato en la síntesis y replicación de ADN mediante la producción de bases nitrogenadas 4. El compromiso medular por la deficiencia de folatos esta bien caracterizado como una pérdida de la sensibilidad profunda y vibratoria, así como del haz corticoespinal, con el desarrollo posterior de paresia, ataxia sensitiva y signos de motoneurona superior, cuadro clínico conocido como degeneración combinada subaguda 9. En el caso de este paciente la clínica medular transversa limita evaluar la presencia de lesión de haces por separado.
El estudio del LCR del paciente fue negativo para anticuerpos IgG contra AQ-4 por inmunofluorescencia indirecta (IFI) y no se encontraron síntomas o signos de compromiso de nervio óptico. En consecuencia, no se cumplían los criterios actuales para sospechar una posible NMOSD 8. Existen reportes de EM asociada a MTLE (3 % de los casos) 1,10. En este caso, las bandas oligoclonales también fueron negativas y no se observaron lesiones supra o infratentoriales sugestivas de desmielinización.
Desde hace más de 100 años se sabe que la espiroqueta invade el SNC desde etapas tempranas de la infección 12, lo que es causa de un cuadro asintomático, en el mejor de los casos, cuando se diagnostica de forma incidental. Sin embargo, también hace pensar que la bacteria tiene cierto tropismo por el SNC y que los mecanismos para el aclara-miento del germen son bastante efectivos 11,13,14.
En la actualidad, la forma de presentación más frecuente es la meningovascular, en un 5 % de los afectados, y responde a un proceso inflamatorio arterial meníngeo secundario a infiltración linfocitaria y también en los espacios perivasculares, lo que conlleva estrechamiento del vaso y en última instancia causa isquemia e infarto 14. El compromiso medular puede ser por infiltrado y vasculitis local (endarteritis de pequeños vasos tipo NISSL, o de mediano vaso, tipo HEUBNER) o por formación de gomas que pueden generar compresión directa sobre los tractos tanto descendentes como ascendentes 14.
En cuanto a la tabes dorsal, se han descrito signos clásicos que consisten en la ausencia de dolor al presionar ciertos sitios anatómicos como el nervio ulnar a la altura de la fosa cubital (signo de Biernacki), el tendón de Aquiles (signo de Abadie), el escroto y los testículos (signo de Pitres) 11. Aunque no existen características específicas en lo referente al estudio citoquímico del LCR, usualmente se encuentra pleocitosis de predominio linfocitario e hiperproteinorraquia. En este paciente solo estaba elevado el contenido de proteínas.
Para el diagnóstico se requieren pruebas inmunológicas que no son 100 % sensibles o específicas y cuyos valores suelen cambiar de acuerdo con la fase de la enfermedad. Por ejemplo, las pruebas no treponémicas en suero tienen una sensibilidad de 78-86 % en sífilis primaria, 100 % en fase secundaria y 95-98 % en la fase latente. Falsos positivos ocurren en 1-2 % y se asocian a estados autoinmunes, abuso de drogas intravenosas, vacunación, embarazo, VIH y endocarditis bacteriana. En la mayoría de estos casos (90 %), los títulos son menores a 1:8 diluciones. En LCR, la VDRL tiene una sensibilidad solo de 30-70 %, pero una especificidad mayor (98 %).
Por lo anterior, recordando la invasión temprana del SNC, algunos recomiendan realizar punción lumbar en todos los pacientes con infección por VIH y sífilis aun cuando estén asintomáticos 11,12. En cuanto al FTA-ABS, tiene mayor sensibilidad que VDRL, pero menor especificidad. Además, una vez es positiva, permanece así de por vida por lo que no es útil para seguimiento o reinfección 15. Su mayor beneficio radica en el alto valor predictivo negativo, es decir, en un paciente con VDRL no reactiva, con alta sospecha de la enfermedad, una FTB-ABS negativa realmente descarta la enfermedad, al igual que la técnica de hemaglutinación (MHA-TP) 15.
La razón para una VDRL no reactiva en un paciente con la enfermedad es el conocido efecto prozona, producto de la alta carga de anticuerpos circulantes contra la espiroqueta y que se resuelve con mayores diluciones de la muestra 16. Es importante realizar un estudio de LCR de forma periódica para medir el impacto de la terapia y si hay reinfección o no. La pleocitosis tarda seis meses en resolver y el LCR se normaliza en todos sus parámetros a los dos años 12.
Aunque no hay características radiológicas que sean propias de la neurosífilis, el realce leptomeníngeo, la forma de vela de la lesión centromedular en el corte sagital y el signo de flip-flop en cordón medular (señal baja en T2 y realce en T1) pueden orientar la sospecha diagnóstica 10,17. Las lesiones en resonancia de cerebro pueden simular a las encontradas en la encefalitis herpética si se presentan lesiones hiperintensas en lóbulos temporales. Las gomas se aprecian con lesión hiperintensa en T2 y FLAIR con realce homogéneo y nodular al contraste en meninges basales 11,18.
El tratamiento antibiótico se inició con base en los lineamientos actuales del CDC de Atlanta, con 14 días de penicilina cristalina a dosis de 24 millones UI/día y la suplementación con ácido fólico según recomendaciones nutricionales internaciones 19,20. En casos de alergia a la penicilina se debería proceder a la desensibilización 21,22.
CONCLUSIÓN
A pesar que hoy en día la mielopatía causada por la neurosífilis es una afección rara y tratable, son escasos los reportes de pacientes recuperados en los cuales la mejoría se logre luego de hasta dos años del tratamiento. En el caso objeto de reporte, debido al compromiso tan severo a nivel medular, la rehabilitación es la única medida viable durante el seguimiento, junto con el estudio de LCR a 3, 6 y 12 meses. Es muy probable que el evento isquémico a nivel talámico haya sido una manifestación meningovascular de la sífilis, siendo este otro distractor que haría pensar inicialmente en compromiso diencefálico por NMOSD.














