INTRODUCCIÓN
Desde la década de 1970, la disponibilidad de neu-roimágenes estructurales -tomografia computarizada y resonancia magnética- y funcionales -tomografia computarizada por emisión de fotón único (SPECT), tomografia por emisión de positrones (PET) y resonancia magnética funcional (fMRI)) - abrió una nueva vía en el estudio de la relación bidireccional que existe entre los fenómenos comportamentales y la actividad neuronal. La introducción de estas técnicas condujo a una mejor comprensión del impacto de una lesión cerebral en la actividad cortical y en el desarrollo de síntomas psiquiátricos 1.
En especial, el reciente desarrollo de la resonancia magnética funcional y de la tractografia permite segmentar diferentes estructuras cerebrales, incluyendo el tálamo, y por lo tanto identificar sus núcleos de forma no invasiva y comprender sus conexiones con otras estructuras del sistema nervioso central, sobre todo con la corteza cerebral. La identificación más precisa del núcleo talámico afectado por la lesión permite proponer una explicación más certera de las manifestaciones a nivel del lenguaje, la cognición y el comportamiento 2,3.
Muchos trastornos del afecto se han asociado con lesiones en las conexiones talamolímbicas: el trastorno depresivo mayor, el trastorno obsesivo-compulsivo, la adicción a sustancias psicoactivas y el trastorno de estrés postraumático, entre otros. Este grupo de trastornos tiene una morbilidad y una mortalidad considerables, por lo cual la identificación de los tractos de conectividad puede proporcionar nuevos medios para una intervención terapéutica eficaz con mínimos efectos secundarios 4.
En fecha reciente se han presentado trabajos completos de tractografias humanas in vivo cuyas aplicaciones potenciales en neurocirugía y otras áreas clínicas son amplias, cómo por ejemplo el tratamiento de trastornos psiquiátricos con estimulación cerebral profunda (DBS, por sus siglas en inglés), en el cual la focalización precisa, tanto de los núcleos como de los tractos, es de suma importancia para el éxito de la terapia 5.
Las alteraciones del estado de ánimo están presentes en diferentes enfermedades mentales, no solo en el trastorno depresivo o en el trastorno bipolar, sino en condiciones en las cuales la alteración afectiva no es el principal marcador de la enfermedad, como en la esquizofrenia 6. Estos síntomas afectan la función y el rendimiento cognitivo, por lo cual tienen un impacto significativo y en cierta medida independiente sobre el funcionamiento psicosocial. Así, su control puede representar una estrategia importante que conduce a mejorar la funcionalidad y permitir la rehabilitación integral 6-7.
MATERIALES Y MÉTODOS
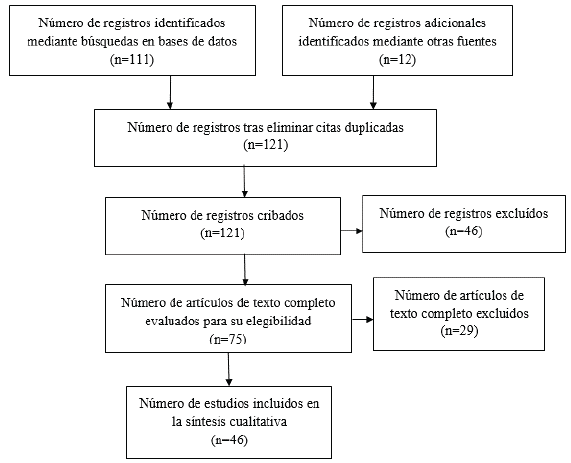
Se realizó una búsqueda en Pubmed y Embase, con los términos "desease, thalamic" y "mood disorders", limitada a artículos en inglés o en español y revisiones narrativas o sistemáticas, metaanálisis y ensayos clínicos controlados aleatorizados. Se encontraron en total 111 estudios, 27 en PubMed y 84 en Embase. De estos se eliminaron dos estudios por encontrarse repetidos. De los 109 artículos resultantes se eliminaron 46, los cuales no se consideraron relevantes para la revisión actual, y tras la lectura completa de los artículos se eliminaron 29 más. De esta manera se obtuvieron en total 34 artículos. Adicionalmente, se añadieron 12 artículos obtenidos por fuera de la búsqueda, para un resultado final de 46 artículos (figura 1).
BASES ESTRUCTURALES Y FUNCIONALES DEL TÁLAMO
Ambos tálamos corresponden al 80 % del diencéfalo y hacen parte de una gran cantidad de vías de conectividad cerebral, entre ellas todas las vías sensitivas, excepto la olfatoria, los circuitos frontosubcorticales, los circuitos de los núcleos basales y las estructuras límbicas 8-9.
El tálamo se divide por medio de la lámina medular interna en tres regiones (figura 2): anterior, medial y lateral. En la región anterior se encuentra el núcleo anterior, en la región medial se encuentra el núcleo dorsomedial, en tanto que la región lateral se subdivide en un segmento ventral y uno dorsal. En el segmento dorsal se encuentran el núcleo lateral dorsal, el núcleo lateral posterior y el pulvinar. El segmento anterior está conformado por el núcleo ventral anterior, el núcleo ventral lateral y el núcleo ventral posterior. El núcleo ventral anterior se subdivide en el núcleo ventral posterolateral y el núcleo ventral posteromedial 8-9.
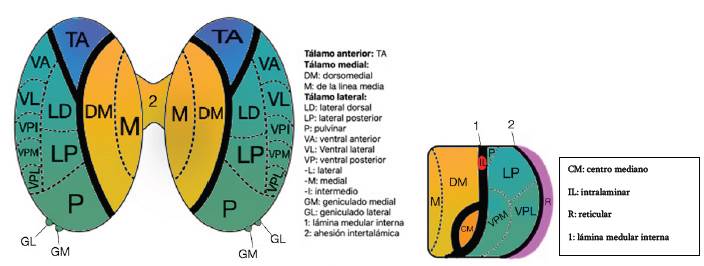
Figura 2 Núcleos del tálamo (Netter F.H. Atlas de Anatomía Humana. 2a edición. Masson S.A. Barcelona. (1999))
El núcleo ventral posterolateral es el relevo de la información somatosensorial del cuerpo, mientras que el núcleo ventral posteromedial cumple la misma función pero para la información proveniente de la cabeza. Los núcleos ventral anterior y ventral lateral están involucrados en los circuitos de control motor que incluyen al cerebelo y los ganglios basales. Adicionalmente, rodeado por la lámina medular interna, se encuentra otro grupo de células: los núcleos intra-laminares, dentro de los cuales se puede identificar el núcleo centromediano y el núcleo parafascicular. Finalmente, entre la lámina medular externa y la cápsula interna se encuentra el núcleo reticular del tálamo, y como continuación rostral de la sustancia gris periacueductal está el núcleo de la línea media del tálamo, que cubre la superficie medial de este 10.
En general, los núcleos del tálamo, con excepción del núcleo reticular, están constituidos por neuronas de proyección, cuyos axones se van a encargar de sus eferencias, y pequeñas interneuronas que usan GABA como neuro-transmisor 10.
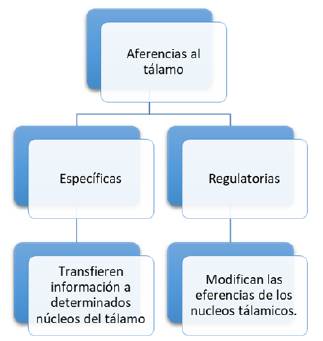
Las aferencias al tálamo se dividen en específicas y regulatorias (figura 3): las primeras son aquellas que transfieren información a determinados núcleos del tálamo, que posteriormente será transmitida a la corteza cerebral. Por otro lado, las aferencias regulatorias son aquellas que modifican las eferencias de los núcleos talámicos. La mayoría de las aferencias regulatorias se origina en la corteza cerebral, principalmente en la misma área cortical a la que cada núcleo enviará proyecciones. También se pueden originar en el núcleo reticular del tálamo o en terminales de la formación reticular 11.
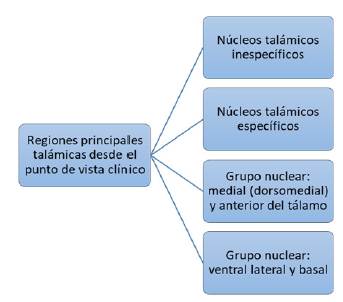
Desde el punto de vista clínico, el tálamo se puede dividir en cuatro regiones principales (figura 4):
El núcleo reticular, el núcleo de la línea media, el núcleo intralaminar y algunas áreas del núcleo ventral anterior median las respuestas generales de alertamiento cortical y se denominan núcleos talámicos inespecíficos. Reciben proyecciones de la formación reticular y fibras del tracto espinotalámico, así como de otras vías sensoriales. Así mismo proyectan fibras a núcleos específicos del tálamo y al mescencéfalo, por lo que las lesiones a este nivel pueden producir alteraciones en el alertamiento.
Los núcleos talámicos específicos reciben información sensorial del cuerpo, la procesan y la proyectan a áreas específicas de la corteza como el área somatosensorial y la corteza visual.
Los grupos nucleares medial (dorsomedial) y anterior del tálamo cumplen un papel importante en la memoria y en las emociones; tienen conexiones con el hipotá-lamo, el giro del cíngulo, la región temporal medial, la ínsula y el lóbulo frontal. El núcleo dorsomedial media las emociones, los efectos derivados del dolor, el ciclo sueño-vigilia y las funciones ejecutivas. Por su parte, el núcleo anterior media funciones ejecutivas y de memoria.
Los grupos nucleares ventral lateral y basal están involucrados en el control sensorio motor y en el procesamiento de información sensorial y su relevo hacia la corteza 9,12.
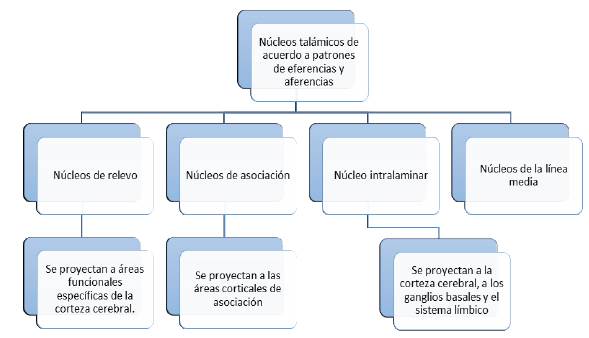
Los núcleos del tálamo también se pueden dividir, de acuerdo con los patrones de eferencias y aferencias específicas, en tres categorías (figura 5): núcleos de relevo, núcleos de asociación y el núcleo intralaminar con los de la línea media.
Los núcleos de relevo reciben fibras de aferencia bien definidas y se proyectan a áreas funcionales específicas de la corteza cerebral. Su función es transmitir información de sistemas funcionales particulares a las áreas corticales apropiadas.
Los núcleos de asociación reciben su nombre por proyectarse principalmente a las áreas corticales de asociación. La mayoría de las aferencias proviene de la corteza cerebral y de algunas estructuras subcorticales.
Los núcleos intralaminar y de la línea media se proyectan, no solo a áreas de la corteza cerebral, sino a los ganglios basales y el sistema límbico y cumplen un papel importante en la función de estos 13.
Se han descrito varias hipótesis acerca de la relación entre el tálamo y las funciones comportamentales complejas, a través del estudio de la lesión directa o su afección en áreas relacionadas. Por su parte, Nadeau y Crosson describieron cinco mecanismos de alteración comportamental o cognitiva asociados con lesiones talámicas, de la siguiente forma 7:
Impacto directo de la lesión talámica: indica su papel fundamental en la red neuronal cerebral y el procesamiento cognitivo
Desconexión cortical de áreas fundamentales para la cognición y el comportamiento luego de lesiones talámicas
Diasquisis: depresión funcional, del metabolismo y del flujo sanguíneo en regiones corticales conectadas con la región talámica dañada
Disregulación neuronal de la corteza
Ataque cerebrovascular (ACV) que cause simultáneamente una lesión talámica e hipoperfusión de la corteza.
Diversas teorías suscriben el concepto de que el tálamo forma parte de un asa córtico-estriado-pálido-tálamo-cortical. Entre las múltiples conexiones existentes se encuentran las conexiones recíprocas talamocorticales, que funcionan como relevo de las aferencias subcorticales a la corteza. También se encuentran el asa córtico-estriado-pálido-talámica y otros circuitos que involucran los núcleos intralaminares y de la línea media que se proyectan al estriado y a la corteza 12.
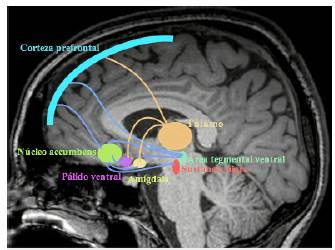
Si bien es cierto que las interconexiones tálamo-corticales son complejas, el avance en neuroimágenes ha permitido establecer algunas relaciones, por ejemplo, la conexión recíproca entre la corteza prefrontal y el núcleo mediodorsal del tálamo. Por un lado, la corteza prefrontal lateral se relaciona con la porción lateral de ese núcleo, que a su vez recibe la mayoría de las aferencias subcorticales desde el tallo cerebral, incluyendo el colículo superior y los núcleos vestibulares, como también fibras GABAérgicas de la pars reticular de la sustancia nigra, y también cumple funciones en la modulación de las interacciones tálamo-cortico-talámicas 10,13. Por otro lado, la corteza prefrontal orbitomedial se relaciona con la porción medial de este, el cual a su vez recibe aferencias de la amígdala, de la corteza olfatoria y de otras áreas límbicas que también envían proyecciones directas (no talámicas) a la corteza prefrontal orbitomedial (figura 6). Adicionalmente, la corteza olfatoria primaria y la corteza entorrinal, prerrinal y parahipocampal envían proyecciones axonales tanto a la corteza prefrontal orbitomedial como al segmento medial del núcleo dorsomedial 7,12,14.
Aparte de las aferencias de las estructuras límbicas, que son excitatorias y probablemente glutamatérgicas, el segmento medial del núcleo dorsomedial también recibe aferencias GABAérgicas del pálido ventral y del globo pálido rostral que forma parte del asa córtico-estriado-pálido-talámico. Estas aferencias GABAérgicas hacen sinapsis en las mismas dendritas donde lo hacen las terminales excitatorias de la amígdala y otras estructuras límbicas. Se sugiere que esta interacción regula la relación entre la corteza prefrontal orbitomedial y el segmento medial del núcleo dorsomedial. La lesión de alguna de estas dos estructuras produce cambios afectivos y en lograr la asociación estímulo-recompensa 2,15.
Los núcleos de la línea media son relativamente pequeños, sin embargo, tienen muchas conexiones, especialmente con las áreas de la red prefrontal medial, y también tienen proyecciones a las mismas áreas del estriado ventromedial que recibe aferencias de las redes del tálamo medial. Estos núcleos además tienen conexiones con la amígdala, el hipo-tálamo y las áreas del tallo cerebral, incluyendo la sustancia gris periacueductal. Muchas de las aferencias del hipotálamo y del tallo cerebral al tálamo medial utilizan neurotransmi-sores específicos como CRH, serotonina y norepinefrina. Esto ha llevado a que se relacione el núcleo paraventricular del tálamo con la respuesta al estrés 11.
TÁLAMO Y AFECTO
Desde el punto de vista estructural, los hallazgos referentes al cambio de volumen del tálamo han sido poco consistentes entre sí. Por medio de resonancia magnética, Frodl y colaboradores reportaron un incremento del tamaño del tálamo en pacientes con diagnóstico de trastorno depresivo mayor en tratamiento farmacológico y antecedente de adversidades durante su infancia 16. En pacientes con diagnóstico de trastorno depresivo mayor y que no habían recibido ningún tipo de manejo antidepresivo Zhao y colaboradores reportaron incremento del tamaño del tálamo derecho por medio de morfometría basada en voxels, mientras que Kong y colaboradores reportaron incremento del tamaño del tálamo izquierdo 17,18. Existen otros estudios en los que se usó resonancia magnética y se encontró disminución del volumen del tálamo bilateral en pacientes con depresión de inicio tardío, así como disminución del volumen de tálamo derecho en pacientes con trastorno depresivo sin manejo farmacológico al momento del estudio. De forma similar, por medio de morfometría basada en voxels se ha observado disminución del volumen del tálamo de forma bilateral en pacientes con diagnóstico de trastorno depresivo mayor 19-24. Estos hallazgos contrastan con lo reportado por Bora y colaboradores en un metaanálisis en el que evaluaron las anormalidades volumétricas en los circuitos córtico-estriado-pálido-talámicos, y no se evidencian cambios estadísticamente significativos al comparar los volúmenes talámicos en pacientes con diagnóstico de trastorno depresivo y controles 25.
En otras enfermedades psiquiátricas, como el trastorno bipolar o la esquizofrenia, también se ha descrito disminución del tamaño del tálamo por medio de morfometría basada en voxels 26. Haznedar y colaboradores reportaron disminución de tamaño del tálamo izquierdo y aumento del tamaño del tálamo derecho en pacientes con trastorno bipolar tipo II respecto a los controles. Sin embargo, estos cambios no fueron estadísticamente significativos al analizarlos en conjunto con los pacientes con diagnóstico de trastorno bipolar tipo I 27. En otro estudio realizado por Adler y colaboradores, por medio de morfometría basada en voxels en 33 pacientes con diagnóstico de trastorno bipolar, se reportó un incremento del volumen del tálamo izquierdo y del cerebelo derecho e izquierdo 28,29.
Respecto a la conectividad y la activación cerebral, se ha demostrado, por medio de imágenes funcionales como resonancia magnética funcional y tomografía por emisión de positrones, la presencia de un aumento en la actividad de la corteza subgenual del cíngulo, el tálamo y el núcleo caudado en pacientes con diagnóstico de trastorno depresivo mayor en estado de reposo 14. En un metaanálisis en el que se evaluaron los cambios en neuroimágenes funcionales en jóvenes entre 4 y 24 años con diagnóstico de trastorno depresivo mayor, se reportó que hay un incremento significativo en la actividad del tálamo derecho e izquierdo, en la corteza prefrontal dorsolateral izquierda, en el giro parahipocampal izquierdo, en la ínsula anterior derecha, en la corteza subgenual del cíngulo izquierda y en la corteza temporal superior izquierda, así como disminución de la actividad en el caudado derecho 30. En otro estudio en el que se indujo un episodio depresivo a los sujetos del estudio por medio de la depleción de triptófano, también se encontró un incremento en el metabolismo de la glucosa a nivel del tálamo medial, de la corteza orbitofrontal, de la corteza del cíngulo anterior y posterior y del estriado ventral 31.
Se considera que el tálamo medial participa en la percepción de las emociones, hecho que también lo confirman en múltiples estudios con imágenes funcionales en pacientes con diagnóstico de trastorno depresivo mayor, en los que se ha evidenciado hiperactivación del tálamo izquierdo ante la presentación de caras tristes. Adicionalmente, se ha descrito disminución de la activación del núcleo pulvinar del tálamo derecho. Se plantea que la hiperactivación del tálamo medial en pacientes con trastorno depresivo mayor se debe a una disminución de la corteza del cíngulo anterior sobre el sistema límbico, lo cual se refleja en una conec-tividad funcional disminuida entre la corteza del cíngulo anterior, la amígdala y el globo pálido. Estas alteraciones en la conectividad mejoran significativamente con el uso de antidepresivos 32-38.
En pacientes con enfermedad de Parkinson y depresión se reportó un incremento en la conectividad funcional entre la amígdala izquierda y la región mediodorsal del tálamo de forma bilateral, por medio de resonancia magnética funcional en estado de reposo en el momento de ser comparados con sujetos sanos y pacientes con enfermedad de Parkinson pero sin depresión. En estos mismos pacientes también se reportó, por medio de PET y SPECT, incremento de la actividad metabólica neuronal a nivel del tálamo, la amígdala, la corteza del cíngulo anterior, el hipocampo y la ínsula 39.
Entre los hallazgos más consistentes a nivel de neu-roimágenes que se han encontrado en pacientes con diagnóstico de trastorno depresivo, está un incremento en el metabolismo y por lo tanto del funcionamiento neuronal a nivel de la corteza orbitofrontal y el tálamo medial, que tiende a regularse con el tratamiento, lo que ha convertido a estas zonas en áreas de interés en la investigación de nuevas formas de tratamiento 40-42.
En trastorno bipolar, se reporta hiperactivación del núcleo pulvinar del tálamo ante la presencia de imágenes de miedo, en comparación con los controles y los pacientes con diagnóstico de trastorno depresivo mayor 36. De igual forma, en estudios realizados en adolescentes con trastorno bipolar por medio de resonancia magnética funcional, se ha encontrado mayor activación del tálamo izquierdo en comparación con el grupo control 43,44.
Por medio de estudios con tractografía, se encontró que la fracción de anisotropía estaba significativamente disminuida en las proyecciones de la rodilla del cuerpo calloso y en el tálamo anterior derecho hacia el fascículo longitudinal superior en pacientes con diagnóstico de trastorno depresivo mayor durante su primer episodio y que no habían recibido ningún antidepresivo, al ser comparados con controles sanos, lo cual sugiere que son cambios específicos de esta enfermedad 45.
Otro metaanálisis evaluó la fracción de anisotropía en diferentes trastornos del estado del ánimo, incluyendo el trastorno depresivo mayor y se encontró una disminución en la fracción de anisotropía, principalmente a nivel de las radiaciones talámicas anteriores izquierdas y en el fascículo longitudinal superior izquierdo 46.
En cuanto a los cambios en el metabolismo cerebral, reflejados en los cambios del flujo cerebral a nivel del tálamo, los resultados siguen siendo controversiales, pues hay estudios que reportan disminución del flujo sanguíneo cerebral del tálamo izquierdo 47, del tálamo derecho 48, o de forma bilateral 49-51 posteriormente al tratamiento, ya sea con estimulación del nervio vago, o con antidepresivos.
Lisiecka y colaboradores reportaron una correlación positiva entre la disminución de los síntomas depresivos durante el tratamiento con antidepresivos y la conectividad funcional basal medida al inicio del estudio, entre la corteza orbitofrontal izquierda y el tálamo derecho e izquierdo, así como una reducción de la conectividad entre la corteza orbitofrontal, el tálamo derecho y el núcleo caudado durante el seguimiento longitudinal de los pacientes que respondieron al manejo antidepresivo 52.
En pacientes con diagnóstico de trastorno bipolar que cursaban con un episodio depresivo, se ha encontrado que quienes tienen una respuesta clínica (medida por la escala de Hamilton para depresión) luego del manejo con levotiroxina asociado con algún modulador del afecto, presentaron disminución del metabolismo de la glucosa valorada por medio de PET a nivel de ambos tálamos 41, mientras que con la administración de ketamina se ha demostrado una normalización del metabolismo de la glucosa en el tálamo medial derecho en pacientes con respuesta al tratamiento (medida por la escala de depresión Montgomery-Asberg) 53.
CONCLUSIONES
Explicar la presencia de síntomas afectivos como una alteración única en la función de una estructura cerebral es insuficiente y se debe considerar siempre un compromiso de los circuitos cerebrales, haciendo especial énfasis en la corteza prefrontal, el giro del cíngulo, el hipocampo, la amígdala, el estriado y el tálamo, es decir, las conexiones entre el lóbulo frontal y el sistema límbico.
Si bien los estudios que han intentado evaluar y relacionar estas regiones con los procesos emocionales no han sido del todo consistentes, cada vez es más evidente la importancia que estas tienen en el mantenimiento de una homeostasis afectiva, y por lo tanto se debe continuar realizando estudios enfocados en este aspecto, no solo para lograr una mayor comprensión sobre la etiología de la patología afectiva, sino también para conseguir un mayor avance en el desarrollo de nuevas terapias farmacológicas y no farmacológicas.
Hasta el momento los hallazgos más consistentes han sido la evidencia de un incremento del metabolismo y la hiperactivación del tálamo, relacionados especialmente con los síntomas depresivos. En este punto también se resalta que los cambios descritos se han observado con mayor frecuencia a nivel del tálamo izquierdo y del tálamo medial. En tal sentido, se evidencia una mayor utilidad de imágenes funcionales, como la resonancia magnética funcional o el PET, mientras que otras técnicas como la morfometría basada en voxels o el SPECT han proporcionado resultados menos consistentes.