INTRODUCCIÓN
El glioblastoma multiforme es un tumor de alto grado, clasificado como grado IV por la Organización Mundial de la Salud (OMS), debido a su rápido crecimiento. 1 El tratamiento convencional incluye cirugía, radio y quimioterapia. El estudio citogenético y molecular del bloque tumoral debería hacerse en todos los casos, porque ayuda a completar el análisis comprensivo del comportamiento tumoral y el pronóstico asociado 2.
Presentación del caso
Adolescente de 13 años, con un mes de evolución de cefalea y posteriormente inicio de crisis focales motoras izquierdas, con compromiso de conciencia y luego movimientos tónico-clónicos bilaterales. En el examen neurológico inicial se encontró apatía y sutil distonía manual izquierda. La imagen de resonancia magnética (IRM) cerebral simple y contrastada mostró una lesión gigante, heterogénea, que infiltraba la región frontal derecha, con edema perilesional, herniación frontomesial a la izquierda, obliteración del ventrículo lateral y captación leptomeníngea e intraparenquimatosa del gadolinio, compatible con un tumor de alto grado (figura 1). Se llevó a cabo biopsia estereotáxica y estudio anatomopatológico; el espécimen estudiado por patología mostró células astrocíticas pobremente diferenciadas, con marcada atipia nuclear y exagerada actividad mitótica, necrosis y proliferación microvascular prominente, lo que confirma un glioblastoma multiforme.
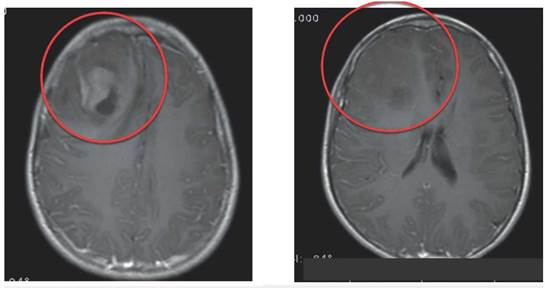
Fuente: Imagen proporcionada por el paciente y su familia.
Figura 1 RMN cerebral inicial. Esta secuencia T1 contrastado muestra una gran lesión heterogénea ocupante de espacio en la región frontal derecha, con herniación frontomesial a la izquierda, edema perilesional, obliteración del ventrículo lateral y captación leptomeníngea e intraparenquimatosa del gadolinio. Resonador Philips 3, Tesla Ingenia™
El paciente fue programado para cirugía resectiva y se extirpó más del 90 % del tamaño tumoral. Sin embargo, al mes de la neurocirugía fue necesario una segunda resección quirúrgica porque el residuo tumoral experimentó un recrecimiento acelerado. El paciente recibió quimioterapia con temozolomida y radioterapia selectiva (braquiterapia). La figura 2 muestra la imagen posterior de control radiológico. Aproximadamente dos años después de la cirugía inicial se realizó IRM cerebral con espectroscopia, la cual mostró lecho quirúrgico con residuo tumoral, elevación del pico de colina, con alteración del ángulo de Hunter: colina y creatina >N-Acetil Aspartate (figuras 3 y 4).
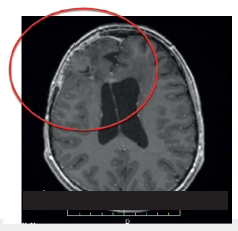
Fuente: Imagen proporcionada por el paciente y su familia.
Figura 2 RMN cerebral secuencia T1 con gadolinio 1 año postcraneotomía y resección. Resonador Philips 3, Tesla Ingenia™
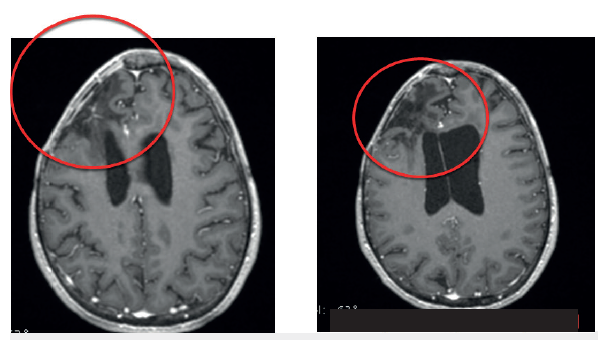
Fuente: Imagen proporcionada por el paciente y su familia.
Figura 3 RMN cerebral secuencia T1 con gadolinio 2 años postcraneotomía y resección: se observa residuo tumoral, que tenía aumento de la captación y perfusión (no mostrado en esta imagen). Resonador Philips 3, Tesla Ingenia™
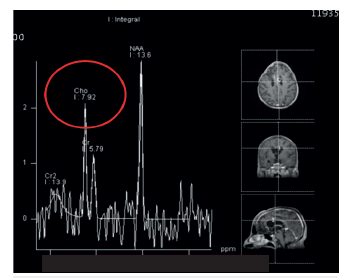
Fuente: Imagen proporcionada por el paciente y su familia.
Figura 4 RMN espectroscopia dos años postcraneotomía. Se observa elevación del pico de colina y alteración del ángulo de hunter en residuo tumoral. Resonador Philips 3, Tesla Ingenia™
Las crisis epilépticas continuaron, muy frecuentes e intratables a pesar del tratamiento con múltiples anticonvulsivos. El paciente ingresó al servicio de urgencias en repetidas ocasiones por recurrencia de las crisis epilépticas y estado epiléptico. En tales ocasiones recibió carbamazepina, clobazam, topiramato, fenitoina, lacosamida, levetiracetam y clonazepam en forma seriada, hasta lograr dosis máximas, monitorizando los niveles séricos o hasta presentarse efectos adversos. El electroencefalograma (EEG) mostró disfimción cerebral difusa entremezclada con actividad epileptiforme frontal derecha, en tanto que la evaluación neuropsicológica reveló un coeficiente intelectual (CI) total de 78, con alteraciones en la atención global y disfunción ejecutiva.
Se inició terapia con dieta cetogénica tecnificada, con fórmula nutricional a base de grasas y trigliceridos de cadena media (TCM) con relación 4:1. El protocolo para implementar la dieta cetogénica incluyó la medición de cetosis en orina diariamente, con resultado entre + y ++, asistencia a consulta nutricional mensual y cumplimiento del plan de alimentación programado (al menos el 90 % de las citas cumplidas con nutrición).
Se obtuvo control progresivo de las convulsiones y se evitaron los ingresos por urgencias y el estado epiléptico, gracias a lo cual se logró desmontar la mayoría de los anticonvulsivos en el transcurso de dos años. La reducción del número de convulsiones fue mayor al 80 % a los seis meses de iniciada la dieta cetogénica; se continuó terapia adicional con clobazam y levetiracetam; no se observó progresión del tamaño tumoral ni recaída. El EEG y la evaluación neuropsicológica no tuvieron variación luego del tratamiento con dieta cetogénica.
A partir del bloque del espécimen tumoral se hizo el estudio molecular ampliado, cuyo resultado se describe en la tabla 1, junto con las implicaciones diagnósticas 3-6.
Tabla 1 Alteraciones genéticas en el espécimen de glioblastoma multiforme del paciente descrito.
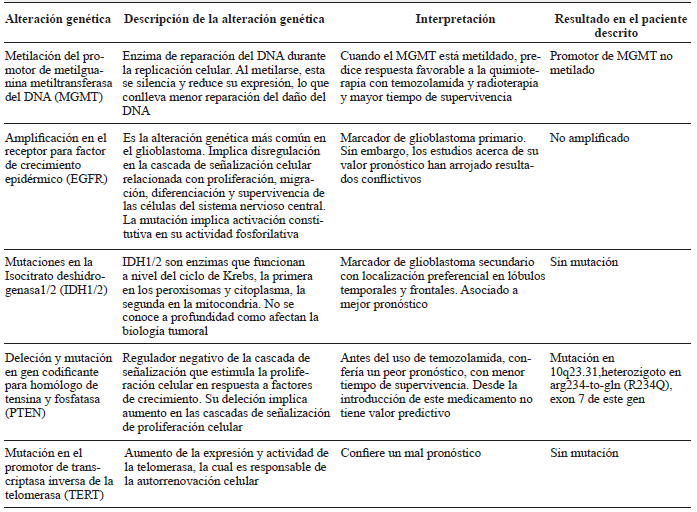
Fuente 12.
En el paciente descrito no se encontraron mutaciones en la isocitrato deshidrogenasa 1 y 2 (IDH1/2) y el promotor de metilguanina metiltransferasa del DNA (MGMT) no estaba metilado, lo que corroboraba un tumor primario y confería un alto riesgo por pobre respuesta a la quimioterapia con temozolamida, respectivamente.
DISCUSIÓN
El glioblastoma es el tumor más agresivo del sistema nervioso central y presenta una sobrevida a los 18 meses inferior al 30 % 7. Tiene alta probabilidad de infiltración, crecimiento acelerado, baja respuesta a la cirugía, quimioterapia y radiación. Se clasifica como un astrocitoma de grado IV/IV, cuyo crecimiento es infiltrativo y difuso, se desarrolla sobre todo en lóbulos frontales y casi siempre es unilateral. La piedra angular del tratamiento es la cirugía resectiva. No obstante, cuando se reseca quirúrgicamente suele haber reaparición del tumor 8.
Los pacientes consultan las más de las veces por pérdida de la memoria, déficit neurológico focal, cefalea, convulsiones y náuseas. La biopsia se realiza para confirmar el diagnóstico anatomopatológico y usualmente se procede con la cirugía resectiva, radioterapia y quimioterapia con temozolomida y bevacizumab 9.
Se ha sugerido que la dieta cetogénica podría interrumpir varios procesos del metabolismo tumoral, además de facilitar el control de las convulsiones en epilepsia refractaria por el efecto Warburg. Las células sanas en presencia de buena oxigenación basan su metabolismo en la fosforilación oxidativa mitocondrial para generar adenosin trifosfato ATP, pero en hipoxia las células obtienen la energía mediante uso de glucólisis por descomposición no oxidativa.
Las células cancerosas a menudo tienen niveles aumentados de especies reactivas de oxígeno (ROS, por sus siglas en inglés), compuestos implicados en la inducción de la angiogénesis y el crecimiento tumoral 10. Se ha señalado que la dieta cetogénica reduce la producción de ROS en el cerebro e induce la activación de genes neuroprotectores, así como la apoptosis de células cancerosas11,12. Esta dieta fue una opción de tratamiento para el paciente cuyo caso se refiere, en el que se puso en evidencia la reducción en el número, la frecuencia y la intensidad de las crisis epilépticas.
Se ha descrito una serie de marcadores genéticos en las células cancerígenas que predicen el origen primario o secundario del tumor, la respuesta al tratamiento y el pronóstico a largo plazo. La alteración genética más común descrita en el glioblastoma multiforme es la amplificación en el receptor para factor de crecimiento epidérmico (EGFR), una proteína transmembrana que regula la proliferación, la diferenciación y la supervivencia celular. Esta proteína al estar alterada, presenta una activación constitutiva de su actividad fosforilativa 13. Los estudios acerca de su valor pronóstico son contradictorios porque en algunos individuos se ve un peor desenlace, mientras que en otros se asocia con un mejor pronóstico.
Las enzimas isocitrato deshidrogenasa 1 y 2 (IDH 1/2) son enzimas del ciclo de Krebs, la primera ubicada en los peroxisomas y en el citoplasma y la segunda en la mitocondria. En general, su presencia indica un mejor pronóstico y mayor sobrevida 14. Algunos estudios sugieren que las mutaciones de isocitrato deshidrogensa 1 (IDH1) son de buen pronóstico en pacientes con gliomas secundarios 15.
La metilguanina metiltransferasa del DNA es una enzima reparadora del DNA durante la replicación celular (MGMT). MGMT se silencia cuando se metila y se inactiva la reparación del material nuclear. A pesar de esto, la metilación del MGMT es un factor predictor de respuesta a la temozolamida y la radioterapia 16.
Por otro lado, se han descrito la deleción y la mutación en el gen codificante para el homólogo de tensina y fosfatasa (PTEN), relacionado con un peor pronóstico antes del uso de la temozolamida, pero en este momento, con el advenimiento de este quimioterapéutico, no se predice respuesta o supervivencia 17.
La mutación en el promotor de la transcriptasa inversa de la telomerasa (TERT) está implicada en la actividad de la telomerasa, la cual aumenta la autorrenovación celular y es de mal pronóstico 18.
En el paciente cuyo caso se reporta se encontraron marcadores genéticos de mal pronóstico, entre ellos ausencia de metilación del MGMT, ausencia de mutación IDH1/2 y ausencia de mutación del TERT. La mutación del PTEN no tiene implicaciones pronósticas porque el paciente accedió a la terapia con temozolamida. El paciente lleva más de ocho años de sobrevida a la fecha de publicación de este artículo, a pesar de haberse encontrado marcadores moleculares de mal pronóstico.
La tomografía por emisión de positrones (PET, por sus siglas en inglés) cerebral podría ayudar a distinguir la naturaleza necrótica o neoplásica de la lesión remanente luego del tratamiento del glioblastoma multiforme y, asimismo, a señalar si predominan los hallazgos compatibles con radionecrosis o recaída tumoral. A este paciente no se le realizó PET cerebral porque las características clínicas, radiológicas, microscópicas y genéticas confirmaban un tumor de mayor grado 9.
La terapia con dieta cetogénica podría ser un tratamiento controlador del crecimiento tumoral en los pacientes con glioblastoma multiforme llevados a cirugía resectiva, quimio y radioterapia. En el paciente cuyo caso se reporta, no se consideró adicionar bevacizumab por el control alcanzado en este momento de la enfermedad y porque la relación riesgo-beneficio era desfavorable.














