INTRODUCCIÓN
En esta revisión se describe la historia del VZ desde su aparición en la selva Zika, su paso por la Polinesia francesa, las islas del Pacífico y, finalmente, su llegada a las Américas, describiendo los avances en el proceso de aislamiento, identificación y tipificación filogenética del virus. Adicionalmente, se hace un recuento de los diferentes modelos que han dilucidado la fisiopatología de esta enfermedad. Con este recuento desde las ciencias básicas se explica cuáles son las diferentes manifestaciones neurológicas de la enfermedad por el VZ reportadas en estudios observacionales en población pediátrica y adulta, con gran profundidad en las manifestaciones y lo desordenes clínicos causados por este virus.
GENERALIDADES
El virus del Zika (VZ) es miembro del serocomplejo de la familia de los flavivirus. Es un virus artrópodo con relevancia en salud pública que causa enfermedades como el dengue, la fiebre amarilla y la fiebre del virus del Nilo Occidental 1; es transmitido, principalmente, por el vector del género Aedes 2. En 1947 fue aislado por primera vez en un macaque rhesus de la selva Zika, en el noreste de Uganda y fue clasificado a partir de la secuencia de análisis de dos genotipos de África y Asia 1. La vigilancia entomológica y virológica ha reportado la presencia de VZ en estado enzoótico en varios países de estos dos continentes 1 y su circulación periódica es reportada por la Organización Mundial de la Salud (OMS) desde 1968 1. La evidencia serológica y entomológica indica que la primera infección en humanos se produjo en la población africana de Uganda 3; con posterioridad, en Nigeria (1971) y en Sierra Leona 4,5. Subsecuentemente, se presentaron otras infecciones en el resto del continente, con diseminación al continente asiático en el que Malasia fue el primer país en reportar la infección por VZ (1977), seguido por Indonesia (1978) 6,7.
Antes de abril del 2007, cuando hubo una epidemia de VZ en la isla de Yap, en Micronesia, solo se habían reportado 14 casos en humanos habían sido reportados. La pandemia conllevó 49 casos confirmados y que el 73 % de los residentes mayores de tres años tuvieran evidencia serológica 8. Se presentó primero en África, Asia y las islas del Pacífico, y luego en las Américas y el Pacífico, sin que se documentaran anormalidades congénitas 9. Diferentes estudios sugieren que hubo múltiples eventos de recombinación que representaron la pérdida y la ganancia de sitios terminales de glicolización en la proteína E, que podría incrementar la inefectividad del mosquito y el tropismo por las células neuronales 1. Adicionalmente, se identificaron grupos de distintos VZ que mostraron un ancestro común de Uganda, seguido de dos eventos en el oriente y en el oeste africanos 1. Ya entre el 2013 y el 2014, el genotipo del VZ asiático se expandió en las islas del Pacífico y causó la epidemia que se conoce como "fiebre del VZ de la Polinesia francesa", la epidemia más larga causada por un arbovirus diferente del dengue que se haya reportado hasta el momento. El VZ también se expandió a otras islas del Pacífico, hacia la isla de Nueva Caledonia, las islas Cook, Tahití y las islas de Pascua 10. Finalmente, el primer caso del virus en las Américas fue reportado en Chile, en la punta este del triángulo de la Polinesia, entre enero y mayo del 2014 10, al documentarse que las cepas del VZ identificadas en la isla de Pascua se relacionaban estrechamente con las encontradas en la Polinesia francesa, lo que sugiere que el patrón de trasmisión y la introducción del VZ en las Américas provino de esta última 10.
En diciembre del 2014 se reportó en Brasil la primera enfermedad exantemática de origen desconocido, la cual fue identificada como infección por VZ 11. En mayo del 2015 se expandió a través del país y estuvo potencialmente asociada con casos de microcefalia en noviembre del 2015. El análisis del reloj filogenético y molecular reveló una única introducción del VZ en las Américas, entre mayo y diciembre del 2013, que concuerda con la fecha en que el vector se introdujo en la isla de Pascua, y se estima que pudo haber un portador del genotipo del VZ asiático, lo cual causó doce meses después la epidemia en Brasil 10,12. Subsecuentemente, el VZ se disemino con rapidez por Suramérica y los países del Caribe, y en enero del 2016 ya se habían reportado 30.000 casos de infección por VZ, aproximadamente seis meses después del pico máximo de epidemia en Brasil, al reportarse que el 93 % de los casos en el noreste del país se debían a la transmisión local 12. Después de la epidemia de las Américas, la OMS declaró la emergencia de salud pública internacional en febrero del 2016 13.
NEUROPATOGÉNESIS EN EL SÍNDROME CONGÉNITO POR ZIKA
A raíz de la asociación entre microcefalia y enfermedades congénitas durante el embarazo, se declaró emergencia pública, tras confirmarse la presencia del virus en el tejido cerebral fetal 14-16, el fluido amniótico 17 y la placenta, lo que ratificaba la transmisión vertical 18. Estudios in vitro e in vivo han demostrado el alto tropismo del virus por las células neuronales 19, dado que tiene como blanco las células neuroprogenitoras derivadas de las células madre pluripotenciales. Cuando los neuroprogenitores son infectados por el VZ, la actividad apoptótica aumenta, lo que genera una desregulación en la progresión del ciclo celular, y ello a su vez conlleva que disminuya la proliferación de los neuroprogenitores, quizá debido a una alteración transcripcional de las vías metabólicas relacionadas con el ciclo celular 20. Modelos animales han mostrado que el VZ tiene efectos marcados en el desarrollo cerebral que son el origen de una disminución apreciable de los neuroproge-nitores primarios encargados del desarrollo de la corteza cerebral, lo que genera una disminución marcada de las células fetales asociada con múltiples mutaciones en genes directamente relacionados con la progresión del ciclo celular y la disminución significativa en la expresión de los genes de microcefalina CDK5RAP2, CASC5, ASPM, CENPJ, STIL, CEP135 y STIL 21. Así pues, el primer reporte de la mutación del gen CDK5RAP2 fue detectada y reportada en un caso de infección congénita por el VZ 22 relacionado con microcefalia primaria dialélica o disminución de la expresión del gen, el cual codifica para una proteína que mide la nucleación de los microtúbulos y la cohesión de los centriolos 23.
MICROCEFALIA
Antes del 2015, la prevalencia anual de casos de microcefalia reportada en Brasil era inferior a 200 casos 24. Entre noviembre del 2015 y el 30 de enero del 2016 se registraron 4783 casos sospechosos de microcefalia, incluyendo muertes fetales. En estudios posteriores, se confirmaron 404 casos (36,6 %) de microcefalia, de 1103 casos que fueron evaluados clínicamente, y mediante pruebas de laboratorio tan solo 15 recién nacidos presentaron infección por VZ. La mayoría de los casos probables que fueron investigados presentaron una proporción significativa de diagnóstico erróneo; probablemente se sobreestimó la prevalencia 25.
En Colombia, por su parte, la epidemia por VZ comenzó en agosto del 2015, sin embargo, la evidencia de la infección confirmada en laboratorio no fue reportada sino hasta octubre de ese mismo año. Para abril del 2016 ya se habían reportado 65 726 casos sospechosos, de los cuales solo 2482 (4 %) fueron confirmados con reacción en cadena con transcriptrasa (PCR-RT, por sus siglas en inglés). Adicionalmente, se notificaron 11 944 embarazos con sospecha de infección por VZ, de los cuales fueron confirmados 1484 (12 %). De esta población, 50 recién nacidos fueron registrados con posible síndrome congénito, pero solo se confirmaron 4 (8 %) casos 26. En Colombia, la prevalencia estimada antes de la introducción del virus en el país fue de 0,3 a 3,1 por 10 000 nacimientos, con un promedio de 1,8 (IC 95 %: 1,7-1,8) por 10 000 nacimientos 27; no obstante, la estimación después de la epidemia no se ha descrito hasta el momento (figura 1).
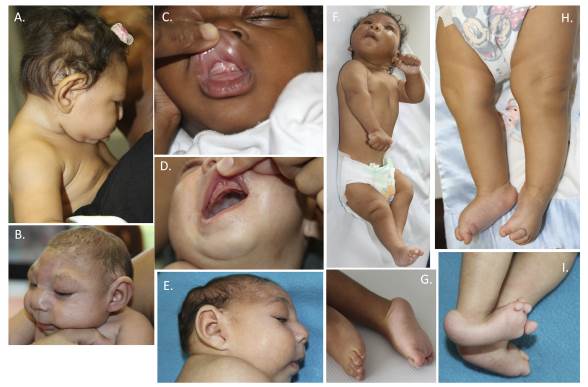
Figura 1 Espectro fenotípico del síndrome congénito por Infección del virus zika A. Desproporción craneofacial, retrognatía, apariencia de cuello corto. B. Implantación alta del cabello, pestañas y cejas prominentes, microcefalia, apariencia de proptosis, frente estrecha con depresiones bilaterales. C y D. Hiperplasia gingival con frenillo lingual superior. E. Desproporción craneofacial, disminución del tamaño vertical del cráneo, cabalgamiento de las suturas con prominencia de la región supraorbitaria, retrognatia, exceso de los pliegues nucales, cuello corto. F y H. Hiperextensión del tronco, espasticidad, tremor distal, puños cerrados, hipertonía, disminución de la extensión de los codos, hoyuelos en los codos, luxación congénita de la rodilla irreductible, artrogriposis. G. Clinodactilia, hipoplasia del quinto metatarsiano, hipoplasia ungueal del quinto artejo. I. Talo valgo bilateral, pie en mecedora bilateral, clinodactilia primero y segundo artejo del pie, 5.o y 4.o desviación radial, segundo y tercer artejo con desviación ulnar, prominencia de los calcáneos.
ALTERACIONES VISUALES, HIPOACUSIA Y OTROS TRASTORNOS NEUROLÓGICOS EN POBLACIÓN PEDIÁTRICA
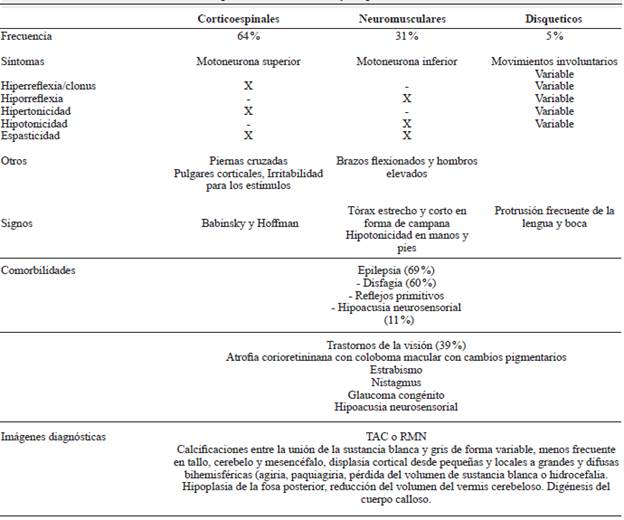
Las alteraciones del neurodesarrollo suelen ser frecuentes en pacientes con zika congénito. Las manifestaciones motoras se pueden dividir en alteraciones corticoespinales (64 %), síntomas neuromusculares (31 %) y síntomas disquinéticos (5 %) (tabla 1) 28. También se ha encontrado asociación con epilepsia (69 %), disfagia (60 %), persistencia de los reflejos primitivos, trastornos de la visión (39 %) 29 manifestados como atrofia corioretininana con coloboma macular, con cambios pigmentarios, estrabismo, nistagmus, glaucoma congénito 30 y alteraciones auditivas (11 %) 29, principalmente secundario a hipoacusia neurosensorial 31. En concordancia con la sintomatología observada, los hallazgos imagenológicos muestran atrofia o displasia cortical, ventriculomegalia y calcificaciones entre la sustancia gris y la blanca, con compromiso de los núcleos de la base, hipoplasia de tallo y del cerebelo con compromiso del vermix, pérdida del volumen de la sustancia blanca, disgenesia de cuerpo calloso e hidrocefalia 22,28,32, malformación de Dandy Walker, así como adelgazamiento de la porción torácica y de la médula espinal hacia el aspecto ventral 29 (figura 1).
NEUROPATOGÉNESIS DEL VIRUS ZIKA EN ADULTOS
En pacientes con infección aguda, el espectro de neurozika comprende manifestaciones clínicas neurológicas heterogéneas que afectan al sistema nervioso central o al periférico, además de los pares craneales. Los mecanismos neuropatogénicos del VZ no son del todo conocidos, aunque se ha demostrado que puede causar daño mediante dos mecanismos: infección viral directa y daño mediado por el sistema inmune. En la patología viral, el virus se replica en la célula y genera la destrucción de la membrana plasmática y la liberación de los viriones, lo que genera la muerte de las células infectadas. En el daño mediado por la inmunidad existe una activación incontrolable del sistema inmune humoral de sus células y moléculas efectoras (citoquinas proinflamatorias), lo cual origina un mayor daño tisular. En el mecanismo de daño neurológico del paciente adulto se ha identificado que el virus tiene la capacidad de invadir las células neuronales y afectar las células del sistema nervioso, incluidas las células madre neurales, los astrocitos, las células precursoras de oligodendrocitos y la microglía 33. La expresión de las proteínas virales del VZ tiene diferentes efectos citopáticos, como alteraciones del ciclo celular, inhibición de la proliferación celular, apoptosis de células del sistema nervioso 34) e inhibición de los receptores tipo RIG-I, sensores de ARN viral necesarios para iniciar una respuesta inmune innata mediante la producción de IFN tipo I 35.
DIAGNÓSTICO Y TRATAMIENTO
La enfermedad por VZ tiene un espectro de síntomas heterogéneos, desde una infección completamente asintomática en el 80 % de los casos, cuadro febril exantemático, cefalea o manifestaciones gastrointestinales, hasta síntomas neurológicos severos. La infección por VZ se confirma usando RT-PCR y se realiza manejo de soporte, ya que no existe tratamientos antivirales específicos para este.
VIRUS ZIKA Y SÍNDROME DE GUILLAIN-BARRÉ
El síndrome de Guillain-Barré (SGB) es un trastorno neurológico en el que la activación anormal del sistema inmune resulta en el daño del sistema nervioso periférico 34, una parálisis neuromuscular rápidamente ascendente, alteraciones sensitivas y neuropatía craneal. Suele ser precedido por una infección respiratoria o gastrointestinal en la que se considera que existe una pérdida de tolerancia inmunológica a los autoantígenos 36, lo cual genera que anticuerpos que se unen a epítopos en la superficie externa de la mielina, activen el sistema de complemento y macró-fagos y, posteriormente, la destrucción de la mielina y una insuficiencia de la conducción nerviosa 37. En la patogénesis del SGB asociado con el VZ se consideran múltiples mecanismos como el mimetismo molecular, la inmunidad humoral y celular y el neurotropismo viral para las células neuronales y gliales 38. En el mimetismo molecular, las poliproteínas de VZ comparten péptidos con proteínas humanas, por lo que títulos altos de anticuerpos contra el VZ provocan una reactividad cruzada entre el componente viral y los gangliósidos de la membrana neuronal 39. Se ha sugerido que el rápido inicio del SGB después de la infección por VZ es una característica distintiva útil que refleja mecanismos parainfecciosos en la patogenia 34,40.
La incidencia estimada del SGB asociado con infección por VZ es de 2-3 casos por cada 10 000 infecciones, similar a la de SGB por infección por Campylobacter 41. Las manifestaciones aparecen 5-10 días después de la infección inicial por VZ; se ha descrito la polineuropatía desmielinizante inflamatoria aguda, la neuropatía axónica motora aguda y el síndrome de Mrller-Fisher como subtipos del SGB asociado CON VZ 42. El pronóstico es similar al SGB asociado con otros procesos infecciosos o no infecciosos. No obstante, se han hecho hallazgos que sugieren que este síndrome asociado con VZ puede generar mayor morbilidad y neuropatía craneal con mayor frecuencia 43. En Colombia se han descrito las características clínicas de los casos de SGB en el contexto de infección por VZ en 68 pacientes, en seis hospitales colombianos 44; 97 % de los pacientes presentaron síntomas compatibles con la infección antes del inicio del SGB con un rango entre síntomas de siete días en promedio. La mitad de los pacientes presentó parálisis facial bilateral y el 67 % contaba con estudios de conducción nerviosa y electromiografía, los cuales en su mayoría eran compatibles con el subtipo de polineuropatía desmielinizante inflamatoria aguda del SGB. De esta manera se logró respaldar el rol de la infección por VZ en la presentación del SGB en Colombia 44. Por otro lado, se ha descrito que los pacientes con SGB e infección concomitante (zika y chikunguña) presentaban una enfermedad más agresiva y estancias hospitalarias prolongadas, y que si bien la infección por VZ puede causar manifestaciones del sistema nervioso central y periférico, el SGB predomina en los pacientes con infección por VZ 45.
ENCEFALITIS Y ENCEFALOPATÍA POR VIRUS ZIKA
La mayor complicación neurológica relacionada con VZ es el síndrome congénito caracterizado por microcefalia, probablemente secundario a un efecto tóxico directo del virus en la neurogénesis 46. Se han documentado diferentes enfermedades neurológicas secundarias a otros arbovirus tales como chikunguña, dengue y VZ. Al evaluar 201 pacientes con probable infección arbovirus, de los cuales 148 fueron confirmados, el 28 % presentó infección por VZ, asociado en un 76 % con debilidad, 61 % con cefalea y 61 % con cuadriparesia 45.
VIRUS ZIKA Y MIELITIS
Es importante resaltar la importancia de casos de mielitis y encefalitis en pacientes con infección por VZ, debido a que la mayoría de casos reportados ocurre en la adultez media, en individuos en quienes posteriormente a un cuadro viral característico, surgen los síntomas asociados con mielitis 46,47; 2 % de los pacientes con monoinfección por VZ presentaron una mediana de 12 días antes del inicio de los síntomas neurológicos. Los principales hallazgos neurológicos descritos fueron paraparesia, cuadriparesia, compromiso sensorial y esfinteriano; sin embargo, estos fueron descritos en conjunto con pacientes con chikunguña y dengue. En otro estudio, los síndromes neurológicos asociados con enfermedad por VZ representaron el 1,1 % 38; se registraron seis casos de mielitis transversa, con una mediana de edad de 22,5 años, siendo más frecuente en hombres, con un intervalo entre la infección por VZ y el inicio de los síntomas neurológicos de 32 días. Todos los pacientes presentaron hiperreflexia y un nivel sensitivo torácico definido asociado con síntomas autonómicos como alteraciones del ritmo cardiaco y labilidad de la presión arterial.
Para el diagnóstico se dispone de la medición de anticuerpos y RT-PCR sérica de VZ 48,49, y se ha reportado RT-PCR de VZ en LCR 48. Con relación al manejo recibido, el uso de esteroide con metilprednisolona 1 g/día endovenoso por cinco días reportó un egreso sin déficit motor, pero con necesidad de manejo farmacológico por calambres y espasmos musculares 46, y en otros reportes se ha descrito el uso de plasmaféresis ante la no mejoría, con una recuperación de la fuerza de 4/5 a la salida del paciente.
OTRAS COMPLICACIONES NEUROLÓGICAS RELACIONADAS CON EL VIRUS ZIKA
El 7 % de los pacientes con monoinfección por VZ presentó encefalitis 45. En estos casos la sintomatología por VZ se caracterizó por fiebre y rash, con posterior aparición de síntomas neurológicos después de una mediana aproximada de 5 días. Las manifestaciones clínicas más frecuentes descritas fueron las alteraciones del comportamiento, la disminución del nivel de conciencia, convulsiones y meningismo. En Río de Janeiro se reportó el primer caso de encefalitis fatal por infección por VZ, en una paciente de 47 años en quien la infección tuvo un curso clínico leve 49. El estudio colombiano de Anaya y colaboradores reportó tres casos de encefalitis en pacientes que tenían una edad media de 33 años, historia de infección por otro arbovirus, alteración del nivel de conciencia y fiebre. En cuanto a las pruebas diagnósticas, en la literatura se reporta pleocitosis en LCR, hiperproteinorraquia y RT-PCR positiva. En las neuroimágenes se ha evidenciado que hay casos sin alteraciones, y también pueden documentarse lesiones corticales que incluyen hiperintensidades de la sustancia blanca subcortical en la secuencia FLAIR e hiperintensidades puntiformes múltiples en DWI 38,45,50. Un número de pacientes fue tratado con aciclovir por sospecha de encefalitis por herpesvirus, con un tiempo de hospitalización de 17 días, y más de la mitad presentó déficit motor o cognitivo al alta. Otras manifestaciones neurológicas raras reportadas incluyen encefalomielitis aguda diseminada (ADEM), parálisis facial periférica y mielorradiculopatía 43.
CONCLUSIÓN
El virus zika se encuentra dentro de las enfermedades arbovirales de vigilancia epidemiológica con posibilidad de generar complicaciones neurológicas con secuelas en la población pediátrica y compromiso neurológico moderado a severo en adultos. Se cree que el neurotropismo viral es responsable de las manifestaciones neurológicas en la población infantil, al influir en la replicación celular del sistema nervioso central e impactar la expresión de genes relacionados con la evolución natural del ciclo celular, haciendo manifiestas las características fenotípicas y las manifestaciones clínicas a lo largo del proceso de neurodesarrollo. En la población adulta se ha relacionado el compromiso de los precursores celulares, así como las alteraciones propiamente citopáticas sobre la progresión del ciclo celular. Por consiguiente, sigue siendo importante su sospecha clínica y el estrecho seguimiento debido a su posible fuente de discapacidad cognitiva y física de origen viral.