INTRODUCCIÓN
La meningitis bacteriana (MB) es una inflamación de origen infeccioso de las leptomeninges y del espacio subaracnoideo causada por bacterias 1,2. Es una condición con alto riesgo de morbimortalidad y considerada una emergencia médica que requiere un diagnóstico y un tratamiento inmediatos 3. En países desarrollados su incidencia se encuentra entre 0,7 y 0,9 casos por 100 000 personas año. En el mundo, los agentes etiológicos más frecuentes de la meningitis bacteriana adquirida en la comunidad del adulto son el Streptococcus pneumoniae y la Neisseria meningitidis4. La Listeria monocytogenes es la segunda causa de MB en pacientes con defectos de inmunidad celular (SIDA, cáncer, trasplantados, quimioterapia) alcohólicos, diabéticos o mayores de 50 años 5. Los pacientes con neutropenia son susceptibles de MB por bacterias entéricas Gram negativas 5.
En Colombia la incidencia es menor a 1 por cada 100 000 habitantes, y en el primer trimestre del año 2020 se observó una disminución de 22,7 % en comparación con el mismo periodo del año 2019. Según reportes oficiales, los agentes etiológicos más frecuentes en nuestra población son, en su orden, Streptococcus pneumoniae, Neisseria meningitidis y Haemophilus influenzae6. La introducción de los antibióticos, el inicio temprano de la terapia empírica, la implementación de la vacunación contra el Streptococcus pneumoniae y el Haemophilus influenzae, la terapia antirretroviral, el desarrollo de nuevas terapias antineoplásicas e inmunomoduladoras y la facilidad de viajar al extranjero son algunos de los factores que han modificado la epidemiología de la enfermedad 7. La virulencia del germen, la ruta de adquisición de la bacteria y los factores de riesgo en el huésped son aspectos que predisponen al desarrollo de esta patología 8 y que en parte determinan la mortalidad y la discapacidad permanente en los que sobreviven 9.
FISIOPATOLOGÍA
La patogénesis y fisiopatología de la MB involucra una interacción compleja entre los factores virulentos de la bacteria y la respuesta inmune del huésped, cuando lo primero supera lo segundo se produce la infección 10. Aunque varios aspectos sobre la patogénesis de la MB aún no son bien comprendidos, las rutas de entrada de las bacterias al sistema nervioso central (SNC) son por vía hematógena, por contigüidad (focos infecciosos parameníngeos) o por soluciones de continuidad (cirugías, fístulas del líquido cefalorraquídeo (LCR). La vía hematógena es la más frecuente e involucra a los patógenos comunes (S. pneumoniae, N. meningitidis, H influenzae, S. del Grupo B y E. coli), y se reconocen cuatro procesos importantes 8:
Colonización: involucra la adherencia bacteriana al epitelio (respiratorio, gastrointestinal o urinario bajo) gracias a sus fimbrias y receptores celulares específicos. La evasión de los mecanismos de defensa del huésped, mediada por proteasas contra la inmunoglobulina A, es importante en esta etapa 11.
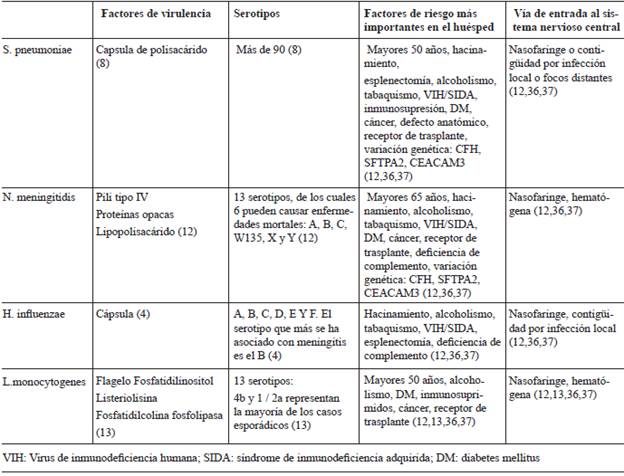
Invasión del torrente sanguíneo: ocurre trans o paracelularmente. El mecanismo exacto de por qué ocurre en algunos individuos se desconoce, pero al parecer depende de la interacción entre factores ambientales, factores del huésped y genéticos del patógeno (tabla 1) 1,8,12. La supervivencia y replicación bacteriana en el torrente sanguíneo es la capacidad bacteriana de eludir al sistema inmune, inhibiendo la fagocitosis o la opsonización dependiente principalmente del complemento, por medio de su cápsula de polisacáridos y diferentes moléculas de superficie. Los factores de virulencia y patogenicidad dependen del germen causal (tabla 1) 1,12,13.
Ingreso al SNC: la severidad y duración de la bacteremia facilita la penetración al espacio subaracnoideo. La entrada de las bacterias es mediada por la interacción de adhesinas bacterianas con el endotelio vascular 1. Las vénulas postcapilares y los plejos coroideos podrían ser el sitio primario de entrada 8. En las leptomeninges y el espacio subaracnoideo las bacterias se replican con facilidad por la escasez de defensas inmunológicas humorales. Posteriormente, el reconocimiento de componentes de la pared bacteriana por la glía desencadena una respuesta inflamatoria mediada principalmente por el TNFα e interleuquinas 6 y 1 β. A pesar de la entrada de leucocitos al espacio subaracnoideo, la respuesta inmunológica es subóptima, por la falta de actividad funcional de opsonización y bactericida 1,14.
Tabla 1 Factores de riesgo para meningitis y vía de entrada al sistema nervioso por agente etiológico.
Fuente:Autores
En las leptomeninges y en el espacio subaracnoideo la interacción entre los componentes de la bacteria y el sistema inmune determina la presentación de la enfermedad y la mayor parte del daño producido. Los polisacáridos de la cápsula y las moléculas de la membrana bacteriana evocan una respuesta humoral y celular inmunológica que lleva a un proceso inflamatorio con disrupción de la barrera hematoencefálica, edema, vasculitis, hipertensión endocraneana y disregulación vascular. Para disminuir la respuesta inflamatoria se utilizan esteroides, antibióticos no bactericidas, inhibidores del complemento y de otras moléculas proinflamatorias; algunos tratamientos son usados o se encuentran en fase de experimentación para reducir la morbimortalidad de la MB 10.
CLÍNICA
Los síntomas iniciales de MB suelen aparecer tempranamente, pero son inespecíficos e incluyen malestar general, náuseas, vómito o mialgias 9. Las manifestaciones clínicas más específicas incluyen cefalea (83 % de los casos), rigidez nucal (74 %), fiebre (74 %) y un puntaje menor o igual a 14 en la escala de coma de Glasgow (71 %) 9,15,16. La rigidez nucal, la fiebre y la alteración de la conciencia conforman la triada clásica descrita en la MB, la cual se reporta solamente en el 42-50 °/o de los pacientes 1,8,15,17,18. También, aunque con menor frecuencia, se observan crisis epilépticas (23 %), signos de focalización (22 %), coma (13 %), neuropatía craneal (9 %), rash cutáneo (8 %) y papiledema (4 %) 2,15,16,19. La presencia de artritis, petequias o púrpura es más frecuente en casos de infección por N. meningitidis, en tanto que la presencia de infartos cerebrales lo es en la infección por S.pneumoniae, y las crisis epilépticas o signos focales tempranos se presentan con mayor frecuencia en la infección por L. monocitogenes. Otras infecciones concomitantes incluyen sinusitis/otitis (34 %), neumonía (9 %) y endocarditis (1 %) 7.
Al examen físico, la irritación meníngea se manifiesta con los signos de rigidez nucal, Kernig y Brudzinski 17. Su especificidad es de alrededor del 95 %, pero su sensibilidad es baja, entre 5-30 % 8,15-17. Por eso, su ausencia no debería ser razón para descartar el diagnóstico de MB 15,16. En los últimos años se describió el signo de la sacudida cefálica (Jolt accentuation), que es el empeoramiento de la cefalea con la rotación rápida de la cabeza en el plano horizontal 20. Este signo ha mostrado mayor sensibilidad (82-97 %), pero una menor especificidad (60-82 %) en el diagnóstico de irritación meníngea 16.
DIAGNÓSTICO
El diagnóstico de MB se basa en el reconocimiento del síndrome clínico, la demostración de la inflamación leptomeníngea y el aislamiento del germen en el LCR. El paciente se presenta con un síndrome de respuesta inflamatorio sistémico y un síndrome neurológico; es importante obtener hemograma, marcadores de respuesta inflamatoria sistémica, pruebas de coagulación, química sanguínea y hemocultivos 18. Todo paciente con sospecha de MB debe tener estudio del LCR, a menos que tenga una contraindicación absoluta para su obtención.
LÍQUIDO CEFALORRAQUÍDEO
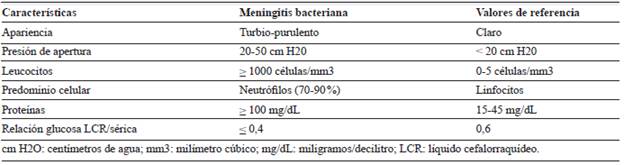
Los hallazgos clásicos en el LCR que se describen en meningitis bacteriana incluyen: pleocitosis (>1000 cel/mm3) de predominio polinuclear (> 70 %), hiperproteinorraquia (> 100 mg/dL), relación glucosa LCR/sérica disminuida (< 0,4) y aumento de la presión de apertura con valores superiores a 30 cm H20 (tabla 2) 1,2,8,9,21. Aun sin aislamiento microbiológico, estos hallazgos en el LCR son frecuentemente utilizados para establecer el diagnóstico e iniciar tratamiento empírico. Sin embargo, el espectro de los hallazgos en el citoquímico del LCR es amplio, lo que puede deberse a fases iniciales de la enfermedad, uso previo de antibióticos o estados de inmunosupresión 1,22.
Tabla 2 Características del LCR en meningitis bacteriana del adulto adquirida en la comunidad.
Fuente: Autores
El aumento de la concentración de lactato en LCR (> 35 mg/dL) antes del inicio de antibiótico, puede alcanzar una sensibilidad del 93 % (89-96 %) y especificidad del 96 % (93-98 %) para diferenciar una meningitis bacteriana de una viral 23.
La identificación específica del agente infeccioso incluye la tinción de Gram, el cultivo y la detección de su material genético por técnicas moleculares en LCR. La tinción de Gram, prueba rápida y no costosa, tiene una sensibilidad de 30-90 % (dependiendo del microorganismo y su carga en LCR), pero con especificidad superior al 90 % 1,8. El cultivo de LCR es el patrón de oro para el diagnóstico de la MB, tiene una sensibilidad de 50-70 % con especificidad del 100 %. Adicionalmente, permite determinar la sensibilidad antibiótica del aislamiento 4,17. Su rendimiento diagnóstico puede estar en relación con el uso previo de antibióticos, el sitio de donde se obtiene la muestra y la carga bacteriana en el LCR 2. Las nuevas pruebas de amplificación de ácidos nucleicos bacterianos, como la PCR (reacción en cadena de la polimerasa) directa o múltiple, pueden resultar positivas hasta en un 50 % de los LCR con cultivos negativos.
El panel de PCR múltiple para meningoencefalitis (Fil-mArray Biofire meningitis/encephalitis) permite identificar en una hora 14 patógenos en simultáneo, incluyendo 6 bacterias (E. coli K1, H. influenzae, L. monocytogenes, N. meningitidis, S. agalactiae, S. pneumoniae) con una sensibilidad y especificad que sobrepasa el 95 % 24,25. Su limitación está en el costo, en el espectro bacteriano restringido, la disponibilidad y la presencia de falsos positivos por contaminación de la muestra por sangre o por inadecuada manipulación 25,26. Técnicas más recientes como la secuenciación de próxima generación metagenómica (mNGS), llamada también secuenciación de alto rendimiento o secuenciación masivamente paralela, permiten secuenciar de forma simultánea e independiente miles de millones de fragmentos genómicos de diferentes patógenos bacterianos, virales, micóticos y parasitarios en una sola prueba 27. La mNGS en LCR identifica múltiples patógenos bacterianos con una sensibilidad de 73-92 %o y especificidad de 96-99 % 28,29. La mNGS representa un paso adelante para el diagnóstico de MB, pero se requieren más estudios para su adecuada implementación e interpretación en la práctica clínica.
NEUROIMAGEN
En general, las neuroimágenes en MB están indicadas para pacientes con sospecha de hipertensión endocraneana (con o sin compartimentalización), previamente a la punción lumbar y para el estudio de las complicaciones neurológicas 30.
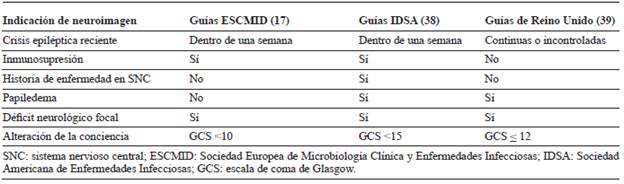
La utilidad de la tomografía de cráneo (TC) simple para el diagnóstico de meningitis es limitada 31 y su realización no debe retrasar la ejecución de la punción lumbar ni el inicio de la terapia antibiótica 9. Esperar la toma de una TC sin indicación no muestra beneficio clínico, aumenta costos y puede retrasar el inicio de la terapia, con desenlaces desfavorables en el paciente 32. Las indicaciones para su realización previamente a la punción lumbar difieren según la guía en referencia y ante la ausencia de consenso su uso debe individualizarse (tabla 3) 9. Para el diagnóstico de la inflamación de las leptomeninges y del espacio subaracnoideo, las imágenes cerebrales con contraste por resonancia magnética (RM) o TC típicamente muestran realce leptomeníngeo 33. La secuencia de inversión de recuperación con atenuación de líquido (FLAIR) contrastada en RM de cerebro parece ser la técnica más sensible para detectar el compromiso leptomeníngeo (figura 1). La alta señal en el espacio subaracnoideo refleja la alta concentración de proteínas en el LCR. La RM de cerebro simple y contrastada es la imagen de elección para detectar y monitorizar las complicaciones neurológicas de la MB (ver sección de complicaciones) 30.
Tabla 3 Indicación de neuroimágenes previamente a punción lumbar en pacientes con sospecha de meningitis, con base en cuatro guías internacionales.
Fuente: Autores
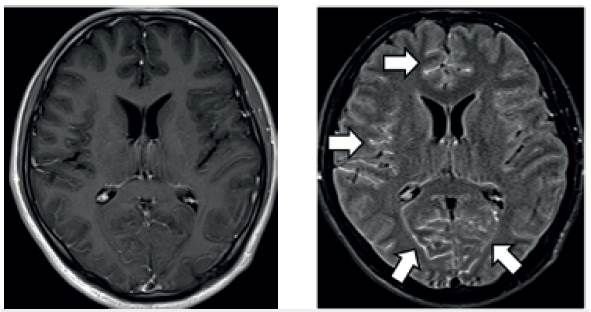
Reproducido y modificado con permiso de Lee y colaboradores 40.
Figura 1 Meningitis infecciosa en imágenes por resonancia magnética. A: imagen T1 contrastada, el realce meníngeo es conspicuo. B: imagen FLAIR contrastada, se observa claramente el realce meníngeo (flechas blancas).
TRATAMIENTO
Ante la sospecha de meningitis, el clínico enfoca el manejo terapéutico en las complicaciones sistémicas y neurológicas, el régimen antibiótico (AB) que se debe iniciar, la necesidad del uso de esteroides y el lugar de hospitalización del paciente. La administración temprana del tratamiento AB será la prioridad. Diferentes estudios han demostrado disminución de la mortalidad si el tratamiento se inicia dentro de la primera hora del ingreso hospitalario 1,8,9,16,31.
La elección de la terapia empírica de los AB para la MB adquirida en la comunidad del adulto estará basada en lo siguiente: hallazgos clínicos, contactos epidemiológicos del paciente, edad, comorbilidades, alergias conocidas, epidemiología local, patrones locales de resistencia al AB y penetración del AB al SNC 2,7-9,16,19. Los regímenes y las dosis recomendadas según los factores mencionados se describen en la tabla 4.
Tabla 4 Recomendaciones de terapia antibiótica empírica para meningitis bacteriana adquirida en la comunidad del adulto.
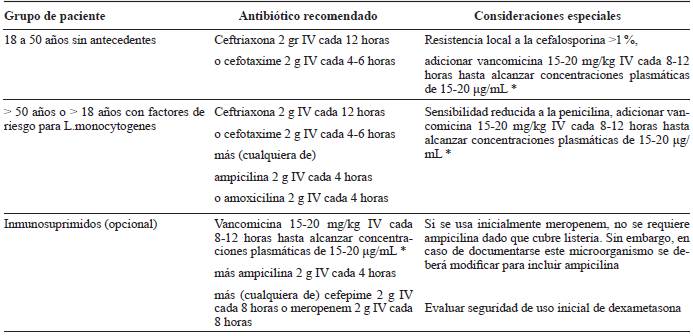
* Pacientes con función renal normal.
Fuente: Autores
Según los resultados obtenidos en la tinción de Gram, el cultivo o las pruebas de PCR en LCR, se modificará la terapia antibiótica de acuerdo con el microorganismo aislado y su susceptibilidad. Los regímenes y la duración del tratamiento según el agente etiológico se resumen en la tabla 5 1,2,7,9,17,19. En el caso de sospecha de meningitis bacteriana sin aislamiento microbiológico se recomienda continuar la terapia basada en el régimen empírico inicial y por el tiempo más largo sugerido. La vía de administración de la terapia AB debe ser intravenosa y con AB bactericidas. Las dosis se pueden modificar de acuerdo con el AB administrado y la función renal o hepática del paciente. Se recomienda que la suspensión de cualquier AB se realice si hay problemas de seguridad relacionados con el medicamento, si hay modificación de la terapia por aislamiento microbiológico o si hay un diagnóstico que excluye la MB adquirida en la comunidad. Por la evidencia clínica disponible, el uso de los nuevos AB (ceftaroline, linezolid, daptomicina y doripenem) o la administración intratecal de los AB no se recomienda de manera rutinaria 8.
Tabla 5 Tratamiento antibiótico según agente etiológico para meningitis bacteriana adquirida en la comunidad del adulto.
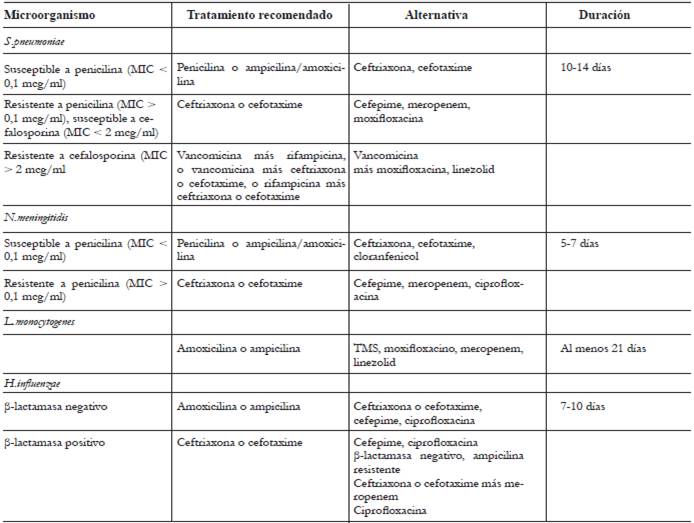
MIC: concentración mínima inhibitoria.
Fuente: Autores
El seguimiento de la MB es clínico y no se recomienda la realización de punción lumbar para el monitoreo de la enfermedad. Lo anterior, por la ausencia de parámetros de referencia para determinar curación o mejoría. Sin embargo, en pacientes sin mejoría clínica después de 48 horas de terapia AB, fiebre persistente por más de siete días sin una mejor explicación, o en pacientes con hidrocefalia comunicante, repetir la punción lumbar puede tener alguna utilidad 2,7,17.
Para disminuir la mortalidad, las complicaciones y las secuelas, la administración temprana e intravenosa de esteroides ha sido estudiada como terapia adjunta en pacientes seleccionados con MB 1,2,7,9. Para pacientes en países desarrollados con sospecha de MB adquirida en la comunidad se recomienda el uso intravenoso de dexametasona. La dosis recomendada es de 10 mg IV cada 6 horas, con la primera dosis 20 minutos antes o al tiempo con la primera dosis de AB 7,9,19,31. La terapia se recomienda hasta obtener el aislamiento del agente etiológico o por 4 días en caso de MB por S. pneumoniae2,9. Es importante resaltar que esta recomendación es para países desarrollados y en pacientes con MB del adulto por S.pneumoniae9,17,31. No se ha demostrado beneficio de la dexametasona en pacientes con MB por otros microorganismos. En un estudio de MB por L. monocytogenes se asoció con una menor probabilidad de supervivencia 7,9,17,19,31. En las ciudades intermedias y grandes de Colombia, la recomendación es seguir los lineamientos de los países desarrollados sobre el uso de la dexametasona como terapia adjunta para MB.
Por último, en pacientes con compromiso del estado de conciencia, déficits focales, estado epiléptico, inestabilidad hemodinámica o signos de tallo se recomienda el manejo en unidad de cuidado crítico 16.
COMPLICACIONES
Las complicaciones de la MB se pueden dividir en sistémicas y neurológicas. Alrededor de la mitad de los sobrevivientes tienen secuelas neurológicas. Estas complicaciones son más frecuentes en pacientes mayores de 65 años, con respuestas inflamatorias sistémicas o con alteraciones del LCR severas, pacientes con crisis epilépticas o signos focales, en infección por S.pneumoniae, con el retraso del tratamiento y en pacientes con mayor número de comorbilidades. Las complicaciones neurológicas, que pueden desarrollarse en cualquier momento de la enfermedad, incluyen: alteración del estado de conciencia, crisis epilépticas, hipertensión endocraneana, edema cerebral, hidrocefalia, abscesos cerebrales, cerebritis, aneurismas micóticos, empiema subdural, infartos cerebrales, ventriculitis, trombosis venosa, déficit focales, neuropatías craneales, pérdida auditiva y deterioro cognitivo 16,19.
PRONÓSTICO Y SECUELAS
La mortalidad por MB del adulto adquirida en la comunidad no es despreciable y aumenta proporcionalmente con la edad. En Estados Unidos la tasa de fatalidad por caso fue de 8,9 % en pacientes de 18 a 34 años y de 22,7 % en mayores de 65 años, entre los años 2003 y 2007. La mortalidad por MB es mayor en pacientes mayores de 60 años con meningitis neumocócica, con compromiso del estado de conciencia, hipotensión sistémica, déficit neurológico focal, bajo conteo celular en LCR y posiblemente crisis epilépticas 34. En el 2019, en Colombia se registraron 207 muertes por meningitis no especificada (CIE 105) en mayores de 15 años, 135 (65,2 %) en hombres y 72 (34,8 %) en mujeres. La tasa de mortalidad fue 0,55 por cada 100 000 habitantes, y ajustada por edad fue de 0,39 x 100 000 para individuos entre 15 y 65 años y de 1,8 x 100 000 para mayores de 65 años 35. El inicio temprano del AB, el uso de la dexametasona y el manejo en unidades de cuidado crítico se relacionan con una menor mortalidad en países desarrollados.
Las complicaciones de la MB mencionadas se asocian con mayor mortalidad, muchas requieren tratamiento durante la hospitalización y algunas son transitorias. Sin embargo, dentro de las secuelas de la MB, la pérdida auditiva es la más común (30-54 %), seguida del déficit neuropsicológico (32 %) y la epilepsia (2-8 %) 8,19. El pronóstico de secuelas de los pacientes con MB adquirida en la comunidad del adulto puede mejorarse con el inicio temprano de la terapia antibiótica y el tratamiento con esteroides.
CONCLUSIÓN
La MB adquirida en la comunidad del adulto es una emergencia médica con alto riesgo de morbimortalidad. El reconocimiento oportuno de los síntomas, un enfoque diagnóstico adecuado y el inicio temprano del tratamiento llevarán a un mejor desenlace para el paciente y posiblemente disminuirán las secuelas de la enfermedad.














