INTRODUCCIÓN
La Listeria monocytogenes (Lm) es un bacilo gram positivo que puede infectar tanto a animales como a seres humanos. Se adquiere por el consumo de alimentos contaminados que puede causar listeriosis, con un amplio espectro de síndromes que puede ir de la gastroenteritis autolimitada hasta infecciones diseminadas como bacteriemia y sepsis.
La Lm tiene un tropismo especial por el sistema nervioso central (SNC), puede producir: meningitis, meningoencefalitis aguda y con menos frecuencia, abscesos cerebrales y romboencefalitis 1,2. Afecta especialmente a poblaciones vulnerables con condiciones de inmunosupresión, adultos mayores, al igual que mujeres en embarazo y neonatos 3. A pesar de su baja frecuencia, su tasa de mortalidad es la más elevada entre las especies bacterianas que producen meningitis 1,4.
EPIDEMIOLOGÍA
El género Listeria agrupa un conjunto de bacterias ubicuas, aisladas en muestras de tierra en ambientes rurales y urbanos de todo el mundo. Sus reservorios son la tierra y los tractos intestinales de animales asintomáticos 5, en tanto que su modo de transmisión es el consumo de alimentos contaminados, entre los cuales los de mayor riesgo son los ofrecidos en charcuterías (productos delicatesen), salchichas, patés y carnes para untar, leche no pasteurizada, comida de mar ahumada y crustáceos cocinados listos para consumir 3,6. Se han descrito diferentes brotes en todo el mundo por consumo de vegetales, ensalada de col y leche pasteurizada. Y la bacteria ha sido aislada en diferentes tipos de queso (feta, blanco, fresco, brie, camembert, azul, panela, campesino y cuajada) 7,8.
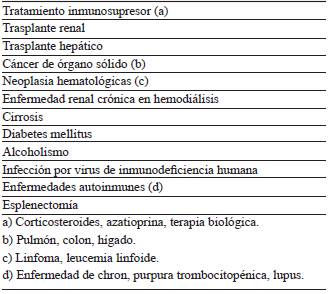
La Lm es la tercera especie infecciosa que causa meningitis bacteriana en adultos, por detrás de Streptococcus pneumoniae y Neisseria meningitidis4. La incidencia anual de meningitis por Lm es 0,03-0,13 casos por 100 000 habitantes 9, sin embargo, en países como los Estados Unidos ha disminuido hasta en 46 % por mejores técnicas en el procesamiento de alimentos, prácticas de alimentación seguras y educación 10. Casi todos los casos de meningitis por Lm son esporádicos 1,9, afecta a edades extremas como neonatos o adultos mayores de 50 años 9,11-14 y su incidencia es mayor en el sexo masculino 9,15. Los principales factores de riesgo para infección invasiva y neurolisteriosis son condiciones que comprometen la inmunidad celular (tabla 1) 1,4,14. Aunque no es frecuente, la neurolisteriosis puede afectar a pacientes jóvenes y sin factores de riesgo 9,11-14. La mortalidad por Lm es la más alta entre todas las causas de meningitis bacteriana, según estudios se ubica entre 17 y 30 % 1,4,11,12,15,16, asociada probablemente con edad avanzada y estados de inmunosupresión; hasta 2/3 de las fatalidades ocurren en pacientes mayores de 65 años 16.
FISIOPATOLOGÍA
El género Listeria incluye 17 especies conocidas, de las cuales Lm es el principal agente de las infecciones en seres humanos 17. Se trata de una bacteria gram positiva, no formadora de esporas, anaerobia facultativa, regularmente en forma de bacilo corto. La temperatura óptima de crecimiento es alrededor de los 30 a 37° C, pero puede crecer hasta 4° C 6.
La ingestión de inóculos de Lm presentes en alimentos contaminados permite su ingreso al tracto gastrointestinal, donde infecta a enterocitos y macrófagos residentes de la mucosa 18, ingresa a su citoplasma y allí logra sobrevivir y replicarse. Muchos pacientes no desarrollan manifestaciones clínicas, pero algunos pueden presentar infección primaria intestinal y producir un cuadro de enteritis. Según sus propiedades intrínsecas, la bacteria y sus mecanismos de virulencia pueden escapar a la sangre y causar bacteriemia e infección de órganos distantes como el SNC 3,19. Las proteínas de superficie bacteriana internalinas A y B permiten la unión con receptores celulares y la inducción de la endocitosis mediada por receptor; además, favorecen su internalización dentro de endosomas. Las enzimas listeriolisina-O y fosfolipasa C posibilitan que la bacteria escape del endosoma hacia el citoplasma y en el interior de la célula inducen la polimerización de proteínas de actina. Gracias a su proteína de superficie ActA, logran movilidad y propulsión ejerciendo presión sobre la membrana celular e invaden células vecinas 3,5.
Se proponen varios mecanismos implicados en la invasión al SNC: por vía circulatoria, la Lm penetra directamente células endoteliales de la barrera hematoencefálica; otro mecanismo es el "troyano", en el que la bacteria, aprovechándose de su localización intracelular en macrófagos, es transportada a las meninges y el parénquima cerebral. Se especula que por la vía neuronal retrógrada, a través de los nervios craneales (principalmente el trigémino), accede al tallo encefálico y genera romboencefalitis 19.
La respuesta inmunológica de tipo celular es la más importante para erradicar la infección por Lm. Los productos microbianos permiten el reclutamiento de macrófagos al lugar de infección y promueven su diferenciación en células dendríticas; estas últimas producen óxido nítrico por la sintasa inducible y el factor de necrosis tumoral (TNF), lo cual genera aniquilamiento bacteriano. Las células natural killer producen interferón, al igual que TNF, y activan más macrófagos que en conjunto con los neutrófilos son directamente listericidas 3,18 .
CUADRO CLÍNICO
El espectro de síndromes clínicos en la infección por Lm es muy amplio: desde un cuadro de gastroenteritis febril hasta una enfermedad invasiva que generalmente se asocia con uno o varios factores de riesgo.
La gastroenteritis febril aguda se ha descrito ampliamente en brotes epidémicos. Luego de consumir alimentos contaminados con Lm se puede desencadenar un cuadro agudo y autolimitado de fiebre, malestar general, dolor abdominal y diarrea no sanguinolenta; es infrecuente que se presente enfermedad invasiva 3. La infección de órganos o sistemas diferentes del tracto gastrointestinal se denomina enfermedad invasiva y puede dar lugar a infecciones maternofetales, bacteriemia y compromiso del SNC.
En la enfermedad maternofetal, las gestantes tienen 17 veces más riesgo de infección, siendo más frecuente en el tercer trimestre. El cuadro clínico suele ser de gastroenteritis aguda y el compromiso obstétrico se manifiesta por trabajo de parto prematuro, amnionitis y pérdida fetal.
La listeriosis diseminada y la neurolisteriosis son presentaciones raras, incluso en conjunto con bacteriemia. La transmisión al feto se da por diseminación transplacentaria o por inoculación a través de los tractos vaginal o gastrointestinal de la madre.
Los neonatos pueden presentar meningitis, bacteriemia y sepsis, con mortalidad del 20 % al 30 % 3. La bacteriemia es la principal causa de listeriosis invasiva 3 y la mayoría de los casos son esporádicos 9. Es más frecuente en adultos mayores 3, al igual que en inmunocomprometidos 1, y en los pacientes con factores de riesgo, la mortalidad es cercana al 50 % 9. Existen reportes de casos de infecciones cutáneas, endocarditis, infecciones endovasculares, artritis séptica, osteomielitis, peritonitis, adenitis, infección urinaria y neumonía por Lm 3.
NEUROLISTERIOSIS
La infección del SNC por Lm puede ser fatal sin tratamiento antibiótico, además de conducir a desenlaces neurológicos desfavorables si dicho tratamiento es inadecuado o se inicia de manera tardía 14). Se requiere alta sospecha para su diagnóstico, la clave está en la edad y los factores de riesgo. Los estudios evidencian al menos una condición de inmunosupresión en el 56-90 % de los afectados 11-13,15,16 (tabla 1). En todo paciente mayor de 50 años que presente fiebre, cefalea, alteración del estado de conciencia y rigidez de nuca, con una evolución aguda, y que además presente condición de inmunosupresión, debe sospecharse meningitis por Lm. Si además presenta crisis epilépticas, alteración en nervios craneales o signos de focalización, el compromiso del parénquima cerebral o del tallo encefálico debe descartarse. En la tabla 2 se describen las manifestaciones clínicas más frecuentes en neurolisteriosis. Debe tenerse en cuenta que los pacientes inmunocomprometidos pueden experimentar síntomas atípicos o ausencia de manifestaciones clásicas como cefalea, déficit neurológico focal o la triada clásica de meningitis 4.
Síndromes neurológicos
No existe una definición universal sobre los procesos clínico-patológicos en neurolisteriosis. Tradicionalmente se han clasificado como meningitis, meningoencefalitis, encefalitis, encefalitis del tallo (romboencefalitis) y absceso cerebral. En un estudio llevado a cabo por Arslan et al. se define meningitis como signos de irritación meníngea asociados con hallazgos inflamatorios en el LCR como pleocitosis, hipoglucorraquia o incremento de proteínas. La encefalitis se define por el compromiso del estado conciencia, crisis convulsivas, déficit neurológico focal o compromiso radiológico del parénquima cerebral. Y se denomina romboencefalitis al compromiso del mesencéfalo, protuberancia o cerebelo en la imagen por resonancia magnética (IRM), y clínicamente por compromiso de nervios craneales, signos cerebelosos (ataxia, temblor) o hemiparesia 14.
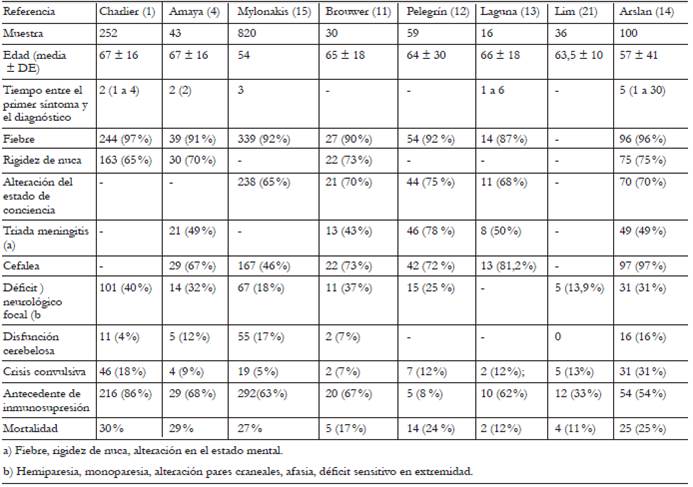
De estos síndromes el más frecuente es la meningoencefalitis, que representa el 84 % de los casos. En el estudio prospectivo MONALISA la meningitis aislada se presentó solamente en el 13 % 1. El tiempo de evolución casi siempre es agudo, de 1-7 días desde el inicio de síntomas hasta el diagnóstico. La mayoría de los casos presenta fiebre al inicio o durante la evolución. La cefalea es un síntoma variable, descrito en el 46-97 % de los pacientes. Según los estudios, la descripción de signos meníngeos hace referencia específicamente a rigidez de nuca, la cual se presenta en 2/3 de los casos. Más de la mitad presentan alteración de la conciencia. La triada de meningitis (fiebre, rigidez de nuca y alteración del estado de conciencia) se presenta aproximadamente en el 50 % 1,4,11,12,14,15,20,21. En comparación con la meningitis por S. pneumoniae o por N. meningitidis, en la ocasionada por Lm la fiebre, la cefalea y la alteración del estado mental son menos frecuentes y se presentan menos signos meníngeos al momento del diagnóstico 14,15.
Hasta el 30 % de los pacientes puede presentar crisis convulsivas, que representan un factor independiente de mortalidad. Estas, fisiopatológicamente, están relacionadas con irritación de la corteza cerebral, ya sea por meningitis, encefalitis, o por absceso cerebral 14.
El déficit neurológico se produce por lesiones inflamatorias o colecciones del parénquima y afecta las estructuras neuroanatómicas elocuentes. En los estudios se evidencia la presencia de signos focales entre el 13 % y el 42 % y signos cerebelosos en el 17 % de los casos. La presencia de signos motores o sensitivos focales, crisis convulsivas o déficit visual campimétrico siempre debe hacer sospechar absceso cerebral, el cual ocupa el 10 % de las infecciones por Lm 22.
La romboencefalitis se presenta en el 9-18 % 12,14 de los casos y debe sospecharse siempre si se presenta ataxia cerebelosa o compromiso de nervios craneales. Las náuseas y el vómito son síntomas frecuentes de esta entidad; muchos pacientes pueden progresar a falla respiratoria 14. El tiempo de evolución de estos procesos patológicos suele ser tardío, con una evolución subaguda o crónica (incluso meses) antes del diagnóstico 1,4,11,12,14,15,20,21.
El compromiso de nervios craneales se presenta en alrededor del 20 %. En tal caso, siempre debe aumentar la sospecha de romboencefalitis, aunque la inflamación leptomeníngea alrededor del tallo encefálico también lo puede ocasionar. Con mayor frecuencia están comprometidos los nervios facial (VII), abducens (VI), vestibulococlear (VIII) y motor ocular común (III). El compromiso del resto de nervios craneales también se ha descrito 1,14. Hasta un 5 % de los pacientes puede presentar compromiso de múltiples nervios craneales 14.
DIAGNÓSTICO
Las ayudas diagnósticas son indispensables en el enfoque de la neurolisteriosis, se deben tomar muestras de sangre para hemocultivos y hacer punción lumbar para el análisis del líquido cefalorraquídeo (LCR). En el hemograma, los pacientes con esta enfermedad presentan leucocitosis, alrededor de 12 000 células/ mm3, a expensas de los polimorfonucleares neutrófilos (PMN) (1,14,15); hasta el 80 % de los casos presenta linfopenia (< 1500 células/mm3) 1. La elevación de la proteína C reactiva es variable, con valores medios entre 1,2 mg/dL (5-339 mg/dL) (14) ya 11,3 mg/dL (23-203 mg/dL) 1.
Líquido cefalorraquídeo
La respuesta inflamatoria meníngea o cerebral puede derivar en hipertensión endocraneana, con presión de apertura media de 27 cmH2O (150-400 cmH2O) 11. Casi todos los pacientes presentan elevación de leucocitos. Diferentes estudios describen pleocitosis con medias de 400 células/mm3 (174-1117 células/mm3) 1, y alrededor del 70 % son PMN 1,13-15. Casi siempre se presenta elevación de proteínas, con media entre 210 y 260 mg/ dL 1,13,14. En un 80 % hay consumo de glucosa 13, con una concentración media de 39 mg/dL (0-130 mg/ dL) 14 y con relación glucosa LCR/sangre de 0,31 (0,220,51) 1. Los pacientes con meningitis por Lm tienen un menor recuento absoluto de leucocitos, un porcentaje de neutrófilos inferior y una más baja concentración de glucosa y de proteínas, en comparación con lo que se presenta en meningitis por otras especies bacterianas 13,15. Por esta razón, no se puede descartar Lm con base solamente en los parámetros citológicos y bioquímicos del LCR 4. En el absceso cerebral los parámetros citológicos y bioquímicos del LCR suelen ser normales 22.
Estudios microbiológicos y moleculares
La Lm puede ser aislada de diferentes tejidos o líquidos corporales. Si con la coloración de gram se visualizan bacilos gram positivos cortos, aumenta la sospecha de infección por Lm 6. Sin embargo, la sensibilidad de las muestras en fresco de LCR es muy baja, siendo positivas tan solo en el 30 % 4,11,14. La Lm crece en medios de cultivos convencionales formando colonias pequeñas (incubación de 1-2 días) con un pequeño halo de beta hemólisis 6. En meningoencefalitis, el cultivo del LCR tiene mayor rendimiento que el hemocultivo. La positividad en LCR es del 80-94 % 1,12-15 y en sangre de 35 -73 % 12,14,15. En absceso cerebral los hemocultivos tienen mayor utilidad: son positivos hasta en el 90 %, en comparación con el 33 % en LCR 22.
Existen diferentes técnicas moleculares basadas en la reacción en cadena de la polimerasa (PCR) para el aislamiento de Lm. En el medio se encuentra disponible el Fil-mArray Meningitis/Encephalitis panel (FilmArray-MEP), el cual detecta los 14 microorganismos principales involucrados en meningitis y encefalitis aguda 23,24. Tiene un límite de detección ligeramente alto para Streptococcus pneumoniae, Neisseria meningitidis, Listeria monocytogenes y Streptococcus agalactiae en comparación con PCR convencional, e igual o mejor comparado con cultivo de LCR 25.
Un estudio observacional prospectivo que analizó 130 muestras de LCR aleatorias con FilmArray-MEP, identificó al menos un microorganismo en el 25 % de las muestras, en comparación con el 6 % de aislamientos por cultivo y el 3 % por examen directo. En el estudio en mención se aisló Lm por medio de FilmArray-MEP en tres pacientes, de los cuales un solo cultivo fue positivo y ningún examen directo 26. Reportes de caso describen el aislamiento de Lm en LCR por medio de FilmArray-MEP en pacientes con meningitis y romboencefalitis 27,28.
Imágenes
La IRM cerebral, de mayor sensibilidad para el diagnóstico de meningoencefalitis y romboencefalitis por Lm, alcanza el 63 % para compromiso meníngeo y parenquimatoso 14. Existen estudios reportan hallazgos por tomografia de cráneo (TAC) en tan solo el 20-40 % de los casos 11,14,15. En meningoencefalitis se observa realce leptomeníngeo difuso, asociado con lesiones corticales o subcorticales focales hiperintensas en T2/FLAIR. También se pueden observar complicaciones secundarias como infartos cerebrales por vasculitis o vasoespasmo 29, hemorragia intracerebral, ventriculitis e hidrocefalia aguda 30. Aunque es infrecuente, se ha reportado mielitis por Lm 31.
En la romboencefalitis se puede observar hiperintensidades focales o difusas en las secuencias T2/FLAIR asociadas con realce nodular o difuso con el medio de contraste en mesencéfalo, puente, bulbo o estructuras cerebelosas 31,32. Los diagnósticos diferenciales de romboencefalitis por Lm son esclerosis múltiple, neuromielitis óptica, síndromes paraneoplásicos, encefalitis de Bickerstaff, síndrome de Behçet, lupus eritematoso sistémico, tumores primarios (gliomas) o metastásicos 32.
En absceso cerebral, la TAC de cráneo contrastada tiene un rendimiento diagnóstico similar a la IRM cerebral contrastada. La mayoría son únicos y de localización supratentorial. En comparación con abscesos piógenos, la Lm tiene predilección por ganglios basales y tronco encefálico (22. Hay varias publicaciones de casos con múltiples abscesos cerebrales por Lm 22,33.
TRATAMIENTO
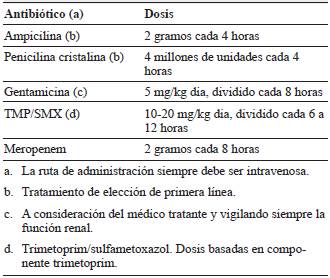
Hasta la fecha no existen estudios aleatorizados que demuestren la efectividad del tratamiento antibiótico en neurolisteriosis. Sin embargo, la piedra angular siguen siendo las penicilinas y las aminopenicilinas 34,35 (tabla 3). En estudios in vitro, los antibióticos betalactámicos en combinación con los aminoglucósidos tienen un efecto sinérgico que aumenta la muerte bacteriana 3,36. Existe controversia sobre la adición de aminoglucósidos al tratamiento convencional con ampicilina, algunos estudios describen desenlaces negativos como, por ejemplo, falla renal aguda 4. Sin embargo, un estudio prospectivo reciente demostró mayor tasa de supervivencia en pacientes tratados con un betalactámico asociado con aminoglucósido 1.
Las guías recomiendan adicionar ampicilina o penicilina G al tratamiento antibiótico empírico convencional de la meningitis bacteriana aguda en pacientes mayores de 50 años o con factores de riesgo para infección por Lm. Una vez logrado el aislamiento bacteriano se debe reducir el espectro antibiótico, y en el caso de Lm continuar el tratamiento con ampicilina o penicilina G. El uso de gentamicina puede iniciarse a consideración del médico tratante, con cautela en pacientes con falla renal. En casos de romboencefalitis se recomienda suministrar terapia combinada con ampicilina y gentamicina 14. En situaciones especiales, la terapia de segunda línea puede ser trimetoprimsulfametoxazol o meropenem. La Lm es intrínsecamente resistente a las cefalosporinas, por lo tanto, estas no son de elección 3,5. No se recomienda tampoco el uso de corticosteroides (dexametasona) para el tratamiento rutinario de meningitis por Lm 37.
Aunque no existe evidencia contundente sobre la duración del tratamiento antibiótico en neurolisteriosis, se recomienda un mínimo de 21 días para casos de meningitis 34,35,37. Las infecciones focales como abscesos y rom-boencefalitis deben ser tratadas durante 6-8 semanas 3.
PRONÓSTICO
El porcentaje de pacientes con secuelas neurológicas y discapacidad varía según los estudios, del 13 % al 68 % 1,2,14,15. Las secuelas más frecuentes son el déficit motor focal y la alteración persistente del estado de conciencia, seguidos por la disfunción cerebelosa y del nervio vestibulococlear 1. La romboencefalitis por Lm es la entidad clínico-patológica que se asocia con mayor riesgo de secuelas neurológicas, aproximándose a un 63 % 12. Es improbable que se presenten recaídas de neurolisteriosis; en un solo estudio reportan un 7 % 15.
Ciertos factores de riesgo aumentan la mortalidad en neurolisteriosis. Las condiciones de inmunosupresión severa (SIDA, malignidad, trasplante) y el tratamiento antibiótico inadecuado aumentan la mortalidad hasta el 40 % 15,20. Igualmente, la presencia de hidrocefalia 12, crisis epilépticas y el retraso en el tratamiento se han reportado como factores independientes para mortalidad por neurolisteriosis 14. Es significativamente mayor en pacientes con hemocultivos positivos y los que reciben dexametasona 1.
CONCLUSIONES
La neurolisteriosis se presenta principalmente como meningitis o meningoencefalitis, y en menor frecuencia romboencefalitis o absceso cerebral. Es la principal causa de muerte entre todas las meningitis bacterianas y se asocia con una alta tasa de discapacidad neurológica. Para su diagnóstico es necesario tener en cuenta la edad y los factores de riesgo, principalmente individuos mayores de 50 años y con condiciones de inmunosupresión. Las ayudas diagnósticas son clave para lograr el aislamiento de Lm; el cultivo de LCR tiene la mejor sensibilidad. Aunque faltan estudios que demuestren la superioridad de los estudios moleculares, el FilmArray-MEP parece ser prometedor en el aislamiento rápido y preciso de los principales microorganismos involucrados en la meningitis piógena, entre estos Lm. La IRM cerebral es el estudio de elección para el diagnóstico de romboencefalitis. La piedra angular del tratamiento sigue siendo la ampicilina, su asociación con aminoglucósido podría disminuir mortalidad.