INTRODUCCIÓN
La meningitis por Mycobacterium tuberculosis es la forma extrapulmonar más letal de la tuberculosis (TB) activa, presenta una alta prevalencia en los países en desarrollo, lugares donde frecuentemente existen deficiencias en los servicios de salud que retrasan el diagnóstico oportuno y el inicio del tratamiento. Esto último contribuye a la elevada morbimortalidad de la enfermedad 1. El diagnóstico de la TB del sistema nervioso no es fácil ya que las características clínicas no son específicas y las pruebas de laboratorio tienen baja sensibilidad, con independencia de los avances en las técnicas de diagnóstico molecular 2.
A pesar de su prevalencia e impacto en la salud pública, hace más de 50 años no se produce una innovación significativa en el tratamiento farmacológico, lo cual impacta en el origen de las formas multi y extremadamente resistentes de la tuberculosis 3. Esta situación hace que el alto grado de sospecha clínica, el tratamiento oportuno y la optimización del control mundial de la tuberculosis constituyan la clave en la lucha contra esta enfermedad 2, más aún cuando la nueva infección por SARS-Cov-2 aumentó la tasa de mortalidad por efecto directo o indirecto, causando retardo en el diagnóstico y abandono del tratamiento anti-TB en algunos pacientes 4. Por lo anterior, la Organización Mundial de la Salud (OMS) propone ampliar el cubrimiento del uso de pruebas diagnósticas y el tratamiento preventivo en las poblaciones con más alto riesgo de contraer tuberculosis 5.
EPIDEMIOLOGÍA
La tuberculosis continúa siendo un problema de salud pública y una de las principales causas de muerte a escala mundial 6. Se estima que una tercera parte de la población está infectada por Mycobacterium tuberculosis, pero solamente el 10 % desarrolla una enfermedad activa secundaria a factores de riesgo como alteración en el sistema inmune, desnutrición, diabetes y edades extremas de la vida 6,7. Colombia es el quinto país con mayor número de casos de TB y una incidencia estimada para el periodo epidemiológico V de 2020 de 8,76 casos por 100 000 habitantes 7,8.
La meningitis por tuberculosis comprende el 1-2 % de los casos de TB activa, la mitad de los cuales ocasiona discapacidad grave o la muerte 6. En el periodo transcurrido del año 2020, el Sivigila ha registrado una incidencia de tuberculosis extrapulmonar (TBE) de 1,51 casos por 100 000 habitantes (16,6 %), en tanto que la TBE farmacorresistente corresponde al 17,39 % de los casos 8,9. Las características demográficas se describieron en un estudio observacional de 36 pacientes realizado entre los años 2003 y 2012 en dos instituciones de Bogotá, en el que se encontró una edad promedio de 52,4 años, con predominio masculino (63,8 %) y coinfección con virus de la inmunodeficiencia humana en el 16,6 % de los casos 10.
FISIOPATOLOGÍA
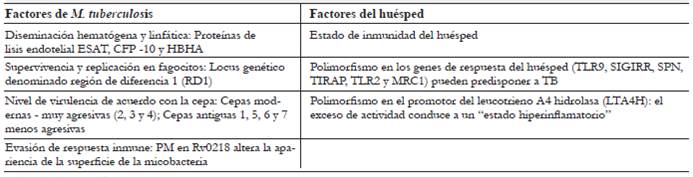
El Mycobacterium tuberculosis es un bacilo intracelular ácido-alcohol resistente, aerobio, no productor de esporas y es el agente causal de la tuberculosis pulmonar y extra-pulmonar 11,12. El punto de partida de la infección por tuberculosis al sistema nervioso central (SNC) se produce mediante la inhalación de gotas infecciosas, con la posterior colonización de los macrófagosalveolares. Posteriormente, el Mycobacterium tueberculosis realiza una replicación inicial y se propagan a los ganglios linfáticos 12.
Para las formas miliares y extrapulmonares, la diseminación ocurre por vía hematógena o a través de la extensión directa al tejido linfoide 13, utilizando un mecanismo de translocación por medio de proteínas de la bacteria conocidas como proteínas bacterianas de objetivo antigénico secretor temprano de 6 kd (ESAT-6) y la proteína de filtrado de cultivo de 10 kd (CFP-10), encargadas de la lisis celular, o mediante la proteína de adhesión de hemaglutinina de unión a heparina (HBHA) que permite la translocación del epitelio sin lisis. Otros mecanismos descritos se dan por invasión directa a las células endoteliales o el transporte por los fagocitos 14. Este proceso ocurre como parte de la progresión que sigue a la infección pulmonar primaria o la reactivación de una TB tardía en otros órganos 15.
La invasión al sistema nervioso central (SNC) se establece por dos rutas. La primera consiste en la interacción de los bacilos con factores extracelulares en el endotelio, que se lleva a cabo gracias al gen Rv0931c (pknD), considerado un factor que promueve dicha interacción y facilita la migración a través de la barrera hematoencefálica (BHE). La segunda ruta es un mecanismo conocido como "caballo de Troya", mediante el cual la infección ingresa por medio de los fagocitos y alcanza el SNC 14,16. Durante la fase de bacilemia, las altas cargas de bacilos conforman progresivamente múltiples focos granulomatosos encapsulados, cuya proliferación continua y su coalescencia generan focos caseosos que se localizan adyacentes al epéndimo o la piamadre, conocidos como focos de Rich. Estos focos pueden descomponerse, liberando con ello material caseoso infectado con bacilos al espacio subaracnoideo 12,15,17.
Una vez los bacilos se encuentran en el espacio subaracnoideo, infectan de manera predominante a la microglía y en menor medida a los astrocitos y a las neuronas 18. La internalización a las células de la microglía se realiza por medio de proteínas como el receptor CD-14 19, que facilita activamente su entrada, con lo cual se genera una gran respuesta inflamatoria debido a la liberación de cito-quinas dentro de las que se destacan el factor de necrosis tumoral alfa (TNF-alfa), el interferón gamma (ENFy) y la interleucina-6 (IL-6). No es claro si la magnitud de la respuesta y la lesión en el SNC son secundarias a la cascada proinflamatoria ocasionada por estas citoquinas, o se deben a los efectos antinflamatorios descritos para la IL-6 14,20.
La relación entre los factores del huésped y los del patógeno que contribuyen a la manifestación de la enfermedad son complejos y esto impacta en el curso y el tratamiento de la enfermedad. En la tabla 1 se describen los factores del huésped y del patógeno en la fisiopatología de la TB del SNC.
FORMAS DE PRESENTACIÓN Y MANIFESTACIONES CLÍNICAS
Tuberculosis meníngea: es la manifestación más común de TB del SNC. Suele presentarse con una fase prodrómica inespecífica, subaguda y progresiva consistente en fiebre, malestar, cefalea intermitente y cambios de la personalidad. Entre dos y tres semanas surge una fase meníngea caracterizada por cefalea prolongada, vómito, confusión y signos meníngeos; estos últimos pueden estar ausentes en niños y adultos mayores 15,21.
Posteriormente, puede haber mayor compromiso del estado de conciencia (estupor y coma), convulsiones y neuropatía craneal por lesión meníngea en la base del cráneo. Los nervios craneales que con mayor frecuencia se comprometen son el nervio óptico, el abducens y el nervio facial. Una de las presentaciones graves corresponde a la aracnoiditis optoquiasmática. Si no se instaura un tratamiento oportuno, puede conllevar una alta mortalidad dentro de las 5-8 semanas posteriores al inicio de los síntomas 13,21.
Un pequeño porcentaje de pacientes cursa con presentaciones atípicas, sin el pródromo característico ni la progresión subaguda, que se manifiestan como una forma de demencia lentamente progresiva durante varios meses, con cambios de personalidad o un síndrome meníngeo agudo, rápidamente progresivo (indistinguible de la meningitis bacteriana) 13,15.
Tuberculoma (granuloma tuberculoso): de los pacientes con TB meníngea el 10 % cursa concomitantemente con tuberculomas, un tercio de estos presenta tuberculomas múltiples. La presentación clínica varía según su localización, siendo más frecuentes la cefalea, las convulsiones, los signos neurológicos focales y el papiledema 21.
Absceso tuberculoso: ocurre en menos del 10 % de los pacientes con TB del SNC. Los síntomas clínicos más frecuentes incluyen fiebre, cefalea y signos neurológicos focales 21,22.
Radiculomielitis: es una complicación infrecuente de la TB, pero puede llegar a ser la manifestación inicial de TB del SNC. Se caracteriza por la presencia de debilidad subaguda en miembros inferiores, gradualmente progresiva con disfunción vesical, parestesias, dolor radicular y atrofia muscular 23.
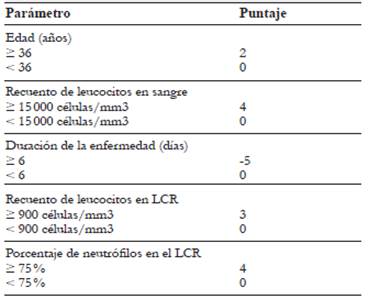
El método más utilizado para definir la gravedad de la tuberculosis meníngea se basa en los criterios del Medical Research Council (MRC), que además predice el desenlace (mortalidad o discapacidad neurológica) tanto en pacientes VIH positivos como en negativos (tabla 2).
Tabla 2 Grados de severidad de la TB meníngea según Medical Research Council (MRC). Escala de coma de Glasgow (GCS, por sus siglas en inglés)

Tomado y adaptado de 14
DIAGNÓSTICO
El diagnóstico de la TB del SNC continúa siendo un desafío médico, debido a la presentación clínica inespecífica, la falta de pruebas rápidas, más sensibles o específicas, el alto costo y el pobre acceso o la ausencia de estas pruebas en muchos países 24.
El diagnóstico inicial y el comienzo del tratamiento se basan en la sospecha clínica 10, las características del líquido cefalorraquídeo (LCR), pruebas microbiológicas o moleculares basadas en la respuesta del huésped y pruebas imagenológicas 13. En la tabla 3 se resumen las características generales del LCR.
Pruebas de diagnóstico microbiológico
Tinción de Ziehl-Neelsen (ZN): es la prueba más rápida, económica y umversalmente aceptada para el diagnóstico de la TB; consiste en la detección de bacilos ácido-alcohol resistentes (BAAR). Se requieren aproximadamente 104 organismos/ml para una detección confiable con esta tinción (sin embargo, el LCR de la mayoría de los pacientes con TB meníngea es paucibacilar y contiene apemas 100-102 organismos/ml) 24,25. La sensibilidad es tan solo del 10-20 %, pero puede aumentar a más del 50 % con mayores volúmenes de LCR (aproximadamente 10 ml), centrifugado a 3000 g y examinado durante 30 min por un microscopista experimentado 25.
Cultivo: considerado durante mucho tiempo el estándar de oro en el diagnóstico de TB meníngea. Su desventaja principal es la obtención de resultados a las 6-8 semanas (10 días en medio líquido y 8 semanas en medio sólido), lo que dificulta la toma de decisiones clínicas rápidas 24,25. La sensibilidad varía del 60 % al 70 % y se incrementa cuando se usan el medio de cultivo sólido y el líquido de manera concomitante 13.
Pruebas de diagnóstico molecular
Pruebas de amplificación de ácidos nucleicos (AAN): se basan en la detección de moléculas específicas de M. tuberculosis en muestras clínicas o cultivos 26. En un metaanálisis se demostró que la precisión diagnóstica de estas pruebas en LCR es insuficiente para reemplazar el cultivo como única prueba diagnóstica 27.
Reacción en cadena de la polimerasa (PCR): la mayoría de los ensayos de PCR para la detección de M. tuberculosis amplifican el gen MPB64 o IS6110, un elemento de inserción con múltiples copias en el genoma de M. tuberculosis. La sensibilidad es del 56 % y la especificidad del 98 %, lo que indica que un resultado negativo no puede descartar TB meníngea 28, y tampoco reemplaza las técnicas microbiológicas previamente descritas, sin embargo, genera resultados en menos tiempo que los cultivos.
Prueba de GeneXpert MTB/RIF (Cepheid): es una prueba molecular completamente automatizada, basada en PCR en tiempo real, que detecta simultáneamente la presencia de M. tuberculosis y su susceptibilidad a la rifampicina (codificada en el gen rpoB) en menos de dos horas 29. En un metaanálisis de Cochrane se demostró una sensibilidad y especificidad del 71 % y 98 %, respectivamente, aunque con una tasa de falsos positivos del 20 % y de falsos negativos del 3 % 30
Prueba Xpert MTB/RIF Ultra: es una prueba de segunda generación que se basa en la detección y amplificación de genes multicopia. En un estudio realizado en Uganda, en 129 pacientes adultos con VIH, se evidenció una sensibilidad del 95 % y especificidad del 97 %. Una muestra de 6 ml o más de LCR se asoció con una mejor detección de tuberculosis 31. En el 2017, la OMS recomendó Xpert MTB/RIF Ultra, antes que el cultivo y la microscopía convencional, como la prueba de diagnóstico inicial para pacientes con sospecha de TB meníngea 32.
Pruebas basadas en la respuesta del huésped
Adenosina deaminasa (ADA): es una enzima necesaria para la conversión de adenosina en inosina que se encuentra particularmente en los linfocitos T del tejido linfoide 24. Varios metaanálisis han proporcionado el valor de ADA en el diagnóstico de tuberculosis meníngea, pero los resultados han sido contradictorios 27,33,34. En el metaanálisis de Tuon y colaboradores se asignaron puntos de corte arbitrarios de 1-10 U/l, considerando que los valores de 1-4 U/l tenían una sensibilidad superior al 93 % y una especificidad alrededor del 72,3 % para excluir TB meníngea; los valores entre 4 y 8 U/l fueron insuficientes para excluir TB meníngea, en tanto que valores superiores a 8 U/l tenían una sensibilidad inferior al 59 % y especificidad mayor al 96 %. Se concluyó que ADA no puede distinguir entre meningitis bacteriana y TB meníngea, pero utilizar los rangos mencionados puede ayudar al diagnóstico, especialmente si se ha descartado meningitis bacteriana 33. Los diferentes métodos utilizados en su medición y la heterogeneidad de los datos limitan la estandarización de esta prueba en la práctica clínica habitual.
DIAGNÓSTICO IMAGENOLÓGICO
Las neuroimágenes son esenciales para el diagnóstico y la evaluación de las complicaciones relacionadas con la TB del SNC. La imagen de elección es la resonancia magnética (RM) cerebral contrastada. En etapas tempranas de la enfermedad, el 30 % tiene tomografías computarizadas (TC) de cráneo normales y alrededor del 15 % de las RM cerebrales son normales 13,24.
En la población adulta, la hidrocefalia comunicante y el realce meníngeo son las características más comunes en pacientes con TB meníngea 15 (figura 1).
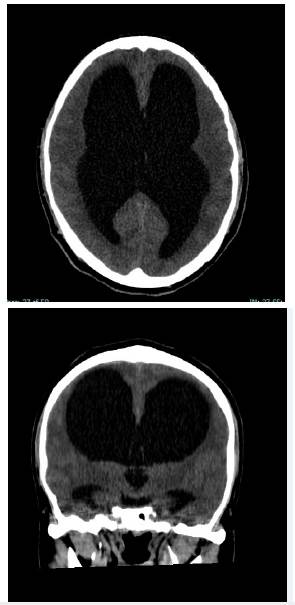
Figura 1 TC cerebral simple de paciente de la Unidad de Servicios de Salud Occidente de Kennedy con cuadro de meningitis crónica por TB con BK positivo en LCR donde se aprecia hidrocefalia de tipo comunicante
La combinación de hidrocefalia extraventricular, exudados basales y áreas de isquemia o infarto tiene una especificidad de 95 al 100 %, pero estas características pueden estar ausentes al inicio de la enfermedad, reduciendo la sensibilidad al 40 % 15,24.
ESCALAS DIAGNÓSTICAS
Debido a la ausencia de una prueba rápida, con alta sensibilidad y especificidad, es necesario realizar una historia clínica rigurosa, precisando el tiempo de evolución y los hallazgos del examen físico y neurológico, que junto con examen de líquido cefalorraquídeo y la aplicación de las diversas escalas permita establecer un diagnóstico y un tratamiento oportunos. Estas escalas se basan en las características clínicas y paraclínicas más predictivas de TB meníngea a lo largo de los estudios 21,24,34.
Una limitación importante es que su rendimiento es variable en diferentes poblaciones y entornos. Pocas escalas se han validado externamente 13.
Las escalas diagnósticas más conocidas y usadas ampliamente son:
Escala de Thwaites (también conocida como escala de Vietnam, del 2002): es una escala diagnóstica sencilla, eficaz, costoefectiva y rápida que compara las características clínicas y de laboratorio de la TB meníngea y de la meningitis bacteriana, considerando que si el puntaje total es de 4 o menos, favorece el diagnóstico de TB meníngea, mientras que si tiene un puntaje de 4 o más, orienta a una meningitis bacteriana, con una sensibilidad del 86 %o y una especificidad del 79 % 34) (tabla 4). Esta escala fue validada en una población colombiana, con una muestra de 527 pacientes en un periodo de 14 años, en el que se demostró una buena sensibilidad, pero baja especificidad cuando se usó para diferenciar TB meníngea de meningitis bacteriana en adultos VIH negativos. Se consideró entonces que era una escala útil para tamizaje y para definir el inicio de un tratamiento empírico, sin embargo, tiene alta probabilidad de falsos positivos por lo que se requiere que se complemente con otras pruebas diagnósticas 35.
Escala de Marais o The Lancet Consensus Scoring System (LCSS): se origina en el 2010 con el objetivo de mejorar la estandarización de los criterios diagnósticos y las definiciones de caso. Se plantearon cuatro categorías diagnósticas, según la solidez de los hallazgos clínicos, de laboratorio (características del LCR), radiológicos (evaluados por RM o TC de cráneo) y la evidencia paraclínica de tuberculosis en otros sistemas, clasificando los casos en definitivos, probables, posibles o sin TB meníngea 36.
TRATAMIENTO
En Colombia, el tratamiento de la tuberculosis se basa en la guía de manejo susceptible a fármacos, publicada en el año 2016, desarrollada por la Sociedad Americana de Tórax, los Centros para el Control y la Prevención de Enfermedades y la Sociedad Americana de Enfermedades Infecciosas 37.
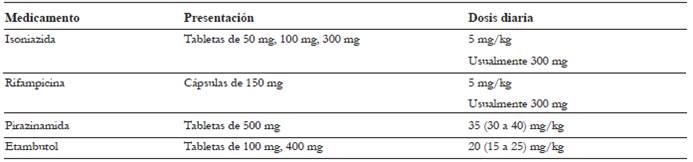
El manejo para la meningitis tuberculosa se inicia con isoniazida (INH), rifampicina (RIF), pirazinamida (PZA) y etambutol (EMB), en una fase inicial que tiene una duración de dos meses. Posteriormente a estos dos meses, en el caso de tratarse de una meningitis tuberculosa que se presume es causada por cepas sensibles, se puede suspender la pirazinamida y el etambutol, y continuar con isoniazida y rifampicina por siete o diez meses más, como se describe en las tablas 5 y 6; sin embargo, aún no está definida la duración óptima del tratamiento 37.
Tabla 5 Régimen de tratamiento para tuberculosis confirmada causada por organismos susceptibles a medicamentos

Modificado de 37
La piridoxina (vitamina B6) a dosis de 25-50 mg al día debe ser dada con la isoniazida en todas las personas que tengan riesgo de neuropatía, como en el caso de mujeres embarazadas, pacientes con VIH, diabetes, aquellos con consumo crónico de alcohol, desnutrición, o insuficiencia renal crónica, o en pacientes con edad avanzada. En el caso de que el paciente tenga neuropatía periférica, los expertos recomiendan aumentar la dosis de piridoxina a 100 mg al día 37.
Hay evidencia del beneficio del uso de los esteroides como adyuvantes en el tratamiento porque disminuyen la tasa de mortalidad en la meningitis tuberculosa. Por lo anterior, se recomienda manejo con dexametasona o prednisolona en un periodo de seis a ocho semanas 37. Existe incertidumbre sobre si los esteroides son beneficiosos o no para las personas VIH positivas con meningitis tuberculosa, debido a la falta de evidencia directa en este grupo 38.
En la actualidad, la resistencia a los antimicrobianos constituye un problema y representa una amenaza para la salud pública. Los esfuerzos mundiales para erradicar la tuberculosis se ven enfrentados a la diseminación de cepas de tuberculosis que son resistentes a los tratamientos convencionales 39. La primera vez que se documentó resistencia a los medicamentos en Mycobacterium tuberculosis fue a finales de la década de 1940, pero no fue sino hasta principios de la década de 1990 que comenzó a recibir atención mundial. Esto coincidió con la detección de brotes de tuberculosis resistente, es decir, resistente al menos a la rifampicina y a la isoniacida, en pacientes coinfectados por el virus de la inmunodeficiencia humana 40.
En contraste con la mayoría de los pacientes con tuberculosis en el mundo, en quienes se espera una cura sin recaídas con un ciclo de seis meses de primera línea, los pacientes que son resistentes a rifampicina, usualmente combinada con resistencia a isoniazida, requieren regímenes de tratamiento más largos, de hasta 20-24 meses, menos efectivos y accesibles que los regímenes de primera línea 39,41.
Los perfiles de resistencia específicos son 42:
Resistencia a un solo fármaco (isoniazida, rifampicina, etambutol o pirazinamida).
Resistencia a isoniazida: resistencia a isoniazida (susceptible a rifampicina).
Resistencia a la rifampicina (TB-RR): organismos que muestran resistencia a la rifampicina, pero que pueden ser susceptibles a la isoniazida.
Multirresistencia (TB - MDR): organismos que muestran resistencia a la rifampicina, así como a la isoniazida o resistentes a otras TB de primera línea.
TB polirresistente (TB-PDR): TB causada por organismos que muestran resistencia a más de un medicamento anti-TB, pero sin incluir la isoniazida ni la rifampicina.
TB pre-extremadamente resistente (TB pre-XDR): TB causada por organismos que muestran resistencia a múltiples medicamentos y resistencia a cualquier fluoroquinolona o a un agente inyectable de segunda línea.
Extremadamente resistente (TB-XDR): cepas de tuberculosis multirresistente también resistentes a cualquier fluoroquinolona y cualquier medicamento inyectable de segunda línea.
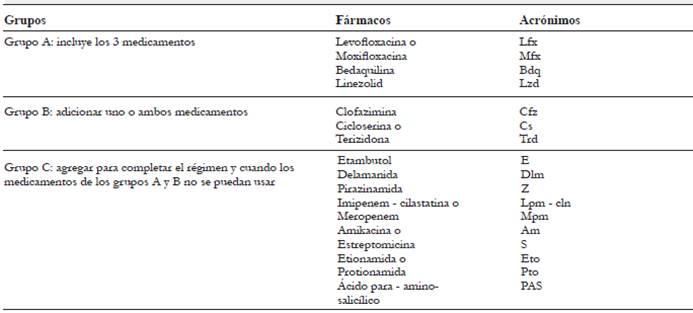
En el año 2018 la OMS revisó la clasificación de los medicamentos antituberculosos. Esta clasificación, que divide a los medicamentos en el grupo A, B, o C, se utiliza para diseñar el régimen de tratamiento más largo de la OMS, con una duración total de 20 meses, porque el régimen de tratamiento estandarizado más corto, que dura 12 meses, se compone de un régimen fijo de medicamentos que no se puede sustituir (tabla 7).
Por tratarse de tuberculosis diseminada, tuberculosis meníngea o tuberculosis del SNC, el tratamiento en la tuberculosis multirresistente debe ser individualizado, con un régimen de tratamiento prolongado, utilizando las siguientes recomendaciones 42: